氢原子的波函数

氢原子是所有原子中最简单的原子,它核外仅有一个电子,电子在核外运动时的势能,只决定于核对它的吸引,它的Schr?dinge r方程可以精确求解。能够精确求解的还有类氢离子,如He+、Li2+离子等。
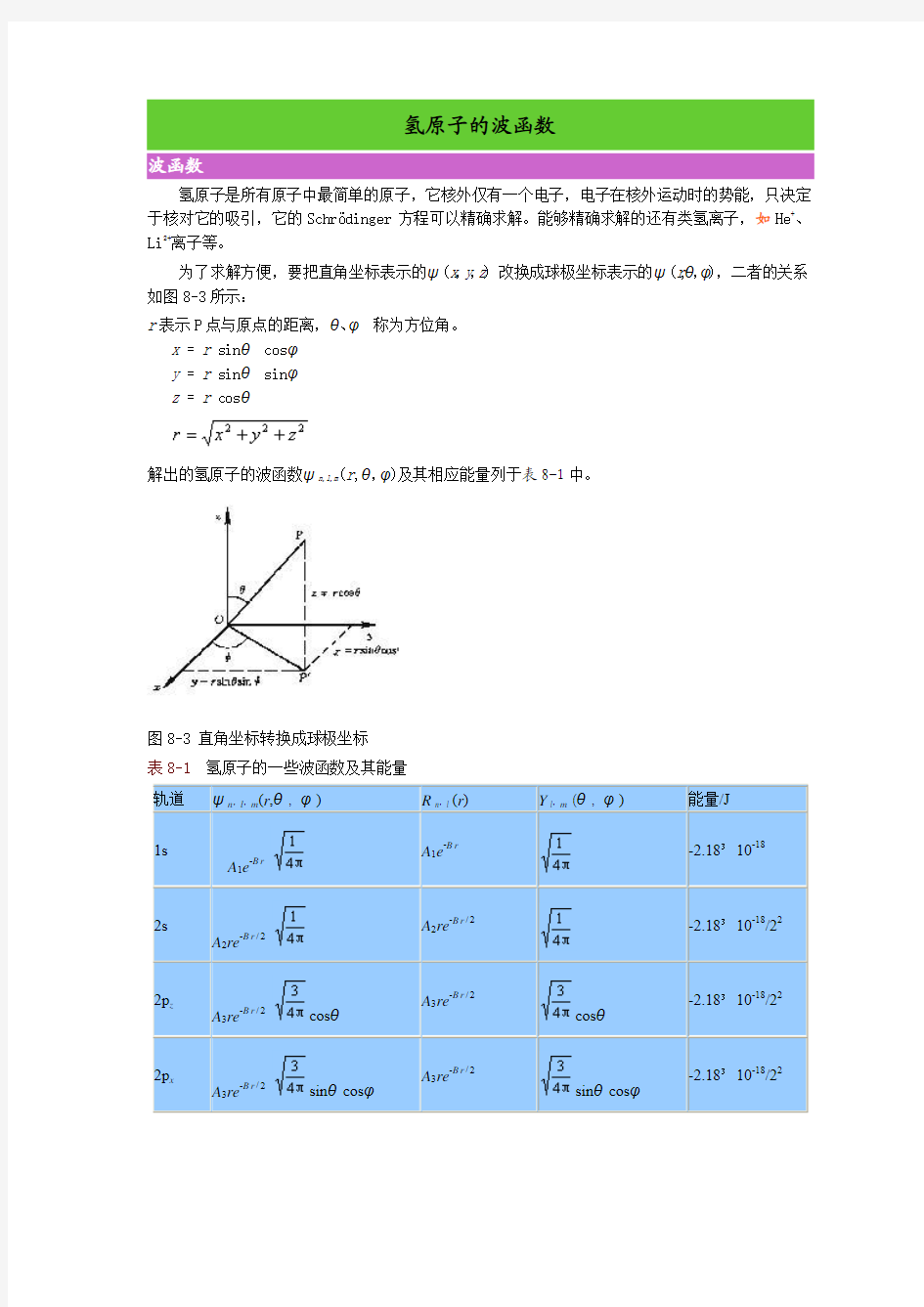
为了求解方便,要把直角坐标表示的ψ(x,y,z) 改换成球极坐标表示的ψ(r,θ,φ),二者的关系如图8-3所示:
r表示P点与原点的距离,θ、φ称为方位角。
x = r sinθcosφ
y = r sinθsinφ
z = r cosθ
解出的氢原子的波函数ψn,l,m(r,θ,φ)及其相应能量列于表8-1中。
图8-3 直角坐标转换成球极坐标
表8-1氢原子的一些波函数及其能量
cos cos
sin sin
sin sin
* A1、A2、A3、B均为常数
为了方便起见,量子力学借用Bohr N H D理论中“原子轨道” (atomic orbit)的概念,将波函数仍称为原子轨道(atomic orbital),但二者的涵义截然不同。例如:Bohr N H D认为基态氢原子的原子轨道是半径等于52.9 pm的球形轨道。而量子力学中,基态氢原子的原子轨道是波函数
ψ1S(r,θ,φ)=A1e-Br,其中A1 和B均为常数,它说明ψ1S在任意方位角随离核距离r改变而变
化的情况,它代表氢原子核外1s电子的运动状态,但并不表示1s电子有确定的运动轨道。1s电子具有的能量是-2.18310-18J。氢原子核外电子的运动状态还有许多激发态,如ψ2s(r,θ,φ)、(r,θ,φ)等,相应的能量是-5.45310-19J。
要解出薛定谔方程的ψ和E,必须要满足一定的条件,才能使解是合理的,因此,在求解过程中必需引进n , l , m三个量子数。这三个参数的取值和组合一定时,就确定了一个波函数。三个量子数的取值限制和它们的物理意义如下:
常用符号n表示。它可以取非零的任意正整数,即1,2,3 …n 。它决定电子在核外空间出现概率最大的区域离核的远近,并且是决定电子能量高低的主要因素。n = 1时,电子离核的平均距离最近,能量最低。n愈大,电子离核的平均距离愈远,能量愈高。所以n也称为电子层数(electron shell number)。对氢原子来说电子的能量完全由主量子数决定,即由式
决定。从这个式子可以看出,n愈大,E就愈大(负值的绝对
值愈小)。
常用符号l表示。它的取值受主量子数的限制,它只能取小于n的正整数并包括零,即l可以等于0、1、2、3 … (n–1),共可取n个数值。按光谱学的习惯,l = 0时,用符号s表示,l= 1时,用符号p表示,l = 2时,用符号d表示,l = 3时用符号f表示等等。轨道角动量量子数决定原子轨道的形状。如l = 0时,原子轨道呈球形分布;l = 1时,原子轨道呈双球形分布等。在多电子原子中,轨道角动量量子数也是决定电子能量高低的因素。所以,在多电子原子中,主量子数相同、轨道角动量量子数不同的电子,其能量是不相等的,即在同一电子层中的电子还可分为若干不同的能级(energy level)或称为亚层(subshell),当主量子n相同时,轨道角动量量子数l愈大,能量愈高。于是有
E n s<E n p<E n d<E n f。
对氢原子来说,E n s = E n p = E n d = E n f。
常用m 表示。它的取值受轨道角动量量子数的限制。即m 可以等于0、±1、±2,…±l等整
数。所以,磁量子数共有(2l +1)个数值。磁量子数决定原子轨道在空间的伸展方向,但它与电子的能量无关。例如l =1时,磁量子数可以有三个取值,即m = 0、±1,说明p 轨道在空间有三种不同的伸展方向,即共有3个p 轨道。但这3个p 轨道的能量相同,即能级相同,称为简并或等价轨道。
综上所述,可以看到n 、l 、m 这三个量子数的组合有一定的规律。例如,n = 1时,l 只能等于0,m 也只能等于0,三个量子数的组合只有一种,即1、0、0,说明第一电子层只有一个能级,也只有一个轨道,相应的波函数写成ψ1,0,0或写成ψ1s 。n = 2时,l 可以等于0和1,所以第二电子层共有两个能级。当n = 2、l = 0时,m 只能等于0;而当n = 2、l = 1时,m 可以等于0、±1。它们的量子数组合共有四种,即2,0,0(ψ2s );2,1,0(
);2,1,±1(
,
)。
这也说明第二电子层共有4个轨道,其中2,0,0的组合是一个能级,其余三种组合属第二个较高的能级。由此类推,每个电子层的轨道总数应为n 2
。参见表8-2
表8-2 量子数组合和轨道数
上述三个量子数的合理组合决定了一个原子轨道。但要描述电子的运动状态还需要有第四个量子数—自旋角动量量子数(spin angular momentum quantum number) ,用符号s i 表示。它不是通过解薛定谔方程得来的,所以与n 、l 、m 无关。电子本身还有自旋运动。自旋运动有两种相反的方向,
电子自旋运动示意图
分别用自旋角动量量子数+1/2和-1/2两个数值表示,也可用正反两个箭头符号↑和↓表示。
两个电子的自旋方向相同时称为平行自旋,反之称为反平行自旋。量子力学建立之后也肯定了上述观点。所以一共要有四个量子数,即n、l、m、s i,才能表示一个电子的运动状态。
实例分析:已知基态Na原子的价电子处于最外层3s亚层,试用n、l、m、s i量子数来描述它的运动状态。
解最外层3s亚层的n= 3、l = 0、m= 0,所以它的运动状态可表示为3,0,0,+1/2(或-1/2)。
氢原子核外只有一个电子,若固定原子核,电子的位置虽不确定,但它具有统计规律性。前已述及,∣ψ∣2表示电子在核外空间某点(r,θ,φ)出现的概率密度,为了形象地表示基态氢原子核外空间各处电子出现的概率密度大小的分布情况,将空间各处的∣ψ∣2值的大小用疏密程度不同的小黑点表示出来。这种在单位体积内黑点数与∣ψ∣2成正比的图形称为电子云(electron cloud)。
图8-4是氢原子∣ψ1s∣2对r作图和1s电子云。从图上看出,离核越近,电子云越密集,即电子出现的概率密度愈大;离核愈远,电子云愈稀疏,电子出现的概率密度愈小。注意,不要把电子云中的一个个小黑点看成一个个电子,因为氢原子核外只有一个电子。还要注意,这里讲的是概率密度,不是概率。以后我们往往用电子云来做概率密度的同义词。
为了加深对波函数意义的理解,我们来研究它的图象,以便得到较直观的效果。但波函数是含有r、θ、φ三个自变量的函数,作二维或三维图困难,于是将波函数写出下列一般形式:
ψn,l,m(r,θ,φ) = R n,l(r)2Y l,m(θ,φ),
公式的意义为:波函数可以写成两个函数即R n,l (r)函数和Y l,m(θ,φ)函数的乘积。这个R n,ll(r)函数又称为波函数的径向部分或径向波函数(radial wave function),它是离核距离r的函数,只与n和l两个量子数有关。Y l,m(θ,φ)函数又称为波函数的角度部分或角度波函数(angular wave function),它是方位角θ和φ的函数,只与l和m两个量子数有关。这两个函数分别含有一个和两个自变量,作图没有困难。作图以后,可以从波函数的径向和角度两个侧面去观察电子的运动状态。虽然,每一部分并不能代表完全的波函数,但能说明许多问题。前面表8-1已经列出了解薛定谔方程获得的氢原子的基态和一部分激发态的波函数及其相应的R n,l(r)函数、Y l,m(θ,φ)函数。
氢原子轨道的角度分布图又称为Y函数图
s 轨道角度分布图示意图
如图8-4。Y l,m(θ,φ)值随方位角改变而变化的情况如图8-5,图8-6。由于角度波函数只与轨道角动量量子数和磁量子数有关,而与主量子数无关,只要l、m相同,即使n不同,它们的角度分布图都是一样的。
Y Px的轨道角度分布图
p轨道角度分布图示意图
表示Y值形成的两个波瓣是沿x轴的方向伸展的,而在yz平面上的Y值为零,这个平面称为节面(nodal plane),即函数值为零的平面。
据此可以类推符号为Y Py、Y Pz的轨道角度分布图的含义。
d轨道角度分布图
符号为轨道角度分布图表示Y的波瓣沿xy轴夹角的方向伸展,而在yz平面和xz平面上的Y 值为零,所以,共有两个节面。原子轨道角度分布图是它们的角度波函数通过计算求值作图得到的,
例如,据此可以类推和的轨道角度分布图的含义。至于符号为的轨道角度分布图
则表示Y沿z轴伸展,xy平面还有一个较小环形分布。符号为的轨道角度分布图表示Y
沿x轴和y轴伸展,也有两个节面。s轨道的Y s函数等于= 0.282,说明在任何方位角其值均为相同的常数,所以s 轨道的角度分布图为一球面如图8-5所示。又如p z轨道的Y Pz函数等于
,将各种不同的θ角代入这个函数,可得如下结果:
从原点出发,引出不同θ值时的射线,在射线截取长度为对应的Y Pz值的点,连接这些射线上的点,并将所得图形绕z轴旋转360°,便得到双球面图形。如图8-5所示。
原子轨道角度分布图中的正负号除了反映Y函数值的正负外,也反映电子的波动性。它类似经典波中的波峰与波谷,当两个波相遇产生干涉时,同号则相互加强,异号则相互减弱或抵消。这一点在讨论化学键的形成时有重要意义。
应该指出,Y值的大小(如Y s= 0.282)并不代表电子离核远近的数值,Y值与r的变化无关。只有R n,l(r)函数才与电子离核远近(r)有关。
s、p、d轨道电子云的角度分布图(截面图),简称Y 2图。它是Y 2l,m(θ,φ)对θ,φ
作的图。此图与原子轨道角度分布图相似,但有两点区别,一是Y 2图“瘦”,因为│Y│<1,平方后就更小;二是Y 2图均是正值。无正负号之分。注意,Y 2图只表示在空间不同方位角电子出现的概率密度的变化情况,不表示电子出现的概率密度与距离的关系。
径向分布函数示意图
径向分布函数(radial distribution function)用D(r)表示,D(r)= R2 n ,l (r) 4πr 2。它的意义是表示电子在一个以原子核为中心,半径为r、微单位厚度为d r的同心圆薄球壳夹层内出现的概率,即反映了氢原子核外电子出现的概率与距离r的关系。注意这里讲的是概率而不是概率密度。概率 = 概率密度3体积,薄球壳夹层的表面积为4πr2, 薄球壳夹层的体积为d v= 4πr2d r 。所以,
概率 =∣ψ∣24πr2d r = R2 n ,l (r) 4πr2 d r = D(r) d r
1.在基态氢原子中,电子出现概率的极大值在r=a0(玻尔半径,a0=5
2.9pm)的球面上,它与概率密度极大值处(原子核附近)不一致,核附近概率密度虽然很大,但在此处薄球壳夹层体积几乎小得等于零,随着r的增大,薄球壳夹层体积越来越大,但概率密度却越来越小,这两个相反因素决定1s径向分布函数图在a0出现一个峰,从量子力学的观点来理解,玻尔半径就是电子出现概率最大的球壳离核的距离。
2.径向分布函数图中的峰数有(n- l)个,例如,1s有1个峰,4s有4个峰,2p有1个峰,3p有2个峰…
3.轨道角动量量子数l 相同,主量子数n不同时,主峰距核位置不同,n越小,距核越近,n越大,距核越远,好象电子处于某一电子层。
4.主量子数n相同,轨道角动量量子数l 不同时,n s比n p多一个离核较近的峰,n p又比n d多一个离核较近的峰…第一个峰与核的距离是n s< n p< n d< n f,说明不同l的“钻穿”到核附近的能力不同。钻穿能力的顺序是n s> n p> n d> n f。例如4s的第一个峰竟钻穿到3d的主峰之内去了。这说明玻尔理论中假设的固定轨道是不存在的,外层电子也可以在内层出现,这正反映了电子的波动性。
第二节氢原子的波函数
第二节氢原子的波函数 氢原子的第二个四分之一氢原子的波函数是所有原子中最简单的原子。它的原子核外只有一个电子。移动到原子核外的电子的势能只取决于检查它的吸引力,它的薛定谔?丁格方程可以精确求解。此外,类氢离子,例如氦离子和锂离子,可以被精确地解决。 2+ + 为了方便地解决这个问题,用直角坐标表示的ψ(x,y,z)应由用球面极坐标表示的ψ(r,θ,φ)代替。两者之间的关系如图8-3所示: r代表P点与原点之间的距离,θ、φ称为方位角。x = r sinθcosφy = r sinθsinφz= r cosθ 波函数ψn,l,m(r,θ,φ)和它们相应的氢原子能量列于表8-1 图8-3笛卡儿坐标被转换成球面极坐标表8-1氢原子的一些波函数和它们的能量轨道1s ψn,l,m(r,θ,φ) R n,l (r) A1e-Br Y l,m (θ,Phi)能量/j-2.18310-18a1e-Br-2.18310-18/222 sa 2re-Br/2a 2re-Br/2-2。量子力学借用了玻尔的“原子轨道”的概念,仍然称波函数为“原子轨道”,但是它们的含义是完全不同的。例如,玻尔认为基态氢原子的原子轨道是半径等于52.9 pm的球形轨道在量子力学中,氢原子基态的原子轨道是波函数 ψ1s(r,θ,φ) = A1e-br,其中a1和b是常数,这表明ψ1s随着离核r
的距离的变化在任何方位角变化 ,它代表氢核外1s电子的运动状态,但并不意味着1s电子有确定的运动轨道1s电子的能量为-2.18310焦耳氢核外有许多电子激发态,如ψ2S(R,θ,φ),θ,φ)等。,相应的能量为-5.45310焦耳 -19 -18 (r, )要求解薛定谔方程的ψ和e,必须满足一定的条件才能使解合理。因此,在求解过程中必须引入三个量子数n、l和m当这三个参数的值和组合固定时,就确定了波函数。这三个量子数的极限值及其物理意义如下: 主量子数通常用符号n表示。它可以取任何非零正整数,即1,2,3?n它决定了在最有可能出现在原子核外空间的区域中,电子离原子核的距离,是决定电子能级的主要因素。当n = 1时,电子离原子核的平均距离最近,能量最低n越大,电子离原子核越远,能量越高。所以n也叫做电子壳层数。对于氢原子,电子的能量完全由主量子数决定,即由公式 决定从这个公式可以看出,n越大,e越大(负值的绝对值 越小) 轨道角动量量子数(有机角动量量子数)通常用符号L表示它的值受主量子数的限制。它只能接受小于N的正整数并且包括零,也就是
氢原子的解析解法
氢原子的解析解法 摘要 本文利用分离变量法和级数解法在球坐标系下求解薛定谔方程,得到了氢原 子的本征值......)3,2,1(21 ==n n E E n ,本征态为拉盖尔多项式和球谐函数的组合[]),()2()2()!(2)!1()2( 121/33φθψm l l l n l na r nlm Y na r L na r e l n n l n na ?? ????+--=+---。同时证明了氢原子内部能量、角动量以及角动量空间取向都是量子化的,核外电子的位置只能用概率描 述。 关键词:氢原子;分离变量法;球坐标系;薛定谔方程 1 引言 氢原子是由一个质子和一个电子构成的最简单原子,是研究物质结构的基础。从1885年瑞士数学教师约翰·雅各布·巴尔末(J.J.Balmer )发现氢原子可见光波段的光谱并给出经验公式开始,人们对其的研究就没有松懈过:1908年,德国物理学家弗里德里希·帕邢(Friedrich Paschen )发现了氢原子光谱的帕邢系;1914年,莱曼系被物理学家西奥多·莱曼(Theodore Lyman )发现;1922年,弗雷德里克·萨姆那·布拉克( Frederick Sumner Brackett )发现布拉克线系,位于红外光波段;1924年,物理学家奥古斯特·赫尔曼·蒲芬德( August Herman Pfund )发现氢原子光谱的蒲芬德线系;1953年,科斯蒂·汉弗莱(Curtis J. Humphreys )发现氢原子光谱的汉弗莱线系。 对于这些现象,经典解释是认为电子在原子核的库伦场中运动。但它与实际中氢原子的稳定性和观测到的线状光谱相矛盾,为此引入新观念是必要的。玻尔的原子理论是建立在三个基本假设的基础上:定态假设、频率假设和角动量量子化条件。这些假想是其模型的基石,虽并不是完全的正确,但是可以得到正确的能量答案。 1926年,埃尔文·薛定谔应用他发现的薛定谔方程,以严谨的量子力学分析,清楚地解释了玻耳答案的正确性。氢原子的薛定谔方程的解答有解析法和代数法两种方法,也可以得出氢原子的能级与光谱谱线的频率。薛定谔方程的解答比波耳模型更为精确,能够得到许多电子量子态的波函数(轨域),也能够解释化学键的各向异性。本文介绍了运用解析法求解氢原子的波函数的具体过程。 2球坐标系中的薛定谔方程 2.1角动量方程 三维情况下的薛定谔方程为: ψψE r V m =+?-))(2(22 (2-1)
MATLAB氢原子的波函数
M A T L A B氢原子的波函 数 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】
氢原子的波函数摘要:针对量子力学中氢原子波函数概念抽象的特点,利用MATLAB方便地绘制波函数的三维空间分布图,指出MATLAB软件是解决量子力学可视化的有效工具。 关键词:MATLAB;波函数;氢原子;空间分布 0 引言 量子力学是物理专业必修的一门专业课,它主要研究微观尺度下粒子的行为与相互作用。许多概念如波函数、测不准原理、角动量理论等抽象难懂,一些现象如:隧道效应、势垒反射等与宏观现实不相符,再加上无法直接用肉眼观察,使得量子力学中许多问题不易理解。因此,在量子力学中引入多媒体,增加动态直观的演示。针对量子力学计算复杂、物理量具有矩阵形式等特点,我们最终选择了具有强大计算能力同时一又有极强图像处理能力的数学软件—MATLAB。 1 MATLAB软件介绍 MATLAB是美国Math Work公司从1982年开始推出的一套高性能的数值计算和可视化软件。它集数值分析、矩阵运算和图形显示于一体,构成了一个方便的、界面友好的用户环境。MATLAB程序设计语言结构完整,且具有良好的移植性,易学易用。此外,它还提供了解决各类问题的工具箱,MATLAB己成为应用学科、计算机辅助分析、设计、仿真不可缺少的软件。 MATLAB具有强大的图形绘制能力,为科学研究提供了极大的方使。MATLAB可以绘制二维、三维乃至四维图形,而且能对图形进行线型、立体、色彩、光线、视角等控制。用户只须指定绘图方式,并提供充足的绘图数据,用很少的程序指令就可得到直观、形象的图形结果。借助于MATLAB的数值计算和图形处理技术,我们可以方便地绘
氢原子的波函数
氢原子是所有原子中最简单的原子,它核外仅有一个电子,电子在核外运动时的势能,只决定于核对它的吸引,它的Schr?dinge r方程可以精确求解。能够精确求解的还有类氢离子,如He+、Li2+离子等。 为了求解方便,要把直角坐标表示的ψ(x,y,z) 改换成球极坐标表示的ψ(r,θ,φ),二者的关系如图8-3所示: r表示P点与原点的距离,θ、φ称为方位角。 x = r sinθcosφ y = r sinθsinφ z = r cosθ 解出的氢原子的波函数ψn,l,m(r,θ,φ)及其相应能量列于表8-1中。 图8-3 直角坐标转换成球极坐标 表8-1氢原子的一些波函数及其能量 cos cos sin sin
sin sin * A1、A2、A3、B均为常数 为了方便起见,量子力学借用Bohr N H D理论中“原子轨道” (atomic orbit)的概念,将波函数仍称为原子轨道(atomic orbital),但二者的涵义截然不同。例如:Bohr N H D认为基态氢原子的原子轨道是半径等于52.9 pm的球形轨道。而量子力学中,基态氢原子的原子轨道是波函数 ψ1S(r,θ,φ)=A1e-Br,其中A1 和B均为常数,它说明ψ1S在任意方位角随离核距离r改变而变 化的情况,它代表氢原子核外1s电子的运动状态,但并不表示1s电子有确定的运动轨道。1s电子具有的能量是-2.18310-18J。氢原子核外电子的运动状态还有许多激发态,如ψ2s(r,θ,φ)、(r,θ,φ)等,相应的能量是-5.45310-19J。 要解出薛定谔方程的ψ和E,必须要满足一定的条件,才能使解是合理的,因此,在求解过程中必需引进n , l , m三个量子数。这三个参数的取值和组合一定时,就确定了一个波函数。三个量子数的取值限制和它们的物理意义如下: 常用符号n表示。它可以取非零的任意正整数,即1,2,3 …n 。它决定电子在核外空间出现概率最大的区域离核的远近,并且是决定电子能量高低的主要因素。n = 1时,电子离核的平均距离最近,能量最低。n愈大,电子离核的平均距离愈远,能量愈高。所以n也称为电子层数(electron shell number)。对氢原子来说电子的能量完全由主量子数决定,即由式 决定。从这个式子可以看出,n愈大,E就愈大(负值的绝对 值愈小)。 常用符号l表示。它的取值受主量子数的限制,它只能取小于n的正整数并包括零,即l可以等于0、1、2、3 … (n–1),共可取n个数值。按光谱学的习惯,l = 0时,用符号s表示,l= 1时,用符号p表示,l = 2时,用符号d表示,l = 3时用符号f表示等等。轨道角动量量子数决定原子轨道的形状。如l = 0时,原子轨道呈球形分布;l = 1时,原子轨道呈双球形分布等。在多电子原子中,轨道角动量量子数也是决定电子能量高低的因素。所以,在多电子原子中,主量子数相同、轨道角动量量子数不同的电子,其能量是不相等的,即在同一电子层中的电子还可分为若干不同的能级(energy level)或称为亚层(subshell),当主量子n相同时,轨道角动量量子数l愈大,能量愈高。于是有 E n s<E n p<E n d<E n f。 对氢原子来说,E n s = E n p = E n d = E n f。 常用m 表示。它的取值受轨道角动量量子数的限制。即m 可以等于0、±1、±2,…±l等整
氢原子的量子理论作业(含标准答案)
第26章 氢原子的量子理论 习题 (初稿) 一、填空题 1. 氢原子的波函数可以写成如下形式(,,)()(,)l l nlm nl lm r R r Y ψθ?θ?=,请给出电子出现在 ~r r dr +球壳内的概率为___________,电子出现在(),θ?方向立体角d Ω内的概率为 _______________。 2. 泡利不相容原理是指 ______________ ,原子核外电子排布除遵循泡利不相容原理 外,还应遵循的物理规律是 __________ 。 3. 可以用用 4 个量子数描述原子中电子的量子态,这 4 个量子数各称和取值范围怎样分 别是:(1) (2) (3) (4) 。 4. 根据量子力学原理,如果不考虑电子自旋,对氢原子当n 确定后,对应的总量子态数目 为_ _个,当n 和l 确定后,对应的总量子态数目为__ __个 5. 给出以下两种元素的核外电子排布规律: 钾(Z=19): 铜(Z=29): ___ __ 6. 设有某原子核外的 3d 态电子,其可能的量子数有 个,分别可表示为 ____________________________。 7. 电子自旋与其轨道运动的相互作用是何种性质的作用 。 8. 类氢离子是指___________________,里德伯原子是指________________。 9. 在主量子数为n=2,自旋磁量子数为s=1/2的量子态中,能够填充的最大电子数是 ________。 10. 1921年斯特恩和格拉赫实验中发现,一束处于s 态的原子射线在非均匀磁场中分裂为两 束,对于这种分裂用电子轨道运动的角动量空间取向量子化难于解释,只能用_________来解释。 二、计算题 11. 如果用13.0 eV 的电子轰击处于基态的氢原子,则: (1)氢原子能够被激发到的最高能级是多少? (2)氢原子由上面的最高能级跃迁到基态发出的光子可能波长为多少? (3)如果使处于基态的氢原子电离,至少要多大能量的电子轰击氢原子?
氢原子Schrodinger解中的量子数的物理意义及波函数图形分布
第7节 氢原子Schrodinger 解中的量子数的物理意 义及波函数图形分布 第一部分 上节课复习内容: 第二部分 本节课授课内容: 1、三个量子数的物理意义 2、电子自旋运动的量子数及总量子数 3、波函数与电子云的图形,径向分布函数 4、自然单位 引言:由氢原子及类氢离子的Schrodinger 方程分离出来的三个方程R 方程、Φ方程和Θ方程的解而引入了三个量子数,这三个量子数的物理意义 第二节 量子数的物理意义 一、主量子数n 1、主量子数n 是在解R 方程时引入的,它决定体系能量的高低,即, 对于氢原子及类氢离子,原子轨道的能量在轨道运动中只决定于主量子数 22 22048n Z h e E n ?-=εμ (......,,n 321=) 当n 值变大时,轨道越远离原子核,而当n 无穷大时,体系的能量趋近于0,所以当原子核与电子的距离为无穷远时,氢原子及类氢离子的体系总能量为0,这样的物理模型可以被当做参考体
系的零点。 2、下面考虑能级差随主量子数n 的变化关系 2222048n Z h e E n ?-=εμ,2 2 2204118)n (Z h e E n +?-=+εμ 所以 ???? ??-+?-=-+22222204118n Z )n (Z h e E E n n εμ ??? ? ??+++?=??? ? ??++?=22 222024222202411 1281128)n (n )n (n h Z e n )n (n h Z e εμεμ 所以,当n 增加时,n n E E -+1是减小的,即,随着主量子数n 的增大,能级差是逐渐减小的。 而对于一维势箱: 2428ml h n E n =,2 4 21 81ml h )n (E n +=+,(......,,n 321=) 所以 2 2 22181ml h )n )n ((E E n n -+=-+ 2 2812ml h )n (+= 即:随着量子数n 的增加,一维势箱中的粒子的能级间隔是逐渐加大的。 3、对于氢原子,Z =1 所以
第二节氢原子的波函数
第二节氢原子的波函数 函数 氢原子是所有原子中最简单的原子,它核外仅有一个电子,电子在核外运动时的势能,只决定于核对它的吸引,它的Schr?dinger方程可以精确求解。能够精确求解的还有类氢离子,如He+、Li2+离子等。 为了求解方便,要把直角坐标表示的ψ(x,y,z) 改换成球极坐标表示的ψ(r,θ,φ),二者的关系如图8-3所示: r表示P点与原点的距离,θ、φ称为方位角。x = r sinθcosφy = r sinθsinφz = r cosθ 解出的氢原子的波函数ψn,l,m(r,θ,φ)及其相应能量列于表8-1中。 图8-3 直角坐标转换成球极坐标 表8-1氢原子的一些波函数及其能量 轨道ψn,l,m(r,θ, φ)R n,l (r)Y l,m (θ, φ)能量/J 1s A1e-B r A1e-B r×10-18 2s A2re-B r/2 A2re-B r/2×10-18/22 2p z A3re-B r/2cosθA3re-B r/2 cosθ ×10-18/22 2p x A3re-B r/2sinθcosφA3re-B r/2 sinθcosφ ×10-18/22 2p y A3re-B r/2sinθsinφA3re-B r/2 sinθsinφ ×10-18/22 * A1、A2、A3、B均为常数 为了方便起见,量子力学借用Bohr N H D理论中“原子轨道”(atomic orbit)的概念,将波函数
仍称为原子轨道(atomic orbital),但二者的涵义截然不同。例如:Bohr N H D认为基态氢原子的原子轨道是半径等于pm的球形轨道。而量子力学中,基态氢原子的原子轨道是波函数ψ1S(r,θ,φ)=A1e-Br ,其中A1和B均为常数,它说明ψ1S在任意方位角随离核距离r改变而变化的情况,它代表氢原子核外1s电子的运动状态,但并不表示1s电子有确定的运动轨道。1s电子具有的能量是×10-18J。氢原子核外电子的运动状态还有许多激发态,如ψ2s(r,θ,φ)、(r,θ,φ)等,相应的能量是×10-19J。 量子数 要解出薛定谔方程的ψ和E,必须要满足一定的条件,才能使解是合理的,因此,在求解过程中必需引进n , l , m三个量子数。这三个参数的取值和组合一定时,就确定了一个波函数。三个量子数的取值限制和它们的物理意义如下: 主量子数(principal quantum number) 常用符号n表示。它可以取非零的任意正整数,即1,2,3 …n 。它决定电子在核外空间出现概率最大的区域离核的远近,并且是决定电子能量高低的主要因素。n = 1时,电子离核的平均距离最近,能量最低。n愈大,电子离核的平均距离愈远,能量愈高。所以n也称为电子层数(electron shell number)。对氢原子来说电子的能量完全由主量子数决定,即由式 决定。从这个式子可以看出,n愈大,E就愈大(负值的绝对值愈小)。 轨道角动量量子数(orbital angular momentum quantum number) 常用符号l表示。它的取值受主量子数的限制,它只能取小于n的正整数并包括零,即l可以等于0、1、2、3 …(n– 1),共可取n个数值。按光谱学的习惯,l = 0时,用符号s表示,l = 1时,用符号p表示,l = 2时,用符号d表示,l = 3时用符号f表示等等。轨道角动量量子数决定原子轨道的形状。如l = 0时,原子轨道呈球形分布;l = 1时,原子轨道呈双球形分布等。在多电子原子中,轨道角动量量子数也是决定电子能量高低的因素。所以,在多电子原子中,主量子数相同、轨道角动量量子数不同的电子,其能量是不相等的,即在同一电子层中的电子还可分为若干不同的能级(energy level)或称为亚层(subshell),当主量子n相同时,轨道角动量量子数l愈大,能量愈高。于是有 E n s<E n p<E n d<E n f。对氢原子来说,E n s = E n p = E n d = E n f。 磁量子数(magnetic quantum number) 常用m 表示。它的取值受轨道角动量量子数的限制。即m 可以等于0、±1、±2,…±l等整数。所以,磁量子数共有(2l+1)个数值。磁量子数决定原子轨道在空间的伸展方向,但它与电子的能量无关。例如l =1时,磁量子数可以有三个取值,即m = 0、±1,说明p轨道在空间有三种不同的伸展方向,即共有3个p轨道。但这3个p轨道的能量相同,即能级相同,称为简并或等价轨道。 综上所述,可以看到n、l、m这三个量子数的组合有一定的规律。例如,n = 1时,l只能等于0,m也只能等于0,三个量子数的组合只有一种,即1、0、0,说明第一电子层只有一个能级,也只有一个轨道,相应的波函数写成ψ1,0,0或写成ψ1s 。n = 2时,l可以等于0和1,所以第二电子层共
第二节氢原子的波函数
第二节? 氢原子的波函数 氢原子是所有原子中最简单的原子,它核外仅有一个电子,电子在核外运动时的势能,只决定于核对它的吸引,它的Schr?dinger方程可以精确求解。能够精确求解的还有类氢离子,如He+、Li2+离子等。 为了求解方便,要把直角坐标表示的ψ(x,y,z) 改换成球极坐标表示的ψ(r,θ,φ),二者的关系如图8-3所示: r表示P点与原点的距离,θ、φ称为方位角。 x = r sinθcosφ y = r sinθsinφ z = r cosθ 解出的氢原子的波函数ψn,l,m(r,θ,φ)及其相应能量列于表8-1中。 图8-3 直角坐标转换成球极坐标 表8-1氢原子的一些波函数及其能量 轨道ψn,l,m(r,θ, φ)R n,l (r)Y l,m (θ, φ)能量/J 1s A1e-B r A1e-B r×10-18 2s A2re-B r/2 A2re-B r/2×10-18/22 2p z A3re-B r/2cosθA3re-B r/2 cosθ ×10-18/22 2p x A3re-B r/2sinθcosφA3re-B r/2 sinθcosφ ×10-18/22
2p y A3re-B r/2sinθsinφA3re-B r/2 sinθsinφ ×10-18/22 * A1、A2、A3、B均为常数 为了方便起见,量子力学借用Bohr N H D理论中“原子轨道” (atomic orbit)的概念,将波函数仍称为原子轨道(atomic orbital),但二者的涵义截然不同。例如:Bohr N H D认为基态氢原子的原子轨道是半径等于 pm的球形轨道。而量子力学中,基态氢原子的原子轨道是波函数 ψ1S(r,θ,φ)=A1e-Br,其中A1 和B均为常数,它说明ψ1S在任意方位角随离核距离r改变而变化的情况,它代表氢原子核外1s电子的运动状态,但并不表示1s电子有确定的运动轨道。1s电子具有的能量是×10-18J。氢原子核外电子的运动状态还有许多激发态,如ψ2s(r,θ,φ)、(r,θ,φ)等,相应的能量是×10-19J。 量子数 要解出薛定谔方程的ψ和E,必须要满足一定的条件,才能使解是合理的,因此,在求解过程中必需引进n , l , m三个量子数。这三个参数的取值和组合一定时,就确定了一个波函数。三个量子数的取值限制和它们的物理意义如下: 主量子数(principal quantum number) 常用符号n表示。它可以取非零的任意正整数,即1,2,3 …n 。它决定电子在核外空间出现概率最大的区域离核的远近,并且是决定电子能量高低的主要因素。n = 1时,电子离核的平均距离最近,能量最低。n愈大,电子离核的平均距离愈远,能量愈高。所以n也称为电子层数(electron shell number)。对氢原子来说电子的能量完全由主量子数决定,即由式 决定。从这个式子可以看出,n愈大,E就愈大(负值的绝对值愈小)。 轨道角动量量子数(orbital angular momentum quantum number) 常用符号l表示。它的取值受主量子数的限制,它只能取小于n的正整数并包括零,即l 可以等于0、1、2、3 … (n–1),共可取n个数值。按光谱学的习惯,l = 0时,用符号s表示,l = 1时,用符号p表示,l = 2时,用符号d表示,l = 3时用符号f表示等等。轨道角动量量子数决定原子轨道的形状。如l = 0时,原子轨道呈球形分布;l = 1时,原子轨道呈双球形分布等。在多电子原子中,轨道角动量量子数也是决定电子能量高低的因素。所以,在多电子原子中,主量子数相同、轨道角动量量子数不同的电子,其能量是不相等的,即在同一电子层中的电子还可分为若干不同的能级(energy level)或称为亚层(subshell),当主量子n相同时,轨道角动量量子数l 愈大,能量愈高。于是有 E n s<E n p<E n d<E n f。 对氢原子来说,E n s = E n p = E n d = E n f。 磁量子数(magnetic quantum number)
氢原子的量子理论-作业(含答案)
第26章氢原子的量子理论习题 (初稿) 一、填空题 1. 氢原子的波函数可以写成如下形式(,,)()(,)l l nlm nl lm r R r Y ψθ?θ?=,请给出电子出现在 ~r r dr +球壳内的概率为___________,电子出现在(),θ?方向立体角d Ω内的概率为 _______________。 2. 泡利不相容原理是指______________,原子核外电子排布除遵循泡利不相容原理外,还 应遵循的物理规律是__________。 3. 可以用用 4 个量子数描述原子中电子的量子态,这 4 个量子数各称和取值范围怎样分 别是:(1)(2)(3)(4)。 4. 根据量子力学原理,如果不考虑电子自旋,对氢原子当n 确定后,对应的总量子态数目 为__个,当n 和l 确定后,对应的总量子态数目为____个 5. 给出以下两种元素的核外电子排布规律: 钾(Z=19): 铜(Z=29): _____ 6. 设有某原子核外的 3d 态电子,其可能的量子数有个,分别可表示为 ____________________________。 7. 电子自旋与其轨道运动的相互作用是何种性质的作用。 8. 类氢离子是指___________________,里德伯原子是指________________。 9. 在主量子数为n=2,自旋磁量子数为s=1/2的量子态中,能够填充的最大电子数是 ________。 10. 1921年斯特恩和格拉赫实验中发现,一束处于s 态的原子射线在非均匀磁场中分裂为两 束,对于这种分裂用电子轨道运动的角动量空间取向量子化难于解释,只能用_________来解释。 二、计算题 11. 如果用13.0 eV 的电子轰击处于基态的氢原子,则: (1)氢原子能够被激发到的最高能级是多少? (2)氢原子由上面的最高能级跃迁到基态发出的光子可能波长为多少? (3)如果使处于基态的氢原子电离,至少要多大能量的电子轰击氢原子?
MATLAB氢原子的波函数
氢原子的波函数 摘 要:针对量子力学中氢原子波函数概念抽象的特点,利用MATLAB 方便地绘制波函数的三维空间分布图,指出MATLAB 软件是解决量子力学可视化的有效工具。 关键词:MATLAB ;波函数;氢原子;空间分布 0 引言 量子力学是物理专业必修的一门专业课,它主要研究微观尺度下粒子的行为与相互作用。许多概念如波函数、测不准原理、角动量理论等抽象难懂,一些现象如:隧道效应、势垒反射等与宏观现实不相符,再加上无法直接用肉眼观察,使得量子力学中许多问题不易理解。因此,在量子力学中引入多媒体,增加动态直观的演示。针对量子力学计算复杂、物理量具有矩阵形式等特点,我们最终选择了具有强大计算能力同时一又有极强图像处理能力的数学软件—MATLAB 。 1 MATLAB 软件介绍 MATLAB 是美国Math Work 公司从1982年开始推出的一套高性能的数值计算和可视化软件。它集数值分析、矩阵运算和图形显示于一体,构成了一个方便的、界面友好的用户环境。MATLAB 程序设计语言结构完整,且具有良好的移植性,易学易用。此外,它还提供了解决各类问题的工具箱,MATLAB 己成为应用学科、计算机辅助分析、设计、仿真不可缺少的软件。 MATLAB 具有强大的图形绘制能力,为科学研究提供了极大的方使。MATLAB 可以绘制二维、三维乃至四维图形,而且能对图形进行线型、立体、色彩、光线、视角等控制。用户只须指定绘图方式,并提供充足的绘图数据,用很少的程序指令就可得到直观、形象的图形结果。借助于MATLAB 的数值计算和图形处理技术,我们可以方便地绘制氢原子波函数的空间分布图,直观感受微观状态下电子行为,加深对理论、概念的理解。 2 氢原子波函数模型建立 由量子理论知,氢原子体系满足薛定谔方程: ()()1 1 121222 2 2 2,,1222r r r r r r e E r ψψμμ-?--?-=∑ (1)
第二节--氢原子的波函数
第二节--氢原子的波函数
第二节氢原子的波函数 波函数 氢原子是所有原子中最简单的原子,它核外仅有一个电子,电子在核外运动时的势能,只决定于核对它的吸引,它的Schr?dinge r方程可以精确求解。能够精确求解的还有类氢离子,如He+、Li2+离子等。 为了求解方便,要把直角坐标表示的ψ(x,y,z) 改换成球极坐标表示的ψ(r,θ,φ),二者的关系如图8-3所示: r表示P点与原点的距离,θ、φ称为方位角。 x = r sinθcosφ y = r sinθsinφ z = r cosθ 解出的氢原子的波函数ψn,l,m(r,θ,φ)及其相应能量列于表8-1中。 图8-3 直角坐标转换成球极坐标 表8-1氢原子的一些波函数及其能量 轨道ψn,l,m(r,θ, φ)R n,l (r)Y l,m (θ, φ)能量/J 1s A1e-B r A1e-B r-2.18×10-18 2s A2re-B r/2 A2re-B r/2-2.18×10-18/22 2p z A3re-B r/2cosθA3re-B r/2 cosθ -2.18×10-18/22
2p x A3re-B r/2sinθcosφA3re-B r/2 sinθcosφ -2.18×10-18/22 2p y A3re-B r/2sinθsinφA3re-B r/2 sinθsinφ -2.18×10-18/22 * A1、A2、A3、B均为常数 为了方便起见,量子力学借用Bohr N H D理论中“原子轨道” (atomic orbit)的概念,将波函数仍称为原子轨道(atomic orbital),但二者的涵义截然不同。例如:Bohr N H D认为基态氢原子的原子轨道是半径等于52.9 pm的球形轨道。而量子力学中,基态氢原子的原子轨道是波函 数ψ1S(r,θ,φ)=A1e-Br,其中A1 和B均为常数,它说明ψ1S在任意方位角随离核距离r改变而变化的情况,它代表氢原子核外1s电子的运动状态,但并不表示1s电子有确定的运动轨道。1s 电子具有的能量是-2.18×10-18J。氢原子核外电子的运动状态还有许多激发态,如ψ2s(r,θ,φ)、 (r,θ,φ)等,相应的能量是-5.45×10-19J。 量子数 要解出薛定谔方程的ψ和E,必须要满足一定的条件,才能使解是合理的,因此,在求解过程中必需引进n , l , m三个量子数。这三个参数的取值和组合一定时,就确定了一个波函数。三个量子数的取值限制和它们的物理意义如下: 主量子数(principal quantum number) 常用符号n表示。它可以取非零的任意正整数,即1,2,3 …n 。它决定电子在核外空间出现概率最大的区域离核的远近,并且是决定电子能量高低的主要因素。n = 1时,电子离核的平均距离最近,能量最低。n愈大,电子离核的平均距离愈远,能量愈高。所以n也称为电子层数(electron shell number)。对氢原子来说电子的能量完全由主量子数决定,即由式 决定。从这个式子可以看出,n愈大,E就愈大(负值的绝对值愈小)。 轨道角动量量子数(orbital angular momentum quantum number) 常用符号l表示。它的取值受主量子数的限制,它只能取小于n的正整数并包括零,即l 可以等于0、1、2、3 … (n–1),共可取n个数值。按光谱学的习惯,l = 0时,用符号s表示,l = 1时,用符号p表示,l = 2时,用符号d表示,l = 3时用符号f表示等等。轨道角动量量子数决定原子轨道的形状。如l = 0时,原子轨道呈球形分布;l = 1时,原子轨道呈双球形分布等。在多电子原子中,轨道角动量量子数也是决定电子能量高低的因素。所以,在多电子原子中,主量子数相同、轨道角动量量子数不同的电子,其能量是不相等的,即在同一电子层中的电子还可
