丁基苯酞对大鼠局部脑缺血再灌注损伤皮层钙凋磷酸酶和钙蛋白酶活性的影响

丁基苯酞对大鼠局部脑缺血再灌注损伤皮层
钙凋磷酸酶和钙蛋白酶活性的影响
董高翔,冯亦璞*
(中国医学科学院、中国协和医科大学药物研究所,北京100050)
关键词:丁基苯酞;脑缺血;神经细胞凋亡;钙凋磷酸酶;钙蛋白酶
中图分类号:R965 文献标识码:A 文章编号:0513-4870(2000)10-0790-03
近年大量文献报道蛋白水解酶在缺血性脑损伤中起重要作用。目前有人报道蛋白水解酶钙凋磷酸酶(calcineurin)和钙蛋白酶(calpain)的激活可导致脑缺血神经细胞凋亡而且其抑制剂对缺血性损伤起保护作用[1~3]。丁基苯酞(DL-3-n-buty lphthalide, NBP)是我所近年开发的一个新型抗脑缺血药物,有良好的抗脑缺血作用。研究表明NBP对低氧低糖及大脑中动脉阻断(MCAO)诱导的大鼠皮层神经细胞凋亡有明显的抑制作用[4],这可能是NBP缩小M CAO后脑梗塞体积的原因。本文旨在研究NBP 对凋亡抑制作用的机制是否与大鼠脑皮层calcineurin和calpain的活性改变有关,以期为该药用于临床提供有力的理论依据。
材料和方法
动物 体重260~280g,♂Wistar大鼠,由中国医学科学院动物繁殖中心提供。
试剂与药品 O-phospho-DL-tyrosine,孔雀绿,酪蛋白(钠盐),ly socephalin,钙调素(CaM)及3-N-吗啡啉丙磺酸(M OPS)均为Sigma产品;DTT, Tween-20,β-巯基乙醇为Serva产品;HEPES,EGTA 等为国产分析纯。
大鼠MC AO模型 体重284±19g,♂Wistar 大鼠,以水和氯醛(400mg·kg-1,ip)麻醉,用大脑中动脉栓塞法造成局部性脑缺血2h后,动物重新麻
收稿日期:1999-11-30
基金项目:国家科委1035工程重大项目基金(94-ZD-01)和国家自然科学基金重大项目基金资助(29790122)
作者简介:冯亦璞,女,教授,博士生导师.
*联系人 Tel:(010)63165173,Fax:(010)63017757,
E-mail:fengpy@https://www.360docs.net/doc/e5320211.html, 醉,尼龙线自颈外动脉抽出,恢复颈总动脉血流再灌注24h[5]。
实验分组、给药方式和组织匀浆制备 动物分7组,每组5只:假手术组、缺血对照组、DL-NBP5, 10及20mg·kg-1及D-和L-NBP20mg·kg-1各组。于缺血前10min ip NBP。大鼠于局部脑缺血2 h,再灌注24h后迅速断头取脑,在冰浴上分离出缺血侧皮层和对侧皮层并各分成两份,制成10%的组织匀浆。以测定calcineurin和calpain的活性。
Calcineurin活性测定[6~8] 取缺血侧和对侧皮层,按1∶9的比例加入MOPS缓冲液(mmol·L-1:MOPS25,CaCl20.3,CaM0.025)制成组织匀浆。1000×g离心10min(4℃),取上清液130μL,加6.6mmol·L-1的O-phospho-DL-tyrosine23μL。30℃孵育40min后,以孔雀绿显色反应检测被水解的磷含量。于660nm波长测吸光度。以磷酸二氢钾为标准品制备标准曲线(线性范围为2~16nmol)。Low ry法定量蛋白含量。
Calpain活性测定[9,10] 取皮层组织加入20 mmol·L-1T ris-HCl缓冲液(mmol·L-1:β-mercaptoethanol5;EDTA0.1;DTT10; lysocephalin5)在冰浴上用玻璃匀浆器将其制成组织匀浆,1000×g离心10min(4℃),取上清液置4℃冰箱待测calpain活性。每个样品分成两管,总体积为200μL,一管为无Ca2+体系,内含酪蛋白0.4mg,12mmol·L-1Tris-HCl,1m mol·L-1 EG TA,及上清液40μL;另一管除用1m mol·L-1 CaCl2代替EGTA外,余内容物均相同。25℃反应30min后依此向各管加入蒸馏水3.0mL,考马斯亮蓝-G250染液(考马斯亮蓝-G2500.05%,乙醇23.5%,磷酸42.5%)0.8m L,充分混合10min后
·
790
·药学学报Acta Pharmaceutica Sinica2000,35(10):790-792 DOI:10.16438/j.0513-4870.2000.10.017
于595nm测吸光度。最后每个样品的calpain酶活性用各相应的无钙管吸光度(A)减去有钙管所得差值来计算。各管calpain活性以ΔA/h·mg-1 (protein)表示。蛋白定量采用Low ry法。
数据统计 两酶活性以均数±标准差表示,组间比较用t检验。
结果
1 丁基苯酞对脑缺血再灌损伤缺血侧和对侧皮层calcineurin活性的影响
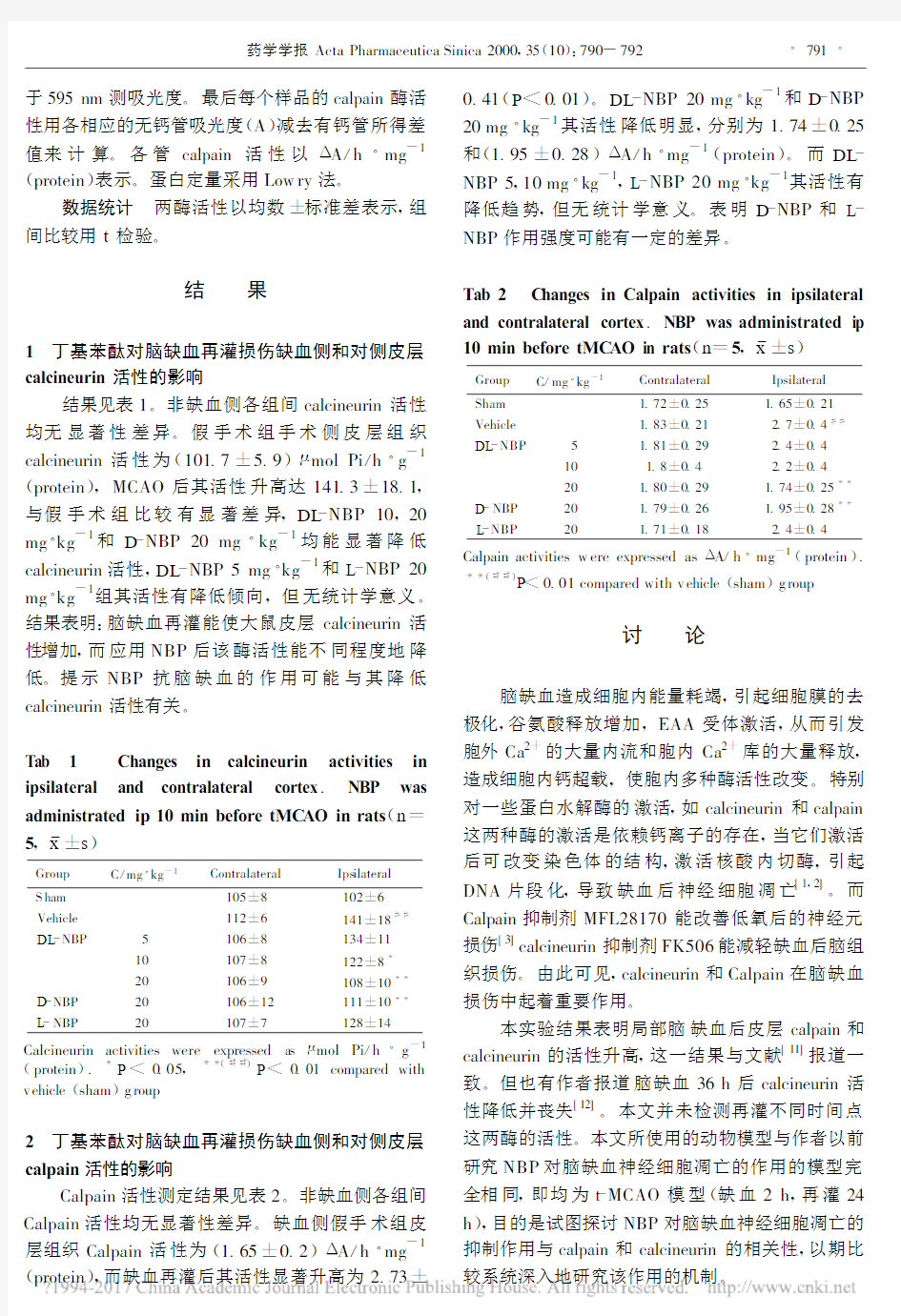
结果见表1。非缺血侧各组间calcineurin活性均无显著性差异。假手术组手术侧皮层组织calcineurin活性为(101.7±5.9)μmol Pi/h·g-1 (protein),MCAO后其活性升高达141.3±18.1,与假手术组比较有显著差异,DL-NBP10,20 mg·kg-1和D-NBP20mg·kg-1均能显著降低calcineurin活性,DL-NBP5mg·kg-1和L-NBP20 mg·kg-1组其活性有降低倾向,但无统计学意义。结果表明:脑缺血再灌能使大鼠皮层calcineurin活性增加,而应用NBP后该酶活性能不同程度地降低。提示NBP抗脑缺血的作用可能与其降低calcineurin活性有关。
Tab1 Changes in calcineurin activities in ipsilateral and contralateral cortex.NBP was administrated ip10min before tMC AO in rats(n= 5,x±s)
Group C/mg·kg-1Contralateral Ips ilateral
S ham105±8102±6
Vehicle112±6141±18## DL-NBP5106±8134±11
10107±8122±8*
20106±9108±10**D-NBP20106±12111±10**L-NBP20107±7128±14 Calcineurin activities were expressed asμmol Pi/h·g-1 (protein).*P<0.05,**(##)P<0.01compared with v ehicle(sham)g roup
2 丁基苯酞对脑缺血再灌损伤缺血侧和对侧皮层calpain活性的影响
Calpain活性测定结果见表2。非缺血侧各组间Calpain活性均无显著性差异。缺血侧假手术组皮层组织Calpain活性为(1.65±0.2)ΔA/h·mg-1 (protein),而缺血再灌后其活性显著升高为2.73±0.41(P<0.01)。DL-NBP20mg·kg-1和D-NBP 20mg·kg-1其活性降低明显,分别为1.74±0.25和(1.95±0.28)ΔA/h·mg-1(protein)。而DL-NBP5,10mg·kg-1,L-NBP20mg·kg-1其活性有降低趋势,但无统计学意义。表明D-NBP和L-NBP作用强度可能有一定的差异。
Tab2 C hanges in Calpain activities in ipsilateral and contralateral cortex.NBP was administrated ip 10min before tMC AO in rats(n=5,x±s)
Group C/mg·kg-1Contralateral Ipsilateral
Sham1.72±0.251.65±0.21 Vehicle1.83±0.212.7±0.4##
DL-NBP51.81±0.292.4±0.4
101.8±0.42.2±0.4
201.80±0.291.74±0.25**
D-NBP201.79±0.261.95±0.28**
L-NBP201.71±0.182.4±0.4
Calpain activities w ere expressed asΔA/h·mg-1(protein).**(##)P<0.01compared with v ehicle(sham)g roup
讨论
脑缺血造成细胞内能量耗竭,引起细胞膜的去极化,谷氨酸释放增加,EAA受体激活,从而引发胞外Ca2+的大量内流和胞内Ca2+库的大量释放,造成细胞内钙超载,使胞内多种酶活性改变。特别对一些蛋白水解酶的激活,如calcineurin和calpain 这两种酶的激活是依赖钙离子的存在,当它们激活后可改变染色体的结构,激活核酸内切酶,引起DNA片段化,导致缺血后神经细胞凋亡[1,2]。而Calpain抑制剂MFL28170能改善低氧后的神经元损伤[3]calcineurin抑制剂FK506能减轻缺血后脑组织损伤。由此可见,calcineurin和Calpain在脑缺血损伤中起着重要作用。
本实验结果表明局部脑缺血后皮层calpain和calcineurin的活性升高,这一结果与文献[11]报道一致。但也有作者报道脑缺血36h后calcineurin活性降低并丧失[12]。本文并未检测再灌不同时间点这两酶的活性。本文所使用的动物模型与作者以前研究NBP对脑缺血神经细胞凋亡的作用的模型完全相同,即均为t-MCAO模型(缺血2h,再灌24 h),目的是试图探讨NBP对脑缺血神经细胞凋亡的抑制作用与calpain和calcineurin的相关性,以期比较系统深入地研究该作用的机制。
·
791
·
药学学报Acta Pharmaceutica Sinica2000,35(10):790-792
NBP 能降低脑缺血侧皮层calcineurin 和Calpain 的活性,从而阻止神经细胞凋亡的启动,减轻脑缺血损伤。NBP 对脑缺血神经细胞凋亡的抑制作用可能与其降低这两酶的活性有关。我们推测
NBP 降低calcineurin 和Calpain 活性的主要原因可能与NBP 降低细胞内钙[13],增加bcl -2表达和减少细胞色素C 从线粒体释放到胞浆中有关(待发表资料)。其原因是:(1)这两种酶的激活是依懒钙的存在;(2)细胞色素C 从线粒体的丢失,可激活这两种蛋白磷酸酶;(3)Bcl -2可抑制细胞色素C 丢失。至于要探讨NBP 对这两种酶的直接作用,则尚待进一步的实验研究。REFERENCES :
[1]Yamashima T ,Saido TC ,Takita M ,et al .T ransient
brain ischemia provokes Ca 2+,PIP2and calpain responses prior to delayed neuronal death in monkeys [J ].Eur J Neurosci ,1996,8(9):1932-1944.[2]M cConkey DJ ,Or renius S .Sig nal transduction pathw ay s
to apoptosis [J ].Stem Cells ,1996,14(6):619-631[3]Chen ZF ,Schottler F ,Lee KS .Neuronal recovery after
moderate hy poxia is improved by the calpain inhibitor M DL28170[J ].Brain Res ,1997,769(1):188-192.[4]Dong GX ,F eng YP .Hypoxia /hy pogly cemia -induced
apoptosis of rat co rtical neurons is prevented by DL -3-n -buty lphthalide .Acta Pharm Sin (in Chinese ),1999,34(3):176-180.
[5]Dong G X ,Feng YP .Effect of DL -3-n -buty lphthalide o n
cortical neuronal apoptosis induced by transient focal
cerebral ischemia in rats [J ].Chin J Pharmacol Tox icol (in Chinese ),2000,14:in press .
[6]
Enan E ,M atsumura F .Specific inhibition of calcineurin by type II sy nthetic py rethroid insecticides [J ].Biochem Pharmacol ,1992,43(8):1777-1784.
[7]
M ar tin B ,Pallen CJ ,Wang JH ,et al .U se of fluorinated ty ro sine phosphates to probe the substrate specificity of the low molecular weight phosphatase activity of calcineurin [J ].J Biol Chem ,1985,260(28):14932-14937.
[8]Hess HH ,Der r JE .Assay of inorganic and organic phospho rus in the 0.1~5nanomo le range [J ].Anal Biochem ,1975,63(2):607-613.[9]
Buroker -Kilgore M ,W ang KK .A coomassie brilliant blue G -250-based colo rimetric assay for measuring activity of calpain and o ther pro teases [J ].Anal Biochem ,1993,208(2):387-392.
[10]Iversen P ,Ertbjerg P ,Larsen LM ,et al .A n FP LC metho d fo r de termination of calpains and calpastatin in porcine m longissimus do rsi [J ].Biochimie ,1993,75(10):869-872.
[11]
Blomgren K ,M cRae A ,Bona E .T he calpain pro teoly tic sy stem in neonatal hypox ic -ischemia [J ].Ann N Y Acad Sci ,1997,825:104-119.
[12]
N agahiro S ,U no M ,Sato k ,et al .Pathophysiology and treatment of cerebral ischemia [J ].J Med Invest ,1998,45(1-4):51-70
[13]
Xiong J ,Feng YP .Effects of 3-n -butylphthalide on the increase of intracellular calcium in neurons subjected to hypoxia and hypog lycemia and its mechanisms [J ].Acta Pharm Sin (in Chinese ),1999,34(12):893-897.
EFFECTS OF 3-N -BUTYLPHTHALIDE ON C ORTICAL CALCINEURIN AND
CALPAIN ACTIVITIES IN FOC AL CEREBRAL ISCHEMIA RATS
DONG Gao -xiang ,FENG Yi -pu
(Institute of Materia Medic a ,Chinese Academy of Medical Sciences and
Peking Union Medical College ,Beijing 100050,China )
ABSTRAC T :AIM To explore if the inhibito ry effect of 3-n -butylphthalide (NBP )on apoptosis induced by transient focal cerebral ischemia in rats is relev ant to co rtical calcineurin and calpain activities .METHODS The model of cerebral ischemia -reperfusion w as used .The activities of the tw o enzy mes were measured by using biochemical methods .RESULTS DL -NBP and D -NBP 20mg ·kg -1
were found to significantly reduce ischemia ipsilateral co rtical calcineurin and calpain activities .However ,L -NBP 20mg ·kg -1show ed no obvious effect .C ONCLUSION The anti -apoptotic effect of NBP m ay be relevant to its inhibition of calcineurin and calpain activities in focal cerebral ischemia rats .
KEY W ORDS :3-n -butylphthalide ;transient focal cerebral ischemia ;neuronal apoptosis ;calcineurin ;calpain
·792·药学学报Acta Pharmaceutica Sinica 2000,35(10):790-792
中国白癜风诊疗共识(2014版)
白癜风诊疗共识(2014版) 中国中西医结合学会皮肤性病专业委员会色素病学组 本指南以中国中西医结合学会皮肤性病专业委员会色素病学组制订的白癜风治疗共识(2009版)为基础,经色素病学组、中华医学会皮肤科分会白癜风研究中心部分专家及国内相关专家讨论制定。参加起草及讨 论的成员(按姓氏汉语拼音排序):傅雯雯、高天文、何黎、贾虹、李恒进、李铁男、李珊山、卢忠、鲁严、 李春英、李强、刘清、马东来、乔树芳、秦万章、宋智琦、孙越、宋秀祖、涂彩霞、温海、王玮蓁、许爱娥、项蕾红、张学军、张建中、郑志忠、赵广、朱光斗。 白癜风治疗目的是控制皮损发展,促进白斑复色。 一、选择治疗方法时主要考虑因素: 1.病期:分进展期和稳定期。进展期判定参考白癜风疾病活动度评分(VIDA)积分、同形反应、Wood灯。①VIDA积分:近6周内出现新皮损或原皮损扩大(+4分),近3个月出现新皮损或原皮损扩大(+3分),近6个月出现新皮损或原皮损扩大(+2分);近1年出现新皮损或原皮损扩大(+1分);至少稳定1年(0分);至少稳定1年且有自发色素再生(-1分)。总分>1分即为进展期,≥4分为快速进展期;②同形反应:皮肤损伤1年内局部出现白斑。损伤包括物理性(创伤、切割伤、抓伤)、机械性摩擦、化学性/热灼伤、过敏性(接触性皮炎)或刺激性反应(接种疫苗、纹身等)、慢性压力、炎症性皮肤病、治疗性(放射治疗、光疗)。白斑发生于持续的压力或摩擦部位,或者是衣物,饰品的慢性摩擦部位,形状特殊,明显由损伤诱发;③Wood灯:皮损颜色呈灰白色,边界欠清,wood灯下皮损面积大于目测面积,提示是进展期。皮损颜色是白色,边界清,wood灯下皮损面积≤目测面积,提示是稳定期。以上3条符合任何一条即可考虑病情进展;④可同时参考激光共聚焦扫描显微镜(简称皮肤CT)和皮肤镜的图像改变,辅以诊断。 2.白斑面积(手掌面积约为体表面积1%):1级为轻度,<l%;2级为中度,l%~5%; 3级为中重度,6%~50%;4级为重度,>50%。白斑面积也可按白癜风面积评分指数(vitiligo area scoring index,VASI)来判定。VASI=∑(身体各部占手掌单元数)×该区域色素脱失所占百分比,VASI值为0~100。 3.型别:根据2012年白癜风全球问题共识大会(VGICC)及专家讨论,分为节段型、非节段型、混合型及未定类型白癜风。①节段型白癜风:沿某一皮神经节段分布(完全或部分匹配皮肤节段),单侧的不对称的白癜风。少数可双侧多节段分布;②非节段型白癜风:包括散发型、泛发型、面肢端型和黏膜型。散发型指白斑≥2片,面积为1~3级;泛发型为白斑面积4级(>50%);面肢端型指白斑主要局限于头面、手足,尤其好发于指趾远端及面部腔口周围,可发展为散发型、泛发型;黏膜型指白斑分布于2个及以上黏膜部位,可发展为散发型、泛发型;③混合型白癜风:节段型和非节段型并存;④未定类型白癜风:指非节段型分布的单片皮损,面积为1级。 4.疗效:面部复色疗效好,口唇、手足部位复色疗效差。病程越短,疗效越好。儿童疗效优于成人。 二、治疗原则 (一)进展期白癜风: 1.未定类型(原称局限型):可外用糖皮质激素(简称激素)或钙调神经磷酸酶抑制剂(他克莫司软膏、吡美莫司乳膏)等,也可外用低浓度的光敏药,如浓度<0.1%的8-甲氧沙林(8-MOP);维生素D3衍生物;局部光疗可选窄谱中波紫外线(NB-UVB)、308nm准分子激光及准分子光。
钙离子处理对肌细胞组织特异性钙激活中性蛋白酶calpain3的影响
钙离子处理对肌细胞组织特异性钙激活中性蛋白酶 calpain3的影响 朱燕1,2 童敏1 罗欣1,2徐幸莲1 周光宏1? (1南京农业大学农业部农产品加工重点开放实验室210095, 2山东农业大学食品科学与工程学院271018) 摘 要:本研究利用RT-PCR和Western blot方法研究钙离子处理对成肌细胞L6形态、分化的影响以及calpain3基因mRNA水平表达和蛋白水平降解的调控。结果表明,成肌细胞L6的细胞分化程度随着钙离子浓度的增加而增大,且死亡细胞明显增多。RT-PCR和Western blot结果表明钙离子处理后calpain3mRNA个样品之间的表达无明显差别,但是免疫印迹图谱却发现,钙离子处理组与对照组相比,94kDa处的条带颜色稍有降低,55kDa处的条带颜色加深,说明有更多的小片段生成,且钙离子浓度大于200μM时94kDa处的条带消失。 关键词:RT-PCR L6成肌细胞 Western blot 骨骼肌特异性钙激活中性蛋白酶,P94是calpain超家族的一员,虽然其在活体中的功能不详,但可能对骨骼肌功能的发挥起到必不可少的作用[1](Sorimachi 2000)。Calpain3蛋白分子由四个结构域组成,这与Calpain1 和Calpain2的大亚基有较高的同源性[2]。除此以外,Calpain3还具有3个特异性的结构,分别是N-端延伸亚基(NS)和两个插入序列:结构域Ⅱ内的插入序列IS1和结构域Ⅲ和Ⅳ之间的插入序列IS2,而IS2与核转导信号具有相似序列。 由于研究发现Calpain3的mRNA表达水平大约是Calpain1 和Calpain2的十倍之多,因而calpain3对于肌肉功能的作用引起人们的极大兴趣。Richard[3](1995)发现calpain3基因突变可以导致2A型肌营养不良症(LGMD2A)的产生,从基因水平证实了起初科学家对于calpain3功能的猜想。自动降解性是Calpain3最主要的性质[45][46],在低或无钙离子存在的情况下Calpain3的半寿期(half live)小于10min。迅速的自动降解性,使得人们几乎无法在离体条件下研究calpain3的用,进而人们把研究方向转向对calpain3表达调控的研究。有的学者利用反义RNA技术对calpain3的mRNA干扰,导致细胞中缺乏含有弥漫α-actitin 的成熟Z盘[4](Poussard et al, 1996)。此外,研究表明大多数情况下缺乏calpain3的活性会导致肌肉的病理反应[5](Kihbara 1998)。 Calpain3作为钙激活中性蛋白酶超家族一员,结构中也含有EF手型这种钙调控结构,表明钙离子也可能是这种蛋白酶的一个重要的调控因子。且在钙离子对calpain3降解的影响上还存在较大争议。本研究利用L6为研究对象,探讨钙离子处理对活体肌细胞中calpain3表达的影响。 1材料与方法 1.1 成肌细胞培养、分化和Ca2+处理 大鼠L6成肌细胞系(购于中国科学院上海细胞库,源自ATCC)按照1.5×105的密度 基金项目:教育部博士点基金(20020307006),国家自然科学基金资助项目(30371016) 作者简介:朱燕(1974-),博士研究生,讲师,主要研究方向:肉品质量控制。*通讯作者Corresponding author:周光宏(1960-),Email:ghzhou@https://www.360docs.net/doc/e5320211.html,
钙调磷酸酶抑制剂
钙调磷酸酶抑制剂 (一)器官移植排斥反应 1、移植排斥反应 人体的免疫系统对各种致病因子有着非常完善的防御机制,能够对细菌、病毒、异物、异体组织、人造材料等“异己成分”进行攻击、破坏、清除,这种复杂的免疫学反应是人体非常重要的一种保护机制。受者进行同种异体组织或器官移植后,外来的组织或器官等移植物作为一种“异己成分”被受者免疫系统识别,后者发起针对移植物的攻击、破坏和清除,这种免疫学反应就是移植排斥反应(transplant rejection)。移植排斥反应是影响移植物存活的主要因素之一。 移植排斥反应是非常复杂的免疫学现象,涉及细胞和抗体介导的多种免疫损伤机制,发生原因主要是受体和移植物的人类白细胞抗原HLA(human leucocyte antigen)不同。因此,供者与受者HLA的差异程度决定了排异反应的轻或重。除同卵双生外,二个个体具有完全相同的HLA 系统的组织配型几乎是不存在的,因此在供受者进行配型时,选择HLA配型尽可能地接近的供者,是减少异体组织、器官移植后移植排斥反应的关键 2、发病机制 排斥反应的发生机制主要包括细胞免疫和体液免疫两个方面。临床最常见的急性排斥反应主要由细胞免疫介导,而超急性排斥反应和慢性排斥反应主要由体液免疫介导。 (1)细胞介导的排斥反应 细胞免疫在急性排斥反应发生发展过程中起主导作用。移植物中供体的淋巴细胞和树突状细胞具有丰富的HLA-Ⅰ和Ⅱ类抗原,是诱发排斥反应的主要致敏原。在移植物植入受体后,随着移植物的血液循环重建,供者的HLA-Ⅰ和Ⅱ类抗原不可避免的暴露于受者的免疫系统,受者的免疫细胞识别外来抗原后,即可引发下述一系列免疫反应: CD8+细胞毒性T细胞前体细胞与供者HLA-Ⅰ类抗原结合后活化增殖为成熟的细 胞毒性T细胞,对移植物产生攻击效应;CD4+T辅助细胞识别供体HLA-Ⅱ类抗原,促使抗原递呈细胞释放IL-I,后者可促进T辅助细胞增殖和释放IL-2,IL-2可进一步促进T辅助细胞增殖并为细胞毒性T细胞的分化提供辅助信号;除了IL-2之外,TH
常见蛋白酶抑制剂
当前位置:生物帮 > 实验技巧 > 生物化学技术 > 正文 蛋白酶及蛋白酶抑制剂大全 日期:2012-06-13 来源:互联网 标签: 相关专题:解析蛋白酶活性测定聚焦蛋白酶研究新进展 摘要: 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度 恩必美生物新一轮2-5折生物试剂大促销! Ibidi细胞灌流培养系统-模拟血管血液流动状态下的细胞培养系统 广州赛诚生物基因表达调控专题 蛋白酶抑制剂 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度。由于蛋白酶抑制剂在液体中的溶解度极低,尤其应注意在缓冲液中加人蛋白酶抑制剂时应充分混匀以减少蛋白酶抑制剂的沉淀。在宝灵曼公司的目录上可查到更完整的蛋白酶和蛋白酶抑制剂表。 常用抑制剂 PMSF 1)抑制丝氨酸蛋白酶(如胰凝乳蛋白酶,胰蛋白酶,凝血酶)和巯基蛋白酶(如木瓜蛋白酶); 2)10mg/ml溶于异丙醇中; 3)在室温下可保存一年; 4)工作浓度:17~174ug/ml(0.1~1.0mmol/L); 5)在水液体溶液中不稳定,必须在每一分离和纯化步骤中加入新鲜的PMSF。 EDTA 1)抑制金属蛋白水解酶; 2)0.5mol/L水溶液,pH8~9;
钙调磷酸酶在神经退行性疾病中的作用
钙调磷酸酶在神经退行性疾病中的作用 报告人:张海宏张强强昔强强 一.文献概述 文献主要讲述了钙调磷酸酶在由蛋白质作物折叠和内质网应激引起的神经退行性疾病 中的作用。那么什么是神经退行性疾病呢? 神经退行性疾病是由错误折叠的蛋白质在大脑中积累导致神经元功能障碍。证据表明:错误折叠的蛋白质通过诱导内质网压力和改变钙的稳态平衡来破坏细胞。胞质钙浓度的变化导致信号传导通路障碍,钙介导的超活化钙调磷酸酶(CaN)是大脑中的主要磷酸酶,能够引起大脑功能障碍和神经突触触发器死亡,导致形成神经退行性疾病。因此,抑制钙调磷酸酶的活性可能在脑损伤的神经退行性疾病治疗方面是一个很有前途的策略。 神经退行性疾病是破坏人的神经元细胞或神经突触,导致人类得病,影响人类,包括抽象思维,熟练的动作,情绪情感,认知与众不同的品质,主要病类包括阿尔茨海默病,帕金森病,海绵状脑病,与肌萎缩侧索硬化症(ALS)等。令人信服的证据表明,脑蛋白错误折叠和聚集是典型的这些疾病的发病机制和最有可能引发特征。错误折叠蛋白的积累可能导致突触异常和神经元死亡,并最终产生脑功能障碍和疾病。.目前,还没有有效的治疗这些疾病或为任何症状前诊断。为了确定新的策略进行治疗,必须了解蛋白质错误折叠的机制和途径,其中错误折叠的聚集诱导神经元死亡和突触的改 二.主要内容 1、内质网应激与钙浓度的变化。 2、钙调磷酸酶生物学。 3、在神经元动态平衡中钙调磷酸酶的作用。 4、钙调磷酸酶和神经退化性。 5、钙调磷酸酶和突触功能障碍。 三、研究内容 1、内质网应激与钙浓度的变化。 什么是内质网应激呢?内质网应激:(内质网压力ERS)是指由于某种原因使细胞质网生理功能发生紊乱的一种亚细胞器病理状态。内质网处于长期的压力下,在内质网腔中逐渐积累错误折叠的蛋白质,而细胞自身可以通过放缓翻译速度并增加正确折叠的蛋白质产物来进行矫正。但随着压力的持续影响,转录因子CHOP延长表达会引起细胞凋亡,这种细胞凋亡体系是由从内质网中释放的钙离子引发的,最终导致神经病变 2、钙调磷酸酶生物学 钙调磷酸酶(简称CaN ):依赖钙和钙调蛋白的丝氨酸/苏氨酸磷酸酶,激活磷酸化的转录因子NF-ATp,参与T细胞激活信号的转导, CaN的结构和功能是当前研究很活跃的领域,由于其在神经及免疫系统中发挥着重要的作用,尤其是90年代后证明它在T细胞活化过程中起关键作用。CaN是迄今所知的惟一一种受Ca~(2+)/钙调蛋白调节的丝氨酸/苏氨酸蛋白磷酸酶。CaN广泛分布于机体内各种组织中,参与多种受Ca~(2+)调节的信号转导通路,并通过作用于不同的底物而产生不同的生物学效应。新近研究表明,CaN信号通路的下游信号因子-T细胞激活核因子在心房颤动(房颤)的发生发展中起重要作用.
常见蛋白酶抑制剂
蛋白酶及蛋白酶抑制剂大全 标签: 相关专题:解析蛋白酶活性测定聚焦蛋白酶研究新进展 摘要: 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度 恩必美生物新一轮2-5折生物试剂大促销! Ibidi细胞灌流培养系统-模拟血管血液流动状态下的细胞培养系统 广州赛诚生物基因表达调控专题 蛋白酶抑制剂 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度。由于蛋白酶抑制剂在液体中的溶解度极低,尤其应注意在缓冲液中加人蛋白酶抑制剂时应充分混匀以减少蛋白酶抑制剂的沉淀。在宝灵曼公司的目录上可查到更完整的蛋白酶和蛋白酶抑制剂表。 常用抑制剂 PMSF 1)抑制丝氨酸蛋白酶(如胰凝乳蛋白酶,胰蛋白酶,凝血酶)和巯基蛋白酶(如木瓜蛋白酶); 2)10mg/ml溶于异丙醇中; 3)在室温下可保存一年; 4)工作浓度:17~174ug/ml(0.1~1.0mmol/L); 5)在水液体溶液中不稳定,必须在每一分离和纯化步骤中加入新鲜的PMSF。 EDTA 1)抑制金属蛋白水解酶; 2)0.5mol/L水溶液,pH8~9; 3)溶液在4℃稳定六个月以上;
4)工作浓度:0.5~1.5mmol/L. (0.2~0.5mg/ml); 5)加入NaOH调节溶液的pH值,否则EDTA不溶解。 胃蛋白酶抑制剂(pepst anti n) l)抑制酸性蛋白酶如胃蛋白酶,血管紧张肽原酶,组织蛋白酶D和凝乳酶; 2)1mg/ml溶于甲醇中; 3}储存液在4℃一周内稳定,-20℃稳定6个月; 4)1作浓度:0.7ug/ml(1umol/L) 5)在水中不溶解。 亮抑蛋白酶肽(leupeptin) 1)抑制丝氨酸和巯基蛋白酶,如木瓜蛋白酶,血浆酶和组织蛋白酶B; 2)lOmg/ml溶于水; 3)储存液4℃稳定一周,-20℃稳定6个月; 4)工作浓度0.5mg/ml。 胰蛋白酶抑制剂(aprotinin) 1)抑制丝氨酸蛋白酶,如血浆酶,血管舒缓素,胰蛋白酶和胰凝乳蛋白酶; 2)lOmg/ml溶于水,pH7~8 3}储存液4℃稳定一周,-20℃稳定6个月; 4)工作浓度:0.06~2.0ug/ml(0.01~0.3umol/L); 5)避免反复冻融: 6)在pH>12.8时失活。 蛋白酶抑制剂混合使用 35ug/ml PMSF…………………………………丝氨酸蛋白酶抑制剂 0.3mg/ml EDTA…………………………………金属蛋白酶抑制剂 0.7ug/ml胃蛋白酶抑制剂(Pepstatin)…………酸性蛋白酶抑制剂 0.5ug/ml亮抑蛋白肽酶(Leupeptin)……………广谱蛋白酶抑制剂
PCR法扩增钙激活酶激活蛋白cDNA
001963 J.S hanxi Agric .Un i v . 学报 收稿日期: 2004-04-20 修回日期:2004-05-17 作者简介:常 泓(1968-),女(汉),山西榆次人,副教授,博士,主要从事分子生物学及生物技术的研究。 基金项目:国家自然科学基金资助课题(30271003);山西省科技攻关项目(011030);山西省青年基金项目(20021038) 文章编号:1671-8151(2005)01-0064-04 PCR 法扩增钙激活酶激活蛋白c DNA 常 泓1 ,南庆贤2 ,岳文斌 3 (1.山西农业大学生命科学学院,山西太谷030801; 2.中国农业大学食品学院,北京100094;3.山西农业大学动物科技学院,山西太谷030801) 摘 要:钙激活酶激活蛋白是钙激活酶的激活蛋白,可以促进钙激活酶活性的发挥,从而促进肉的嫩化。采用PCR 技术,以山羊肝脏cDNA 为模板经扩增得到钙激活酶激活蛋白(ca l pa i n activator)基因,并进行了序列测定。该片段长1017bp ,5 端非翻译区长39bp ,3 端非翻译区长567bp 。编码区长411bp ,编码一个长137个氨基酸残基的蛋白质,其理论分子量为14298D a 。与Edon M e llon i 等(1998)报道的从牛脑中提取纯化的钙激活酶激活蛋白的氨基酸序列相比发现,二者仅有五个位点不同。关键词:钙激活酶激活蛋白; cDNA 文库;聚合酶链式反应 中图分类号:S81 文献标识码:A Am plificati o n of C al p ain A ctivat or c DNA usi n g PCR CHANG Hong et a.l (C olle ge of L i f e S cience ,Shanx i Agr icultural Universit y,T ai gu Shanx i 030801,China )Abstract :T he c DNA o f ca l pa i n activator , a prote i n that can ac tivate calpa i n ,w as a m plified by po l ym erase chain reacti on (PCR )w it h te m plate of cDNA of goat li ve r .T he a mp lified frag m ent w as c l oned and sequenced .The c DNA,cons i sti ng o f 1017bp ,had a 5 un translated reg ion of 39bp and 3 untranslated reg i on o f 567bp .The cod i ng reg i on w as 411bp i n s i ze and encoded a pepti de o f 137a m i no ac i d resi dues w ith a theoretical m olecu lar m ass o f 14298D a .Compar i ng w ith t he resu lt o f Edon M ell on i e t .al (1998),there w ere fi ve d ifferen t site o f a m i no acid .K ey word s :Ca l pa i n acti va t o r ; c DNA library ;PCR 最新的研究表明,钙激活酶激活蛋白(cal pa i n activator )[1] 是钙激活酶(calpa i n EC 3 4 22 17)活性的主要调节者,对活体组织中钙激活酶活性的发挥起着主要的激活作用。钙激活酶激活蛋白是钙激活酶系统中除钙激活酶抑制蛋 白(cal p astati n )[2] 外的另一个调节者,钙激活酶激活蛋白是钙激活酶系统的一个新成员。 钙激活酶系统是高度可调的、依赖于C a 2+ 的蛋白质水解酶系统,参与细胞内一系列变化。[2~5] 在活体肌肉组织中,钙激活酶是导致肌纤维蛋白降解的主要因素[2,4] 。试验研究还表明,钙激活酶同样是宰后肌肉成熟过程中肌原纤维降解的主要因素,直接关系到肉的嫩化程度,而嫩度是影 响肉品质的关键因素[6] 。促进肉嫩化,提高肉的 嫩度是畜牧业和食品工业面临的一个很重要的问 题。但是,活体组织中钙激活酶是如何被激活的一直是个迷,如何激活钙激活酶而促进肉嫩化更 无法实现。近年来,许多科学家分析[7] ,在钙激活酶系统中存在一个钙激活酶活性的直接调节者, 它可以增强钙激活酶在生理条件下对Ca 2+ 的亲和 性,促进C a 2+与钙激活酶在C a 2+ 结合位点结合,从而促进钙激活酶活性的发挥。 首次发现钙激活酶激活蛋白的是美国Texas 健康科学中心大学生理和药理系D e M arti n o 等人[1] 。1998年以来[8~10] ,意大利热那瓦大学生化研究所的Pontre m o li 和M ellon i 等人对钙激活酶激活蛋白的研究较多。目前已知其氨基酸序列和c DNA 序列。钙激活酶激活蛋白是一个分子量为
中性蛋白酶
1.1中性蛋白酶的来源 蛋白酶是一类催化蛋白质肽键,生成蛋白胨、蛋白肽及氨基酸等产物的水解酶,其广泛分布于自然界的植物、动物和微生物中。例如木瓜蛋白酶主要来自于植物木瓜,胰蛋白酶来自动物的胰腺,来自微生物的蛋白酶没有特定名称,例如有来自AS1.398枯草芽孢杆菌的蛋白酶,有来自宇佐美曲霉的蛋白酶等等,其中微生物来源的蛋白酶数量与种类最多,也最具研究、开发与生产价值。随着水解条件之一的pH值的升高,蛋白酶分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶,这也同时划分了它们应用的领域有所不同。 1.2中性蛋白酶的研究现状 对于中性蛋白酶的研究主要集中于以下几个方面: 一是继续研究发现新的蛋白酶品种,为蛋白酶家族添加新成员,尽管此项工作的难度越来越大,但其意义不容否认。 二是对现有蛋白酶进行修饰、改性,延长和强化其功能,期望在降低应用成本的同时,减少酶本身的一些缺陷对其应用的限制。 三是通过生物技术手段提高酶产量,降低酶生产成本。现代生物技术不仅发达而且发展很快,技术应用的可选择范围也很广,例如物理或化学诱变技术、细胞质融合技术、转基因技术以及克隆技术等等。可以肯定和确认的是:上述技术的应用都取得了不同程度的效果;同时这些技术各有优势,所以并存至今。 四是提取和纯化技术方面,朱建星利用萃取技术使酶液浓度提高到发酵酶液的3.6倍多。刘东旺等应用盐析、层析和凝胶过滤等技术,纯化后的酶活力超过纯化前的19倍之多等等。此外,在纯化倍数提高的同时往往伴随着提取率的提高。 1.3中性蛋白酶的生产现状 中性蛋白酶的生产水平随着研究水平的提高而提高。总体上发达国家高于国内,而国内厂家之间也参差不齐,以微生物发酵来源的中性蛋白酶为例,报道说的范围从数百至一万多(u/ml)都有。导致这种差别的原因可能是不同类的菌种,不同来源的同类菌种,不同的菌株改良程度,不同的发酵工艺优化水平等等。 1.4中性蛋白酶的应用 蛋白酶在工业化应用酶中占的比例很大(超过50%),而中性蛋白酶在蛋白酶中占的比例也很大。占比大的原因之一是应用范围大而广。以中性蛋白酶为例,它可用于皮革业提高皮革的质量;可用于牙膏帮助清除牙渍;可用于饲料以提高消化吸收率;用于食品加工最为广泛,加入待焙烤的面团中可以调节面团筋力,加入肉类中可以使肉制品嫩化、改善口感,加入牛奶中可以加速凝乳,加入以蛋白质为主的废弃料中可以制取多种水解产品。 在蛋白酶应用中有些问题令人困惑不解值得重视,例如不同来源的蛋白酶水解蛋白质的主要位点有差别,所以即使使用同一种蛋白质原料,不同来源蛋白酶的水解产物和水解率也会有所区别;如果混合食用不同来源的蛋白酶,假如总酶量与单一蛋白酶相同,由于水解的主要位点增加,也有可能提高水解率和水解程度。 另外用于食品水解的蛋白酶还有一层要求就是风味和口味,目前主要问题是口味即苦味。尽管“风味蛋白酶”的诞生在一定程度上降低了疏水基团的外露,很大程度上减少了水解产物的苦味,不过因其高昂的价格和苦味的残留依然不能得心应手地应用。 1.5本课题的研究目的与意义 从上述内容可知,虽然蛋白酶的研究、生产与应用已相对成熟,但是还有一些问题值得研究和解决,包括为提高产酶量而进行的菌种特性的改善、发酵工艺的优化、发酵酶液的浓缩与纯化等等。其中最基础的就是菌种产酶能力的提高。 尽管前面提到各种改善菌种的现代生物技术,包括物理或化学诱变技术、细胞质融合技术、转基因技术以及克隆技术等等,有的已经相当先进。但是从成本性、发酵副产物的安全性与稳定性、实用技术的可推广性等方面考虑,对菌种进行诱变不失为行之有效和有研究价值的研究。虽然诱变
白癜风诊疗指南2014
白癜风诊疗指南2014 本指南以中国中西医结合学会皮肤性病专业委员会色素病学组制订的白癜风治疗共识(2009版)为基础,经色素病学组、中华医学会皮肤科分会白癜风研究中心部分专家及国内相关专家讨论制定。 白癜风治疗目的是控制皮损发展,促进白斑复色。 一、选择治疗方法时主要考虑因素: 1.病期:分进展期和稳定期。进展期判定参考白癜风疾病活动度评分(VIDA)积分[1]、同形反应、Wood灯。①VIDA积分:近6周内出现新皮损或原皮损扩大(+4分),近3个月出现新皮损或原皮损扩大(+3分),近6个月出现新皮损或原皮损扩大(+2分);近1年出现新皮损或原皮损扩大(+1分);至少稳定1年(0分);至少稳定1年且有自发色素再生(-1分)。总分>1分即为进展期,≥4分为快速进展期;②同形反应:皮肤损伤1年内局部出现白斑。损伤包括物理性(创伤、切割伤、抓伤)、机械性摩擦、化学性/热灼伤、过敏性(接触性皮炎)或刺激性反应(接种疫苗、纹身等)、慢性压力、炎症性皮肤病、治疗性(放射治疗、光疗)。白斑发生于持续的压力或摩擦部位,或者是衣物,饰品的慢性摩擦部位,形状特殊,明显由损伤诱发;③Wood灯:皮损颜色呈灰白色,边界欠清,Wood灯下皮损面积大于目测面积,提示是进展期。皮损颜色是白色,边界清,Wood灯下皮损面积≤目测面积,提示是稳定期。以上3条符合任何一条即可考虑病情进展;④可同时参考激光共聚焦扫描显微镜(简称皮肤CT)[2]和皮肤镜的图像改变,辅以诊断。 2.白斑面积(手掌面积约为体表面积1%):1级为轻度,<1%;2级为中度,1%~5%;3级为中重度,6%~50%;4级为重度,>50%。白斑面积也可按白癜风面积评分指数(vitiligo area scoring index,VASI)来判定。VASI=Σ(身体各部占手掌单元数)×该区域色素脱失所占百分比,VASI值为0~100[3]。 3.型别:根据2012年白癜风全球问题共识大会(VGICC)及专家讨论,分为节段型、非节段型、混合型及未定类型白癜风。①节段型白癜风:沿某一皮神经节段
钙调神经磷酸酶催化结构域的活性和性质
381 钙调神经磷酸酶催化结构域的活性和性质 杨淑杰 魏 群(
382 1 材料与方法 ( , Nde μ° °×μ?ó?ò??a Bio-Rad 公司产品. 抗 CNA 和催化结构域多肽的多克隆抗体为本实验室制备的 [13]. DNA 测序按照双脱氧链终止法进行. (
383 blotting 印迹检测, 用本室制备的抗CNA 的多克隆抗体检测CNA 和催化结构域多肽, 两者都可被识别, 证明催化结构域多肽是CNA 的突变体. 2.2 催化结构域多肽和CNA 磷酸酶活力比较 用Mn 2+做激活剂, 按材料和方法进行磷酸酶活力分析. 分别测定在下列4种情况下的CNA 及CNA 催化结构域多肽的磷酸酶活力 : 加 CaM; 加CaM 和CNB. CNA 的磷酸酶活力是依次增加的, 而CNA 催化结构域多肽的比活力基本保持不变(图2). 两者相比, 在有CaM 和CNB 时, CNA 催化结构域多肽的活力为CNA 的20倍. 2.3 金属离子对磷酸酶活性的调节 ( 无EGTA 和Ca 2+ ; 2 mmol/L Ca 2+. 结果为4种情况下酶活基本不变, 则说 明CNA 催化结构域多肽不依赖 Ca 2+的调节 (图3). 但Mg 2+在pH=8.5时仍为其强激活剂. (
384 随温度和pH 值升高, 两者酶活性先增高, 随 后降低. CNA 的最适反应温度为 50 (图 5(a)). CNA 的最适反应pH 为7.0, CNA 催化 结构域多肽的最适反应pH 为8.0(图5(b)). 3 讨论 通过分子生物学手段, 我们对CNA 催化 结构域的cDNA 进行了克隆
蛋白酶抑制剂选择指南
蛋白酶抑制剂选择指南 1 蛋白酶抑制剂选择指南 抑制剂 工作浓度 分子量 抑制蛋白酶种类 稳定性 AEBSF终浓度1mM MW:239.5不可逆的丝氨酸蛋白酶抑制剂,抑制胰蛋白酶,糜 蛋白酶,纤溶酶,凝血酶及激肽释放酶. 可溶于水,其pH7的水溶液在4o C可保持稳定1-2个月,在pH>8的情况下会发生缓慢水解 Aprotinins 抑肽酶终浓度2ug/ ml MW:6512 可逆的丝氨酸蛋白酶抑制剂,可抑制纤溶酶,激肽 释放酶,胰蛋白酶,糜蛋白酶,但不抑制凝血酶和 Factor Xa。 非常稳定,当pH>12.8时失去活性,可溶于 水(10mg/ml),-20o C下可长期保存 Bestatin终浓度10uM MW:308.4 可逆的丙氨酰-氨基肽酶抑制剂, 工作液可保存一天,1mM的甲醇贮存液在 -20o C可保存至少一个月 E-64 Protease Inhibitor终浓度10uM MW:357.4 不可逆的半胱氨酸酸蛋白酶抑制剂,抑制半胱氨酸 酸蛋白酶而不会影响其他酶的半胱氨酸残基,与小 分子量的巯基醇如beta-巯基乙醇不会产生反应, 具有高度特异性。工作液在正常pH值下可保持稳定数天,1mM的水溶液在-20o C可保存几个月 EDTA, 4Na终浓度10mM MW:380.2 金属蛋白酶的可逆性螯合物,可能同时影响其他金 属依赖性生物过程。其水溶液很稳定,其贮存液(pH8.5的0.5M 水溶液)在4o C可保存数月 Leupeptin, 半硫酸盐 亮抑酶肽(亮肽素) 终浓度100uM MW:493.6 可逆的丝氨酸及半胱氨酸蛋白酶制剂,可抑制胰蛋 白酶样蛋白酶及一些半胱氨酸蛋白酶如:Lys-C内 切蛋白酶,激肽释放酶,木瓜蛋白酶,凝血 酶,Cathepsin B及胰蛋白酶。 工作液的稳定期为数小时,贮存液(10mM 水溶液)在4o C时稳定期为一周,-20o C时 稳定期为一个月 Pepstatin A 终浓度1uM MW:685.9 可逆的天冬氨酸蛋白酶,可抑制胃蛋白 酶,Cathepain B&L,血管紧张肽原酶(renin)及以1mg/ml溶于甲醇,搅拌过夜可以 1mg/ml溶于乙醇,333mg/ml溶于6N的
钙蛋白酶系统研究进展_梅承君
钙蛋白酶系统研究进展 梅承君1,庞辉2,康相涛1*,孙桂荣1(1.河南农业大学,河南郑州450000;2.河南省公安厅,河南郑州450000)摘要阐述了钙蛋白酶系统的分类、结构,并且综述钙蛋白酶系统的一般生物学功能及影响因素。 关键词钙蛋白酶;钙蛋白酶抑制蛋白;钙蛋白酶激活蛋白;嫩度 中图分类号Q55文献标识码A文章编号0517-6611(2006)22-5774-03 Research Adva nce in C alpain System MEI C heng-jun et al(Hen an Agricul tu ral University,Zhen gzh ou,Henan450000) Abstract This paper revie wed th e classi ficati on and structu re of cal pain sys tem,the general biological function and its affecting factors. Key w ords C alp ain;Cal pas tatin;Calpain activator;Tenderness 钙蛋白酶是1964年由Guroff首次发现,1972年Bush等首先在骨骼肌中确认,1976年Da yton等对其进行纯化。钙蛋白酶被鉴定、纯化后,其名称有钙活化中性蛋白酶(Calcium a ctiva te d ne utra l prote ase,Calcium ac tiva ted ne utral SH prote ase, c alpain)简写为CANP(EC,3,4,22,17)、钙激活酶(Ca2+-a ctiva t-ed enzy me)、钙激活中性蛋白酶(Calcium a ctiv ate d ne utral pro-te ase)等。1983年Go ll等提出钙蛋白酶在骨骼肌肌丝蛋白降解过程中起关键作用[1]。目前,已证明它广泛地分布于绝大多数动物的细胞中。在一定浓度的钙离子作用下,钙蛋白酶主要作用于细胞骨架蛋白、蛋白激酶和磷酸酶,还参与细胞内的信号传递[2]。 1钙蛋白酶系统 1.1钙蛋白酶的分类Calpain中的Cal代表钙调蛋白(Ca-l moclulin),pain代表木瓜蛋白酶(Pa pain)。Calpain由钙调蛋白和木瓜蛋白酶两者以非共价键结合而成。钙蛋白酶系由多种同工酶构成。根据分布特点可将其分为组织特异性和非组织特异性蛋白酶两大类[3]。目前研究比较深入的是非组织特异性蛋白酶,已知的2种非组织特异性同工酶是Ca-l pain1和Ca lpain2。Ca lpain1可被L mol水平的钙离子激活,又称L-Calpain;Ca lpain2可被mmol水平的钙离子激活,又称m-Calpain。除活化时需要的钙离子浓度不同和结构略有差别以外,这2种同工酶生化和催化的性质几乎完全相同。红细胞内仅含有Calpain1,其余的哺乳动物细胞中均含有2种形式的钙蛋白酶。由于细胞内钙离子的波动在微摩尔(L mol)浓度水平以下,所以Ca lpain1很可能在正常生理条件下发挥功能,而Calpain2则可能在病理情况(细胞内钙超载条件)下才能激活[4]。 1.2钙蛋白酶系统的结构[5] 1.2.1钙蛋白酶的结构。钙蛋白酶系中L-Calpain和m-Ca-l pain由不均一的二聚体蛋白构成,其大、小亚基的分子量分别为80和30kD。Calpain3、8a、9、11、12和13也都分别由大、小2个亚基构成。大亚基具有催化活性,L-Ca lpain和m-Ca-l pain的大亚基分别由CANP1和CAN P2基因编码;小亚基具有调节功能。尽管L-Calpain和m-Calpain大亚基氨基酸 基金项目国家/8630计划资助项目(2002AA242021);河南省重大科技攻关项目(022*******,0322010600);河南省高校杰出科研人才 创新工程项目(2000KY CX005)。 作者简介梅承君(1979-),女,河南焦作人,硕士研究生,研究方向:家禽育种。*通讯作者。 收稿日期2006-08-09序列有明显差异,但是其高级结构基本相同,都由4个结构域组成,从N端起分别命名为?、ò、ó、?结构域。在大亚基中,结构域?由1~80位氨基酸残基组成,约占全部分子的10%,在蛋白酶激活的情况下很容易发生自溶,由此推测其可能起钙蛋白酶的活性调节作用,L-Calpain和m-Ca lpain仅在结构域?中不同;结构域ò含有81~330位氨基酸残基,约占全部分子的35%,是表现钙蛋白酶水解活性的关键部位,在未被激活的条件下含有2个次级区域[6];结构域ó由331~560位氨基酸残基组成,约占全部分子的35%,其功能为结合钙离子和磷脂,与蛋白酶调控亚基或其他调控蛋白有关;结构域?由561~705位氨基酸残基组成,占全部分子的20%,是结合钙离子的部位,含有4个钙结合蛋白所特有的EF-手型结构(1个EF-手型结构包含2个与钙离子结合环相连的氨基酸螺旋)[7]。L-Ca lpain、m-Calpain、Ca lpain9的小亚基含有2个结构域,这2个结构域由一段富含脯氨酸的序列相连,其中结构域ò与大亚基的结构域?相同,含有4个可以结合钙的EF-手型结构,故也具有结合钙的活性[8]。在其他钙蛋白酶中,如Calpain3、8a、11、12、13,尽管其大亚基也有结构域?,但其大、小亚基之间并没有相互联系。Ca lpain5、6、7、8b、10、15为非典型的钙蛋白酶,其部分结构域缺失或被取代,没有结构域?,因此推测其大、小亚基间也不存在联系。 1.2.2钙蛋白酶抑制蛋白的结构。钙蛋白酶抑制蛋白(Ca-l pastatin)是细胞内专一抑制钙蛋白酶活性的蛋白质。通过抑制钙蛋白酶活性,可抑制肌肉内蛋白质降解,参与肌肉生长过程中蛋白质的更新。在屠宰后的动物体内,它可抑制钙蛋白酶的活性,从而明显影响肉的嫩度。它可以识别钙蛋白酶与钙结合引起的构象变化,并与之特异性结合。钙蛋白酶抑制蛋白通过抑制钙蛋白酶的自溶作用而发挥作用,且该抑制作用不受pH值的影响。钙蛋白酶抑制蛋白共由5个部分(?、ò、ó、?、?)组成,其中4个是钙蛋白酶抑制蛋白的活性中心。当钙蛋白酶被钙离子激活后,如果附近有钙蛋白酶抑制蛋白存在,则将迅速与之结合而抑制蛋白酶活性,从而保证钙蛋白酶对底物只进行局部的特定位点的水解。 目前对钙蛋白酶抑制蛋白的生化性质了解的还不十分清楚。根据钙蛋白酶抑制蛋白在SDS电泳中的行为,可将其分为70和110kD两种类型。70kD类型主要存在于红细胞中,110kD类型存在于肝、心脏和其他组织中。虽然这2种钙蛋白酶抑制蛋白分子大小不同,但它们的功能性质相似。 安徽农业科学,Jou rnal of Anh ui Agri.S ci.2006,34(22):5774-5776责任编辑刘月娟责任校对孙能森
特应性皮炎指南
特应性皮炎指南 特应性皮炎是皮肤科的常见疾病之一,对患者生活质量有明显影响。我国特应性皮炎的患病率20年来逐渐上升。为了规范特应性皮炎的诊断和治疗,中华医学会皮肤性病学分会免疫学组于2008年制定了我国第1版特应性皮炎诊疗指南,指南发表6年来,国内外有关特应性皮炎的发病机制、治疗理念、治疗方法和药物都有了显著变化。为此,中华医学会皮肤性病学分会组织免疫学组和特应性皮炎协作研究中心的专家对2008版指南进行了修订,希望有助于我国皮肤科医生在临床实践中的学习和应用。本指南非强制性,且在今后将不断补充和修订。 特应性皮炎(atopicdermatitis,AD)是一种慢性、复发性、炎症性皮肤病,患者往往有剧烈瘙痒,严重影响生活质量。本病通常初发于婴儿期,1岁前发病者约占全部患者的50%,该病呈慢性经过,部分患者病情可以迁延到成年,但也有成年发病者。在发达国家本病儿童中患病率可高达10°%~20%。在我国,20年来特应性皮炎的患病率也在逐步上升,1998年学龄期青少年(6~20岁)的总患病率为0.70% [1],2002年10城市学龄前儿童(1~7岁)的患病率为2.78%[2],而2012年上海地区流行病学调查显示,3~6岁儿童患病率达8.3%(男8.5%,女8.2%),城市显著高于农村(10.2%比4.6%)[3]。
1.病因及发病机制 特应性皮炎的发病与遗传和环境等因素关系密切[4]。父母亲等家族成员有过敏性疾病史者,患本病的概率显著增加,遗传因素主要影响皮肤屏障功能与免疫平衡。本病患者往往有Th2为主介导的免疫学异常,还可有皮肤屏障功能的减弱或破坏如表皮中丝聚蛋白减少或缺失;环境因素包括环境变化、生活方式改变、过度洗涤、感染原和变应原等。此外,心理因素(如精神紧张、焦虑、抑郁等)也在特应性皮炎的发病中发挥一定作用[4-5]。 特应性皮炎确切发病机制尚不清楚。一般认为是在遗传因素基础上,由于变应原进入和微生物定植(如金黄色葡萄球菌和马拉色菌),形成皮肤免疫异常反应和炎症,引发皮疹和瘙痒,而搔抓和过度洗涤等不良刺激又可进一步加重皮肤炎症。特应性皮炎的异常免疫反应涉及多个环节,如朗格汉斯细胞和皮肤树突细胞对变应原的提呈、Th2为主的异常免疫反应、调节性T细胞功能障碍、IgE过度产生和嗜酸性粒细胞升高等。此外,角质形成细胞产生细胞因子和炎症介质也参与了炎症反应等。非免疫性因素如神经-内分泌因素异常也可参与皮肤炎症的发生和发展[4-6]。 2.临床表现 特应性皮炎的临床表现多种多样,最基本的特征是皮肤干燥、慢性湿疹样皮炎和剧烈瘙痒。本病绝大多数
src激酶抑制剂综述
Src(sarcoma gene)受体激酶家族抑制剂 研究综述 药学0703班 U200717953 周俊
Src(sarcoma gene)受体激酶家族抑制剂研究综述 摘要;本文介绍了src的组成,作用以及与相关疾病的作用,总结了近几年研究src激酶家 族的方向,以src激酶家族作为靶点寻找抗癌药物中的一些进展和成果,并逐一分析比较有代表性的药物,如喹啉衍生物,嘧啶衍生物等等化合物,最后总结近期成果,指出现有工作的不足和未来的研究方向。 关键词鸡肉瘤病毒基因(src)酪氨酸蛋白激酶抑制因子ATP结合位点 引言: sarcoma gene(鸡肉瘤病毒基因,以下简称src)的组成 Src是一类癌基因,其表达产物主要是酪氨酸蛋白激酶类。Src在许多组织细胞中表达,在癌症发病机制中处于重要的地位,是肿瘤,癌症分子表达途径的重要的激酶。Src家族是研究最早最深入的家族,包括Blk, Brk, Fgr, Frk,Fyn, Hck, Lck, Lyn, c-Src, Srm,c-Yes等成员。根据氨基酸序列,可以分为两个亚族:一族是Src, Fyn, Yes and Fgr并且广泛在不同的组织中表达,Lck, Blk, Lyn and Hck和造血细胞有关.研究表明,Src与其他众多酶类可联合在一起促进多个细胞反应进程。Src 与多种激酶受体偶联,包括酪氨酸激酶受体,整合单白受体,G蛋白偶联受体等。.通过偶联作用影响细胞生长,发育,乃至转移扩散。最好的例子就是与EGFR(一种有关细胞生长的受体)的结合,Src可以使EGFR自身磷酸化,降低EGFR 的中间体的调节与胞吞作用。 除了牵涉到细胞内的反应,Src可能也在初级肿瘤细胞的转移中扮演着一个重要的角色。实际上Src转移细胞的存在减少了ECM反应以及组织反应的损失。分子调节这些过程的机理建立在Src和FAK的反应的基础上。Src与粘附分子有关。Src的磷酸化使得在粘附分子上的整联蛋白受体接收的黏着性与转移信号得以传播。 Src的作用靶点 一般来说就目前的研究而言,src的作用靶点有以下几类: 第一种是以src激酶为作用靶点。到目前为止还没有被批准的src激酶抑制剂,但是新的分子,有选择性的有潜力的化合物已经在被合成。设计测试更加有效的抑制剂,运用分子模型筛选技术,组合化学研发新的药物已经成为趋势。一般而言,一个抑制剂的选择性应该严格作用于癌细胞而不干扰正常细胞的生长进程,抑制剂也应间接作用于酶合成这样的在癌细胞进程中也会发生的物质。 第二种就是以SH2和SH3区域为靶点的药物,该药物是很多疾病的重要靶点,如癌症cardiovascular ,restenosis。这些分子阻断src和其他蛋白底物作用属于信号阻断途径,一般而言,SH2区域识别特殊的多肽包括一个磷酸化的酪氨酸残基。SH2的抑制剂分子设计基于氨基酸特定的排列顺序。在许多例子中,多肽库中产生的第一代配体给与了重要的信息以成功设计连接无受体的src的SH2的受体。而SH3的抑制剂则是基于与该区域作用的分子的多肽,其配体能够和SH3区域的酪氨酸富集区作用,但是一般而言这种作用是很弱的,因为形成的离子键和氢键数量有限。因此SH3抑制剂KI值在微摩尔范围内很低。尽管合成此种抑制剂的效果已经显现,但只有少量例子在文献中出现。 Src激酶家族的作用 Src酪氨酸激酶联系的受体对细胞的生长和分裂是非常重要的,它具有双重作用,既可以
