化学竞赛专题讲座三
化学竞赛专题讲座
胡征善 三、晶体结构
(一)概述
1.坐标系
2
P :简单
C :底心 I :体心 F :面心
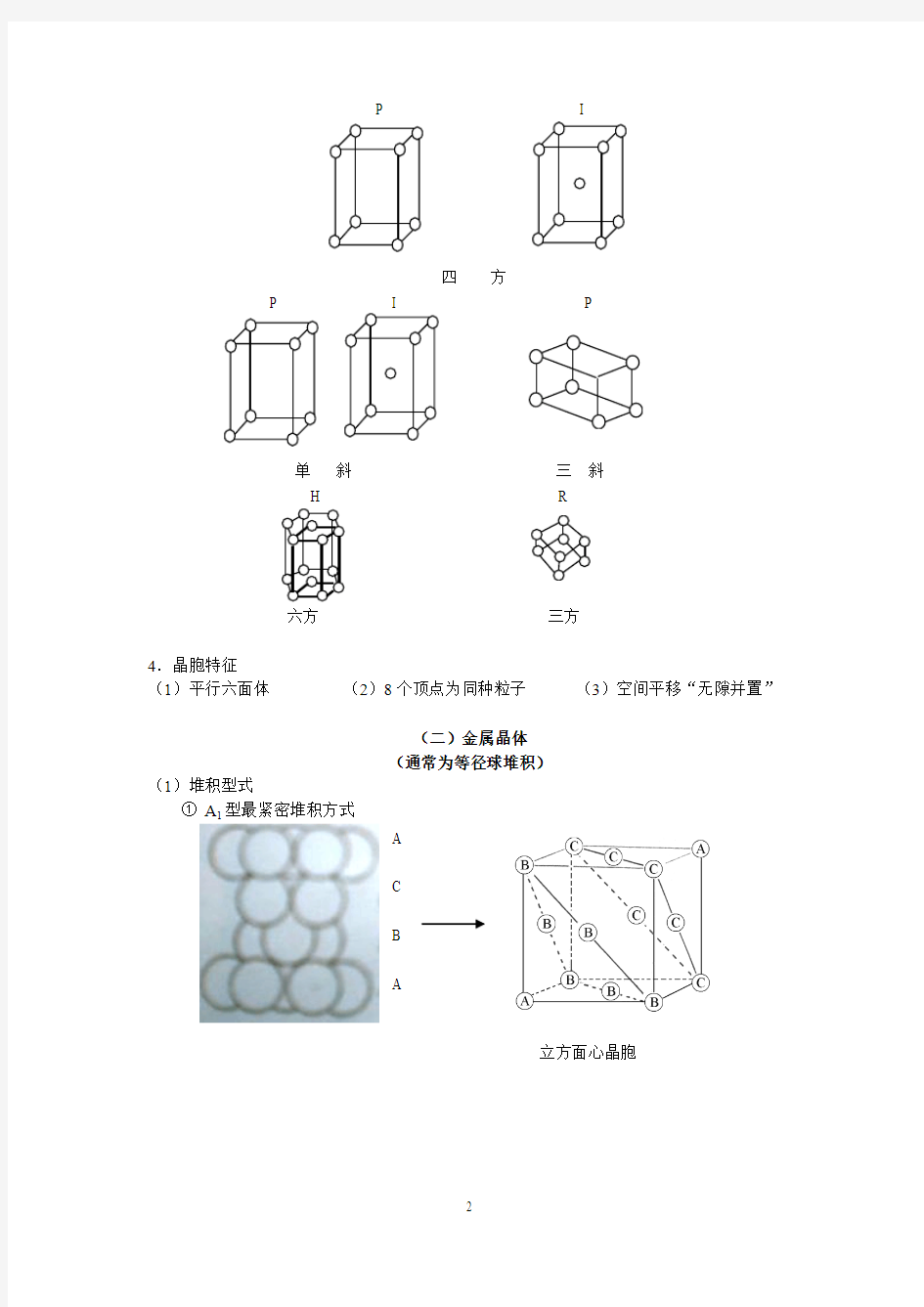
3.14种空间点阵式
P
I F
立
方
P
正 交
P I
四 方
P
P
单 斜
三 斜
H R
六方 三方
4.晶胞特征
(1)平行六面体 (2)8个顶点为同种粒子 (3)空间平移“无隙并置”
(二)金属晶体 (通常为等径球堆积)
(1)堆积型式
① A 1型最紧密堆积方式
立方面心晶胞
② A 3型最紧密堆积方式
六方晶胞 B 层中阵点位置的分数坐标为(2/3,1/3,1/2)
③ A 2型最紧密堆积方式
体心立方晶胞 ④ A 4型最紧密堆积方式
四面体堆积
二、空间利用率= V (球总)/ V (晶胞)×100%
堆积型式 空间利用率(%) 特点
A 1面心立方 74.06 面心球与该面四个顶点球相切
A 3密集六方* 74.06 a=b ,c=2√2/3 a ,正四面体高h =√2/3 a A 2体心立方 68.02 体心球与立方体顶点球相切 A 4四面体** 34.01
A B A B A a
b
c
A 层
B 层 A 层
说明:
8r =√3a r =√3a/8 正四面体空隙正八面体空隙
A1每个晶胞中,有4个球,四面体空隙数有8个,八面体空隙有4个——中心1个,12条棱心12×1/4=3。所以整个晶体中:球数: 四面体空隙: 八面体空隙= 1:2:1
面心两点间距离为√2 a/2
A3每个晶胞中,粗线为截取的晶胞。晶胞上底面的3个原子和中层的2个原子(其中有1个是晶胞外的原子)和晶胞外另1个原子构成1个正八面体的空隙X,此正八面体在晶胞中只占1/2,晶胞中共有4个这样的正八面体,故晶胞中正八面体空隙数为1/2×4=2。正四面体空隙O,正四面体空隙数1/4×8 + 2 = 4。所以在A3每个晶胞中,球数:正四面体数:正八面体数= 2:4:2 = 1:2:1
a b
c
●
(三)离子晶体 (不等径球的堆积)
离子晶体的堆积:离子晶体中由于多数情况下阴离子半径大,因此可以认为是先是阴离子按一定方式堆积,然后阳离子填在阴离子的空隙中。
三角形 四面体 八面体 立方体 1. 离子半径比对结构的影响
*
**
*** 个面的1/4:
****
六方ZnS 晶胞 CaF 2晶胞
金红石(TiO 2)晶胞
C = 0 C = 1/2
μ
μ
μ
2.典型离子晶体
3.分数坐标(其坐标值是0或分数)
a.离子电荷
b.离子半径
离子半径是离子的重要特征之一。与原子一样,单个离子也不存在明确的界面。所谓离子半径,是根据离子晶体中正、负离子的核间距测出的,并假定正、负离子的核间距为正、负离子的半径之和。可利用X射线衍射法测定正、负离子的平均核间距,若知道了负离子的半径,就可推出正离子的半径。
离子半径大致有如下的变化规律:
(1)在周期表各主族元素中,由于自上而下电子层数依次增多,所以具有相同电荷数的同族离子的半径依次增大。例如:Li+<Na+<K+<Rb+<Cs+;F—<Cl—<Br—<I—(2)同一周期中主族元素随着族数递增,正电荷的电荷数增大,离子半径依次减小。如:Na+>Mg2+>Al3+
(3)若同一种元素能形成几种不同电荷的正离子时,则高价离子的半径小于低价离子的半径。例如:r(Fe3+)(60pm)<r(Fe2+)(75pm)
(4)负离子的半径较大,约为130~250pm,正离子的半径较小,约为10~170pm
(5)周期表中处于相邻族的左上方和右下方斜对角线上的正离子半径近似相等。例如:Li+(60pm)≈Mg2+(65pm);Sc3+(81pm)≈Zr4+(80pm);Na+(95pm)≈Ca2+(99pm) 由于离子半径是决定离子间引力大小的重要因素,因此离子半径的大小对离子化合物性质有显著影响。离子半径越小离子间的引力越大,要拆开它们所需的能量就越大,因此,离子化合物的熔、沸点也越高。
c.离子电子层结构
原子形成离子时,所失去或者得到的电子数和原子的电子层结构有关。一般是原子得或失电子之后,使离子的电子层达到较稳定的结构,就是使亚层充满的电子构型。
简单负离子(如Cl—、F—、S2—等)的最外电子层都是8个电子的稀有气体结构。但是,简单的正离子的电子构型比较复杂,其电子构型有以下几种:
(1)2电子构型:最外层电子构型为1s2,如Li+、Be2+等。
(2)8电子构型:最外层电子构型为n s2n p6,如Na+、Ca2+等。
(3)18电子构型:最外层电子构型为n s2n p6n d10,如Ag+、Zn2+等。
(4)18+2电子构型:次外层有18个电子,最外层有2个电子,电子构型为(n-1)s2(n-1)p6(n-1)d10n s2,如Sn2+、Pb2+等。
(5)9~17电子构型:属于不规则电子组态,最外层有9~17个电子,电子构型为
n s2n p2n d1~9,如Fe2+、Cr3+等。
离子的外层电子构型对于离子之间的相互作用有影响,从而使键的性质有所改变。例如Na+和Cu+的电荷相同,离子半径几乎相等,但NaCl易溶于水,而Cu+Cl—难溶于水。显然,这是由于Na+和Cu+具有不同的电子构型所造成的
5. 离子的极化作用和变形性
当带有相反电荷的离子相互接近形成物质时,离子间除存在库仑引力外,还能在相反电荷的作用下使原子核外的电子运动发生变形,这种离子使异号离子电子运动发生变形的作用叫做离子极化作用。异号离子本身电子运动发生变形的性质叫做离子的变形性(即可极化性)。它们之间的相互作用如图所示。
正离子负离子
离子的极化作用和变形性示意图
正离子和负离子同时具有极化作用和变形性两种性质。对于正离子来说,极化作用占主导(个别离子半径较小的阴离子F—离子也具有极化作用),而对负离子来说,变形性占主导。
a. 影响离子极化作用的因素
(1)离子所带正电荷数越高,半径越小,则极化作用越强。
(2)对于不同电子构型的正离子来说,由于d态电子云的空间分布弥散,屏蔽作用小,因此含有d电子的离子比电荷数相同半径相近的8电子离子的极化作用强。离子极化作用的大小关系是:18电子和(18+2)电子构型>9~17电子构型>8电子构型。
(3)离子构型相似,所带正电荷相同的离子,半径越小,离子极化作用越强。如Mg2+>Ba2+。
b. 影响离子变形性的因素
(1)阴离子的半径越大,负电荷数越高,变形性越大。如:O2—>F—;S2—>Cl—、I—>Br—。
(2)18电子或(18+2)电子构型和9~17电子构型的阳离子,其极化作用和变形性均较大。如:Ag+>Na+、K+;Hg2+>Mg2+、Ca2+。
(3)一些复杂的无机阴离子因为形成结构紧密对称性强的原子团,变形性通常不大。而且复杂阴离子中心原子氧化数越高,变形性越小。常见的一些阴离子的变形性比较如下:ClO4—<F—<NO3—<OH—<CN—<Cl—<Br—<I—;SO42—<H2O<CO32—<O2—<S2—。
c. 离子的附加极化作用
正负离子由于产生电场,具有极化作用,可使异号离子发生变形,同时本身在异号离子的作用下也会发生变形。由于正负离子相互极化的结果,使正负离子的变形性增大,从而进一步加强了正离子与负离子的相互极化作用,这种加强的极化作用称为附加极化作用。由于18电子构型以及9~17电子构型极化作用和变形性均较大,当它们和较大的阴离子结合时,相互极化作用就较强烈。由于离子的极化作用,可影响到离子化合物化学键型的变化,从而进一步影响到化合物的性质。
d. 离子极化对化学键型的影响
阴阳离子结合成化合物时,如果相互间完全没有极化作用,则其间的化学键纯属离子键.实际上,相互极化的关系或多或少存在着。对于含d x或d10电子的阳离子与半径大或电荷高的阴离子结合时尤为重要,由于阳阴离子相互极化,使电子云发生强烈变形,阳阴离子外层电子云发生重叠。相互极化越强,电子云重叠的程度也越大,键的极性也越弱,键长缩短,从而由离子键过渡到共价键。如:
键的极性增大
HF HCl HBr HI
极化作用增强,键的共价性增强
卤化银的某些性质
(1)可使化合物溶解度降低
因为离子极化的存在导致离子键逐渐向共价键过渡,使键的极性减弱,所以与极性分子(H2O)之间作用力减小,则溶解度减小。
(2)可使离子晶体的晶格类型发生转变
离子极化的存在使晶体的配位数减小,则导致晶格类型发生变化。
(3)导致化合物的颜色加深
因离子极化的存在导致化合物的吸收波长往长波方向移动(红移),则化合物颜色就会加
深。如Ag +和S 2—
均无色,按理形成的Ag 2S 应为无色,但由于离子极化的存在导致吸收波红移而变为黑色。
(4)可导致离子型晶体的熔点越低 离子极化作用越强,电子云重叠的程度也越大,则由离子键过渡到共价键的程度也越强,即离子晶体中的共价成分越大,使得熔化时原来需要打断的离子键部分变成了分子间作用力,所以晶体的熔点会降低。 (5)可导致盐的热稳定性越低
大部分的盐是由阳离子与含氧酸根组成的离子化合物。如果阴阳离子之间极化作用越强,则越容易使含氧阴离子变形以至于达到分解的程度,即盐的热稳定性降低。 6.晶格能
1mol 离子晶体被破坏生成气态阳离子和气态阴离子所需要的能量(kJ/mol )。常用的理论计算公式——波恩—朗德(Born —Lande )公式:
U==
式中M 为马德隆(Made —lung )常数,有离子晶体的结构有关;n 为波恩指数,与离子的电子层结构有关;Z +、Z —分别为正负离子的价态;r 0为相邻的正负离子间的核间距离(以m 为单位)。
(四)原子晶体
金刚石、晶体硅、碳化硅属于原子晶体,其晶胞见金属晶体A 4堆积型式,亦属立方ZnS
型结构(Zn 2+和S 2—
全部换作C 或Si 原子)。所有C 或Si 原子间均以共价键结合,最小环为六元环,形状为 (椅式),每个C 或Si 共用12个这种六元环。 SiO 2晶体(原子晶体CO 2亦如此),无非是晶体硅中每个Si
—Si 键中插入1个氧原子,但∠SiOSi= 142°,每个硅原子与紧邻的氧原子和硅原子均呈正四面体结构。
(五)分子晶体
干冰、C 60、Cl 2、Br 2、I 2等晶体属立方面心构型(A 1堆积型式),每个分子紧邻有12个分子。环六次甲基四胺(乌洛托品,分子式为C 6H 12N 4)晶体属立方体心构型(A 4堆积型式)。
(六)晶体密度 与 晶胞的关系
宏观物理量 微观结构
平行四面体 六方晶胞 顶点 1/8 1/6 棱 1/4 1/3 面 1/2 1/2
内 1 1
ρ(晶体) a 3 a 2b
abc
3a 2c ×sin60°==3√3 a 2c/2 略
1.385×10—7MZ +Z —
r 0
(1—1/n) kJ/mol
(七)几种重要晶体的联想
a
C、Si原子交替连接:SiC
(八)晶体的微观投影式
1.由SiO 4四面体组成的多种硅酸根结构
4
27
Si 3O 9
Si 6O 1812
—
(Si 4O 11)n 6 n
—
(SiO 3)n 2n
—
(Si 2O 5)n 2n
—
2. 几种晶胞沿体对角线的投影图
(1)体心立方
(2)面心立方
(3) 立方ZnS
(4)CaF 2
(九)物质的熔沸点比较
1、晶体类型不同时,一般是:原子晶体>离子晶体>分子晶体。例外的有:MgO 、CaO (离子晶体)>Si 、SiC 、SiO 2(原子晶体)。
2、金属晶体
① 碱金属单质的熔沸点随原子序数增大而降低;钠、镁、铝的熔沸点随原子序数增大而升高。
② 低共熔合金的熔点低于各组成成分的熔点。如:钠>钾>钠-钾合金。
③ 除汞、碱金属、镓等少数金属外,金属晶体>分子晶体;某些金属晶体[如W (熔点3410℃ 沸点 5660℃)、Cr (熔点 1857℃ 沸点 2672℃)等]>某些原子晶体[如晶体硅、SiO 2(熔点1723℃ 沸点2230℃)等]。
④ 过渡金属单质的熔沸点一般都很高,熔点普遍高于1000℃,沸点大部分高于2500℃。但ⅡB 金属熔沸点较低:Zn 熔点420℃ 沸点907℃;Cd 熔点320.9℃ 沸点 765℃;Hg 熔点—39℃ 沸点 357℃。
3、原子晶体
由于键能 E (C —C )>E (Si —C )>E(Si —Si) >E(Ge —Ge),所以熔点是:金刚石(熔点3550℃ 沸点4827℃)>碳化硅(2700℃时升华)>晶体硅(熔点1410℃ 沸点2355℃)
√2 a
>晶体锗(熔点937℃沸点2830℃),但沸点有别。
4、离子晶体
对于典型的离子晶体而言,其熔沸点高低取决于离子键的强弱。离子键的强弱可借用库仑作用公式F == —Q1Q2 /r2来定性判断(式中“—”表示吸引,Q1、Q2分别表示阴阳离子所带的电荷,r为阴阳离子核间距即阴阳离子的半径之和)。若阴阳离子所带的电荷相同时,其熔沸点随阴阳离子的半径之和增大而降低。例如:NaX的熔沸点随卤素离子X—的半径增大而降低(将Na+换成K+、Rb+、Cs+亦可);RCl 的熔沸点随金属阳离子R+(除Li+外)半径增大而降低。若阴阳离子的半径之和相近时,其熔沸点随阴阳离子所带的电荷增大而升高。例如:CaO(熔点2614℃沸点2850℃)>NaF (熔点993℃沸点1695℃),因为它们的离子半径:Ca2+、O2—、Na+、F—分别为0.099nm、0.140nm、0.095nm、0.136nm。
5、分子晶体
影响分子间作用力的因素较多,通常有:
①相对分子质量——组成和结构相似的物质,相对分子质量越大,分子间作用力越大,其熔沸点越高(但必须注意H分别与N、O、F直接相连时所形成物质分子间的氢键作用)。符合此条规律的有:
a. 除NH3、H2O、HF外的同主族的气态氢化物;
b. 稀有气体的单质;
c. 卤素单质;
d. CH4和CX4;
e. SiH4和SiX4;
f. 直链烷烃(丙烷熔点比乙烷低,除外)。
g. 官能团数目及其位置均相同,且烃基结构相似时,炔烃、卤代烃、醇、醛、酮、羧酸等的沸点随分子中碳原子数增大而升高。
h. 碳原子数和碳骼结构相同时,物质的熔沸点随—X、—OH、—CHO、—COOH增多而升高。
i. 碳原子数、卤原子数和碳骼结构相同时,物质的沸点随卤素原子序数增大而升高。
②分子的极性——分子间存在氢键的物质熔沸点通常高于分子间无氢键的物质;当相对分子质量相近时,极性分子的熔沸点通常高于非极性分子。例如:SO2(熔点—72.7℃沸点—10℃) >Cl2(熔点—101℃沸点—34.6℃);甲醛(熔点—92℃沸点—21℃)>乙烷(熔点—183.3℃沸点—88.6℃);一氧化碳(熔点—199℃沸点—191℃)>氮气(熔点—210℃沸点—196℃)。
③都存在分子间氢键的物质,其熔沸点取决于分子间氢键的数目和单个氢键的强度。例如:H2O>HF>NH3;相对分子质量相近的氨基酸和一元羧酸,氨基酸>一元羧酸。
④分子的形状—— a. 很多同分异构体如烷烃和二甲苯、三甲苯,分子的对称性越高,沸点越低。b.脂肪酸及其酯,不饱和度越大,沸点越低。例如:硬脂酸甘油酯、软脂酸甘油酯>油酸甘油酯。
化学竞赛专题讲座二:共价粒子的空间构型(分子结构)
化学竞赛专题讲座 二、共价粒子的空间构型(分子结构) Lewis 结构 共振论 价层电子互斥模型(VSEPR ) 等电体原理 杂化轨道 一、Lewis 结构 共振论 1.令共价粒子中所有原子价层电子数为8(H 为 2)时的电子总数为n 0,实际各原子价层电子数之和(加阴离子的电荷数、减阳离子的电荷数)为n v ,则: 共价键数==(n 0—n v )/2 其中n 0—n v == n s 共用电子数 2.依上述要求写出各种Lewis 结构式(以点线式表示),并用形式电荷Q F 对其稳定性进行判断: Q F == n v —n r (孤对电子数)—n s == 某原子所形成的价键数—该原子的单电子数(碳C 为4) 8—该原子价电子数 a.各原子的Q F 为零的结构最稳定; b.若相邻原子的Q F ≠0时,通常是 ①Q F 要小;②非金属性强(电负性大)的原子Q F <0,另一原子Q F >0为稳定结构; ③相邻原子的Q F 为同号则不稳定,但N 2O 4例外。 (二)共振论 个相对合理的Lewis 结构式表示,在不改变原子的相对位置时,变换价键表 示形式,用Lewis 式的“混 合” (三)键级 【1】 N 2F 2有三种异构体(已合成了2种)、N 4H 4(H 化学环境完全相同),写出它们的Lewis 式并讨论其稳定性。 N 2F 2 : N 4H 4: 因为:n 0 = 638 = 48 , n v = 3 36 + 235 + 7—1 == 34 所以:共价键数==(n 0—n v )/2 ==(48—34)/2 = 7 较稳定 最稳定(S=N 键的键长最短) 对原子为8电子构型的粒子的简捷判定式 各共振体中指定价键的总数 键级== N=N N=N N=N N=N N=N Cl + S —S N N S ⊕ +2 Cl + S —S N N S ⊕ +2 Cl + S —S N N S ⊕ ⊕ Cl + S —S N N S ⊕ ⊕ O O N —N O O ⊕ ⊕ H H N —N H H 0 0 中N —N 键的键长> 中的N —N 键键长。 Cl + S —S N N S ⊕ ⊕
初中化学竞赛辅导讲义(十)
初中化学竞赛辅导讲义(十) 可能用到的相对原予质量:H 一1 C--12 N 一14 O--16 Na 一23 Mg-24 S-32 C1—35.5 K —39 Ca —40 一、选择题(本题共l0小题,每小题1分,共10分。每小题只有1个选项符合题意) 1.下列有关数据项目中,描述物质化学性质的是 ( ) A .熔点 B .沸点 C .硬度 D .着火点 2.下列说法中,你不赞成的是 ( ) A .生产和使用电瓶车时无污染,不应限制生产和使用 B .为了保护环境,充分利用资源,要将垃圾分类回收 C .即使将烟囱建的高一些,也未必能够避免烟所产生的环境污染 D .认识酸雨、温室效应、臭氧空洞的产生需要一定的化学知识 3.中科院广州化学研究所采用最新的纳米技术,成功地开发了“用二氧化碳制取全降解塑料”的新技术。下列说法错误的是 ( ) A .该技术有助于减少“白色污染” B .泫技术有助于缓解“温室效应” C .该技术开辟了利用二氧化碳的新途径 D .全降解塑料不属于有机合成材料 4.“群众利益无小事,食品安全是大事”下列做法会导致食品对人体健康有害的是 ( ) A .用蔗糖作食品的甜味剂 B .用干冰保藏易腐败的食物 C .用甲醛溶液浸泡海产品 D .用袋装生石灰作饼干类食品的干燥剂 5.受热时软化成型,冷却后固化,但一经固化后,就不能用加热的方法使之软化的塑料,属于热同性塑料。制造下列物品应该用热固性塑料的是 ( ) A .炒菜用的铁锅手柄 B .食品包装袋 C .雨衣 D .电线外面的塑料护皮 6.近来我国航天事业的发展突飞猛进,“神六”载人航天飞船已经顺利升空和返航。下列燃料电池比较适合在宇宙飞船上使用的是 ( ) A .氢氧燃料电池 B .乙醇燃料电池 C .甲烷燃料电池 D .一氧化碳燃料电池 7 8,氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域,已知 氮、硅的原子结构示意图依次为:N ,Si 。请推测氮化硅的化学式(分子式) 为 ( ) A .Si 3N 4 B .Si 4N 3 C .Si 3N 7 D .Si 7N 3 9.双氧水(H 2O 2)的沸点比水高,但受热易分解。某试剂厂制得7%一8%的双氧水,欲将其浓缩 成30%的溶液,可采用的适宜方法是(蒸馏是利用液体沸点不同分离液体混合物的一种方法) +14 2 8 4 +7 2 5
2002年全国中学生化学竞赛(省级赛区)一等奖
2002年全国中学生化学竞赛(省级赛区)一等奖 山东省(38名) 湖南省(37名)
上海市(27名)
上海中学(高二)CO20089 海南省(10名) 姓名学校证书编号姓名学校证书编号冯丹海南中学CO20103 蔡玮加积中学CO20108 胡江海海南中学CO20104 杨博宇海南中学CO20109 周雪峰海南中学CO20105 吴通海南中学CO20110 郑桂川海南中学CO20106 郑星丽农垦中学CO20111 李尉海南中学CO20107 谢宗宙海南中学CO20112 安徽省(22名) 姓名学校证书编号姓名学校证书编号程鸣全椒中学CO20113 沈况合肥一中CO20124 刘郴淮南二中CO20114 李翔萧县中学CO20125 史铭马鞍山二中(高二)CO20115 吴子健马鞍山二中(高二)CO20126 俞义轶当涂一中CO20116 吕世靖来安中学CO20127 李昶无为一中CO20117 江来安庆一中(高二)CO20128 刘坤合肥一中CO20118 丁一马鞍山二中(高二)CO20129 夏凡马鞍山二中(高二)CO20119 陆伟凤阳中学CO20130 何鹏当涂一中CO20120 陶亮马鞍山二中CO20131 王景昊无为一中CO20121 张啸定远中学CO20132 毛宏理萧城中学CO20122 董若冰马鞍山二中(高二)CO20133 张荣华滁州中学CO20123 支兴华马鞍山二中CO20134 江西省(29名) 姓名学校证书编 号 姓名学校证书编号 焦杨江西师大附中CO20135 付晔弋阳县第一中学CO20150 叶林江西师大附中CO20136 彭冬财鹰潭市第一中学CO20151
初中化学竞赛专题辅导9: 综合实验
竞赛专题辅导九:综合实验 【内容综述】 1、熟练掌握各基本实验操作技能<制气分型,型,集气有排水法,排空气法,干燥,净化…) 2、培养审准实验目的,审定全系统步骤先后顺序合理,以达目的的能力 【要点讲解】 1、读审题中信息,联系学过的知识,紧扣实验目的,创设途径选择最佳。 2、分解每一步骤,明确这一步目的,严格准确操作<如气体的投制,净化,干燥各步) 3、审定系统顺序使整个流程谐调<如先查气密后制气,先去杂后干燥;用洗气瓶,长管进短管出…) 例1、例用下图给出装置,设计实验以粗略测定铜的相对原子量<已知氢、氧原子的相对质量)回答提出问题。 <1)按气流从左至右流向,仪器组装连接顺序为<用大写字母标)______________ <2)各组仪器接口顺序为<用小写字母标)____________
<3)写出下列装置的作用A ___________B_____________F__ __________grdafhiT3t 解读:1.读、审题目,实验目的:粗测铜的原子相对质量,由给出的图示,可进行氢气还原氧化铜实验,能测生成水的量,则可达目的。因是计量实验,要尽量使实验值准确,要净化干燥、产物水量要防止其它湿气的干扰。grdafhiT3t 2.分解审定;参照图示,除HCl用F,干燥用A;测定水量D紧接C,防止大气中湿气干扰后接B。接口位置注意,洗气瓶导管,长进短出,干燥管粗进细出。grdafhiT3t 答案:<1)E→F→A→C→D→B <2)e→f’, f→a , a’→c , c’→d’ , d’→b’ 3)A干燥,B吸收大气口水气 F吸收中混有的HCl 例2、已知某食盐中掺有纯碱。为测定纯碱含量,按下图装置进行实验:
2000年全国高中化学奥林匹克竞赛山东省预赛试题
2000年全国高中化学奥林匹克竞赛山东省预赛试题 (满分100分,时间120分钟) Al 27 S 32 K 39 Ca 40 Fe 56 Cu 64 Zn 65 Ba 137 一、选择题 (每小题1分,共10分。每小题只有一个选项符合题意) 1.科技文献中经常出现下列词汇,其中与相关物质的颜色并无联系的是 A .赤色海潮 B .绿色食品 C .白色污染 D .棕色烟气 2.微量元素是指在人体内含量不到万分之一的元素,这样的元素有20余种,它们对人体的正常代谢起着重要的作用。下列元素中不属于微量元素的是 A .I B .F C .Zn D .H 3.在化学研究领域中,通常所说的“溶液浓度”的单位是 A. % B. L/mol C. g/cm 3 D. mol/L 4.喹啉是一种重要的杂环化合物,其分子结构与萘相似,将萘分子α位上的一个碳原子换成氮原子即成为喹啉,则喹啉的结构简式为 A . N B. N N C. NH 2 D. N N 5.下列分子中所有的原子都满足最外层8电子结构的是 A . 次氯酸 B . 二氟化氙 C . 三氟化硼 D . 氯化硫(S 2Cl 2) 6.据报道,科学家用激光把置于铁室中的石墨靶上的碳原子炸松,与此同时,再用射频电火花喷射氮气,此时,碳、氮原子结合成碳氮化合物薄膜。此种化合物晶体比金刚石还硬的原因是 A .氮元素的非金属性比碳强 B .氮原子最外层上的电子比碳多 C .氮原子的相对原子质量比碳大 D .氮原子的半径比碳小 7.某同学在实验报告中记录了以下内容:①用托盘天平称取11.7g 食盐,②用量筒量取5.36mL 盐酸,③用pH 试纸测得溶液的pH 值为1.12。其中合理的是 A .① B .②③ C .①③ D .①②③ 8.下列化学式对应的结构式从成键情况看不合理的是 A .CH 3N , H H B .CH 2SeO , H-C-O-H C .CH 4S , H C H H S H D .CH 4Si , Si H H H H 9.如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs +核间距离为a ,氯化铯的式量为M ,N A 为阿伏加德罗常数,则氯化铯晶体的密度是
高中化学竞赛用书推荐
高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一
全国中学生化学竞赛预赛专题讲座
全国中学生化学竞赛预赛专题讲座 第一讲差量法 例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数? 答案:1、8克2、7∶53、11.2克4、8∶7 7∶235、82.2% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2及原混合气体中CO2的质量比? 练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2及FeCl3物质的量之比为()(高一试题) A 1∶1B3∶2 C 7∶ D 2∶7 练习7 P克结晶水合物A?nH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为() A18Pn/(P—q) B 18Pn/q C18qn/P D18qn/(P—q) 答案:1 、96% 5、A 6 、C7、A 第二讲平均值法 例题:
2018年全国高中化学竞赛(初赛)模拟试题2(word含答案)
高中化学竞赛初赛模拟试卷(02)(时间:3小时满分:100分) 题号 1 2 3 4 5 6 7 8 9 10 满分 H 1.008 相对原子质量He 4.003 Li 6.941 Be 9.012 B 10.81 C 12.01 N 14.01 O 16.00 F 19.00 Ne 20.18 Na 22.99 Mg 24.31 Al 26.98 Si 28.09 P 30.97 S 32.07 Cl 35.45 Ar 39.95 K 39.10 Ca 40.08 Sc 44.96 Ti 47.88 V 50.94 Cr 52.00 Mn 54.94 Fe 55.85 Co 58.93 Ni 58.69 Cu 63.55 Zn 65.39 Ga 69.72 Ge 72.61 As 74.92 Se 78.96 Br 79.90 Kr 83.80 Rb 85.47 Sr 87.62 Y 88.91 Zr 91.22 Nb 92.91 Mo 95.94 Tc [98] Ru 101.1 Rh 102.9 Pd 106.4 Ag 107.9 Cd 112.4 In 114.8 Sn 118.7 Sb 121.8 Te 127.6 I 126.9 Xe 131.3 Cs 132.9 Ba 137.3 La- Lu Hf 178.5 Ta 180.9 W 183.8 Re 186.2 Os 190.2 Ir 192.2 Pt 195.1 Au 197.0 Hg 200.6 Tl 204.4 Pb 207.2 Bi 209.0 Po [210] At [210] Rn [222] Fr [223] Ra [226] Ac- La Rf Db Sg Bh Hs Mt Ds La系 La 138.9 Ce 140.1 Pr 140.9 Nd 144.2 Pm 144.9 Sm 150.4 Eu 152.0 Gd 157.3 Tb 158.9 Dy 162.5 Ho 164.9 Er 167.3 Tm 168.9 Tb 173.0 Lu 175.0 第一题(4分) 1.下列物质中,可溶于水的是 A 胆固醇: B 芬必得: C 维生素C: D 保幼激素JH-I: 2.信息、材料和能源被称为新科技革命的三大支柱。下列有关说法错误的是 A 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 B 目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 C 2002年12月30日发射成功的“神州四号”使用了大量的复合材料 D 法国已经掌握了核燃料的循环使用,并应用在各核电站中 3.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是 A CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol B H2(g)+Cl2(g)=2KCl(g);△H=-184.6kJ/mol C 2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol D CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol 4.右图为一种冰的晶胞,请问该每个晶胞中有几个氢键 A 2 B 4 C 8 D 12
初中化学竞赛难题集
初中化学竞赛难题集 1.将1LH2、O2,N2、Cl2的混合气体在密闭容器里点火,生成1g溶液,则剩下的气体可能是( ) A H2、O2、N2BH2、N2、HCl C HCl、 O2、N2 D O2、N2、Cl2 答案;B,D 2、在托盘天平两盘上,放上A、B两个烧杯,烧杯内均盛有质量不同但都含有硫酸9.8克的稀硫酸,已知A烧杯比B烧杯重,现在A、B两烧杯中分别投入等质量的铁和锌反应结束后,天平保持平衡,则反应前A、B烧杯最大质量差为________或________. 答案:0、0027g、0、0014g 3、一定质量的铁粉加入盐酸和氯化铜混合溶液中,反应完全后过滤,称得滤渣的质量与所加的铁粉质量相同,则混合溶液中盐酸和氯化铜两溶质的分子个数比为 ____. 假设加入64g铁粉,参与反应,生成64g铜需要铁粉56g 和酸反应要铁粉8g 8x2/56:1=2:7 所以酸和氯化铜的物质的量浓度之比是2:7 答案:2:7 4、SO3溶液在浓硫酸中所形成的液体称发烟硫酸,其浓度通常以游离的SO3含量来表示,如20%的发烟硫酸即表示在硫酸中含有20%的SO3。现有20%的发烟硫酸5Kg,用水冲稀可得______Kg25%的稀硫酸.
答案:20.9 SO3 + H2O ====H2SO4 80 98 5kg*20%=1kg x=1.225kg 1.225kg+(5kg-1kg)=5.225kg 5.225kg/25%=20.9kg 5、在一个6L的密闭容器中,放入3LX( g )和2LY( g ),在一定条件下发生反应:4X( g )+3Y(g )=2Q(g)+nR( g).达到平衡后,容器温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中n的值是____. 答案:6 4+3<2+n n>5 6 两金属A和B的相对分子质量之比为8:9,等质量的A和B分别与足量的稀盐酸反应,生成的氢气质量之比为3:4.则两金属的化合价之比为(): A1:2B2:1 C3:2D 2:3 x/8:y/9=3:4 x:y=2:3 化合价/相对分子质量=m氢气 答案:D 7、肥皂的主要成分为硬脂酸钠(C17H35COONa),它与水中的Ca2+、Mg2+起反应生成硬脂酸钙和硬脂酸镁沉淀而不能起泡。现有肥皂水溶液和四种等体积的待测溶液:①蒸馏水;②0.1% CaCl2溶液;③1% CaCl2溶液;④10% MgCl2溶液。试回答:检验这四种溶液应选用的方法是__________________________。 答案:分别在溶液中滴加肥皂水溶液,看起泡的快慢。
2020年高中化学竞赛预赛试题(山东省)
2020年全国高中化学奥林匹克竞赛山东省预赛试题 (满分100分时间120分钟) 可能用到的相对原子质量: H:1 C:12 N:14 O:16 S:32 Cl:35.5 N a:23 Mg:24 Ca:40 Fe:56 Cu:64 Ag:108 一、选择题 (本题包括20小题,每小题有1~2个选项符合题意。每小题2分,共40分) 1.加酶洗衣粉可洗去衣物上的汗渍、油渍和血迹,因而深受人们的喜爱。下列衣料中不能用加酶洗衣粉洗涤的是: ①人造丝织物②蚕丝织物③ 涤纶织物④羊绒织物⑤ 维纶织物⑥ 棉麻织物 (A) ①③⑤ (B) ②③⑤ (C) ②④ (D) ②④⑥ 2.下列做法中不正确的是 (A) 水银温度计不慎摔破后,在可能散落水银的地方用硫粉覆盖 (B) 苯酚溶液不慎沾到皮肤上,立即用酒精洗涤 (C) 被蚊虫叮咬后,可在叮咬处涂抹稀氢氧化钠溶液中和蚁酸,消除红肿 (D) 燃着的酒精灯歪倒,撒出酒精并着火,应迅速用湿抹布扑盖 3.大脑营养学研究表明,大脑的生长发育与不饱和脂肪酸密切相关。从深海鱼油中提取出的DHA是一种不饱和程度很高的脂肪酸,被称为“脑黄金”,它的分子中含有6个碳碳双键,学名为二十六碳六烯酸,它的分子组成为 (A) C25H41COOH (B) C25H39COOH (C) C26H31COOH (D) C26H47COOH 4.下列实验操作中,仪器末端需插入液面下的有①制备氢氧化亚铁时将氢氧化钠溶液注入硫酸亚铁溶液中所用的滴管②制取氢气的简易装置中的长颈漏斗③实验室里进行石油蒸馏的装置中的温度计④将洗气装置用于排水量取气体的体积时,较长的一根导管⑤ 用乙醇制取乙烯时所用的温度计 (A) ②③④⑤ (B) ①②③⑤ (C) ①②③④⑤ (D) ①②④⑤ 5.某溶液中含有大量的Ag+、NH4+、Al3+、Fe2+四种金属离子。往该溶液中加入过量氢氧化钠溶液,充分搅拌后,再加入过量稀硝酸,此时溶液中一定能大量存在的金属离子是 (A) Na+、Al3+、Fe3+、Ag+ (B) Na+、Al3+、Fe2+ (C) Na+、Al3+、Fe3+ (D) Na+、Fe3+、Ag+ 6.测得HClO4·H2O的结构为H3O+ClO4-,下列最能证明该结构正确的叙述是 (A) 是酸性最强的无机酸 (B) 有强氧化性 (C) 遇热易分解 (D) 有4个相同的键 7.贫铀炸弹是一种杀伤力很强的武器。贫铀是提炼铀235后的副产品,其主要成分是铀238。贫铀炸弹不仅有很强的穿甲能力,而且铀238具有放射性,人长期受到核辐射会患皮肤癌和白血病。以下关于铀元素的叙述正确的是 (A) 23892U原子中中子数比核外电子数多146个 (B) 23892U和23592U互为同素异形体 (C) 铀元素位于元素周期表的第六周期 (D) 铀元素属于过渡元素 8.氟化氢气体能以(HF)n形式存在,已知氟化氢气体中存在下面的平衡:H3F33HF;H2F22HF(正反应均为吸热反应)。则下列叙述中不正确的是 (A) 若气体的平均摩尔质量为40g·mol-1,则H3F3的体积分数可能为10% (B) 若气体的平均摩尔质量为42g·mol-1,则H3F3的体积分数必小于10% (C) 若在定温定容下再充入H3F3,则H3F3与HF的浓度(mol·L-1)比值增大 (D) 若在定温定容下再充入HF,则H3F3与HF的浓度(mol·L-1)比值增大 9.下列物质在晶体状况时,阴阳离子个数比不为1:1的是 (A) NaHSO4 (B) CaH2 (C) Na2O2 (D) CaC2 10.常温下,取下列固体各10g分别与90g水充分混合,所得溶液中溶质的质量分数 最小的是 (A) Na2O (B) CaO (C) SO3 (D) CuSO4·5H2O 11.F是一种治疗艾滋病的新药 (结构简式如图)。 已知F分子中苯环与—NH—CO—O—基团在同一平面内,关于F的以下说法正确的是N H
2015年全国初中化学竞赛试题及解答-精选.pdf
2015年全国初中化学素质和实验能力竞赛(第24届天原杯)复试试题可能用到的相对原子质量: H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、S-32、Cl-35.5、K-39、Ca- 40、Fe-56、Cu-64、Zn-65、Ag-108、Ba-137 一、选择题(本题包括15个小题,每小题2分,共30分。每小题有1个或2个选项符合题意。若有2个答案的错1个不得分,漏选1个扣1分。请将答案填在答题卡相应题号的空格内) 1.网络神曲“化学是你,化学是我”揭示了化学与生活的密切关系。下列有关说法中正确的 是() A.碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 B.84消毒液在日常生活中使用广泛,溶液无色、有漂白作用,它的有效成分为Ca(ClO)2 C.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 D.明矾[KAl(SO4)2·12H2O]溶于水会形成胶体,因此可用于自来水的消毒杀菌 2.科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中每个 代表一个碳原子,每个代表一个氢原子,下列说法中正确的是:() A. 该分子的分子式C5H4 B. 该分子中碳元素的质量分数为93.75% C. 该分子中的氢原子与碳原子的原子个数比为5:4 D.等质量的该物质与甲烷相比,燃烧时消耗的氧气更多 3.下列做法不会使人中毒的是() A.用工业酒精配制白酒饮用B.将燃气热水器安装在浴室内 C.向蔬菜大棚内通入适量的CO2D.用胆矾对饮用水进行消毒 4. 海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压, 水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能 通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的 是() A.溶质质量增加B.溶剂质量减少 C.溶液质量不变D.溶质质量分数减少 5.已知①钠、镁、铝等活泼金属能与乙醇反应,生成乙醇的金属化合物和氢气;②二氧化碳 不支持燃烧是相对的,有些金属如镁能在二氧化碳中燃烧生成金属氧化物和单质碳, 则在下表各选项中,不能利用置换反应通过Y得到W的一组化合物是()
化学竞赛专题讲座
化学竞赛专题讲座 胡征善 四、配合物 一、常见的一些配位体——配体为多原子时,粗体字表示的原子往往是配位原子 二、配合物的同分异构现象 构造异构 配合物的同分异构现象几何异构 空间异构 (立体异构)旋光异构
2.空间异构 (1)几何异构 ② 单齿配体数为4的平面四方配合物 对于M a 2b 2和M a 2bc ,它们存在两种几何异构体 b a b a M M c a a c b a b a 对于M abcd ,它存在三种几何异构体 ③ 单齿配体数为6的正八面体配合物 对于M a 4b 2 b a b a M M b a a b b c c b M M a d a d b a b a 顺式 反式 顺式 反式 b d M a c Cl NH 3 Cl NH 3 Pt Pt Cl NH 3 H 3N Cl 顺—二氯二氨合铂(Ⅱ) 反—二氯二氨合铂(Ⅱ) 橙黄色晶体 鲜黄色晶体 有抑制某些癌的作用 没有治癌作用 a b a a a a M M b a a a b b 顺式 反式
对于 M a 3b 3 面式:3个相同的配体占据八面体一个面的各个顶点。 经式:3个相同的配体好像占据地球的经纬线(经纬线用“ ”表示) 。 对于M a 2b 2c 2 (2)旋光异构(亦称对映异构)——一个分子或离子完全没有对称性(指无对称中对称面或对称的旋转轴)或只有对称的旋转轴,它的镜像不能与自己重叠。 例如:[Co(en)2Cl 2] 对映异构 旋光异构现象与人类有密切关系,多数天然物质具有旋光性。例如:烟草中天然尼古丁是左旋的,有很大的毒性,而人工合成的尼古丁毒性很小;二羟基苯基—1—丙氨酸的左旋体可作为药物,是治疗振颤性麻痹症的特效药,而其右旋体则毫无药效。 三、特殊配合物——过渡金属羰基配合物和“夹心”配合物(π电子配合物) 1. 过渡金属羰基配合物 除锆和铪的羰基配合物尚未制得外,其他过渡金属都能形成羰基配合物。 ① EAN(18电子)规则——金属原子价电子数[(n —1)d x n s y , 价电子数为x+y] + 配位体 提供的电子总数==18。 b a b a b a M M b a b b a a 面式 经式 b a b M c a b c b a b a c M M a b a c c b a b c b a b M M c b a c a c Cl en Co en Cl en en Cl Cl Co Co Cl Cl en en
全国初中化学竞赛试题及解答
20XX年全国初中化学素质和实验能力竞赛(第24届天原杯)复试试题可能用到的相对原子质量: H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、S-32、Cl-35.5、K-39、Ca- 40、Fe-56、Cu-64、Zn-65、Ag-108、Ba-137 一、选择题(本题包括15个小题,每小题2分,共30分。每小题有1个或2个选项符合题意。若有2个答案的错1个不得分,漏选1个扣1分。请将答案填在答题卡相应题号的空格内) 1.网络神曲“化学是你,化学是我”揭示了化学与生活的密切关系。下列有关说法中正确的是() A.碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 B.84消毒液在日常生活中使用广泛,溶液无色、有漂白作用,它的有效成分为Ca(ClO)2 C.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 D.明矾[KAl(SO4)2·12H2O]溶于水会形成胶体,因此可用于自来水的消毒杀菌 2.科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中每个 代表一个碳原子,每个代表一个氢原子,下列说法中正确的是:() A. 该分子的分子式C5H4 B. 该分子中碳元素的质量分数为93.75% C. 该分子中的氢原子与碳原子的原子个数比为5:4 D.等质量的该物质与甲烷相比,燃烧时消耗的氧气更多 3.下列做法不会使人中毒的是() A.用工业酒精配制白酒饮用B.将燃气热水器安装在浴室内 C.向蔬菜大棚内通入适量的CO2D.用胆矾对饮用水进行消毒 4. 海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压, 水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能 通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的 是() A.溶质质量增加B.溶剂质量减少 C.溶液质量不变D.溶质质量分数减少 5.已知①钠、镁、铝等活泼金属能与乙醇反应,生成乙醇的金属化合物和氢气;②二氧化碳不支持燃烧是相对的,有些金属如镁能在二氧化碳中燃烧生成金属氧化物和单质碳, 则在下表各选项中,不能利用置换反应通过Y得到W的一组化合物是()
2003全国高中化学奥林匹克竞赛山东省预赛试题
(满分100分时间120分钟) 可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 C1:35.5Na:23 Mg:24 Ca:40 Fe:56 Cu:64 Ag:108 一、选择题(本题包括20小题,每小题有1—2个选项符合题意。每小题2分,共40分) 1.加酶洗衣粉可洗去衣物上的汗渍、油渍和血迹,因而深受人们的喜爱。下列衣料中不能用加酶洗衣粉洗涤的是:①人造丝织物②蚕丝织物③涤纶织物④羊绒织物 ⑤维纶织物⑥棉麻织物 (A)①③⑤(B)②③⑤(C)②④(D)②④⑥ 2.下列做法中不正确的是 (A)水银温度计不慎摔破后,在可能散落水银的地方用硫粉覆盖 (B)苯酚溶液不慎沾到皮肤上,立即用酒精洗涤 (C)被蚊虫叮咬后,可在叮咬处涂抹稀氢氧化钠溶液中和蚁酸,消除红肿 (D)燃着的酒精灯歪倒,撒出酒精并着火,应迅速用湿抹布扑盖 3.大脑营养学研究表明,大脑的生长发育与不饱和脂肪酸密切相关。从深海鱼油中提取出的DHA是一种不饱和程度很高的脂肪酸,被称为“脑黄金”,它的分子中含有6个碳碳双键,学名为二十六碳六烯酸,它的分子组成为 (A)C25H41COOH (B)C25H39COOH (C)C26H31COOH (D)C26H47COOH 4.下列实验操作中,仪器末端需插入液面下的有①制备氢氧化亚铁时将氢氧化钠溶液注入硫酸亚铁溶液中所用的滴管②制取氢气的简易装置中的长颈漏斗③实验室里进行石油蒸馏的装置中的温度计④将洗气装置用于排水量取气体的体积时,较长的一根导管⑤用乙醇制取乙烯时所用的温度计 (A)②③④⑤(B)①②③⑤ (C)①②③④⑤(D)①②④⑤ 5.某溶液中含有大量的Ag+、NH4+、Al3+、Fe2+四种金属离子。往该溶液中加入过量氢氧化钠溶液,充分搅拌后,再加入过量稀硝酸,此时溶液中一定能大量存在的金属离子是 (A)Na+、A13+、Fe3+、Ag+(B)Na+、Al3+、Fe2+ (C)Na+、Al3+、Fe3+(D)Na+、Fe3+、Ag+ 6.测得HClO4·H2O的结构为H3O+C1O4-,下列最能证明该结构正确的叙述是 (A)是酸性最强的无机酸(B)有强氧化性 (C)遇热易分解(D)有4个相同的键 7.贫铀炸弹是一种杀伤力很强的武器。贫铀是提炼铀235后的副产品,其主要成分是铀238。贫铀炸弹不仅有很强的穿甲能力,而且铀238具有放射性,人长期受到核辐射会患皮肤癌和白血病。以下关于铀元素的叙述正确的是 (A)23892U原子中,中子数比核外电子数多146个 (B) 23892U和23592U互为同素异形体 (C)铀元素位于元素周期表的第六周期
化学竞赛计算题的解题方法和技巧
化学竞赛计算题的解题方法和技巧 初中化学竞赛试题中常设置新颖、灵活的计算题,借以考查学生的灵活性和创造性。为 了提高解题速率,提高学生的逻辑、抽象思维能力和分析、解决问题的能力,掌握化学计算 的基本技巧非常必要。现将化学竞赛计算题的解题方法和技巧归纳如下,供参考。 1.守恒法 例1 某种含有MgBr2和MgO的混合物,经分析测得Mg元素的质量分数为38.4%,求溴 (Br)元素的质量分数。(Br---80) 解析:在混合物中,元素的正价总数=元素的负价总数,因此,Mg原子数×Mg元素的化 合价数值=Br原子数×Br元素的化合价数值+O原子数×O元素的化合价数值。 设混合物的质量为100克,其中Br元素的质量为a克,则38.4 故Br%=40%。 2.巧设数据法 例2 将w克由NaHCO3和NH4HCO3组成的混合物充分加热,排出气体后质量变为 w 克,求混合物中NaHCO3和NH4HCO3的质量比。 解析:由2NaHCO3Na2CO3+H2O↑+CO2↑ NH4HCO3NH3↑+H2O↑+CO2↑ 可知,残留固体仅为Na2CO3,可巧设残留固体的质量为106克,则原混合物的质量为 106克×2=212克,故m NaHCO3=168克,m NH4HCO3=212克-168克=44克。 3.极值法 例3 取3.5克某二价金属的单质投入50克溶质质量分数为18.25%的稀盐酸中,反应结束 后,金属仍有剩余;若2.5克该金属投入与上述相同质量、相同质量分数的稀盐酸中,等反 应结束后,加入该金属还可以反应。该金属的相对原子质量为( ) A.24 B.40 C.56 D.65 解析:盐酸溶液中溶质的质量为50克×18.25%=9.125克,9.125克盐酸溶质最多产生H2 的质量为=0.25克。由题意知,产生1克H2需金属的平均质量小于3.5克×4=14 克,大于2.5克×4=10克,又知该金属为二价金属,故该金属的相对原子质量小于28,大于 20。答案选A。 4.十字交叉法
高二化学竞赛辅导培训计划
高二化学竞赛辅导培训计划 一、辅导思想 1、举全备课组之力参与竞赛辅导。 2、辅导教师认真备课、上课,精心辅导。 3、辅导教师严格学生课堂管理。 4、强调竞赛辅导纪律,关注参赛学生进出教室。 二、辅导要求 教师方面:1.多研讨,多做题。 2.加强资料的搜集和分类管理。 3.做好学生的出勤和考试管理。 学生方面:1.加强出勤,保证出满勤; 2.创造条件,使学生能在足够时间完成相关内容。 3.加强指导,努力提高学生的兴趣和信心。 三、辅导计划 1.把选拔出的选手组成竞赛班,以讲座的形式复习基础知识,这个阶段是较大规模的复习训练。 2.进入专题训练。以小专题的形式加强训练。 3. 模拟考试。这个阶段主要任务是设计模拟竞赛试卷,改卷,评卷。取材范围广,如历届赛题,培训题等等。这一阶段要求老师与学生充分发挥主观能动性,认真严肃对待每一次测试,限时保质保量完成。 四、做好竞赛学生工作 1. 抓好竞赛学生的思想工作 2. 引导竞赛学生掌握正确的学习方法 3. 抓好课堂教学中基础知识的掌握与竞赛能力的培养 4. 抓好知识的拓宽、加深,培养竞赛拔尖人才 五、辅导时间 利用晚上化学自习进行,其它时间待定 六、负责老师: 每位教师按要求精心组织竞赛内容,力求习题精选,知识点覆盖全面,涉及常见易错点。当堂讲解知识点及习题,有针对性和突破性的专题辅导。 七、辅导措施: 1、注重基础知识训练。 由于竞赛命题大多以课本为依据,因此在辅导时要紧扣课本,严格按照由浅入深、由易到难、由简到繁、循序渐进的原则,适时联系课本内容。 2、不拘泥于课本,适当扩展深度。 由于竞赛题目往往比平时考试试题难,教师必须在课本的基础上加以延伸、拓
中国化学会第21届(2019年)全国高中学生化学竞赛(省级赛区)试题和答案(内部资料,请不要上传到互
中国化学会第 21届( 2019 年)全国高中学生化学竞 赛 (省级赛区)试题 时间: 3 小时 满分: 100 分) 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 6 10 7 10 12 8 4 10 12 9 100 H 1.008 相对原子质量 He 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La - Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr [223] Ra [226] Ac - Lr Rf Db Sg Bh Hs Mt Ds Rg 第一题(12 分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成 Si (OH ) 4 1.已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪 50 年代就发现了 CH 5+ 的存在,人们曾提出该离子结构的种种假设,然而,直 至 1999 年才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢 原子围绕着碳原子快速转动;所有 C - H 键的键长相等。 2.该离子的结构能否用经典的共价键理论说明?简述理由。 第二题( 6分) 羟胺和用同位素标记氮原子( N* )的亚硝酸在不同介质中发生反应,方程式如下: NH 2OH + HN*O 2→A +H 2O NH 2OH +HN*O 2→B +H 2O A 、 B 脱水都能形成 N 2O ,由 A 得到 N*NO 和 NN*O ,而由 B 只得到 NN*O 请分别写出 A 和 B 的路易斯结构式。 ) 路易斯酸 3.该离子是( A 质子酸 B 2003年 5月报道, 在石油中发现一种新的烷烃分子, 子钻石”,若能合成,有可能用作合成纳米材料的理想模板。该分子的结构简图如下: 4.该分子的分子式为 C 自由基 D 亲核试剂 因其结构类似于金刚石, 被称为 “分 6.该分子有几种不同级的碳原子? 7.该分子有无手性碳原 子?
