光谱法研究微乳体系中稀土钕离子_与牛血清白蛋白的作用_张红梅

DOI:10.15958/https://www.360docs.net/doc/e56371897.html, ki.gd xbzrb.2004.01.011
第21卷第1期贵州大学学报(自然科学版)Vol.21No.1 2004年 2月Journal of Guizhou University(Natural Sciences)Feb.2004文章编号 1000-5269(2004)01-0064-04
光谱法研究微乳体系中稀土钕离子(Ⅲ)
与牛血清白蛋白的作用
张红梅1,2,张朝平1
(1.贵州大学化学与生化学院化学系,贵州贵阳 550025;2.盐城师范学院化学系,江苏盐城 224002)
摘 要 用紫外光谱研究了不同pH值下微乳体系中稀土Nd3+离子与牛血清白蛋白(B SA)的作用。初步探讨了微乳体系中Nd3+与牛血清白蛋白作用的机理。同时,制备了它们的固态聚合物,测定了红外光谱特性,表明BSA在SDS微乳体系中确与Nd3+离子发生了反应。
关键词 稀土金属离子;牛血清白蛋白;微乳液;紫外/可见光谱;红外光谱
中图分类号 Q648。2+3 文献标识码 A
稀土离子与生物配体的配合物由于其独特的性质,在众多领域引起了人们的广泛关注[1~4]。血清白蛋白-B SA(bovine serum albumin)是人和动物体内血浆中含量最丰富的蛋白质,同时也是一种含多个配位基团的生物有机大分子,其生物功能与其特定结构密切相关,因此研究稀土与蛋白质的作用对探讨其生物功能奥秘有着重要意义。微乳体系中血清白蛋白(B SA)与稀土离子(Ⅲ)的作用,在文献中少见报道[5]。因十二烷基硫酸钠(SDS)对牛血清白蛋白的螺旋结构有重组效应[6],为此,本文研究了在SDS存在下的微乳体系中B SA与稀土离子Nd3+作用的配合位置及配位引起的蛋白质结构的变化。
1 实验
1.1 主要试剂和仪器
试剂:牛血清白蛋白(B SA)(上海丽珠东风生物技术有限公司),用时未经纯化,配成一定浓度的溶液于<5℃冰箱中保存;SDS(A.R重庆无机化学试剂厂),配成0.2%溶液;硝酸钕用纯度大于99.9%的稀土氧化物(ACR OS ORGANICS)经硝酸溶解转化而成。稀土溶液与B SA溶液均用Tris(三羟甲基氨基甲烷)缓冲溶液配制,离子强度为0.15mol/l(NaCl)。用NaOH和HNO3来调节所需pH值,并在Orion-818pH计上校正其准确pH值。其余试剂均为AR级,实验用水为二次蒸馏水。
仪器:UV-265型紫外分光光度计(日本岛津);Orion-818型酸度计(USA);Vector-22(Brucker Co.German)红外光度计;CS-501型超级恒温器(重庆试验设备厂)
1.2 实验方法
称取一定量的B SA(固体)于锥形瓶A中,加入0.2%SDS溶液,及不同pH值(7.3,6.3,5.3,4.3)的tris 缓冲液,庚烷和正戊醇;在另一锥形瓶B中,加入一定量Nd(NO3)3溶液及相同pH值的tris缓冲液,庚烷和正戊醇,分别于磁力搅拌器上搅拌乳化,形成透明均一的微乳液后,再将二者混合于三颈瓶中,于50±0.5℃下恒温2小时50分钟,取出后水浴减压回流1.5h,冷却,取上层清液,以A中微乳液作为参比,测定不同pH值下聚合物的uv/vis吸收光谱。三颈瓶中物质于高速离心机上分离出沉淀,分别用水和丙酮多次洗涤后,将其于真空干燥箱中干燥,样品用于IR测试。
2 结果与讨论
2.1 BSA与Nd3+物种的UV光谱:
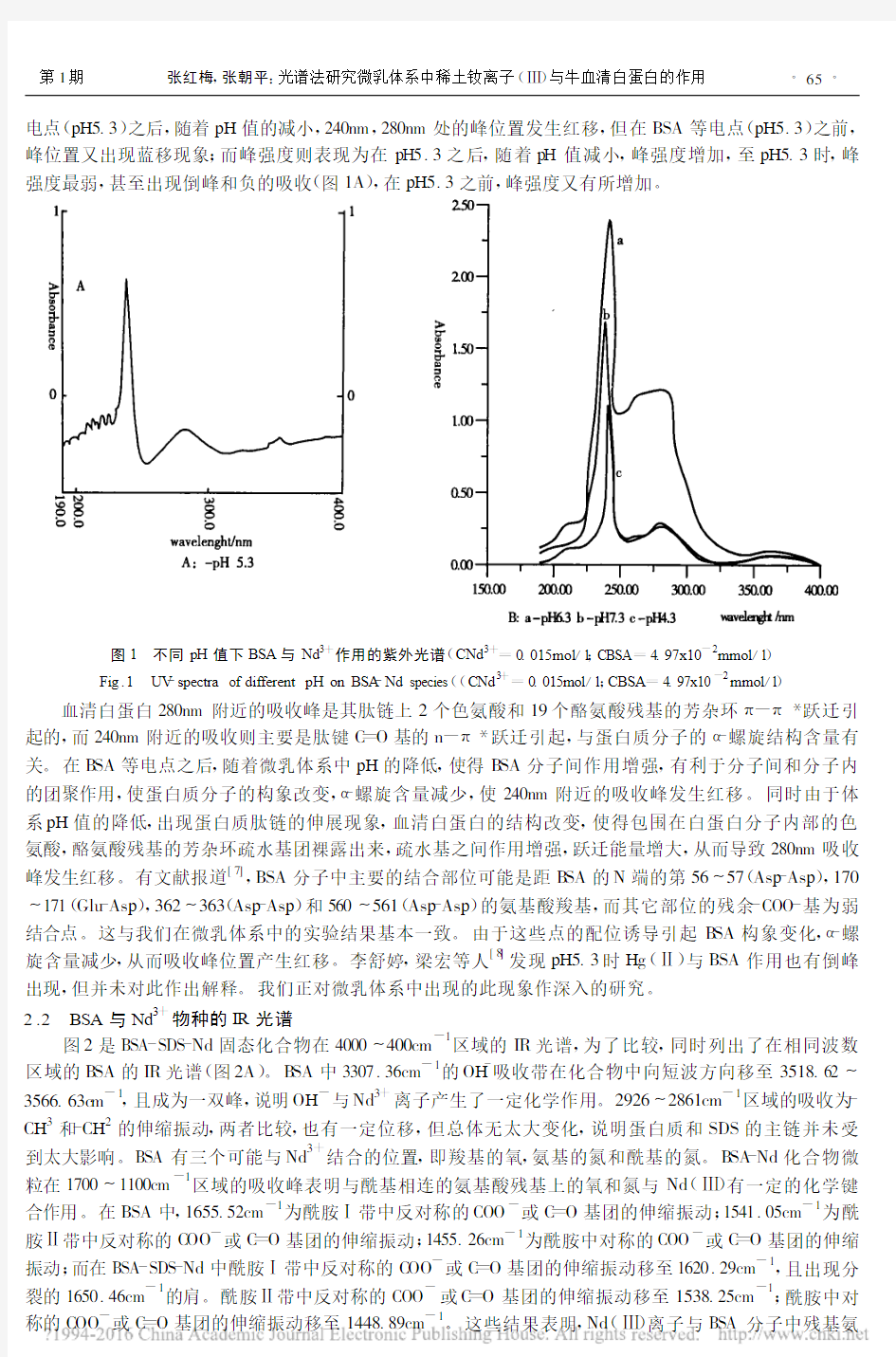
图1是不同pH值微乳体系中BSA与Nd3+离子作用的紫外吸收光谱。从图上可以看出,只在BSA等
收稿日期:2003-09-19
作者简介:张红梅(1979-),女,现为贵州大学化学系硕士研究生。研究方向:生物无机化学。
电点(pH5.3)之后,随着pH 值的减小,240nm ,280nm 处的峰位置发生红移,但在BSA 等电点(pH5.3)之前,峰位置又出现蓝移现象;而峰强度则表现为在pH5.3之后,随着pH 值减小,峰强度增加,至pH5.3时,峰强度最弱,甚至出现倒峰和负的吸收(图1A ),在pH5.3之前,峰强度又有所增加
。
图1 不同pH 值下BSA 与Nd 3+作用的紫外光谱(CNd 3+=0.015mol /l ;CBSA =4.97x10-2mmol /l )
Fig .1 UV -spectra of different pH on BSA -Nd species ((C Nd 3+=0.015mol /l ;CBSA =4.97x10-2mmo l /l )
血清白蛋白280nm 附近的吸收峰是其肽链上2个色氨酸和19个酪氨酸残基的芳杂环π-π*跃迁引起的,而240nm 附近的吸收则主要是肽键C =O 基的n -π*跃迁引起,与蛋白质分子的α-螺旋结构含量有关。在B SA 等电点之后,随着微乳体系中pH 的降低,使得B SA 分子间作用增强,有利于分子间和分子内的团聚作用,使蛋白质分子的构象改变,α-螺旋含量减少,使240nm 附近的吸收峰发生红移。同时由于体系pH 值的降低,出现蛋白质肽链的伸展现象,血清白蛋白的结构改变,使得包围在白蛋白分子内部的色氨酸,酪氨酸残基的芳杂环疏水基团裸露出来,疏水基之间作用增强,跃迁能量增大,从而导致280nm 吸收峰发生红移。有文献报道[7],BSA 分子中主要的结合部位可能是距B SA 的N 端的第56~57(Asp -Asp ),170~171(Glu -Asp ),362~363(Asp -Asp )和560~561(Asp -Asp )的氨基酸羧基,而其它部位的残余-COO -基为弱结合点。这与我们在微乳体系中的实验结果基本一致。由于这些点的配位诱导引起B SA 构象变化,α-螺旋含量减少,从而吸收峰位置产生红移。李舒婷,梁宏等人[8]发现pH5.3时Hg (Ⅱ)与BSA 作用也有倒峰出现,但并未对此作出解释。我们正对微乳体系中出现的此现象作深入的研究。
2.2 BSA 与Nd 3+物种的IR 光谱
图2是BSA -SDS -Nd 固态化合物在4000~400cm -1区域的IR 光谱,为了比较,同时列出了在相同波数
区域的B SA 的IR 光谱(图2A )。B SA 中3307.36cm -1的OH -吸收带在化合物中向短波方向移至3518.62~3566.63c m -1,且成为一双峰,说明OH -与Nd 3+离子产生了一定化学作用。2926~2861cm -1区域的吸收为-CH 3和-CH 2的伸缩振动,两者比较,也有一定位移,但总体无太大变化,说明蛋白质和SDS 的主链并未受到太大影响。BSA 有三个可能与Nd
3+结合的位置,即羧基的氧,氨基的氮和酰基的氮。B SA -Nd 化合物微粒在1700~1100cm -1区域的吸收峰表明与酰基相连的氨基酸残基上的氧和氮与Nd (Ⅲ)有一定的化学键
合作用。在BSA 中,1655.52cm -1为酰胺Ⅰ带中反对称的COO -或C =O 基团的伸缩振动;1541.05cm -1为酰
胺Ⅱ带中反对称的C OO -或C =O 基团的伸缩振动;1455.26cm -1为酰胺中对称的COO -或C =O 基团的伸缩振动;而在BSA -SDS -Nd 中酰胺Ⅰ带中反对称的C OO -或C =O 基团的伸缩振动移至1620.29cm -1,且出现分裂的1650.46cm -1的肩。酰胺Ⅱ带中反对称的COO -或C =O 基团的伸缩振动移至1538.25cm -1
;酰胺中对称的C OO -或C =O 基团的伸缩振动移至1448.89cm -1。这些结果表明,Nd (Ⅲ)离子与BSA 分子中残基氨·65·第1期 张红梅,张朝平:光谱法研究微乳体系中稀土钕离子(Ⅲ)与牛血清白蛋白的作用
Wavenumber cm -
1图2 BSA (A ),BSA -SDS -Nd (B )聚合物在4000~400cm -1范围内的红外光谱(溴化钾压片)
Fig .2 The IR spectra of BSA (A ),BSA -SDS -Nd (B )polymeric pa rticles in 4000~400cm -1range (Disc o f KBr )
基的氮和羧基的氧均可能存在直接的键合作用。1398.50和1383.97cm -1归属于酰胺Ⅳ带中C -N 伸缩或N -H 变形振动;其中BSA -SDS -Nd 化合物中1156.96cm -1
尤为突出,此为BSA 中C -N -C 伸缩振动,
表明酰胺图3 Nd (Ⅲ)离子与BSA 的相互作用
Fig .3 The interaction of BSA -Nd (Ⅲ)
上的氮与N d 3+离子产生了较强的配位键。BSA 中的C -S 伸缩带从695.92cm -1移动到Nd 聚合物中的659.41c m -1,移动了约36cm -1,这也说明Nd 和C -S 键中的配位体产生了化学作用。而在Nd 聚合物谱图上的600.76cm -1,499.82c m -1,则为Nd -O 键伸缩振动。以上这些结果表明,Nd (Ⅲ)离子与B SA 分子中残基氨基的氮和羧基的氧及C -S 键均可能存在直接的键合作用,这种作用如图3所表明的那样发生在蛋白质的表面,而BSA 的主体骨架并未受到影响。
参
考文献[1]Harris W .R ..Estimation of the ferrous -trans ferrin binding constants based on thermodynamic studies of nickel (Ⅱ)-trans ferrin .Inorg .Chem .[J ],1986,69(1~2):1-7.·66·贵州大学学报(自然科学版) 第21卷
[2]Evans C .H .Infl uence of extracellular calcium on cell permeabiliz ation and gro wth regulation by the l ymphpkine leukoregul in .Bi oche mistry of the Lan -
thanides ,new york :Plenum Pres s [P ],1990:85.
[3]Qian Z .M .,Tang P .L ..A dyna mic observation on the micro -structure of a water -based electro -meological fluid us ing an optical microsc ope .Biochem .
Biophys .Acta [J ],1995,1269:205-214.
[4]Cheng Y ,Chen B ,Lu J ,et al .The reaction of lanthanide ions with ndoxyl steearic acides and its utilization for the ESR study on the permeability of lipid -
bilayer of erythocyte membrane to gadolinium ions [J ].Inorg .Biochem .[J ],1998,69(1~2):1-7.
[5]SHEN De -jun ,ZHA NG Chao -ping ,LUO YU -ping (申德君,张朝平,罗玉萍).Preparation of Polymeric Nanoparticles of BSA -SDS -A g and Inves tigation
of Properties of Its Hydrogeles (Ⅱ).Chinese J .Spectroscopy and Spectral Anal ysis ,2002,22(2):257-261.
[6]Moriyama Y ,Sato Y ,andTakedaK ,J .R eformation of the Helical Structure of Bovine Serum Albumin by the Addition of Small A mounts of Sodium Dodec yl
Sulfate after the Disruption of the Structure by Urea .ColloidandInterface Sci .,1993156:420.
[7]Chen Y H ,Yang J T ,Single -charge transfer bet ween He 2+and helium ,neon ,and argon .Obs erved selecti on rule for exit channels .Martinez H M .Biochem -
is try ,1972,11:4120-4125.
[8]Shuting LI ,Danming ZHA ,Hong LIANG (李舒婷,查丹明,梁宏).Chines e J .Spectros copy and Spectral Analysis ,1999,19(5):700-703.
Study on Interaction of Neodymium Ions (Ⅲ)with Bovine Serum
Albumin (BSA )in Microemulsion Condition by Spectrum
ZHANG Hong -mei 1,2,ZHANG Chao -ping 1
(1.Department of Chemsitry ,College of Chemis try and bi oche mistry ,Guizhou University ,Guiyang ,
Guizhou 550025China ;2.Depart ment of Chemsitry ,Yan Cheng Normal College ,Jiangs u ,224002)
A bstract The interaction of Neodymium ions (Ⅲ)with bovine serum albumin (BSA )in different pH range has been investigated by UV spectr ometry in microemulsion conditiin .And solid polymer of Nd (III )with bovine ser um albumin (
B SA )has been prepared ,the IR spectrum has measured .It was pr obed that the posi -tion of the interaction of Nd (Ⅲ)with bovine serum albumin (B SA )in mircroemulsion condition .
Key words Neodymium Ions ;bovine serum albumin (B SA );microemulsion ;UV /Vis ;IR ·
67·第1期 张红梅,张朝平:光谱法研究微乳体系中稀土钕离子(Ⅲ)与牛血清白蛋白的作用
牛血清白蛋白的提取与鉴定演示教学
如有侵权请联系网站删除 牛血清白蛋白的提取与鉴定 一、实验目的 1. 掌握牛血清白蛋白的提取与鉴定方法 2.掌握盐析法、透析法及电泳法 二、实验原理 牛血清白蛋白是牛血清中的简单蛋白,是血液的主要成分(38g/100ml),分子量68kD。等电点4.8。应用相同浓度硫酸铵盐析法将血清中白蛋白与其它球蛋白分离,最后用透析法除盐,即可提取白蛋白。再利用电泳过程中带电粒子的移动速度与粒子荷电量、电场强度、粒子重量与半径及介质的黏稠度等有关,对牛血清白蛋白进行分离与鉴定。 三、操作步骤 (一)盐析取离心管一支加入牛血清2mL、加入等量PBS(磷酸盐缓冲生理盐水)稀释血清,摇匀后,逐滴加入pH7.2饱和硫酸铵溶液2mL,边加边摇,充分混匀,然后静止放臵10分钟,再离心(2000r/min)10min,将上清液倾入试管中。 (二)透析(1 )取干净的比色板,在各孔内滴加一滴纳氏试剂 (2)透析袋未放入水中时,立即取水中液体检查有无NH4+ (3)取玻璃纸一张,折成袋形,将离心后的上清液倒入袋内,用线扎紧上口(注意要留有空隙),用玻璃棒悬在盛有半杯蒸馏水的100mL烧杯内,使透析袋下半部侵入水中,对蛋白液进行透析,常用玻璃棒搅拌袋外(烧杯中)液体,以缩短透析时间。 (4)每隔2分钟检查一次,更换蒸馏水多次,用纳氏试剂检查袋外液体的NH4+,观察颜色变化并记录,直至袋内盐分透析完毕。 (5)将袋内液体倾入试管,即得牛血清白蛋白溶液。 (三)电泳(1)点样取一张膜条,将薄膜无光泽面向下,放入培养皿中的巴比妥缓冲液中使膜条充分浸透,取出,用干净滤纸吸去多余的缓冲液,以薄膜的无光泽面距一端1.5㎝处作点样线,将牛血清样品与待测的牛血清白蛋白溶液分别用点样器在同一张薄膜的点样线处不同位置点样。标准液点一次,待测液点三次。 (2)电泳将点样后的膜条臵于电泳槽架上,放臵时膜条无光泽面向下,点样端臵于阴极,待平衡5min后,打开电源,调节电泳仪的电压为160伏,通电60min,关闭电源后用镊子将膜条取出。 (3)染色将膜条直接浸于盛有氨基黑10B的染色液中,染2分钟取出,立即浸于漂洗液中,分别在漂洗液Ⅰ、Ⅱ、Ⅲ中各漂洗5min,直至背景漂洗干净为止,用滤纸吸干薄膜。(4)鉴定比较样品与待测液中白蛋白在薄膜上的电泳结果,看位置是否一致。 四、仪器和试剂 仪器:离心管、离心机、试管、玻璃纸、烧杯、比色板、滴管、玻璃棒、电泳仪、醋酸纤维素薄膜、天平 试剂:牛血清待测液、牛血清样品、PBS(磷酸盐缓冲生理盐水,用0.01mol/L磷酸盐缓冲液(pH7.2)配制的0.9%NaCl溶液)、pH7.2饱和硫酸铵溶液、纳氏试剂、巴比妥缓冲液、氨基黑10B染色液、漂洗液 五、预测结果位置一致,实验成功。若在待测液的电泳结果中出现其他球蛋白的黑带区域,则说明提取不够纯。 六、参考文献[1]陆红玲.生物化学与分子生物学实验教程.西安:第四军医大学出版社,2010 精品资料
免疫比浊法工艺模板
纤维蛋白(原)降解产物测定试剂盒(胶乳增强免疫比浊法) 主要生产工艺及反应体系的研究 一、实验目的 研究合适的纤维蛋白(原)降解产物的生产工艺和最佳反应体系。二、实验设计思想 纤维蛋白(原)降解产物测定试剂盒(胶乳增强免疫比浊法)原理是样本中的FDP抗原与试剂中的抗体结合,形成抗原抗体复合物,产生吸光度变化,胶乳试剂可特异性的增大该吸光度的变化,增大试剂的灵敏度。该吸光度变化的高低与样本中的FDP的含量成正比,测定该吸光度,采用与校准品比较,即能得出样本FDP的含量。 三、主要仪器及试剂材料 1.D240全自动生化分析仪/雷杜420全自动生化分析仪 生产商:南京神州英诺华医疗科技有限公司/深圳雷杜生命科学股份有限公司 2.纤维蛋白(原)降解产物校准品 FDP含量:84μg/mL 生产商:上海捷门生物技术合作公司 批号:S2814-1 四、实验内容及程序 纤维蛋白(原)降解产物测定试剂盒主要生产工艺过程的研制及试剂盒反应体系的建立分为三个部分:生产工艺的研制、试剂盒组成的研制、试剂盒反应体系的建立。 产品拟定标准: 线性范围:在拟定线性范围内,相关系数r≥0.99; 准确度:测定已知溯源的FDP质控品,相对偏差(Bias%)≤±25%; 灵敏度:测定已知溯源的FDP质控品12次,结果CV≤20%; 精密度:测定已知溯源的FDP质控品20次,结果CV≤15%。 1.主要工艺描述
1.1原液的准备 购进商品化的高效价纤维蛋白(原)降解产物抗体致敏胶乳,将其稀释成合适的倍数,作为试剂2备用。选择合适的缓冲体系,加入一定量的增浊剂和稳定剂作为试剂1备用。 1.2原液的验证 购进有溯源的定值校准品,在生化分析仪上,将适量的校准品加入试剂1中,在适宜的条件下,和试剂2反应,根据校准品浓度和吸光度做剂量/响应曲线,得出一条持续上升的平滑曲线,即得到合格的原液。 2.反应体系的组成及其研究 2.1购进有溯源并标示有定值的校准品; FDP含量:84μg/ml 生产商:上海捷门生物技术合作有限公司 批号:? 2.2致敏胶乳的准备 抗体致敏胶乳:上海捷门生物技术合作有限公司提供 用实验室PBS缓冲液(0.1mol/L,PH=7.4)将其倍半稀释,分别稀释成:3.5倍、3倍2.5倍、2倍、1.5倍。用上述已准备好的不同稀释倍数FDP抗体致敏胶乳和稀释好的校准品在生化仪上进行操作。 2.2.1实验方法 2.2.2实验结果
牛的牛血清白蛋白残留检测酶联免疫分析(ELISA)
牛的牛血清白蛋白残留检测酶联免疫分析(ELISA) 试剂盒使用说明书 本试剂仅供研究使用 目的:本试剂盒用于测定牛血清,血浆及相关液体样本中类牛血清白蛋白残留检测的含量。 实验原理: 本试剂盒应用双抗体夹心法测定标本中牛的牛血清白蛋白残留检测水平。用纯化的牛的牛血清白蛋白残留检测抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入类牛血清白蛋白残留检测,再与HRP标记的类牛血清白蛋白残留检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的类牛血清白蛋白残留检测呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中牛的牛血清白蛋白残留检测浓度。 试剂盒组成: 试剂盒组成48孔配置96孔配置保存 说明书1份1份 封板膜2片(48)2片(96) 密封袋1个1个 酶标包被板1×48 1×96 2-8℃保存 标准品:2700ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存 样本处理及要求: 1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。仔细收集上 清,保存过程中如出现沉淀,应再次离心。 2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心 20分钟左右(2000-3000转/分)。仔细收集上清,保存过程中如有沉淀形成,应该再次离心。 3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。仔细收集上清,保存过程 中如有沉淀形成,应再次离心。胸腹水、脑脊液参照实行。
异硫氰酸荧光素_牛血清白蛋白标记物的化学发光反应
异硫氰酸荧光素2牛血清白蛋白标记物的化学发光反应 黄春保 *1 慈云祥2 常文保21(黄冈师范学院化学系,黄州438000) 2(北京大学化学与分子工程学院,北京100871) 摘 要 采用反相流动注射法,系统地研究了碱性介质中和阳离子在表面活性剂C TM AB 存在下,N aClO 氧化 异硫氰酸荧光素2牛血清白蛋白标记物的化学发光行为和化学发光反应的条件,提出了反相流动注射化学发 光测定牛血清白蛋白的新方法。该法测定牛血清白蛋白线性范围为0.08~16mg P L;检出限为0.032mg P L 。讨 论了蛋白质标记物化学发光增强作用的原因。 关键词 异硫氰酸荧光素,牛血清白蛋白,化学发光反应,流动注射法 2001205217收稿;2001211226接受 1 引 言 蛋白质测定在临床医学和生命科学研究中具有重要意义。这方面的研究引起了人们的广泛重视。近年来,常见蛋白质测定方法的报道,其中大多是利用蛋白质与生色探针的结合作用,生成有色复合物后以分光光度法测定[1~3],少数是将蛋白质用卟吩、四环素等荧光探针标记后,用荧光光度法测定 [4,5],也见有蛋白质电分析方法的报道[6]。这些方法在临床检测和生化分析中具有一定的应用价值。 研究发现,在碱性条件下,选用某些氧化剂氧化异硫氰酸荧光素(FI TC),能产生化学发光,但强度很弱。若在碱性介质中,将异硫氰酸荧光素标记到蛋白质分子上,生成的蛋白质标记物则更易于氧化,不仅化学发光能力极大增强,而且发光强度与蛋白质的含量呈良好的线性关系。本文采用反相流动注射方法,研究了碱性介质中,次氯酸钠氧化异硫氰酸荧光素2牛血清白蛋白(B SA)标记物的化学发光行为、反应条件和阳离子表面活性剂的增敏作用,提出了反相流动注射化学发光测定牛血清白蛋白的新方法。体系的发光强度与B SA 的含量在0.08~16mg P L 范围内呈良好的线性关系;检测限为0.032mg P L 。由于采用反相流动注射进样方式,消除了样品背景干扰,故方法的灵敏度高,且稳定性好。 2 实验部分 2.1 仪器与试剂 GD 21型微光测量仪(西北有色地质研究所);LP 21型蠕动泵(北京东方仪器设备公司);自动平衡记录仪(上海大华仪表厂);821型pH 计(中山大学)。 BSA(A.R.,Sigma 公司)。FITC 溶液(1g P L):称取50mg FI TC(第三军医大学朝晖制药厂),用5mL 0.5mol P L 碳酸盐缓冲溶液和少量水使其溶解后转入50mL 容量瓶中定容。9.0@10 -2mol P L NaClO 溶液(pH=9.5):移取1.5mol P L NaClO 溶液,适当稀释,用HCl 调节溶液酸度至pH =915(酸度计测量),然后定容,该溶液在使用前配制。8.0@10-4mol P L C TM AB 溶液;0.5mol P L NaHCO 32Na 2CO 3缓冲溶液(pH= 9.5)。所用试剂均为分析纯,用二次蒸馏水配制溶液。 2.2 实验方法 2.2.1 FITC 2BSA 标记物的制备与分离 准确称取40mg B SA 置于比色管中,依次加入1.5mL 水,0.5mL 碳酸盐缓冲溶液,摇匀后缓慢滴加1mL FI TC 溶液,混合均匀后置于冰箱(4e )中反应12h 。用G 225色谱柱分离游离的FI TC 。收集FI TC 2BS A 标记物并定容20mL 。该液准确稀释250倍后用于化学发光体系的条件实验。 2.2.2 测定方法 采用反相流动注射法。测定装置流程和抽取试液速度、试液混合顺序如图1所示。NaClO 溶液通过旋转六通阀注入,每次注射体积为100L L 。试液在流动过程中混合,并立即流进发光仪第30卷 2002年4月 分析化学(FE NXI HUA X UE) 研究简报 Chinese Journal o f Analytical Chemistry 第4期 447~449
胶乳增强免疫比浊反应原理
胶乳增强免疫比浊反应原理: 免疫比浊反应原理: 当样本中的待测抗原与试剂中的特异性多克隆抗体相遇后,即可发生特异性的结合反应(一个抗原具有多个不同的抗原决定簇(反应位点),可以连接多个不同的对应位点抗体;而抗体具有两个相同的抗原结合位点,可以同时结合两个待测抗原;),从而形成网状的抗原-抗体分子复合物,引起溶液中浊度的变化,通过测试溶液中透射或散射的吸光度变化,从而确定样本中待测抗原的浓度; 胶乳增强免疫反应比浊原理: 基于免疫反应原理,和纳米颗粒的特殊效应(表面效应、量子尺寸效应、小尺寸效应、宏观量子隧道效应),不只可以检测样本中的完全抗原,也可以检测样本中的半抗原、抗体,从而引起浊度变化,此时浊度与空白样本的不同作为待测物浓度的检测依据。 免疫透射比浊法 原理: 可溶性抗原与相应抗体反应后形成的免疫复物,使介质浊度发生改变,光线通过抗原抗体反应后的溶液时,被其中的免疫复合物微粒吸收,在保持抗体过量的情况下,吸光度(A 值)与免疫复合物量呈正相关。透射光强度和形成的免疫复合物呈反比。 优点:透射比浊法灵敏度比单扩高5-10倍,重复性好,结果准确,操作简便,且能用全自动或半全自动生化分析仪进行检测。 不足: ①抗体用量较大; ②溶液中存在的抗原-抗体复合物分子应足够大(35-100nm),分子太小则阻挡不了光线的通过;数量要足够多,如果数量太少,则溶液浊度变化太小,对光通量影响不大。灵敏度较散射比浊法低; ③透射比浊测定在抗原-抗体反应的第二阶段,需在抗原抗体反应达到平衡后进行检测,耗时较长。 胶乳增强免疫比浊法 在一般的透射比浊法中,少量小分子免疫复合物极难形成浊度,要形成较大的免疫复合物,参与反应的抗原、抗体量应较大(浓度高),这无法满足高灵敏度检测项目的要求。胶乳增
牛血清白蛋白的提取与鉴定
第八次实验: 牛血清白蛋白的 提取与鉴定 一、实验名称牛血清白蛋白的提取与鉴定 二、实验目的1、掌握盐析法提取牛血清白蛋白 2、掌握血清蛋白醋酸纤维素薄膜电泳法 鉴定牛血清白蛋白 3、了解用溴甲酚绿鉴定血清蛋白 三、实验原理1,蛋白质是水化作用较强的高分子物质, 向其加入碱土金属的中性盐类可是蛋白质胶粒脱水并失去 电荷,从溶液中沉淀出来。球蛋白在半饱和的硫酸铵溶液 中可析出,而清蛋白则需在饱和的硫酸铵溶液中可析出。 可将血清中白蛋白与其它球蛋白分离,最后用透析法除盐, 即可提取白蛋白。2,利用电泳过程中带电粒子的移动速度
与粒子荷电量、电场强度、粒子重量与半径及介质的黏稠 度等有关,可对牛血清白蛋白进行分离与鉴定。3,血清中 的白蛋白与溴甲酚绿在ph=4.2的条件下结合生成绿色化合 物,溶液由黄色变为绿色,而球蛋白基本不与之反应,缩 短反应时间可去除干扰,其颜色的深浅与白蛋白浓度成正 比,可用于鉴定牛血清白蛋白。 四、实验步骤 (一)盐析取离心管一支加入牛血清2mL、加入等量PBS磷酸盐缓冲生理盐水稀释血清,摇匀后,逐滴加入pH7.2饱和硫酸铵溶液2mL,边加边摇,充分混匀,然后静止放臵10分钟,再离心(4000r/min)10min,将上清液倾入试管中。 (二)透析取玻璃纸一张,折成袋形,将离心后的上清液倒入袋内,用线扎紧上口(注意要留有空隙),用玻璃棒悬在盛有半杯蒸馏水的100mL烧杯内,使透析袋下半部侵入水中,对蛋白液进行透析,常用玻璃棒搅拌袋外(烧杯中)液体,以缩短透析时间。更换蒸馏水多次,用纳氏试剂检查袋外液体的NH4+,观察颜色变化,直至袋内盐分透析完毕。将袋内液体倾入试管,即得牛血清白蛋白溶液。(三)BCG法鉴定 白蛋白+溴甲酚绿ph=4.2 绿色复合物 或(三)电泳鉴定
体外诊断试剂胶乳比浊法学习.
胶乳免疫比浊法相关知识 很多公司开展了荧光胶乳免疫层析做定量分析及胶乳增强免疫比浊分析项目,关注胶乳标记技术的技术人员越来越多。本人总结了部分胶乳微球标记技术,并加以分类,以便朋友们查阅: 胶乳微球物理吸附: 反应微球带磺酸基、羧基、醛基表面的都是疏水微球,都可以用来设计被动吸附蛋白。磺酸基微球表面含带有负电荷的磺酸基团,pka大约为2,因此在酸性pH保持稳定。醛基微球表面也带有磺酸基团,但能和蛋白行程共价键。羧基微球表面含带负电荷的羧基基团,在pH5.0以上时保持稳定。 带有疏水基团的蛋白的吸附和配位结合,是最简单和直接的标记方法。这种方法中,微球溶液和含目标蛋白的溶液混合,反应后,未结合的游离蛋白通过清洗步骤除去,从而获得胶体蛋白复合物。疏水吸附方法只能用于疏水微球(硫酸盐、羧基、醛基表面修饰的微球)。醛基表面修饰微球是一个特例,其疏水吸附结果取决于后来的共价结合。虽然物理吸附是不依赖pH的,但反应缓冲液的pH对蛋白的结构有非常大的影响,从而影响蛋白吸附到微球上的反应效率。一般,在被吸附蛋白等电点附近pH时,物理吸附效率会很高。 反应步骤: 1.用反应缓冲液系数蛋白到10mg/ml; 2.用反应缓冲液系数胶乳微球到1%; 3.将蛋白溶液加入到胶乳微球溶液中,10ml胶乳中加入1ml蛋白溶液。室温搅拌孵育2hr; 4.离心或超滤,除去未结合蛋白; 5.将微球蛋白复合物用储存缓冲液溶解。 注意事项: 1.最优蛋白标记量影响因素 1)有效比表面积:粒径减小时,比表面积/mg微球值得增加; 2)胶体稳定性:蛋白对胶乳有稳定和去稳定作用; 3)免疫反应:最近标记量由免疫反应需要决定。 2.胶乳微球中加入蛋白后,快速搅拌混合,利于反应均衡。反应体积是1ml时,可用移液器吸取蛋白加入微球中,并吹打数次。如果反应体积较大时,用烧杯,边搅拌边加入蛋白, 3.储存缓冲液和反应缓冲液不同时,抗体有脱落的可能; 4.表面活性剂能使得抗体从胶乳中脱落,所以应避免加入。 微球共价结合抗体方法: 一、一步法 1.准备50mM pH 6.0的reaction buffer,醋酸或MES buffer更合适 2.用reaction buffer溶解抗体,使其浓度为1mg/mL。 3.用reaction buffer 悬浮微球,使其浓度为1% w/v 4.边搅拌边将一倍体积的抗体溶液加入到10倍体积的微球悬液中,室温下持续搅拌20分钟 5.准备浓度为10mg/ml(52umol/mL)的EDC溶液,用前准备,现配现用。 6.将计算需求量的EDC溶液加入到上述微球悬液中。(Note 6). 7.室温下,立即调节pH (Note 7). 8.移除未结合的蛋白,并将包被微球用storage buffer重悬。(Note 3 and 4) B. 两步法 为了避免EDC将相邻微球之间的蛋白偶联导致微球聚集或者蛋白之间交流,两步法偶联抗体更合适。两步法中,在蛋白加入之前,多余的EDC被移除。两步法中,蛋白也可以使用更高pH的buffer来溶解,从蛋白的稳定性方面和加速蛋白和活化微球之间的交联速度方便考虑,是非常有利的。
牛血清白蛋白的提取与鉴定 自主设计实验
自主实验设计 牛血清中白蛋白的提取与鉴定 小组成员: 【目的】 1.通过牛血清白蛋白的提取与鉴定,掌握盐析、离心、电泳、及呈 色反应的原理及应用。 2.通过实验掌握实验的基本操作、原理及为以后的学习打下坚实的 基础。 【原理】 本实验用盐析、离心、透析、电泳及呈色反应来分离、纯化及鉴定牛血清白蛋白。首先用盐析初步分离,在半饱和硫酸铵溶液中,血清球蛋白沉淀下来,经离心后上清液中含白蛋白。第二步用玻璃纸利用透析原理通过不断改变膜内外的浓度差让膜内的盐离子不断溢出达到纯化的目的,得到较纯的白蛋白。第三步利用电泳将蛋白彻底分离。最后,将其与标准膜一起染色,漂洗,进行对比即可达到鉴定的目的。
【操作】 1盐析 取小牛血清0.5ml+PBS液0.5ml+饱和硫酸铵2.3ml,充分混合均匀,静置20min,2500r/min 离心10min。 2、透析 取玻璃纸一张,折成袋形,将离心后的上清液倒入袋内,用线扎紧上口(注意要留有空隙),放入有自来水的小烧杯中透析,要不断震动,每隔2min换一次水,换15次。放入试管待用。 3、准备与电泳 1)取两条2.5cm x 8.0cm 的膜条,将膜条无光泽面向下,放入培养皿中的巴比妥缓冲液中冲锋浸透。 2)将充分浸透的两条膜条取出,用干净滤纸吸去多余的缓冲液,以醋纤膜的光泽面距一端1.5cm处作为点样线,并用铅笔在上面编好号①②。 3)用两个点样器分别在标准液和测定液中櫵一下,点样器下端粘上薄层标准液和样液,然后将点样器竖直,进行点样。 4)电泳将点样后的膜条置于电泳槽架上,放置时点样面向下(无光泽面),点样端置于阴极,膜条与滤纸贴紧,待平衡5min后,即可通电。调节电泳仪,使两极间距的电压为15v/cm,电流0.4~0.6Ma/cm 膜条,通电50分钟关闭电源。 5)通电完毕后,用镊子取出膜条,直接浸于盛有氨基黑10B的染色
胶乳透射免疫比浊法-国家食品药品监督管理总局
附件 5 胱抑素C测定试剂(胶乳透射免疫比浊法) 注册技术审查指导原则 本指导原则旨在指导技术审评部门对胱抑素C测定试剂(胶乳透射免疫比浊法)的技术审评工作,同时也为注册申请人注册 申报资料的准备及撰写提供参考。 本指导原则是对胱抑素C测定试剂(胶乳透射免疫比浊法)的一般要求,申请人应依据产品的具体特性确定其中内容是否适 用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。 本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验 证资料。应在遵循相关法规的前提下使用本指导原则。 本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。 一、适用范围 胱抑素C测定试剂(胶乳透射免疫比浊法)是指基于透射 免疫比浊法原理,利用半自动生化分析仪、全自动生化分析仪对人血清、血浆中的胱抑素C进行体外定量分析的试剂。 目前胱抑素C含量的测定方法主要是基于抗原抗体反应的 — 1 ——
免疫方法,如胶乳免疫比浊法、胶体金免疫比色法、单向免疫扩散法、酶联免疫吸附法、放射免疫测定法、荧光免疫测定法等, 免疫比浊法可分为透射免疫比浊法和散射免疫比浊法。其中透射免疫比浊法可适用于半自动生化分析仪、全自动生化分析仪,散射免疫比浊法需特定蛋白分析仪。 从方法学上讲,本指导原则仅适用于胶乳透射免疫比浊法,不适用于散射免疫比浊法。 依据《体外诊断试剂注册管理办法》(国家食品药品监督管 理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂 分类子目录的通知》(食药监械管〔2013〕242号),胱抑素C测定试剂(免疫比浊法)管理类别为二类,分类代号为6840。 二、注册申报资料要求 (一)综述资料 综述资料主要包括产品预期用途、产品描述、方法学特征、 生物安全性评价、研究结果总结以及同类产品上市情况介绍等 内容,应符合《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《关于公布体外诊断试剂注册申报资 料要求和批准证明文件格式的公告》(国家食品药品监督管理总 局公告2014年第44号)的相关要求。相关描述应至少包含如 下内容: 1.产品预期用途及辅助诊断的临床适应证背景情况 (1)胱抑素C的生物学特征、结构与功能、在体内正常和 病理状态下的代谢途径和存在形式。 胱抑素C(Cystatin C, CysC)是一种半胱氨酸蛋白酶抑制剂,也被称为γ—微量蛋白及γ—后球蛋白,广泛存在于各种组织的—— 2 —
牛血清白蛋白
BSA牛血清白蛋白 牛血清白蛋白(BSA),又称第五组分,是牛血清中的一种球蛋白,包含583个氨基酸残基,分子量为66.430 kDa,等电点为4.7。牛血清白蛋白在生化实验中有广泛的应用,例如在western blot中作为Blocking agent。 CAS号:9048-46-8 英文名称:Bovine albumin 英文同义词:nhsa;BSA-C;AC-BSA;ALBUMIN, PIG;albumenpowder;SERUM ALBUMIN;ACETYLA TED BSA;BSA ACETYLATED;Bovine albumin;BSA, METHYLA TED 中文名称:牛血清白蛋白 中文同义词:蛋白粉;牛白蛋白;卵蛋白粉;血清蛋白;血清白蛋白;牛血蛋白质;复合氨基酸;牛血清蛋白;牛血清白蛋白;血清白蛋白(牛) CBNumber: CB5107573 分子式:N/A 英文别名:Bovine serum albumin 化学性质 储存条件: 2-8°C 溶解度: PBS: >40 毫克/毫升 form : lyophilized powder Merck : 13,8542 稳定性:Stable. Incompatible with strong oxidizing agents and strong acids. Refrigerate. EPA化学物质信息:Albumins, blood serum(9048-46-8) 用途 1、用于生化研究、遗传工程和医药研究 2、用作医药保健食品、调味品 3、维持渗透压、pH缓冲、载体作用 4、在PCR体系中有助于Taq酶的稳定性及活性,可以提高PCR的效率
胶乳透射免疫比浊法
附件5 胱抑素C测定试剂(胶乳透射免疫比浊法) 注册技术审查指导原则 本指导原则旨在指导技术审评部门对胱抑素C测定试剂(胶乳透射免疫比浊法)的技术审评工作,同时也为注册申请人注册申报资料的准备及撰写提供参考。 本指导原则是对胱抑素C测定试剂(胶乳透射免疫比浊法)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。 本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。 本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。 一、适用范围 胱抑素C测定试剂(胶乳透射免疫比浊法)是指基于透射免疫比浊法原理,利用半自动生化分析仪、全自动生化分析仪对人血清、血浆中的胱抑素C进行体外定量分析的试剂。 目前胱抑素C含量的测定方法主要是基于抗原抗体反应的 —1 —
免疫方法,如胶乳免疫比浊法、胶体金免疫比色法、单向免疫扩散法、酶联免疫吸附法、放射免疫测定法、荧光免疫测定法等,免疫比浊法可分为透射免疫比浊法和散射免疫比浊法。其中透射免疫比浊法可适用于半自动生化分析仪、全自动生化分析仪,散射免疫比浊法需特定蛋白分析仪。 从方法学上讲,本指导原则仅适用于胶乳透射免疫比浊法,不适用于散射免疫比浊法。 依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),胱抑素C测定试剂(免疫比浊法)管理类别为二类,分类代号为6840。 二、注册申报资料要求 (一)综述资料 综述资料主要包括产品预期用途、产品描述、方法学特征、生物安全性评价、研究结果总结以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。相关描述应至少包含如下内容: 1.产品预期用途及辅助诊断的临床适应证背景情况 (1)胱抑素C的生物学特征、结构与功能、在体内正常和病理状态下的代谢途径和存在形式。 胱抑素C(Cystatin C, CysC)是一种半胱氨酸蛋白酶抑制剂,也被称为γ—微量蛋白及γ—后球蛋白,广泛存在于各种组织的—2 —
胶乳颗粒增强比浊法浅谈
胶乳颗粒增强比浊法浅谈 目前,体液标志蛋白的检测方法主要采用免疫学方法,以酶联免疫吸附测定(Enzyme-Linked ImmunosorbentAssay,ELISA)、放射免疫测定(Radioimmunoassay,RIA)和胶体金层析法(俗称“金标”)这几种方法为主。ELISA方法虽然在临床上使用了近二十年,但它依然存在一些致命缺点,定量准确性差、操作时间长、自动化程度低,一般只能用于定性检测。RIA灵敏度高,但不稳定,重复性比ELISA差,而且存在放射性污染的危险。金标方法虽然稳定性较好,但灵敏度较低,只能定性,不能定量。特别是重复性差这一缺点限制了这些检测技术在临床上的应用,尤其不适合用于需要通过准确定量来帮助对疾病进行诊断的体液标志蛋白的定量检测。因此,寻找更加稳定、准确的血浆蛋白定量检测方法一直是国际上近十年来的研究热点。 胶乳颗粒增强比浊法(particle-enhanced turbidimetric immunoassay, PETIA)是近年来出现的一种较为稳定、准确的体液蛋白均相免疫比浊检测方法。PETIA法大体分为两种。一种是散射比浊检测法;另一种是透射比浊检测法。这两种方法的基本原理非常相似,都是在高分子胶乳微球的表面交联单克隆抗体,当交联有抗体的微球与抗原结合后,在短时间内会迅速聚集在一起,改变了反应液的散光性能或透光性能。而且,反应液散光性能或透光性能(即吸光度)的改变与被测抗原的浓度有较强的相关性,在一定范围内可以反映被测抗原的浓度。PETIA检测方法是在均相反应体系中进行抗原、抗体反应及结果的测定。抗原、抗体反应后,直接测定反应液的吸光度值,省却了ELISA法反复孵育和洗板等烦琐操作步骤,几分钟就能获得结果,省时省力。此外,纳米免疫比浊法操作步骤的简化也相应地避免了许多人为操作因素和试剂、环境等外界因素的干扰,稳定性和重复性都较好,能较真实地反映被测物质的含量。免疫比浊法的灵敏度虽然比ELISA法差一些,但足于检测到健康人血浆中许多标志蛋白的下限值,可完全满足临床检测要求。
牛血清白蛋白分离提纯工艺
课程设计说明书 课程名称:生物分离工程 设计题目:牛血清白蛋白的分离提纯工艺 院系:环境与化学工程学院 学生姓名:孙盼盼 学号:41004020111 专业班级:10级生物工程01班 指导教师:王晓军 2013年6月20日
目录 1.设计任务书 (1) 2.设计背景 (1) 2.1 牛血清白蛋白分离提纯的简介 (1) 2.2 牛血清白蛋白分离提纯的意义 (1) 3.设计原理 (2) 4.设计工艺流程及设计方案说明 (2) 4.1对原材料的粗分级分离 (3) 4.2对粗分离成分进行细分级分离 (3) 4.3 蛋白的结晶与重结晶 (3) 4.4 对分离出的蛋白质进行纯度鉴定 (3) 4.5 牛血清白蛋白质分离提纯的整个工艺流程 (3) 5.操作过程 (4) 5.1蛋白质分离的准备阶段 (4) 5.2细分级分离设备的设计 (4) 5.3蛋白质的纯度鉴定 (8) 6.参考文献 (8) 7.课程设计心得 (9)
1.设计任务书 现有一混合物料液中含有酪蛋白(分子量:57000Da,pI 4.5)、β-乳球蛋白(分子量:35000Da,pI 5.1)、α-乳白蛋白(分子量:14000Da,pI 4.2)和牛血清白蛋白(分子量:66200Da,pI 4.7),设计一个分离纯化工艺纯化其中的牛血清白蛋白。 2.设计背景 2.1 牛血清白蛋白分离提纯的简介 蛋白质是(protein)是生命的物质基础,没有蛋白质就没有生命。因此,它是与生命及与各种形式的生命活动紧密联系在一起的物质。机体中的每一个细胞和所有重要组成部分都有蛋白质参与。蛋白质占人体重量的16%~20%,即一个60kg重的成年人其体内约有蛋白质9.6~12kg。人体内蛋白质的种类很多,性质、功能各异,但都是由20多种氨基酸按不同比例组合而成的,并在体内不断进行代谢与更新。 蛋白质具有很多生物化学共性,运用相关性质进行蛋白质的分离制备多种不同的单一蛋白质,更好的为人们所有。蛋白质的分离提纯技术已经很成熟,相关的工艺流程包含各种不同的分离提纯设备,这些设备运用蛋白质的不同原理对其进行分离纯化,单一蛋白质的分离提纯在现实生活中具有重要意义! 2.2 牛血清白蛋白分离提纯的意义 牛血清中的简单蛋白,是血液的主要成分(38g/100ml),分子量68kD。等电点4.8。含氮量16%,含糖量0.08%。仅含已糖和已糖胺,含脂量只有0.2%。白蛋白由581个氨基酸残基组成,其中35个半胱氨酸组成17个二硫
双水相萃取技术在提取牛血清白蛋白中的应用
牛血清白蛋白(BSA),又称第五组分,是牛血清中的一种球蛋白,包含583个氨基酸残基。分子量为66.430 kDa,等电点为4.7。其在血液中的主要起维持渗透压作用、PH缓冲作用、载体作用和营养作用。在动物细胞无血清培养中,可起到生理和机械保护作用和载体作用。目前,石家庄鼎晨科技有限公司致力于研究牛血清白蛋白的溶液标准物质。此外,纽邦生物科技有限公司也专业提供牛血清白蛋白。 双水相萃取技术主要技术特征是条件温和,两相间界面张力小,生物相容性高,萃取后目标产物的后处理简便,一般不存在有机溶剂残留问题,易于放大工艺,可获得较高收率和纯度,已经在生物化学、细胞生物学以及生物化工等领域得到了广泛的应用。 国内双水相萃取技术在提取牛血清白蛋白中的应用十分广泛。邓凡政等建立了由亲水性离 子液体四氟硼酸1-甲基-3-丁基咪唑和KH 2PO 4 形成的双水相体系萃取分离牛血清白蛋白(BSA) 的新方法,结果表明,磷酸二氢钾盐浓度为80g/L,离子液体浓度在160~240 mL/L,BSA的浓度为30~50 mg/L,溶液酸度在pH 4~8范围,离子液体双水相体系对BSA有较高的萃取率;林潇利用双水相技术萃取牛血清白蛋白回收率为96.90%。结果表明,此方法回收率、重现性好,且适用于牛血清白蛋白和牛血红蛋白混合样品的检测,为蛋白质分离提取提供了一种新思路;田明玉考察了多种单羟基的短链醇/无机盐双水相体系对牛血清白蛋白的萃取能力。结果表明,多种体系对牛血清白蛋白都有较好的萃取效果,在磷酸二氢钾18%(W/W)/乙醇18%(W/W)、碳酸钠13%(W/W)/乙醇18%(W/W)时,收率达到最大分别为94.0%、93.6%,此时其分配系数分别为11.52、11.24,这与传统的低分子量聚乙二醇/磷酸氢二钾体系萃取效果相似。 国外在双水相提取牛血清白蛋白中也取得了长足的发展。LouwrerA用乙醇/磷酸氢二钾体系萃取分离牛血清白蛋白,酪蛋白,核糖核酸酶等蛋白质,实验结果表明:被萃取物在该体系能得到较好的分离,而且部分稳定性较高的蛋白的生物活性得到了很好的保持;E-Kiss等人采用硫酸铵/叔丁醇双水相体系对牛血清白蛋白进行分离提取,结果表明,牛血清白蛋白能保持较高活性沉淀到两相界面处;据外文文献记载,牛血清白蛋白在聚乙二醇/葡聚糖双水相体系中分配特性的研究实验中,结果表明:pH对其影响主要为任一NaCl浓度下,pH=5.0处均出现一波峰。当pH>7并继续增大时,开始受电位差的影响。由于BSA所带的负电荷不断增大,在电位差的影响下,聚阴离子不断向上相富集使得分配系数呈向上趋势。 目前,通过市场的调研和实践,证实了双水相萃取牛血清白蛋白的可行性。石家庄鼎晨科技有限公司应用双水相萃取技术制备的牛血清白蛋白降低了其成本,扩大了生产规模,提高了纯化倍数和相的分离速度,系统经济,成本低且无毒,此技术的大规模应用为社会带来了广大的社会效益。该公司充分利用双水相萃取技术的作用条件温和,可调节因素多,易于放大和操作的优点来分离提纯牛血清白蛋白,从而达到降低成本,提高产率的目的,这些也是传统工艺所没有的特点。 双水相萃取技术是一种新型液液萃取分离技术,其技术有点很多,譬如,条件温和,工艺易于放大,杂质少,纯度高等。然而,相关研究和应用还不够深入,一些技术难题还有待解决。双水相萃取技术的发展趋势为:解决易乳化,相分离时间长,成相聚合物的成本较高,水溶性高聚物粘度较大且不宜定量控制等问题。开发新型优质的双水相体系,进一步拓宽应用领域,与其他技术结合的多元化利用。今后,随着对双水相体系研究的深入,双水相萃取将成为一种优良的分离技术。
体外诊断试剂胶乳比浊法学习
胶乳免疫比浊法相关知识很多公司开展了荧光胶乳免疫层析做定量分析及胶乳增强免疫比浊分析项目,关注胶乳标记技术的技术人员越来越多。本人总结了部分胶乳微球标记技术,并加以分类,以便朋友们查阅: 胶乳微球物理吸附: 反应微球带磺酸基、羧基、醛基表面的都是疏水微球,都可以用来设计被动吸附蛋白。磺酸基微球表面含带有负电荷的磺酸基团,pka大约为2,因此在酸性pH 保持稳定。醛基微球表面也带有磺酸基团,但能和蛋白行程共价键。羧基微球表面含带负电荷的羧基基团,在以上时保持稳定。 带有疏水基团的蛋白的吸附和配位结合,是最简单和直接的标记方法。这种方法中,微球溶液和含目标蛋白的溶液混合,反应后,未结合的游离蛋白通过清洗步骤除去,从而获得胶体蛋白复合物。疏水吸附方法只能用于疏水微球(硫酸盐、羧基、醛基表面修饰的微球)。醛基表面修饰微球是一个特例,其疏水吸附结果取决于后来的共价结合。虽然物理吸附是不依赖pH的,但反应缓冲液的pH对蛋白的结构有非常大的影响,从而影响蛋白吸附到微球上的反应效率。一般,在被吸附蛋白等电点附近pH时,物理吸附效率会很高。 反应步骤: 1.用反应缓冲液系数蛋白到10mg/ml; 2.用反应缓冲液系数胶乳微球到1%; 3.将蛋白溶液加入到胶乳微球溶液中,10ml胶乳中加入1ml蛋白溶液。室温搅拌孵育2hr; 4.离心或超滤,除去未结合蛋白;
5.将微球蛋白复合物用储存缓冲液溶解。 注意事项: 1.最优蛋白标记量影响因素 1)有效比表面积:粒径减小时,比表面积/mg微球值得增加; 2)胶体稳定性:蛋白对胶乳有稳定和去稳定作用; 3)免疫反应:最近标记量由免疫反应需要决定。 2.胶乳微球中加入蛋白后,快速搅拌混合,利于反应均衡。反应体积是1ml时,可用移液器吸取蛋白加入微球中,并吹打数次。如果反应体积较大时,用烧杯,边搅拌边加入蛋白, 3.储存缓冲液和反应缓冲液不同时,抗体有脱落的可能; 4.表面活性剂能使得抗体从胶乳中脱落,所以应避免加入。 微球共价结合抗体方法: 一、一步法 1.准备50mM pH 的reaction buffer,醋酸或MES buffer更合适 2.用reaction buffer溶解抗体,使其浓度为1mg/mL。 3.用reaction buffer 悬浮微球,使其浓度为1% w/v 4.边搅拌边将一倍体积的抗体溶液加入到10倍体积的微球悬液中,室温下持续搅拌20分钟 5.准备浓度为10mg/ml(52umol/mL)的EDC溶液,用前准备,现配现用。 6.将计算需求量的EDC溶液加入到上述微球悬液中。(Note 6). 7.室温下,立即调节pH (Note 7). 8.移除未结合的蛋白,并将包被微球用storage buffer重悬。(Note 3 and 4)
牛血清白蛋白的提取与鉴定
牛血清白蛋白的提取与鉴定 一、实验目的掌握牛血清白蛋白的提取与鉴定方法 二、实验原理牛血清白蛋白是牛血清中的简单蛋白,是血液的 主要成分(38g/100ml),分子量68kD。等电点4.8。应用相同浓度硫酸铵盐析法将血清中白蛋白与其它球蛋白分离,最后用透析法除盐,即可提取白蛋白。再利用电泳过程中带电粒子的移动速度与粒子荷电量、电场强度、粒子重量与半径及介质的黏稠度等有关,对牛血清白蛋白进行分离与鉴定。
三、实验步骤 (一)盐析取离心管一支加入牛血清2mL、加入等量PBS(磷酸盐缓冲生理盐水)稀释血清,摇匀后,逐滴加入pH7.2饱和硫酸铵溶液2mL,边加边摇,充分混匀,然后静止放臵10分钟,再离心(4000r/min)10min,将上清液倾入试管中。 (二)透析取玻璃纸一张,折成袋形,将离心后的上清液倒入袋内,用线扎紧上口(注意要留有空隙),用玻璃棒悬在盛有半杯蒸馏水的100mL烧杯内,使透析袋下半部侵入水中,对蛋白液进行透析,常用玻璃棒搅拌袋外(烧杯中)液体,以缩短透析时间。更换蒸馏水多次,用纳氏试剂检查袋外液体的NH4+,观察颜色变化,直至袋内盐分透析完毕。将袋内液体倾入试管,即得牛血清白蛋白溶液。(三)电泳 (1)点样取一张膜条,将薄膜无光泽面向下,放入培养皿中的巴比妥缓冲液中使膜条充分浸透,取出,用干净滤纸吸去多余的缓冲液,以薄膜的无光泽面距一端1.5㎝处作点样线,将牛血清样品与待测的牛血清白蛋白溶液分别用点样器在同一张薄膜的点样线处不同位臵点样。 (2)电泳将点样后的膜条臵于电泳槽架上,放臵时膜条无光泽面向下,点样端臵于阴极,待平衡5min后,打开电源,调节电泳仪的电压为160伏,通电60min,关闭电源后用镊子将膜条取出。(3)染色将膜条直接浸于盛有氨基黑10B的染色液中,染2分钟取出,立即浸于漂洗液中,分别在漂洗液Ⅰ、Ⅱ、Ⅲ中各漂洗
牛血清蛋白提取
牛血清蛋白试验 【摘要】本次历时三周的实验,主要是通过一系列提纯,分离,得到牛血清蛋白,并电泳,在此过程中学习一些基础的医学生化实验知识,比如盐析,凝胶过滤层析,DEAE-纤维素离子交换层析,α1-AT活力测定及蛋白定量,SDS-聚丙烯酰胺凝胶电泳等,另外,还学习了一些实验仪器的使用,如分光光度计,离心机,电泳胶的制作等 【关键字】牛血清蛋白,电泳,盐析,凝胶过滤层析,比色 【Abstract】The experiment lasted three weeks, mainly through a series of purification, separation, obtained bovine serum albumin, and electrophoresis, in the process learn some basic medical knowledge of biochemical experiments, such as salt precipitation, gel filtration, DEAE-cellulose ion exchange chromatography, α1-AT activity assay and protein quantification, SDS-polyacrylamide gel electrophoresis, etc. in addition, a number of experiments studying the use of instruments such as spectrophotometer, centrifuges, gel electrophoresis of production, etc.【Key words】Bovine serum albumin, electrophoresis, salt precipitation, gel filtration chromatography,colorimetric 正文 前言:血清是血液的组成成分,是血液经离心或凝固后析出来的液体成分。血清的主要成分是免疫球蛋白和血清白蛋白,本系列实验采用牛血清提取蛋白质进行试验。由于在蛋白质溶液中加入无机盐会破坏蛋白质的稳定结构,而使蛋白质析出,牛血清首先经过分段盐析进行蛋白质的粗提,得到α1-AT粗提蛋白成分。之后通过凝胶过滤层析,利用分子两大小的差别,导致的经过凝胶形成的固定相的分子筛时流速不同而进一步分离除盐。第三步,运用DEAE-纤维素离子交换剂对负电物质的吸引能力,除去溶液中的大部分球蛋白。之后通过α-AT对胰蛋白酶的抑制力来测定α1-AT的活力。最后,通过SDS-聚丙烯酰胺凝胶电泳测定1 蛋白质分子量。 材料与方法 材料、主要仪器与主要试剂 材料:牛血清 主要仪器:离心机,真空泵,层析柱,分光光度计,恒温水浴箱,电泳仪器一套 主要试剂:牛血清待测液,牛血清样品,PBS,pH7.2饱和磷酸钠溶液,奈氏试剂 方法:1.盐析 取样→离心→弃上清,加硫酸铵后4°C30min→抽滤→得粗样 2.凝胶过滤层析 蛋白样用PBS溶解→装柱及平衡→上样→洗脱→凝胶再生 3.α1-AT活力测定及蛋白定量 α1-AT活力测定→蛋白定量——双缩脲法 4.SDS-聚丙烯酰胺凝胶电泳
