Suzuki Heck sonogram机理
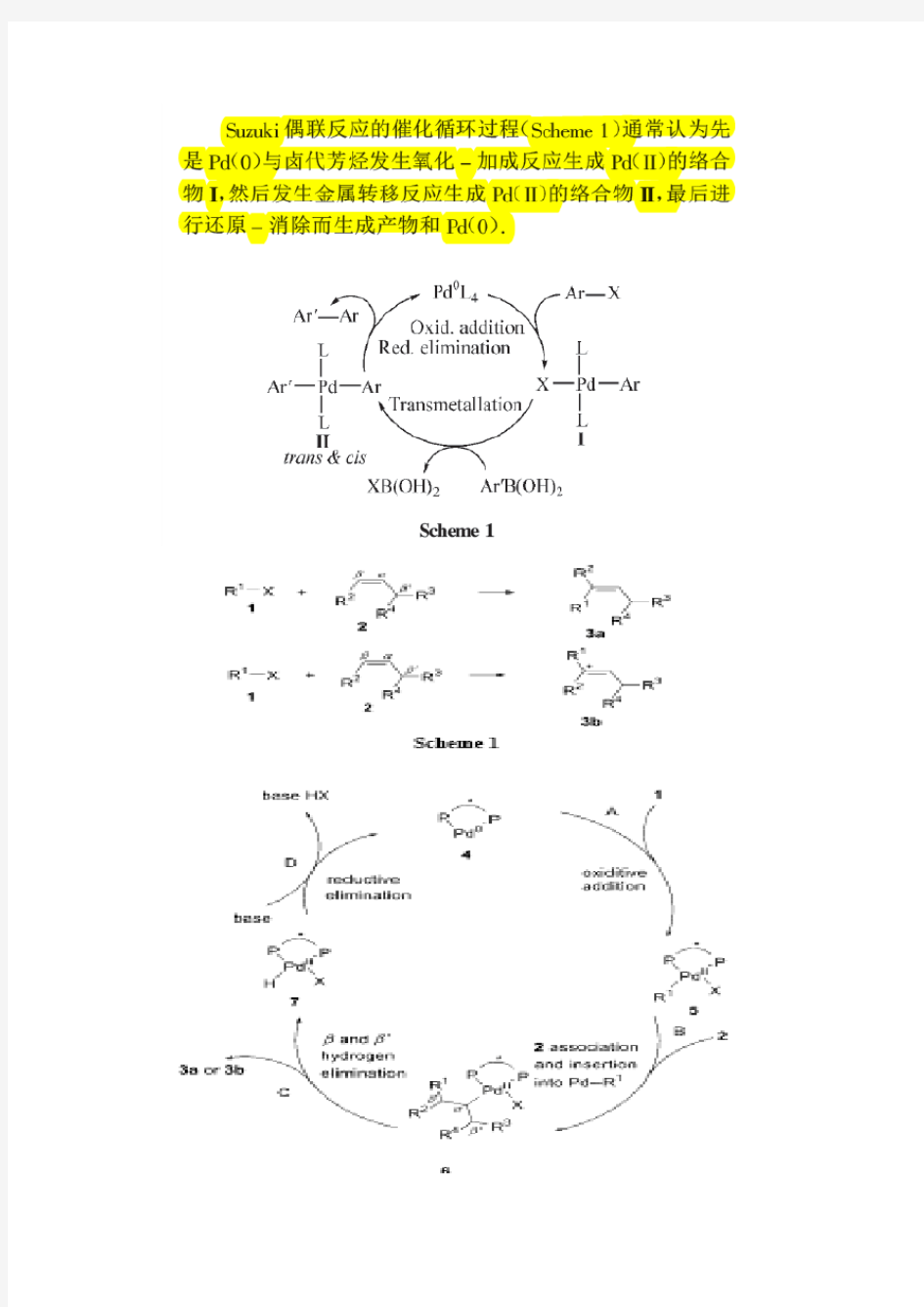
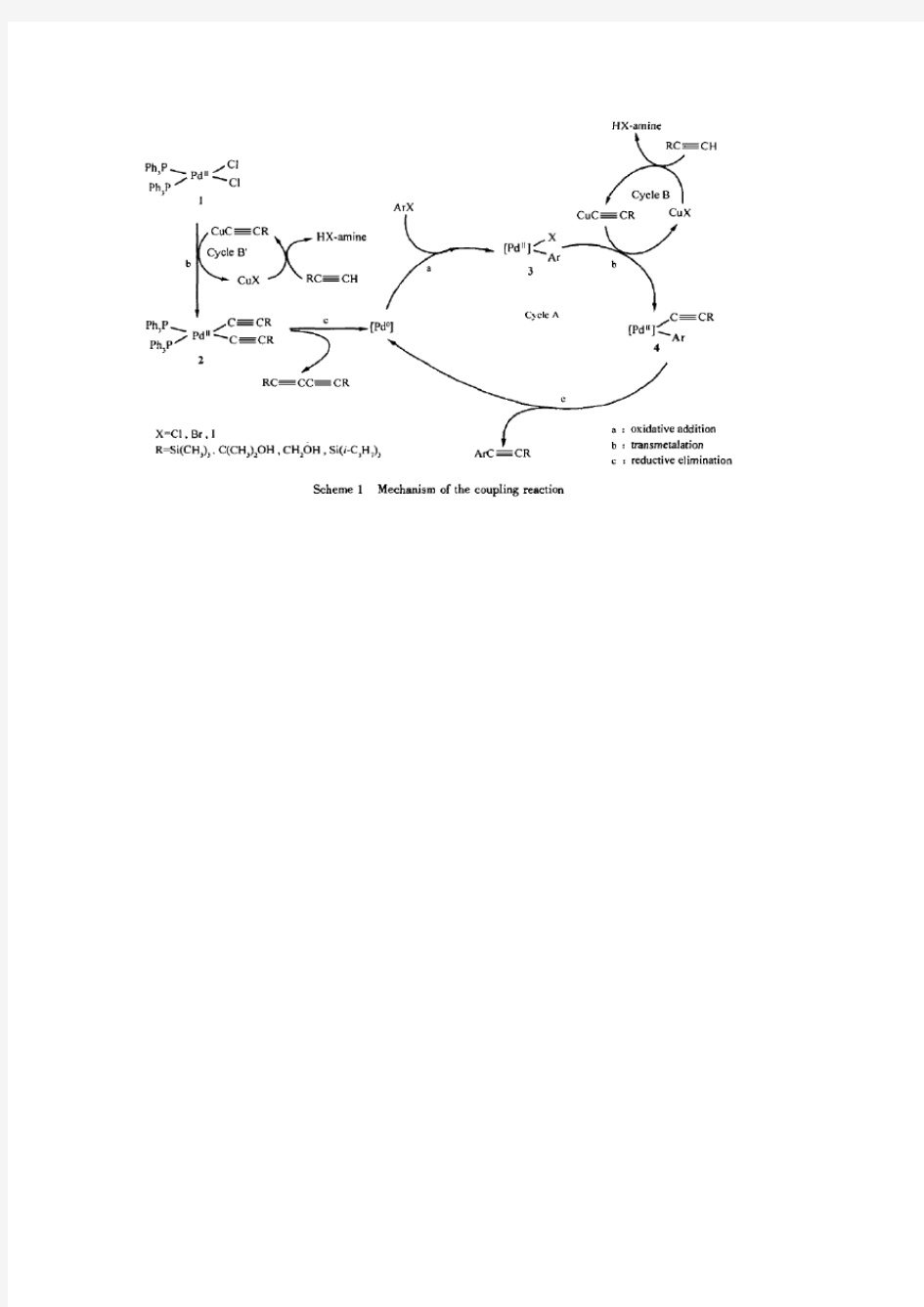
有机人名反应
有机人名反应 有机人名反应 1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢 2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮 3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物 4.Criegee臭氧化:烯烃臭氧化后水解成醛酮 5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚 6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮 7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇 8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变 9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮 10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮 11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮 12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化 13.Sarett氧化:CrO3?Py络合物氧化醇成醛酮 14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物 15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇 16.Wacker氧化:Pd催化剂下,烯烃氧化成酮 1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自 由基开裂发生醇的去氧作用 2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键 连接取代基;带吸电子基团的苯环,取代基在烯丙位。) 3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇
关于Suzuki反应
关于Suzuki反应 1 Suzuki的详细介绍 自从1979年Suzuki等报道了通过钯催化的有机硼化学物和卤代烃可以在很温和的条件下发生偶联反应制备不对称联芳烃以后,为芳-芳键的形成展开了一个新的领域。目前,Suzuki-Miyaura交叉偶联反应已逐渐成为现代有机合成中关于碳-碳键的生成的最为有效的方法之一。最近十年来,Suzuki-Miyaura交叉偶联反应通常是在很温和的条件下,不受水以及很多官能团的影响,这种反应被大量用在实验室制备药物以及精细化工中合成大量的有用的有机中间体。尽管还有别的方法如Heck偶联反应,Negishi偶联反应,Stille偶联反应,Himama 偶联反应,Sonogashira偶联反应和Kumuda偶联反应等也可以达到同样的目的。但是Suzuki-Miyaura偶联反应被证明是目前制备联芳基及其衍生物最为广泛利用的方法,与其他钯催化的偶联反应相比,Suzuki-Miyaura偶联反应主要有以下几个优点:首先,反应条件相对较温和而且所用的各种硼酸及其衍生物相对于其他偶联反应中所用的有机金属试剂对环境是很稳定的,容易保存,也容易处理。其次,反应的后处理很容易,且含硼副产物相对于别的有机溶剂容易除去,这对于工业生产来说是很有优势的。再次,反应中所用到的硼试剂相对于很多的官能团(例如羰基,羟基,氨基等)都是很稳定的,这是由于硼原子的电负性(2.0)接近碳原子的电负性(2.5),而大大高于锂,镁以及大多数其他的过渡金属原子(电负性值介于0.85-1.75之间)。最后,由于其使用的是低毒性的硼试剂并产生无毒的硼副产物,为用绿色化学合成碳-碳键提供了一条有效途径。 Suzuki-Miyaura交叉偶联的反应机理通常是被认为是一个普通的催化循环过程这个过程主要包括三个步骤,它们分别是:(1)氧化加成(oxidative addition);(2)转移金属化(transmetalation);(3)还原消除(reductive elimination)。在这个循环过程中氧化加成通常被认为是反应的控制步骤,因此不难理解卤代芳烃反应速度的排列顺序是碘代芳烃>溴代芳烃>氯代芳烃。当然,这个反应的活性很大程度上受到芳环上取代基性质的影响,即推电子基团与供电子基团以及空间位阻的影响。通常来说,相同结构的卤代烃,芳环上的负电荷越强,空间位阻越大,则反应越慢。 当然还有其他方面的影响,如反应中所用的碱的碱性、催化剂的价态、配体以及所用的溶剂都对Suzuki-Miyaura交叉偶联反应有很大的影响。下面我们举例来讨论各种条件对反应的影响。 在1944年,Wallow和Novak证明膦配体的阻滞在Suzuki-Miyaura交叉偶联反应限制催化效果中起到关键作用,他们证明温和的、有效的催化剂可以在没有膦配体的情况下进行反应,在他们的研究中证明了反应速率还与反应所在环境的PH值有很大的关系,例如他们用碳酸钾代替碳酸氢钾使得反应的速率有所提高。 在1944年Smith极其合作者对Suzuki-Miyaura交叉偶联反应进行了深入的研究,当他们在合成一种新的治疗高血压药的反应中,他们发现在Suzuki-Miyaura交叉偶联中所用的碱的PKa值接近于10(例如强碱碳酸盐)对反应有利,然而当使用碳酸氢盐时(PKa接近于6)反应将不是很好,考虑到苯硼酸的PKa值接近于8.8,他们认为当PH值为9时反应最佳。苯硼酸将转化为三羟基苯硼酸盐,认为这种负离子比中性的硼酸更有利于反应。 Kinetic的研究证明了水的含量和碱的存在对提高硼酸的反应活性是必需的。他们认为用1mol的水和1mol的碳酸盐在反应开始时产生对提高硼酸负离子是必要的。Kinetic的研究证明了水的含量和碱的存在对提高硼酸的反应活性是必需的。他们认为用1mol的水和1mol的碳酸盐在反应开始时产生对提高硼酸负离子是必要的. 最近,Suzuki在其前面所研究的烯烃偶联的基础上提出了另一个催化循环过程(如图1.3.4)。这个机理在氧化加成和金属转换之间加入了配体交换的步骤。 这种催化循环的机理现在已经被广泛的接受了,主要是由于在这个催化循环中的几个有用的体都被分离出来了,而且鉴定了他们的结构。
suzuki偶联反应
Suzuki-Miyaura交叉偶联反应机理及其在有机合成中的应用 学院:化学学院 专业:有机化学 学号: 姓名:
一、Suzuki-Miyaura 交叉偶联反应概念 Suzuki 反应(铃木反应),也称作Suzuki 偶联反应、Suzuki-Miyaura 反应(铃木-宫浦反应),是一个较新的有机偶联反应,是在钯配合物催化下,芳基或烯基的硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。 Z=Cl,Br,I 自从1981年Suzuki 等报道了通过钯催化的有机硼化学物和卤代烃可以在很温和的条件下发生偶联反应制备不对称联芳烃以后,为芳-芳键的形成展开了一个新的领域[1]。Suzuki-Miyaura 交叉偶联反应被证明是目前制备联芳基及其衍生物最为广泛利用的方法,因为其具有很强的底物适应性及官能团耐受性,常用于合成多烯烃、苯乙烯和联苯的衍生物,从而应用于众多天然产物、有机材料的合成中。铃木章也凭借此贡献与理查德·赫克、根岸英一共同获得2010年诺贝尔化学奖。 二、Suzuki-Miyaura 交叉偶联反应机理 Suzuki-Miyaura 交叉偶联的反应机理通常是一个普通的催化循环过程。这个过程主要包括三个步骤: (1)氧化加成(oxidative addition) (2)转移金属化(transmetalation) (3)还原消除(reductive elimination) Ar-Pd-Ar 1 Ar-Ar Pd(0) ArX ArPdX ArPdOH NaOH NaX B(OH)4 ArB -(OH)3 NaOH ArB(OH)2 氧化加成 还原消除 转移金属化 Z B(OH)2 Br Z + 3% Pd(PPh 3)4Benzene, Na 2CO 3/H 2O
Suzuki反应的研究进展
应的副产物少,反应产率高,并且毒性较小,产物易于处理等很多特点,一直是形成碳-碳键最有效的方法之一,引起研究者的广泛关注。广泛应用于天然产物、药物中间体以及功能材料的合成中。 一、Suzuki芳基偶联反应及机理 Suzuki芳基偶联反应可以表示为: Scheme 1 反应经历了氧化加成、芳基阴离子向金属中心迁移和还原消除的催化循环过程: Scheme 2 二、卤代芳烃参与的Suzuki反应。氯代芳烃相对于其他取代芳烃而言,其原料易得,是一种适合于有机合成生产的理想原料。1996年Saito等首次报道NiCl2(dppf)可以催化氯代芳烃的Suzuki反应,并比较NiCl2(dppf)和Pd(PPh3)4对各种氯代芳烃的催化效果。当氯取代芳烃上接吸电子基团时,NiCl2(dppf)催化的产率通常超过95%,Pd(PPh3)4和 NiCl2(dppf)的效果差不多,甚至更高,但对于接供电基团的氯代芳烃,Pd(PPh3)4的催化效果比NiCl2(dppf)差得多,这说明Ni催化剂对底物的电负性不如Pd敏感,这正是Ni催化剂的优点,使其有普遍的应用性。Buchwald等道了两个易于制得的膦配体1 和2,其中配体1对位阻较大的氯苯衍生物
有机合成反应Heck反应
经典化学合成反应标准操作 1. 前言 (1) 2. 分子内的Heck反应 (2) 2.1 生成烯基取代的反应 (2) 2.1.1 分子内Heck反应化生成环外双键示例 (3) 2.2 形成季碳中心的反应 (4) 2.2.1 分子内不对称Heck反应示例 (5) 2.3 多烯大环的合成 (5) 2.2.1 Heck反应用于合成大环多烯示例 (6) 3. 分子间的Heck 反应 (7) 3.1 常规分子间Heck反应 (7) 3.1.1 Pd(OAc)2-P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 (8) 3.1.2 不饱和酮的Heck反应标准操作 (9) 3.1.3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (9) 3.1.4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (9) 3.1.5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例 .. 10 3.1.6 非共轭双键Heck反应示例 (10) 3.2 不对称分子间Heck反应 (11) 3.3 非常用离去基团的Heck反应(Irina P. Beletskaya Chem. Rev. 2000, 100, 3009-3066) (11) 3.3.1 重氮盐参与的Heck反应示例 (12) 3.3.2 酰氯参与的Heck反应示例 (14)
1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination-insertion):烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
有机反应和反应机理
十、反应和反应机理 有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有机反应(organic reaction)。 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应:在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消去基团连在两个相邻的碳原子上,则称为1,2-消除或β-消除;两个消去基团连在1,3位碳原子上,则称为1,3-消除或γ-消除。其余类推。 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原子的氧化和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还原。氧化和还原总是同时发生的,由于有机反应的属性是根据底物的变化来确定的,因此常常将有机分子中碳原子氧化数升高的反应为氧化反应,碳原子氧化数降低的反应为还原反应。有机反应中,多数氧化反应表现为分子中氧的增加或氢的减少,多数还原反应表现为分子中氧的减少或氢的增加。
Heck反应机理及示例
Heck 反应的机理及示例 机理:Heck 反应的机理有一定的规律,通常认为反应共分四步:(a )氧化加成(Oxidative addition ): RX (R 为烯基或芳基,X=I > TfO > Br >> Cl)与Pd 0L 2的加成,形成Pd Ⅱ配合物中间体;(b )配位插入 (Cordination-insertion ):烯键插入Pd-R 键的过程; (c )β-H 的消除; (d )催化剂的再生:加碱催化使重新得到Pd 0L 2。 示 例: OMe O MeO N O NCO 2Me OMe N O MeO O NCO 2Me OMe Pd(PPh ) , NEt (12eq)MeCN, 80℃, 10h 12 A stirred solution of 1 (98 mg, mmol), triethylmine mL, mmol) and catalytic tetrakis(triphenylphosphine)palladium(0) (ca. 5 mg, 4 μmol) in mL of acetonitrile was heated at 80 ℃ in a sealed tube under an argon atmosphere for 10 h. The reaction mixture turned dark orange after ca. 10 min, and the catalyst plated out on the walls of the tube as a shiny layer of palladium metal upon completion of the reaction. The reaction mixture was cooled to room temperature; the reaction was quenched with aqueous NaHCO 3(15 mL), and
Suzuki反应
铃木反应 维基百科,自由的百科全书 (重定向自Suzuki反应) Suzuki反应(铃木反应),也称作Suzuki偶联反应、Suzuki-Miyaura反应(铃木-宫浦反应),是一个较新的有机偶联反应,是在钯配合物催化下,芳基或烯基的硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。[1][2] 该反应由铃木章在1979年首先报道,在有机合成中的用途很广,具有很强的底物适应性及官能团耐受性,常用于合成多烯烃、苯乙烯和联苯的衍生物,从而应用于众多天然产物、有机材料的合成中。[3][4][5]。铃木章也凭借此贡献与理查德·赫克、根岸英一共同获 得 2010年诺贝尔化学奖。[6] 目录 [隐藏] ? 1 概述 ? 2 机理 ? 3 讨论 ? 4 展望 ? 5 参见 ? 6 参考文献 ?7 外部链接
[编辑]概述 Suzuki反应对官能团的耐受性非常好,反应物可以带着-CHO、-COCH3、-COOC2H5、-OCH3、-CN、-NO2、-F等官能团进行反应而不受影响。反应有选择性,不同卤素、以 及不同位置的相同卤素进行反应的活性可能有差别,三氟甲磺酸酯、重氮盐、碘鎓盐或芳基锍盐和芳基硼酸也可以进行反应,活性顺序如下: R2-I > R2-OTf > R2-Br >> R2-Cl 另一个广泛应用的底物是芳基硼酸,由芳基锂或格氏试剂与烷基硼酸酯反应制备(见Miyaura硼酸化反应,Miyaura反应)。这些化合物对空气和水蒸气比较稳定,容易储存。Suzuki反应靠一个四配位的钯催化剂催化,广泛使用的催化剂为四(三苯基膦)钯(0)Pd(PPh3)4与PdCl2(dppf),其他的配体还有:AsPh3、n-Bu3P、(MeO)3P,以及双齿配体Ph2P(CH2)2PPh2(dppe)、Ph2P(CH2)3PPh2(dppp)等。(以上的所有Pd配体都是厌氧的,因此反应必须在氮气,氩气等惰性气体下反应)。[7] Suzuki反应中的碱也有很多选择,最常用的是碳酸钠,碳酸铯,醋酸钾,磷酸钾等。碱金属碳酸盐中,活性顺序为: Cs2CO3 > K2CO3 > Na2CO3 > Li2CO3 而且,加入氟离子(F?)会与芳基硼酸形成氟硼酸盐负离子,可以促进硼酸盐中间体与 钯中心的反应。因此,氟化四丁基铵、氟化铯、氟化钾等化合物都会使反应速率加快,甚至可以代替反应中使用的碱。 [编辑]机理 反应机理见下图。首先卤代烃2与零价钯进行氧化加成,与碱作用生成强亲电性的有机钯中间体4。[8]同时芳基硼酸与碱作用生成酸根型配合物四价硼酸盐中间体6,具亲核性,与4作用生成8。最后8经还原消除,得到目标产物9以及催化剂1。
有机合成反应Heck反应
经典化学合成反应标准操作 1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联
反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl) 与Pd0L 2的加成,形成PdⅡ配合物中间体; (b)配位插入(Cordination-insertion): 烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化 使重新得到Pd0L 2 。
总的说来,Heck反应可以分为两大类:分子内反应和分子间反应。第一篇该反应的报道是Heck 在1972年发表。 I +Pd(OAc)2 (20 mol%) n Bu N (1 eq) NMP, 100°C, 2h Nolley, .; Heck, R. F.; Tetrahedron 1972, 37, 2320 Mori 和 Ban于1977年首次报道了分子内的Heck反应: Br N Ac CO2Me N Ac CO2Me Pd(OAc)2 (2 mol%) PPh, DMF TMEDA (2 equaiv) 125°C, 5h 43% Indole product formed as result of Pd-H isomerization of product clefin Mori, M.; Ban, K.; Tetrahedron1977, 12, 1037
Suzuki反应-药明康德
经典化学合成反应标准操作 Suzuki 反应 编者:刘德军、武伟 药明康德新药开发有限公司化学合成部
目录 1 前言 (3) 1.1 Suzuki反应的通式 (3) 1.2 Suzuki反应的机理 (3) 1.3 Suzuki反应的特点及研究方向 (4) 2 有机硼试剂的合成 (4) 2.1 通过金属有机试剂制备单取代芳基硼酸 (4) 2.1.1 通过Grinard试剂制备单取代芳基硼酸示例 (4) 2.1.2 通过有机锂试剂制备单取代芳基硼酸示例 (5) 2.2 通过二硼烷频哪酯制备芳基硼酸酯 (6) 2.2.1 通过二硼烷频哪酯制备芳基硼酸酯示例(一) (9) 2.2.2 通过二硼烷频哪酯制备芳基硼酸酯示例(二) (10) 2.2.3 通过芳基硼酸转化为芳基硼酸酯 (10) 2.3 烯基硼酸酯的制备 (10) 2.4 烷基硼酸酯的制备 (10) 3 催化剂的制备 (11) 3.1 Pd(PPh3)4的制备 (11) 3.2 Pd(PPh3)2Cl2的制备 (12) 3.3 Pd(dppf)Cl2的制备 (12) 4Suzuki偶联的应用 (12) 4.1 普通的芳卤和芳基硼酸的Suzuki偶联 (13) 4.1.1 Pd(PPh3)4-Na2CO3-DME-H2O 体系Suzuki偶联反应示例 (14)
4.2 大位阻芳基硼酸参与Suzuki偶联反应 (14) 4.3 含敏感功能团的芳基硼酸(酯)参与Suzuki偶联反应 (15) 4.3.1 芳基硼酸频哪酯和芳基卤代物的Suzuki偶联 (16) 4.3.2 带着酯基底物的Suzuki偶联反应示例(一) (16) 4.3.3 带着酯基底物的Suzuki偶联反应示例(二) (17) 4.4 杂环芳基硼酸参与Suzuki偶联反应 (17) 4.5烷基硼酸参与Suzuki偶联反应 (18) 4.6烯基硼酸参与Suzuki偶联反应 (19) 4.7 Triflate参与Suzuki偶联反应 (19) 4.7.1芳基的三氟甲基磺酸酯与芳基硼酸偶联示例 (20) 4.7.2 芳基的Triflate与芳基硼酸偶联示例 (20) 4.8 芳基氯参与Suzuki偶联反应 (21) 4.8.1钯催化下芳基氯参与Suzuki偶联反应示例(一) (21) 4.8.2钯催化下芳基氯参与Suzuki偶联反应示例(二) (22) 4.9 镍催化体系用于Suzuki偶联反应 (22) 4.9.1 NiCl2(dppf)和n-BuLi催化下芳基氯参与Suzuki偶联反应示例 (22) 4.10 其他方法 (23) 4.10.1 直接Pd/C用于Suzuki偶联反应示例 (23) 4.10.2 直接Pd(OAc)2用于Suzuki偶联反应示例 (23)
负载型钯催化剂在Heck反应中的应用
万方数据
万方数据
万方数据
负载型钯催化剂在Heck反应中的应用 作者:陶荣哨, 孙莉, 汪祝胜, 胡卫雅, 裴文 作者单位:浙江工业大学化学工程与材料学院,杭州,310014 刊名: 化工生产与技术 英文刊名:Chemical Production and Technology 年,卷(期):2013,20(4) 参考文献(24条) 1.Mizoroki T.Mori K.Ozaki A Arylation of olefin with aryl iodide catalyzed by palladium 1971 2.Heck R F.Nolley J P Palladium-catalyzed vinylic hydrogen substitution reactions with aryl,benzyl,and styryl halides 1972(14) 3.Farina V High-turnover palladium catalysts in crosscoupling and Heck chemistry:a critical overview 2004 4.Miyazaki F.Yamaguchi K.Shibasaki M The synthesis of a new palladacycle catalyst.Development of a high performance catalyst for Heck reactions 1999 https://www.360docs.net/doc/f68223405.html,gasi M.Moggi P Anchoring of Pd on silica functionalized with nitrogen containing chelating groups and applications in catalysis 2002(82/183) 6.Steel P G.Teasdale C W T Polymer supported palladium N-heterocyclic carbine complexes:long lived recyclable catalysts for cross coupling reactions 2004 7.Corma A.Garcia H.Leyva A Basic zeolites containing palladium as bifunctional heterogeneous catalysts for the Heck reaction[外文期刊] 2003(01) 8.Artok L.Bulut H Heterogeneous suzuki reactions catalyzed by pd(0)-y zeolite[外文期刊] 2004(20) 9.Tonks L.Anson M S.Hellgardt K Palladium catalysed Heck reactions and allylic substitution reactions using glass bead technology 1997(24) 10.F Zhao.B M Bhanage.M Shirai Heck reactions of iodobenzene and methyl acrylate with conventional supported palladium catalysts in the presence of organic and/or inorganic bases without ligands 2000(06) 11.C P Mehnert.D W Weaver.J Y Ying Heterogeneous Heck catalysis with palladium-grafted molecular sieves 1998 12.M Wagner.K K(o)hler.L Djakovitch Heck reactions catalyzed by oxide-supported palladium-structure-activity relationships 2000 13.Andersson C M.Karabelas K.Hallberg A Palladium/ Phosphinated polystyrene as a catalyst in the Heck arylation.a comparative study 1985 14.刘蒲.王岚.李利民壳聚糖钯(0)配合物催化Heck芳基化反应研究[期刊论文]-有机化学 2004(01) 15.Belen Altava.M Isabel https://www.360docs.net/doc/f68223405.html,ardo Palladium Nmethylimidazolium supported complexes as efficient catalysts for the Heck reaction 2006 16.G Singh.S Bail.Ajai K Singh Palladium(0) complexes of (P,P) and(P,N) ligands immobilized on silica gel as catalysts in selective Heck type carbon-carbon coupling reactions 2007 17.胡国辉.周健民.杨育林气相法二氧化硅负载胺-钯配合物的制备及对Heck反应催化性能的研究[期刊论文]-浙江大学学报(理学版) 2009(05) 18.Fengyu Zhao.Masayuki Shirai Palladium-catalyzed homogeneous and heterogeneous Heck reactions in NMP and water-mixed solvents using organic,inorganic and mixed bases 2000 19.裴文.董华水相中Pd/C催化的杂环芳卤的还原偶联反应研究[期刊论文]-有机化学 2008(05) 20.周健民.杨育林.赵岚MCM-41固载胺钯配合物的制备及对Heck反应催化性能的研究[期刊论文]-有机化学 2008(05) 21.唐中民.赖国华.周仁贤MCM-41分子筛固载腈钯配合物的合成及其催化Heck偶联反应的性能[期刊论文]-化学通报(印刷版) 2009(09) 22.K K(o)hler.W Magner.L Djakovitch Supported palladium as catalyst for carbon-carbon bond construction (Heck reaction) in organic synthesis 2001
suzuki反应的研究和应用进展
Suzuki反应的研究和应用进展 李健 摘要:近年来suzuki偶联反应在有机合成中体现出了越来越重要的作用,也是有机合成研究的热点。本文综述了该反应的研究和应用进展。 关键词:suzuki反应,研究,应用 Abstract:In recent years, the Suzuki coupling reaction incarnates more and more important role in organic synthesis research. And it is one of the central issues of organic synthesis. In this paper the latest study of the Suzuki coupling reaction and their applications are reviewed. Key words: Suzuki coupling reaction, research, application 一、前言 芳基—芳基的偶联反应是现在合成中重要的手段之一,这些片段在天然产物的合成中是和常见的(例如生物碱),在制药和农药,染料中都是经常见的。[27]近几年来Mizoroki–Heck反应和Suzuki–Miyaura反应已经成为芳基偶联的常用的方法,传统的方法都是通过活化C—H键来实现C-C键的形成,而直接偶联的方法更具原子经济性。[40]现在通过许多的金属试剂都可以实现偶联反应,这种方法提供了一种基础普通的合成方法。1972年,Kumada、Tamato和Corriu独自报道了烯基或芳基的卤化物与有机镁的反应可以被Ni(Ⅱ)的化合物显著的催化。Kochi报道了Fe(Ⅲ)可以有效的催化格氏试剂和卤代烯烃的偶联反应。Murahashi 首先报道了Pd催化的格氏试剂的反应,然后这种催化效用随后被Negishi应用在有机铝试剂,锌试剂和锆试剂上。随后,许多有机金属试剂被证明在偶联反应中是有效的亲核试剂。[1] (一)Suzuki反应 1979年铃木章首先报道了在钯配合物催化下,芳基或烯基的硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联反应,此反应在有机合成中的用途很广,具有很强的底物适应性及官能团耐受性,常用于合成多烯烃、苯乙烯和联苯的衍生物。Suzuki反应对官能团的耐受性比较好,反应物可以含有-CHO、-COCH3、-COOC2H5、-OCH3、-CN、-NO2、-F等官能团参加反应并且这些官能团不受影响。 [33]不同的卤素和不同位置的卤素的反应的活性都不一样,具体如下:R2-I > R2-OTf > R2-Br > R2-Cl。另外,三氟甲磺酸酯、重氮盐、碘鎓盐或芳基锍盐和
有机合成经典反应Heck反应
- 经典化学合成反应标准操作 1. 前言 (1) 2. 分子的Heck反应 (3) 2.1 生成烯基取代的反应 (3) 2.1.1 分子Heck反应化生成环外双键示例 (3) 2.2 形成季碳中心的反应 (5) 2.2.1 分子不对称Heck反应示例 (6) 2.3 多烯大环的合成 (6) 2.2.1 Heck反应用于合成大环多烯示例 (7) 3. 分子间的Heck 反应 (8) 3.1 常规分子间Heck反应 (8) 3.1.1 Pd(OAc)2-P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 9 3.1.2 不饱和酮的Heck反应标准操作 (11) 3.1.3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (11) 3.1.4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (11) 3.1.5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例12 3.1.6 非共轭双键Heck反应示例 (12) 3.2 不对称分子间Heck反应 (14)
3.3 非常用离去基团的Heck反应(Irina P. Beletskaya Chem. Rev. 2000, 100, 3009-3066) (14) 3.3.1 重氮盐参与的Heck反应示例 (15) 3.3.2 酰氯参与的Heck反应示例 (17) 1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination-insertion):烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
Suzuki反应操作示例
Suzuki coupling Br B O O NH + NH To a mixture of 4-(4,4,5,5-tetramethyl-[1,3,2]dioxaborolan-2-yl)-1H-indole (2 g, 8.2 mnmol) and 3-bromobenzene (0.87 ml, 8.3 mmol) in THF (28 ml) were added palladium catalyst Pd(PPh3)4 (284 mg, 0.25 mmol) and the freshly prepared sodium hydroxide solution (984 mg in 9 ml of water).The system was degassed and then charged with nitrogen for three times. The mixture was stirred under nitrogen at 70 °C oil bath for 6 hours. The reaction solution was cooled to room temperature, diluted with ethyl acetate and separated from water layer. The ethyl acetate solution was washed by brine, dried over Na2SO4 and concentrated. The residue was purified on a silica gel column eluding with hexanes: EtOAc 9:1 to give 1.38 g (78%yield) of 4-phenyl-1H-indole as a colorless liquid.
Heck反应的发现及发展
Heck反应的发现及发展 摘要Heck反应是一类重要的有机反应,用于卤代芳烃的烯基化,此外还有羰基化方法。本文主要介绍了Heck反应的发现,催化剂的发展,羰基化的发展。 关键词Heck反应;催化剂;羰基化 1Heck反应的发现 早在1969年,Fujiwara、Heck等人报道了利用芳烃或芳基汞化合物对烯烃进行芳基化的反应,但该过程会消耗定量的二价钯化合物,形成单质钯[1]。1971年,Mizoroki等人顺利在PdCl2的催化下用碘苯对烯烃进行芳基化,反应过程中产生的HI用乙酸钾吸收[2]。研究人员发现,只要乙酸钾的量超过碘苯,生成的 苯乙烯就不会发生聚合。反应可用下式表示: Scheme 1 钯最初是以二价存在,但在反应过程中会被还原成单质钯,但单质钯与PdCl2的催化活性相当,这是与Fujiwara等人报道的反应的一大区别。吡啶,三乙胺,苯甲酸钾都可用来吸收HI,但乙酸钾的效果最好。在乙酸钾过量的情况下,碘苯与乙烯生成的苯乙烯会进一步与碘苯反应,生成反-1,2-二苯乙烯以及1,1-二苯乙烯。若以苯乙烯、丙烯、丙烯酸甲酯作烯烃,则主要产物分别是反-1,2-二苯乙烯,β-甲基苯乙烯,肉桂酸甲酯。由此可以发现,苯基主要取代烯烃化合物原取代基的β位,而且以反式产物为主,以避免较大的空间位阻。 1972年,Heck等人以芳基卤、苄基卤和苯乙烯基卤等对烯键上的氢进行取代,该反应使用有一定空间位阻的胺吸收生成的卤化氢,并且不需要高压体系,而是直接常压下100°C回流(Mizoroki报道的反应温度是120°C),而且不需要添加溶剂(Heck曾使用1-甲基-2吡咯烷酮作溶剂,但效果并不明显),催化剂使用乙酸钯[3]。Heck本人之前曾用有机汞、锡和铅等对烯烃进行芳基化和烷基化,Heck指出该种方法存在两个不足之处:首先,制备有机汞、锡和铅等化合物并
Suzuki反应铃木反应
Suzuki反应(铃木反应) 铃木反应 - 简介 Suzuki反应(铃木反应),也称作Suzuki偶联反应、Suzuki-Miyaura反应(铃木-宫浦反应),是一个较新的有机偶联反应,是在钯配合物催化下,芳基或烯基的硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。 通式: 铃木反应 - 概述 Suzuki反应对官能团的耐受性非常好,反应物可以带着-CHO、-COCH3、-COOC2H5、-OCH3、-CN、-NO2、-F等官能团进行反应而不受影响。反应有选择性,不同卤素、以及不同位置的相同卤素进行反应的活性可能有差别,三氟甲磺酸酯、重氮盐、碘鎓盐或芳基锍盐和芳基硼酸也可以进行反应,活性顺序如下:R2-I > R2-OTf > R2-Br >> R2-Cl 另一个底物一般是芳基硼酸,由芳基锂或格氏试剂与烷基硼酸酯反应制备。这些化合物对空气和水蒸气比较稳定,容易储存。Suzuki反应靠一个四配位的钯催化剂催化,广泛使用的催化剂为四(三苯基膦)钯(0),其他的配体还有:AsPh3、n-Bu3P、(MeO)3P,以及双齿配体Ph2P(CH2)2PPh2(dppe)、Ph2P(CH2)3PPh2(dppp)等。Suzuki反应中的碱也有很多选择,最常用的是碳酸钠。碱金属碳酸盐中,活性顺序为:Cs2CO3 > K2CO3 > Na2CO3 > Li2CO3 而且,加入氟离子(F?)会与芳基硼酸形成氟硼酸盐负离子,可以促进硼酸盐中间体与钯中心的反应。因此,氟化四丁基铵、氟化铯、氟化钾等化合物都会使反应速率加快,甚至可以代替反应中使用的碱。
铃木反应 - 机理 铃木反应示意图 首先卤代烃2与零价钯进行氧化加成,与碱作用生成强亲电性的有机钯中间体4。同时芳基硼酸与碱作用生成酸根型配合物四价硼酸盐中间体6,具亲核性,与4作用生成8。最后8经还原消除,得到目标产物9以及催化剂1。 氧化加成一步,用乙烯基卤反应时生成构型保持的产物,但用烯丙基和苄基卤反应则生成构型翻转的产物。这一步首先生成的是顺式的钯配合物,而后立即转变为反式的异构体。还原消除得到的是构型保持的产物。 铃木反应 - 基本因素 SUZUKI cross coupling reaction 的基本因素总的来说可以分为下面几个部分, 底物的活性
经典化学反应Heck 反应-
经典化学合成反应标准操作 Heck 反应
目录 1. 前言 (2) 2. 分子内的Heck反应 (3) 2.1 生成烯基取代的反应 (3) 2.1.1 分子内Heck反应化生成环外双键示例 (4) 2.2 形成季碳中心的反应 (5) 2.2.1 分子内不对称Heck反应示例 (6) 2.3 多烯大环的合成 (6) 2.2.1 Heck反应用于合成大环多烯示例 (7) 3. 分子间的Heck 反应 (8) 3.1 常规分子间Heck反应 (8) 3.1.1 Pd(OAc)2-P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 (9) 3.1.2 不饱和酮的Heck反应标准操作 (10) 3.1.3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (10) 3.1.4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (10) 3.1.5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例 .. 11 3.1.6 非共轭双键Heck反应示例 (11) 3.2 不对称分子间Heck反应 (12) 3.3 非常用离去基团的Heck反应(Irina P. Beletskaya Chem. Rev. 2000, 100, 3009-3066) (12) 3.3.1 重氮盐参与的Heck反应示例 (13) 3.3.2 酰氯参与的Heck反应示例 (15)
1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination-insertion):烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
