ICP-OES常用元素谱线与检测极限

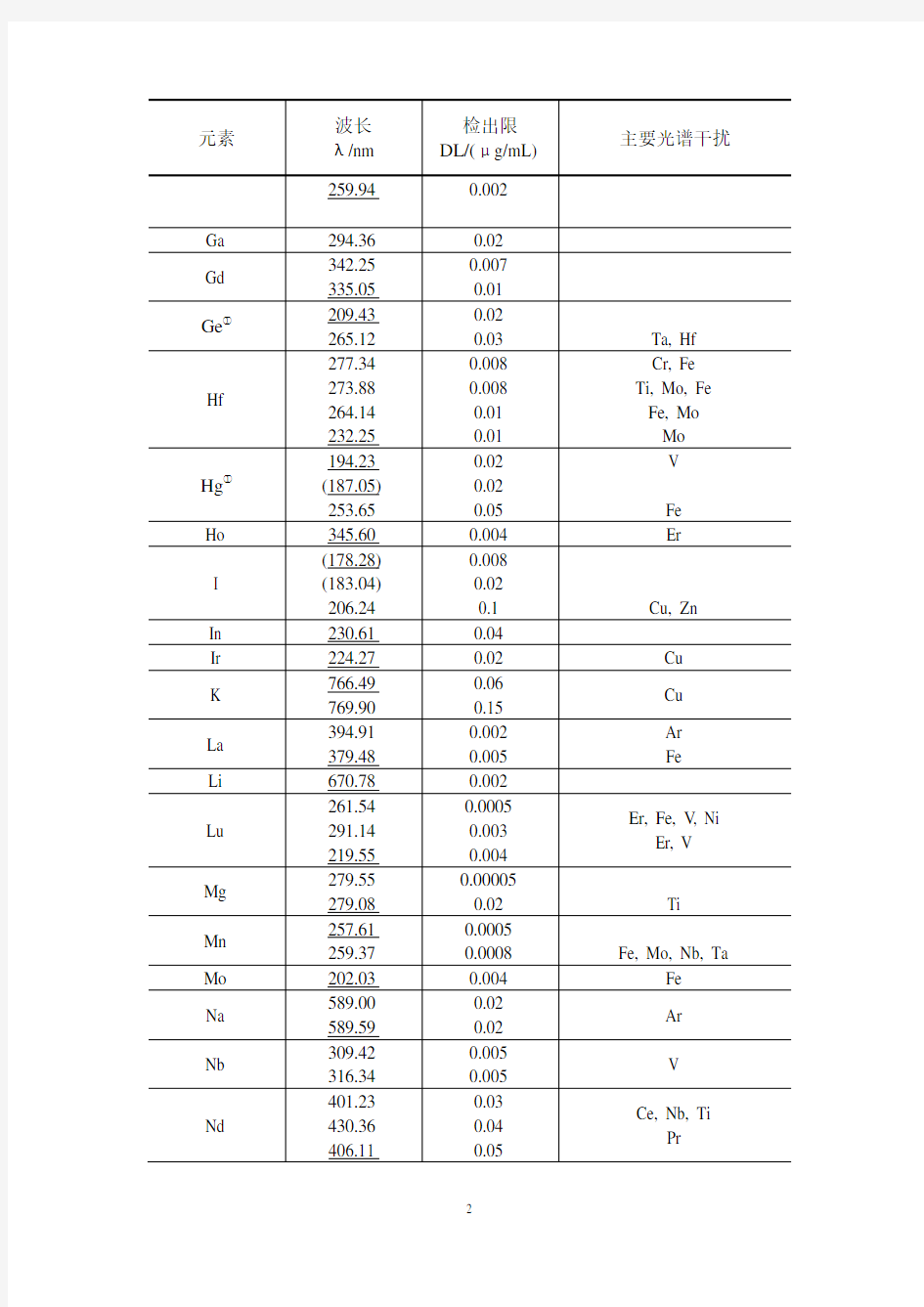
ICP-AES常用谱线及检出限
注:1.波长下划横线者为最佳波长;
2.波长有()者需用真空光路。
①这些元素可用氢化法测定,其检出限比表中列出的检出限低100~200倍。
实验6.3钼阳极X射线特征谱线的精细结构
实验6.3 钼阳极X 射线特征谱线的精细结构 一、实验目的 1. 通过Mo 阳极X 射线在单晶NaCl 上的第5级布拉格反射谱研究其特征谱线的精细 结构; 2. 测定钼元素特征谱K α、K β 及K γ谱线; 3. 解析K α谱线的双线结构,测定其双线结构的波长间隔; 二、实验原理 我们已经知道,Mo 阳极X 射线特征谱K α和K β线都是双线结构,可以通过其在NaCl 单晶上的高阶布拉格衍射谱观测出来,然而它们的物理本质是不一样的。 K β是由纯K β线——M 壳层到K 壳层的原子跃迁和K γ线——N 壳层到K 壳层的原子跃迁组成的,两条谱线的波长差为1.2 pm (见表1),所以只能在高阶衍射谱上分辨开来。 表1 钼特征谱K 、K 及K 线跃迁能量、波长和相对强度 K α的精细结构源于L 壳层的精细结构,即电子的自旋轨道特性。在X 射线谱上,L 壳层实际上是由三个子层L I 、L II 和L III 组成,这些子层向K 壳层的跃迁要遵从选择定则: ?l =±1,?j =0,±1 (1) ?l 为跃迁中轨道角动量l 的变化量,?j 为总角动量j 的变化量。这样一来,只有两种从L 壳层到K 壳层的跃迁:K α1 和K α2 (见图1)。表2中给出了钼元素这两条谱线的参考值,可以看出K α双线的波长间隔?λ=0.43 pm 。 表2 钼元素K 的波长及相对强度 本实验中,通过布拉格反射在NaCl 晶体上的高阶衍射解析出钼X 光谱的精细结构。 按照布拉格反射定理,入射光特征谱线的波长和掠射角存在下列关系时,接受到的反射光强度最大: n ?λ=2?d ?sin θ (2) n : 衍射阶数,d =282.01 pm :NaCl 晶面间距。 可以看出,双线的波长间距?λ 决定布拉格衍射时双线之间的角间距?θ 图1 特征谱K α的精细结构
关于计算极限的几种方法
目录 摘要 (1) 引言 (2) 一.利用导数定义求极限 (2) 二.利用中值定理求极限 (2) 三.利用定积分定义求极限 (3) 四.利用施笃兹公式 (4)
五.利用泰勒公式 (5) 六.级数法 (5) 七.结论 (6) 参考文献 (6)
内容摘要
引言: 极限是分析数学中最基本的概念之一,用以描述变量在一定的变化过程中的终极状态。早在中国古代,极限的朴素思想和应用就已在文献中有记载。例如,3世纪中国数学家刘徽的割圆术,就是用圆内接正多边形周长的极限是圆周长这一思想来近似地计算圆周率 的。随着微积分学的诞生,极限作为数学中的一个概念也就明确提出。但最初提出的这一概念是含糊不清的,因此在数学界引起不少争论甚至怀疑。直到19世纪,由A.-L.柯西、K. (T.W.)外尔斯特拉斯等人的工作,才将其置于严密的理论基础之上,从而得到举世一致的公认。 数学分析中的基本概念的表述,都可以用极限来描述。如函数()x f y =在 0x x =处导数的定义,定积分的定义,偏导数的定义,二重积分,三重积分的定义,无穷级数收敛的定义,都是用极限来定义的。极限是研究数学分析的基本公具。极限是贯穿数学分析的一条主线。 一.利用导数定义求极限 据文[]1定理1导数的定义:函数)(x f 在0x 附近有定义,对于任意的x ?, 则)()(00x f x x f y -?+=? 如果x x f x x f x x ?-?+=→?→? ) ()(lim lim 000 0存在,则此极限值就 称函数)(x f 在点0x 的导数记为 )('0x f .即x x f x x f x f x ?-?+=→?) ()(lim )('0000在这 种方法的运用过程中。首先要选好)(x f ,然后把所求极限。表示成)(x f 在定点0x 的导数。 例1:求a x x a a x x a a a a x --→lim 解:原式0)(lim lim 1lim 0---?=---=-→→→a x x a a x a a x a x x a a a x x a a a a x a a a a a x x a x x ,令a x x a y -=, 当a x →时,0→y ,故原式a a a a a a a y y a ln |)'(0=?== 一般地,能直接运用导数定义求的极限就直接用导数定义来求,值得注意的是许
元素分析知识总结
元素分析知识总结 第一章.原子吸收光谱 1·共振线,第一共振线 共振吸收线:原子由基态跃迁到激发态所吸收的谱线。 第一共振线:由基态跃迁到能量最低的激发态所吸收的谱线。这条谱线强度最大, 灵敏度最高。 2·原子吸收谱线的自然宽度、中心频率、半峰宽 原子吸收线并非是一条严格的几何线,而是占据着极窄的频率范围,具有一定 的自然宽度。原子吸收光谱的轮廓以原子吸收谱线的中心频率和半宽度来表征。 半宽度(Δv):是指在极大吸收系数一半处,吸收光谱线轮廓上两点之间的频率差。 海森堡测不准原理:当核外电子跃迁到激发态时,激发态的能级和电子在激发态 停留的时间是测不准的,具有不确定度。即: E1 :E1 ±ΔE t1 : t1 ±Δt ΔE·Δt≥h/2π 只有当Δt→∞,ΔE→0 ,此时激发态的能量E1 才有定值,但是电子在激发态的时间只有约10-8,所以激发态的能量E1 是测不准的,只能是一个范围。 而电子在基态是稳定的,所以电子在基态停留时间的Δt→∞,所以ΔE→0 , 基态能量E0具有定值。所以V= (E1 - E0)/h 是测不准的,中心频率具有不 确定度,所以原子吸收线具有自然宽度。自然宽度(ΔυN)一般为10-5nm数量 级。 中心频率半峰宽 3·为什么原子吸收线具有自然宽度? 根据海森堡测不准原理:ΔE·Δt≥h/2π 电子在基态是稳定的,所以电子在基态停留时间的Δt→∞,所以ΔE→0 , 基态能量E0具有定值。而电子在激发态的时间只有约10-8,所以激发态的能量 E1 是测不准的,只能是一个范围。所以谱线的频率V= (E1 - E0)/h 是测不准 的,中心频率具有不确定度,所以原子吸收线具有自然宽度。自然宽度(Δυ N)一般为10-5nm数量级。
元素常用光谱特征线解析
元素常用光谱特征线
377.764 206.170 Bi 223.061 222.825 Hg 184.957* 253.652 227.658 306.772 239.356 405.393 Ca 422.673 272.164 Ho 410.384 410.109 393.367 412.716 396.847 417.323 242.4.93 256.015 Co 240.7.25 304.4.00 In 303.936 325.609 352.6.85 410.476 252.1.36 451.132 359.349 263.942 Cr 357.869 360.533 Ir 263.971 266.479 425.437 284.972 427.480 237.277 894.350 404.414 Cs 852.110 455.536 K 766.491 404.720 459.316 769.898 216.509 357.443 Cu 324.754 217.894 La 550.134 392.756 218.172 407.918 327.396 494.977 419.485 Dy 421.172 404.599 Li 670.784 274.120 394.541 323.261 394.470 279.553 308.147 Mg 385.213 202.580 Lu 335.956 328.174
283.306 244.791 319.990 Pd 247.642 276.309 340.458 Ti 364.268 363.546 365.350 399.864 491.403 231.598 Pr 495.136 504.553 513.342 Tl 276.787 237.969 258.014 377.572 214.423 355.082 Pt 265.945 248.717 283.030 U 351.463 358.488 394.382 306.471 415.400 420.185 382.856 Rb 789.023 421.556 V 318.398 318.540 794.760 437.924 345.188 265.654 Re 346.046 242.836 W 255.135 268.141 346.473 294.740 339.685 410.238 Rh 343.489 350.252 369.236 370.091 Y 407.738 412.831 414.285 372.803 266.449 Ru 349.894 379.940 Yb 398.799 267.198 346.437 206.833 202.551 Sb 217.581 212.739 Zn 213.856 206.191 231.147 307.590
高等数学极限计算方法总结
极限计算方法总结 《高等数学》是理工科院校最重要的基础课之一,极限是《高等数学》的重要组成部分。求极限方法众多,非常灵活,给函授学员的学习带来较大困难,而极限学的好坏直接关系到《高等数学》后面内容的学习。下面先对极限概念和一些结果进行总结,然后通过例题给出求极限的各种方法,以便学员更好地掌握这部分知识。 一、极限定义、运算法则和一些结果 1.定义:(各种类型的极限的严格定义参见《高等数学》函授教材,这里不一一叙述)。 说明:(1)一些最简单的数列或函数的极限(极限值可以观察得到)都可 以用上面的极限严格定义证明,例如: )0,(0lim ≠=∞→a b a an b n 为常数且; 5 )13(lim 2 =-→x x ; ???≥<=∞→时当不存在, 时 当,1||1||0lim q q q n n ;等等 (2)在后面求极限时,(1)中提到的简单极限作为已知结果直接运 用,而不需再用极限严格定义证明。 2.极限运算法则 定理1 已知 )(lim x f ,)(lim x g 都存在,极限值分别为A ,B ,则下面极限都存在,且有 (1)B A x g x f ±=±)]()(lim[ (2)B A x g x f ?=?)()(lim (3))0(,)()(lim 成立此时需≠=B B A x g x f 说明:极限号下面的极限过程是一致的;同时注意法则成立的条件,当条 件不满足时,不能用。 3.两个重要极限 (1) 1sin lim 0=→x x x
(2) e x x x =+→10 ) 1(lim ; e x x x =+∞ →)11(lim 说明:不仅要能够运用这两个重要极限本身,还应能够熟练运用它们的变形形式, 作者简介:靳一东,男,(1964—),副教授。 例如:133sin lim 0=→x x x ,e x x x =--→21 0) 21(lim ,e x x x =+ ∞ →3 )31(lim ;等等。 4.等价无穷小 定理2 无穷小与有界函数的乘积仍然是无穷小(即极限是0)。 定理3 当0→x 时,下列函数都是无穷小(即极限是0),且相互等价,即有: x ~x sin ~x tan ~x arcsin ~x arctan ~)1ln(x +~1-x e 。 说明:当上面每个函数中的自变量x 换成)(x g 时(0)(→x g ),仍有上面的 等价 关系成立,例如:当0→x 时, 13-x e ~ x 3 ;)1ln(2x - ~ 2x -。 定理4 如果函数)(),(),(),(11x g x f x g x f 都是0x x →时的无穷小,且 )(x f ~)(1x f ,)(x g ~)(1x g ,则当) ()(lim 110 x g x f x x →存在时,)() (lim 0x g x f x x →也存在且等于)(x f )()(lim 110 x g x f x x →,即)() (lim 0x g x f x x →=) ()(lim 110x g x f x x →。 5.洛比达法则 定理5 假设当自变量x 趋近于某一定值(或无穷大)时,函数)(x f 和)(x g 满 足:(1))(x f 和)(x g 的极限都是0或都是无穷大; (2))(x f 和)(x g 都可导,且)(x g 的导数不为0; (3)) () (lim x g x f ''存在(或是无穷大);
元素常用光谱特征线(绝大部分元素)
原子吸收光谱各元素常用谱线 元素常用光谱特征线 元素灵敏线次灵敏线元素灵敏线次灵敏线 Ag328.068338.289Er400.797415.110 381.033 393.702 397.360 Al309.271308.216 309.284 394.403 396153 Eu459.403 311.143 321.057 462.722 466.188 As188.990193.696 197.197 Fe248.327 208.412 248.637 252.285 302.064 Au242.795267.595 274.826 312.278 Ga287.424 294.418 403.298 417.206 B249.678249.773Gd368.413371.357 371.748 378.305 407.870 Ba553.548270.263 307.158 350.111 388.933 Ge265.158 259.254 270.963 275.459 Be234.861313.042 313.107 Hf307.288 286.637 290.441 302.053 377.764 Bi223.061206.170 222.825 227.658 306.772 Hg184.957*253.652 Ca422.673239.356 272.164 393.367 396.847 Ho410.384 405.393 410.109 412.716 417.323
Co240.7.25242.4.93 304.4.00 352.6.85 252.1.36 In303.936 256.015 325.609 410.476 451.132 Cr357.869359.349 360.533 425.437 427.480 Ir263.971 263.942 266.479 284.972 237.277 Cs852.110894.350 455.536 459.316 K766.491 404.414 404.720 769.898 Cu324.754216.509 217.894 218.172 327.396 La550.134 357.443 392.756 407.918 494.977 Dy421.172419.485 404.599 394.541 394.470 Li670.784 274.120 323.261 Mg385.213279.553 202.580 230.270 Lu335.956 308.147 328.174 331.211 356.784 Mn279.482222.183 280.106 403.307 403.449 Se196.090 203.985 206.219 207.479 Mo313.259317.035 319.400 386.411 390.296 Si 251.612 250.690 251.433 252.412 252.852 Na588.995330.232 330.299 589.592 Sm429.674 476.027 520.059 528.291 Nb334.371334.906 358.027 407.973 412.381 Sn224.605 235.443 286.333 Nd463.424 468.35 489.693 492.453 562.054 Sr460.733 242.810 256.947 293.183 407.771 Ni232.003231.096Ta271.467255.943
光谱分析知识点
原子发射光谱分析 1、原子发射光谱分析的基本原理(依据) 2、ICP光源形成的原理及特点(习题2) :ICP是利用高频加热原理。 当在感应线圈上施加高频电场时,由于某种原因(如电火花等)在等离子体工作气体中部分电离产生的带电粒子在高频交变电磁场的作用下做高速运动,碰撞气体原子,使之迅速、大量电离,形成雪崩式放电,电离的气体在垂直于磁场方向的截面上形成闭合环形的涡流,在感应线圈内形成相当于变压器的次级线圈并同相当于初级线圈的感应线圈耦合,这种高频感应电流产生的高温又将气体加热、电离,并在管口形成一个火炬状的稳定的等离子体焰矩。 其特点如下: 工作温度高、同时工作气体为惰性气体,因此原子化条件良好,有利于难熔化合物的分解及元素的激发,对大多数元素有很高的灵敏度。 (2)由于趋肤效应的存在,稳定性高,自吸现象小,测定的线性范围宽。(3)由于电子密度高,所以碱金属的电离引起的干扰较小。 (4)ICP属无极放电,不存在电极污染现象。 (5)ICP的载气流速较低,有利于试样在中央通道中充分激发,而且耗样量也较少。 (6)采用惰性气体作工作气体,因而光谱背景干扰少。 3、掌握特征谱线、共振线、灵敏线、最后线、分析线的含义及其它们之间的内 在联系。(习题3) 4、:由激发态向基态跃迁所发射的谱线称为共振线(resonance line)。共振线 具有最小的激发电位,因此最容易被激发,为该元素最强的谱线。 5、灵敏线(sensitive line) 是元素激发电位低、强度较大的谱线,多是共振 线(resonance line)。 最后线(last line) 是指当样品中某元素的含量逐渐减少时,最后仍能观察到的几条谱线。它也是该元素的最灵敏线。 进行分析时所使用的谱线称为分析线(analytical line)。 由于共振线是最强的谱线,所以在没有其它谱线干扰的情况下,通常选择共振线作为分析线。 发射光谱定性分析的基本原理和常用方法。(习题5 由于各种元素的原子结构不同,在光源的激发下,可以产生各自的特征谱线,其波长是由每种元素的原子性质决定的,具有特征性和唯一性,因此可以通过检查谱片上有无特征谱线的出现来确定该元素是否存在,这就是光谱定性分析的基础。 进行光谱定性分析有以下三种方法: (1)比较法。将要检出元素的纯物质或纯化合物与试样并列摄谱于同一感光板上,在映谱仪上检查试样光谱与纯物质光谱。若两者谱线出现在同一波长位置上,即可说明某一元素的某条谱线存在。本方法简单易行,但只适用于试样中指定组分的定性。
光谱基础知识解读
太阳光光谱 紫外线谱带:波长280-400nm之间,其特点是穿透性强,可使人体皮肤黑色素沉积,颜色加深,过度的紫外线曝晒会导致皮肤癌,可导致地毯、窗帘、织物及家具油漆褪色。 可见光谱带:波长380~780nm之间,其特点是肉眼可以看见的唯一光谱,可见光波段进一步可以分为不同的颜色(赤橙黄绿蓝靛紫七色),对人体没有直接伤害。 红外光谱带:波长700~2400nm之间,其特点是我们可以直接感受到阳光“不可见”的热量,所含能量最大,所以热量也高。 各波段的远近红外线构成了太阳能的53%,紫外线占3%,可见光占44%。 元素光谱简介 如果物质是以单原子的形式而存在,关键看该原子的电子激发能了。如果在可见光的某个范围内,并且吸收某一部分光线,那它就显剩下的部分的光线的颜色。如该原子的电子激发能非常低,可以吸收任意的光线,该原子就是黑色的,如果该原子的电子激发能非常高。不能吸收任何光线,它就是白色的。如果它能吸收短波部分的光线,那它就是红色或黄色的。 具体的元素光谱:红色代表硫元素,蓝色代表氧元素,而绿色代表氢元素。 元素燃烧发出的光谱 燃烧所发出的光色根据不同的元素发出不同的光谱,每一种元素燃烧时都发出多条光谱,这种光通过三梭镜或光栅后会在屏障上显现出多条亮线,也就是说只发出有限的几种频率的光,这就是这种元素的光谱。其中会有一条或几条最亮的线,这几条最亮的线决定了在人眼中所看到的颜色。 观察光谱的方法 连续光谱的光线在通过含某种元素的气体时在光谱带上会出现多条暗线,这些暗线刚好与这种元素的光谱线位置相同,强度刚好相反,(光谱线越强的位置暗线越明显)这就是元素的吸收光谱。天文学家就是利用吸收光谱来查明遥远的恒星大气和星云中所含的元素,观察恒星红移或蓝移也要利用吸收光谱。 观察固态或液态物质的原子光谱,可以把它们放到煤气灯的火焰或电弧中去烧,使它们气化后发光,就可以从分光镜中看到它们的明线光谱 原子决定明线光谱 实验证明,原子不同,发射的明线光谱也不同,每种元素的原子都有一定的明线光谱.彩图7就是几种元素的明线光谱.每种原子只能发出具有本身特征的某些波长的光,因此,明线光谱的谱线叫做原子的特征谱线.利用原子的特征谱线可以鉴别物质和研究原子的结构。 吸收光谱 吸收光谱高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,
极限计算方法总结
极限计算方法总结 一、极限定义、运算法则和一些结果 1.定义:(各种类型的极限的严格定义参见《高等数学》函授教材,这里不一一叙述)。 说明:(1)一些最简单的数列或函数的极限(极限值可以观察得到)都可以用上面的 极限严格定义证明,例如:)0,(0lim ≠=∞→a b a an b n 为常数且; 5)13(lim 2=-→x x ;??? ≥<=∞→时当不存在,时当,1||1||0lim q q q n n ;等等 (2)在后面求极限时,(1)中提到的简单极限作为已知结果直接运用,而不需 再用极限严格定义证明。 2.极限运算法则 定理1 已知 )(lim x f ,)(lim x g 都存在,极限值分别为A ,B ,则下面极限都存在,且有 (1)B A x g x f ±=±)]()(lim[ (2)B A x g x f ?=?)()(lim (3))0(,)()(lim 成立此时需≠=B B A x g x f 说明:极限号下面的极限过程是一致的;同时注意法则成立的条件,当条件不满足时, 不能用。 3.两个重要极限 (1) 1sin lim 0=→x x x (2) e x x x =+→1 )1(lim ; e x x x =+∞→)11(l i m 说明:不仅要能够运用这两个重要极限本身,还应能够熟练运用它们的变形形式, 作者简介:靳一东,男,(1964—),副教授。 例如:133sin lim 0=→x x x ,e x x x =--→21 0) 21(lim ,e x x x =+∞ →3 )31(lim ;等等。 4.等价无穷小 定理2 无穷小与有界函数的乘积仍然是无穷小(即极限是0)。 定理3 当0→x 时,下列函数都是无穷小(即极限是0),且相互等价,即有: x ~x sin ~x tan ~x arcsin ~x arctan ~)1ln(x +~1-x e 。 说明:当上面每个函数中的自变量x 换成)(x g 时(0)(→x g ),仍有上面的等价 关系成立,例如:当0→x 时, 13-x e ~ x 3 ;)1ln(2 x - ~ 2x -。
金属元素分析方法
金属元素分析方法 原铁矿中二氧化硅、三氧化铝、三氧化二铁的测定试剂:氢氧化钠;盐酸;准确含量的标样准确称取0.2 克试样至银坩埚中,加入2-3 克氢氧化钠固体,并与试样充分搅拌均匀,加盖放入730 度左右的马弗炉中烧15 分钟取出,少冷却,用镊子夹住用热水冲洗银坩埚,用(1+1)盐酸冲洗银坩埚及盖子,在用水冲洗坩埚,将试液转移到已有20mL 盐酸的250mL 的容量瓶中,待冷却后加水稀释至标线,此溶液做测定二氧化硅、三氧化铝、三氧化二铁的母液。 一、分光光度法测定三氧化二铁 试剂:磺基水杨酸;氨水 准确移取母液5.00mL至100mL容量瓶中,加10mL5^磺基水杨酸,用(1+1)氨水调至黄色并过量3-4 滴,用水稀释至刻度。同时做标样。 二、分光光度法测定二氧化硅试剂:钼酸铵、草酸、硫酸亚铁铵、硫酸 草硫混酸配置:a .30克草酸b.30克硫酸亚铁胺把a放入500mL烧杯中,用沸水把草酸充分溶解;把b放入500mL烧杯中,用沸水充分溶解;却后加169mL(1+1)硫酸搅匀,放入 a 中,加水稀释到1000mL 。 分析步骤:准确移取母液 5.00mL 至100mL 容量瓶中,,加入40mL (1+99)盐酸,加5mL 钼酸铵(10%的水溶液),摇匀静置(显色)可放到热水中保温使显色,10 分钟后,加20mL 草硫混酸,用水稀释至刻度摇匀。同时做标样。将 b 冷 磷的分析 一:钢铁中磷的分析 1 、分析原理: 试样以硝酸溶解,加高锰酸钾将磷全部氧化为正磷酸,加钼酸铵形成磷钼蓝,用氯化亚锡将还原为磷钼蓝,测量吸光度。 2 、试剂 (1)硝酸:(2+5) (2)高锰酸钾(4%) (3)钼酸铵-- 酒石酸钾钠混合液: 将20%钼酸铵溶于20%酒石酸钾钠等体积混合,当日配置。 (4)氟化钠--氯化亚锡溶液;100mL2.4%氟化钠溶液中加0.2克氯化亚锡,氟化钠预先配置,用时加氯化亚锡。
极限计算方法总结(简洁版)
极限计算方法总结(简洁版) 一、极限定义、运算法则和一些结果 1.定义:(各种类型的极限的严格定义参见《高等数学》函授教材,这里不一一叙述)。 说明:(1)一些最简单的数列或函数的极限(极限值可以观察得到)都可以用上面的极限严格定义证 明,例如:)0,(0lim ≠=∞→a b a an b n 为常数且;5)13(lim 2=-→x x ;???≥<=∞→时当不存在, 时当,1||1||0lim q q q n n ; 等等 (2)在后面求极限时,(1)中提到的简单极限作为已知结果直接运用,而不需再用极限严格定义证明。 2.极限运算法则 定理 1 已知 )(lim x f ,)(lim x g 都存在,极限值分别为A ,B ,则下面极限都存在,且有 (1) B A x g x f ±=±)]()(lim[ (2)B A x g x f ?=?)()(lim (3))0(,)()(lim 成立此时需≠=B B A x g x f 说明:极限号下面的极限过程是一致的;同时注意法则成立的条件,当条件不满足时,不能用。 3.两个重要极限 (1) 1sin lim 0=→x x x (2) e x x x =+ →1 )1(lim ; e x x x =+∞ →)11(lim 说明:不仅要能够运用这两个重要极限本身,还应能够熟练运用它们的变形形式, 作者简介:靳一东,男,(1964—),副教授。 例如: 133sin lim 0=→x x x ,e x x x =--→21 0)21(lim ,e x x x =+∞→3)3 1(lim ;等等。 4.等价无穷小 定理2 无穷小与有界函数的乘积仍然是无穷小(即极限是0)。 定理3 当0→x 时,下列函数都是无穷小(即极限是0),且相互等价,即有: x ~x sin ~x tan ~x arcsin ~x arctan ~)1ln(x +~1-x e 。 说明:当上面每个函数中的自变量x 换成)(x g 时(0)(→x g ),仍有上面的等价
金属成分分析
金属成分分析:按标准、要求对相应材质进行定量分析,判断其是否符合相应标准或要求。如果供应商提供的原材料、半成品和成品的材料实际化学成分不符合协议标准,那么它将成为影响产品最终性能的关键因素。 此外,随着现代冶金技术的进步,已经证明了一些具体元素的重要性,过去这些元素被称为“其他元素”,如今更确切的称之为“微量元素。 我们的化学试验室配备了一流的设备,能将测量的不确定度减小到最低。 我们所采用的软件可以分析以下材料: ?碳钢、低合金钢、中合金钢、高合金钢、不锈钢、工具钢、粉末冶金钢材 ?铁 ?铝合金 ?铜合金 ?镍合金 ?钛合金 ?锌合金 ?电镀材料 可检测以下常见金属类型以及未知金属成分分析: 1、不锈钢成分分析—不锈钢牌号鉴定:304、304L、316等不锈钢;元素含量检测:镍Ni、铬Cr、钼Mo、铁Fe等; 2、合金成分分析检测——铜合金、铝合金、锌合金、焊锡及其他合金:碳C,氮N,硫S,磷P,硅Si,铜Cu,铁Fe,铝Al,锡Sn,钼Mo,镍Ni,铬Cr,锰Mn,钛Ti,钨W,铅Pb,锌Zn……; 3、金属材料中常规金属元素分析检测、氧氮氢气体元素检测、贵金属检测、重金属检测、RoHS检测及其他各类材料金属成分检测。 材质:铁基合金(碳钢,不锈钢,工具钢,铸铁等) 铜基合金(纯铜,黄铜,白铜,青铜等) 铝基合金(变型铝,铸铝,纯铝等) 镁基合金(镁铝锌,镁铝硅等) 镍基合金(高温合金,精密合金等 钛基合金(纯钛,T,TC11等) 锡基合金(纯锡,铅锡合金,无铅焊锡等) 锌基合金(纯锌,锌铝合金等) 序号No. 类别Category 项目Items A 化学性能Chemical Analysis A-1 矿石类分析定性测定 A-2 矿石类分析定量测定 A-3 钢铁材料常规元素C,S,Si,Mn,P(ICP法) A-4 钢铁材料合金元素(ICP法) A-5 铜合金与铝合金常规元素C,S,Si,Mn,P(ICP法) A-6 铜合金与铝合金合金元素 A-7 镍合金,钛合金,金属焊料元素测定 A-8 金属材料痕量元素N O H 稀土元素 A-9 异物分析异物能谱测定
光谱部分复习提纲
原子发射光谱仪(AES) 原子发射光谱法是一种成分分析方法,可对约70种元素(金属元素及磷,硅,砷,碳,硼等非金属元素)进行分析。这种方法常用于定性,半定量和定量分析。在一般情况下,用于1%以下含量的组份测定,检出限可达ppm,精密度为±10%左右,线性范围约2个数量级。但如采用电感耦合等离子体(ICP)作为光源,则可使某些元素的检出限降低至10-3 ~ 10-4ppm,精密度达到±1%以下,线性范围可延长至7个数量级。这种方法可有效地用于测量高,中,低含量的元素。 原子发射光谱的产生: 原子的外层电子由高能级向低能级跃迁,能量以电磁辐射的形式发射出去,这样就得到发射光谱、原子发射光谱是线状光谱。一般情况下,原子处于基态,通过电致激发,热致激发或光致激发等激发光源作用下,原子获得能量,外层电子从基态跃迁到较高能态变为激发态,约经10-8 s,外层电子就从高能级向较低能级或基态跃迁,多余的能量的发射可得到一条光谱线。 共振线: 共振线是原子由激发态跃迁至基态而产生的。由于这种迁移及激发所需要的能量最低,所以基态原子对共振线的吸收也最严重。当元素浓度很大时,共振线呈现自蚀现象。自吸现象严重的谱线,往往具有一定的宽度,这是由于同类原子的互相碰撞而引起的,称为共振变宽。由于自吸现象严重影响谱线强度,所以在光谱定量分析中是一个必须注意的问题。 原子发射光谱法仪器分为三部分:光源、分光仪和检测器。 1. 光源 光源具有使试样蒸发,解离,原子化,激发,跃迁产生光辐射的作用.光源对光谱分析的检出限,精密度和准确度都有很大的影响.目前常用的光源有直流电弧,交流电弧,电火花及电感耦合高频等离子体(ICP)。 2. 分光仪 3. 常用的检测方法有:目视法、摄谱法和光电法。 定量分析方法:(1)校准曲线法,(2)标准加入法,(3)内标法。 原子吸收光谱仪 基本原理:仪器从光源辐射出具有待测元素特征谱线的光,通过试样蒸气时被蒸气中待测元素基态原子所吸收,由辐射特征谱线光被减弱的程度来测定试样中待测元素的含量。
最常用的表面分析技术-电子能谱思考题
《电子能谱思考题》 1. 最常用的表面分析技术有哪些? 它们各自可测的元素有哪些?它们可获得哪些表面信息?它们各有何优点? XPS、AES和SIMS是目前广泛使用的三种最常用的表面分析技术。XPS和AES 可检测原子序数>2的所有元素;而SIMS可检测所有的元素。XPS主要获取表面元素和化学键信息,此外还可得到元素深度分布和价带结构等信息;AES主要获取表面元素信息,此外还可得到元素深度分布和表面成像以及化学键等信息;SIMS主要获取表面元素和同位素信息,此外还可得到元素深度分布和表面成像以及化合物等信息。XPS的最大特色在于能获取丰富的化学信息,定量分析好,对样品表面的损伤最轻微;AES的最大特色是空间分辨力非常好,具有很高的微区分析能力,可进行表面分布成像。SIMS的最大特色是检测灵敏度非常高,并可分析H和He以及同位素,可作微区、微量分析以及有机化学分析。 2. 用电子能谱进行表面分析对样品有何一般要求?有哪些清洁表面的常用制备方法? 由于电子能谱测量要在超高真空中进行,测量从样品表面出射的光电子或俄歇电子。所以对检测的试样有一定的要求:即样品在超高真空下必须稳定,无腐蚀性,无磁性,无挥发性。另外在样品的保存和传送过程中应尽量避免样品表面被污染。在任何时候,对被分析样品的表面都应尽量少地接触和处理。 常用清洁表面的制备方法有:真空解理、断裂,稀有气体离子溅射,真空刮削,高温蒸发,真空制备薄膜等。 3. 什么是化学位移和终态效应?它们有何实际应用? 原子因所处化学环境不同而引起的内壳层电子结合能变化,在谱图上表现为谱峰的位移,这种现象称为化学位移。所谓某原子所处化学环境不同有两方面的含义:一是指与它相结合的元素种类和数量不同;二是指原子具有不同的价态。 电子的结合能与体系的终态密切相关。由电离过程中引起的各种激发产生的不同体系终态对电子结合能的影响称为终态效应。电离过程中除了驰豫现象外,还会出现诸如多重分裂,电子的震激(Shake up)和震离(Shake off)等激发状态。这些复杂现象的出现同体系的电子结构密切相关,它们在XPS谱图上表现为除正常光电子主峰外,还会出现若干伴峰。 化学位移和终态效应常用来作元素化学态的识别,并可以推知原子结合状态和电子分布状态。此外它们还可以给出某些体系的结构信息。它们可提供材料表面丰富的物理和化学信息。 4. 在XPS谱图中可观察到几种类型的峰?从XPS谱图中可得到哪些表面有关的物理和化学信息?
极限计算方法总结
极限计算方法总结 靳一东 《高等数学》是理工科院校最重要的基础课之一,极限是《高等数学》的重要组成部分。求极限方法众多,非常灵活,给函授学员的学习带来较大困难,而极限学的好坏直接关系到《高等数学》后面内容的学习。下面先对极限概念和一些结果进行总结,然后通过例题给出求极限的各种方法,以便学员更好地掌握这部分知识。 一、极限定义、运算法则和一些结果 1.定义:(各种类型的极限的严格定义参见《高等数学》函授教材,这里不一一叙述)。 说明:(1)一些最简单的数列或函数的极限(极限值可以观察得到)都可以用上面的 极限严格定义证明,例如:)0,(0lim ≠=∞→a b a an b n 为常数且;5)13(lim 2 =-→x x ;???≥<=∞→时当不存在,时当,1||1||0lim q q q n n ;等等 (2)在后面求极限时,(1)中提到的简单极限作为已知结果直接运用,而不需 再用极限严格定义证明。 2.极限运算法则 定理1 已知 )(lim x f ,)(lim x g 都存在,极限值分别为A ,B ,则下面极限都存在,且有 (1)B A x g x f ±=±)]()(lim[ (2)B A x g x f ?=?)()(lim (3))0(,) ()(lim 成立此时需≠= B B A x g x f 说明:极限号下面的极限过程是一致的;同时注意法则成立的条件,当条件不满足时, 不能用。 3.两个重要极限 (1) 1sin lim =→x x x (2) e x x x =+→1 )1(lim ; e x x x =+∞→)11(l i m 说明:不仅要能够运用这两个重要极限本身,还应能够熟练运用它们的变形形式, 作者简介:靳一东,男,(1964—),副教授。 例如:133sin lim =→x x x ,e x x x =--→21 ) 21(lim ,e x x x =+∞ →3)3 1(lim ;等等。 4.等价无穷小 定理2 无穷小与有界函数的乘积仍然是无穷小(即极限是0)。
仪器分析总习题及参考答案
1、试述“仪器分析”是怎样的一类分析方法?有何特点?大致分哪几类?具体应用最广的 是哪两类? 2、光谱法的仪器通常由哪几部分组成?它们的作用是什么? 光谱法的仪器由光源、单色器、样品容器、检测器和读出器件五部分组成。作用略。 3、请按照能量递增和波长递增的顺序,分别排列下列电磁辐射区:红外线,无线电波,可 见光,紫外光,X射线,微波。 能量递增顺序:无线电波、微波、红外线、可见光、紫外光、X射线。 波长递增顺序:X射线、紫外光、可见光、红外线、微波、无线电波。 4、解释名词电磁辐射电磁波谱发射光谱吸收光谱荧光光谱原子光谱 分子光谱特征谱线 电磁辐射――电磁辐射是一种以巨大速度通过空间传播的光量子流,它即有波动性,又具有粒子性. 电磁波谱――将电磁辐射按波长顺序排列,便得到电子波谱.电子波谱无确定的上下限,实际上它包括了波长或能量的无限范围. 发射光谱――原来处于激发态的粒子回到低能级或基态时,往往会发射电磁辐射,这样产生的光谱为发射光谱. 吸收光谱――物质对辐射选择性吸收而得到的原子或分子光谱称为吸收光谱. 荧光光谱――在某些情形下,激发态原子或分子可能先通过无辐射跃迁过渡到较低激发态,然后再以辐射跃迁的形式过渡到基态,或者直接以辐射跃迁的形式过渡到基态。通过这种方式获得的光谱,称为荧光光谱. 原子光谱――由原子能级之间跃迁产生的光谱称为原子光谱. 分子光谱――由分子能级跃迁产生的光谱称为分子光谱. 特征谱线――由于不同元素的原子结构不同(核外电子能级不同),其共振线也因此各有其特征。元素的共振线,亦称为特征谱线。 5、解释名词:灵敏线共振线第一共振线 共振线――由任何激发态跃迁到基态的谱线称为共振线. 主共振线――由第一激发态回到基态所产生的谱线;通常是最灵敏线、最后线 灵敏线――元素的灵敏线一般是指强度较大的谱线,通常具有较低的激发电位和较大的跃迁几率。 AAS 解释下列名词:多普勒变宽、谱线轮廓、光谱通带、释放剂、峰值吸收积分吸收锐线光源多普勒变宽――又称为热变宽,它是发射原子热运动的结果,主要是发射体朝向或背向观察器运动时,观测器所接收到的频率变高或变低,于是出现谱线变宽。 谱线轮廓――是谱线强度随波长(或频率)分布的曲线。 光谱通带――仪器出射狭缝所能通过的谱线宽度。 释放剂――当欲测元素和干扰元素在火焰中形成稳定的化合物时,加入另一种物质,使与干扰元素化合,生成更稳定或更难挥发的化合物,从而使待测元素从干扰元素的化合物中释放出来,这种加入的物质称为释放剂。
光谱分析复习提纲.doc
1 ?原子发射光谱法 原子发射光谱法是一种成分分析方法,可对约70种元素(金属元素及磷,硅,砂,碳,硼等非金属元素)进行分析。这种方法常用于定性,半定量和定量分析。在一般情况下,用于1%以下含量的组份测定,检出限可达ppm,精密度为±10%左右,线性范围约2个数量级。但如采用电感耦合等离子体(ICP)作为光源,则可使某些元素的检出限降低至10'3~ W4ppm,精密度达到±1%以下,线性范围可延长至7个数量级。这种方法可有效地用于测量高,中,低含量的元素。 原子发射光谱的产生: 原子的外层电子由高能级向低能级跃迁,能量以电磁辐射的形式发射出去,这样就得到发射光谱、原子发射光谱是线状光谱。一般情况下,原子处于基态,通过电致激发,热致激发或光致激发等激发光源作用下,原子获得能量,外层电子从基态跃迁到较高能态变为激发态,约经10'8s,外层电子就从高能级向较低能级或基态跃迁, 多余的能量的发射可得到一条光谱线。共振线: 共振线是原子由激发态跃迁至基态而产生的。由于这种迁移及激发所需要的能量最低,所以基态原子对共振线的吸收也最严重。当元素浓度很大时,共振线呈现自蚀现象。自吸现象严重的谱线,往往具有一定的宽度,这是由于同类原子的互相碰撞而引起的,称为共振变宽。由于自吸现象严重影响谱线强度,所以在光谱定量分析中是一个必须注意的问题。 原子发射光谱法仪器分为三部分:光源(重点ICP光源)、分光仪和检测器。 1. 光源 光源具有使试样蒸发,解离,原子化,激发,跃迁产生光辐射的作用?光源对光谱分析的检出限,精密度和准确度都有很大的影响.目前常用的光源有直流电弧,交流电弧,电火花及电感耦合高频等离子体(ICP)o 2. 分光仪 3. 常用的检测方法有:目视法、摄谱法和光电法。 定量分析方法:(1)校准曲线法,(2)标准加入法,(3)内标法。 2. 原子吸收光谱法 基本原理:仪器从光源辐射出具有待测元素特征谱线的光,通过试样蒸气时被蒸气中待测元素基态原子所吸收,市辐射特征谱线光被减弱的程度來测定试样中待测元素的含量。 用途: 原子吸收光谱仪可测定多种元素,火焰原子吸收光谱法可测到10-9g/mL数量级, 石墨炉原子吸收法可测到10-13g/mL数量级。其氢化物发生器可对8种挥发性元素汞、币申、铅、硒、
原子发射光谱试题
一、判断题 1. 原子内部的电子跃迁可以在任意两个能级之间进行,所以原子光谱是由众多条光谱线按一定顺序组成。() 2. 光栅光谱为匀排光谱,即光栅色散率几乎与波长无关。() 3. 由第一激发态回到基态所产生的谱线,通常也是最灵敏线、最后线。() 4. 自吸现象是由于激发态原子与基态原子之间的相互碰撞失去能量所造成的。() 5. 自蚀现象则是由于激发态原子与其他原子之间的相互碰撞失去能量所造成的。() 6. 在原子发射光谱分析中,自吸现象与自蚀现象是客观存在且无法消除。() 7. 光谱线的强度与跃迁能级的能量差、高能级上的原子总数及跃迁概率有关。() 8. 自吸现象与待测元素的浓度有关,浓度越低,自吸越严重。() 9. 原子发射光谱仪器的类型较多,但都可分为光源、分光、检测三大部分,其中光源起着十分关键的作用。()10. ICP光源中可有效消除自吸现象是由于仪器具有很高的灵敏度,待测元素的浓度低的原因。()11. Al 308.26nm,(I)的谱线强度为8级,309.27nm(I)的谱线强度为9级。采用光谱分析确定试样中铝是否存在时,若前一谱线在试样谱带中出现而后一谱带未出现,可判断试样中有铝存在。()12. 交流电弧的激发能力强,分析的重现性好,适于定量分析,不足的是蒸发能力也稍弱,灵敏度稍低。 () 二、选择题 1. 在用光栅单色器分光后的光谱中,每10nm波长间隔距离——() A. 随波长减少而增加; B. 随波长增加而增加; C. 随波长减少而减少; D. 几乎不随波长变化 2. 原子发射光谱的产生是由——() A. 原子次外层电子在不同能级间的跃迁; B. 原子外层电子在不同能级间的跃迁; C. 原子内层电子在不同能级间的跃迁; D. 原子外层电子的振动和转动。 3. 光栅的分辨率取决于——() A. 刻线宽度; B. 总刻线数; C. 波长; D. 入射角 4. 光电直读光谱仪中,采用——光源时,测定试样为溶液?() A. 电火花; B. ICP; C. 直流电弧; D. 交流电弧 5. 在原子发射光谱的光源中,激发温度最高的光源是——() A. 电火花; B. ICP; C. 直流电弧; D. 交流电弧 6. 与光谱强度无关的因素是——() A. 跃迁能级间的能量差; B. 高能级上的原子数; C. 跃迁概率; D. 蒸发温度。 7. ICP光源高温的产生是由于——( ) A. 气体燃烧; B. 气体放电; C. 电极放电; D.电火花 8. 进行谱线检查时,通常采取与标准光谱比较法来确定谱线位置,通常作为标准的是() A. 铁谱; B. 铜谱; C. 碳谱; D.氢谱 9. 元素的发射光谱具有特征性和唯一性,这是定性的依据,判断元素是否存在的条件是() A. 必须将该元素的所有谱线全部检出;
