外周血PBMC的分离

外周血PBMC 的分离
原 理
外周血各种血细胞的密度不尽相同,利用淋巴细胞分层液(Ficoll )作密度梯度离心,
使一定比重的细胞群按相应密度梯度分布,从而将各种血细胞加以分离。
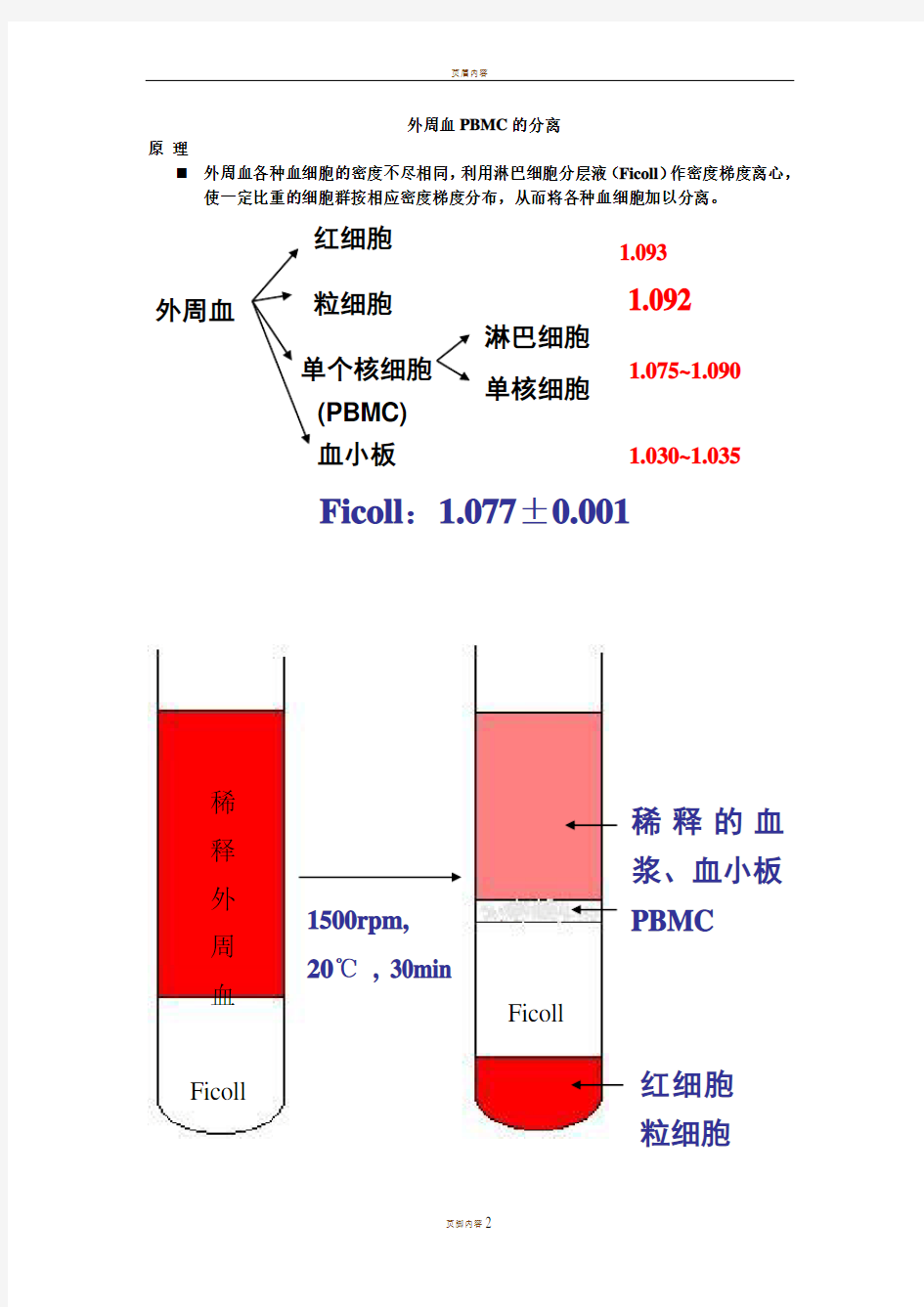
外周血 红细胞
粒细胞
单个核细胞 血小板
淋巴细胞
单核细胞
1.030~1.035
1.075~1.090
Ficoll :1.077±0.001
(PBMC) 1.092
1500rpm, 20℃ , 30min
PBMC
红细胞粒细胞
Ficoll
稀释外周血 Ficoll
稀释的血浆、血小板 1.093
实验步骤
? 1.采血,稀释
(外周血:稀释液=1:2)
? 2.在离心管中加入Ficoll,沿倾斜的管壁缓缓加入稀释的外
周血(Ficoll:稀释血=1:2)
? 3.18℃,1500r/min,离心30min
? 4. 轻轻吸取PBMC层移入另一试管中
? 5.加足量稀释液充分洗涤,1800 r/min离心5min ,弃上清。
注意事项
?每毫升外周血液大约可获1×106单个核细胞
?Ficoll应适量,外周血应充分稀释
?温度直接影响到Ficoll的比重和分离效果
?在Ficoll上加入稀释外周血时,应缓慢加,以免冲散界面?吸取单个核细胞层时,应避免吸出过多的上清液或分层液
而导致血小板污染
提取外周血淋巴细胞
https://www.360docs.net/doc/fe14952037.html,/bbs/topic/791076?keywords=淋巴细胞 分离淋巴细胞是许多实验最基本的技术,也是关键的技术之一。现在大多数用的密度梯度离心法。一般我用5ml抗凝血就可以得到pbmc大约4-5x106的细胞。现在将我分离淋巴细胞的经验于大家共分享。 我的经验 1,新鲜血(肝素抗凝20u/ml)+1640(无血清)培养液按照1:1 稀释 2. 在10ml玻璃试管中预先加入淋巴细胞分离液,使分离液:1640:新鲜血=1:1:1(最好用玻璃试管,分离液的量可以增加些,我的经验是1:1;1足够了!!) 3.小心的将稀释后的血液加到分离液的上面,开始的加入一定一定要慢,要尽量的贴近液面加。 4. 离心 .转速:1500/分 温度20c -28c 时间:20分钟 no break(就是不要刹车,这个很重要,不然由于急剧的减速度,会把已经分离的单个核细胞层又弄混了,加速度也最好不要太大) 5。取出试管,看看是不是分为好几层??顺次为血浆---单个核细胞层--分离液--红细胞 6.用毛吸管吸取上面的血浆层,注意无菌,保存好,留着有用!!!! 7.用毛吸管,吸出单个核细胞层(白白的那一层),重悬于(2—5倍体积的不完全培养液中).你会问:混在其中的淋巴细胞分离液怎么办?别着急。还有办法的。 8 离心。转速:2000-2300/分(转速一定要提高,不然淋巴细胞很难与分离液分开!!) 时间:10分钟 温度:4c 9震荡后,用培养液重悬至1ml(为什么?嘿嘿,马上告诉你) 10.细胞计数+洗涤细胞。刚才不是重悬到1ml吗?取一些放于96孔板中留着计数用(100ul足够了),然后细胞悬液在离心机上离心,在离心的同时,计数你得到的pbmc吧。这样是不是很节省时间?? 11.计数细胞:计数细胞用的细胞计数板的结构是四个角有4个大正方形,每个正方形有16个小正方形. a. 取96板中的细胞悬液10ul,用3%冰醋酸稀释到原来的4倍(这样既能溶解红细胞,又保证细胞浓度不是很大,方便计数) b. 从上面的稀释悬液中取9ul于细胞计数板上,开始计数细胞 c.计数原则:对于压线的细胞,只说左边的和上边的。总共数4大正方形 d.计算细胞浓度:4大格细胞的平均数x 104 x 4 得到的就是细胞的浓度 e 细胞总数是:细胞浓度x1ml(现在知道为什么重悬到1ml了吧?) 12.培养:取出离心的细胞,震荡,按照每个孔1-2x106个/ml的浓度,将细胞用10%NCS+1640重悬后加入到24孔板中,然后拿出保存的人血浆,2滴/孔(经验得知这样,淋巴细胞生长情况会更好)。加入rIL-2 25-50u/孔后,放入培养箱. 看了pbmc 的经验很受启发,我不是做pbmc分离的,但曾经用过淋巴细胞分离液,谈几点体会,希望能共同提高! 1、因为吸取上层血浆的时候很容易打乱层次结构,离心后我一般直接用吸管伸入中间层吸出所需细胞,然后再吸血浆,如果与淋巴细胞分离液交界处变混浊,少吸一点就是了,反正血浆多得是 2、吸取细胞的时候尽量不要吸到下层的淋巴细胞分离液,因为淋巴细胞分离液的比重比淋巴细胞大,用离心的方法是不可能去除的 3、重悬细胞的时候不要用含血清的培养基,因会使细胞粘附成团 建议; 不同厂家生产的淋巴细胞分离液,密度不同。所以第一步离心的转速也会有所不同。最好是按照说明书摸出最合适的转速,这是分离成败的关键!!!!!!。
外周血单个核细胞的分离(优质参考)
实验二十四外周血单个核细胞的分离 (Separation of mononuclear cell in peripheral blood) 免疫细胞是一组不均一的细胞群体,它包括T、B淋巴细胞、NK细胞、单核细胞/巨噬细胞以及粒细胞等,这些细胞的生物学特性,如细胞的大小、密度、表面电荷、黏附能力以及细胞表面的分子标志等均存在差异,借助这些差异可区分不同的细胞类别。外周血单个核细胞(PBMC)的分离主要有两种方法,即聚蔗糖-泛影葡胺(Ficoll-Hypaque)分离法和聚乙烯吡咯烷酮硅胶(Percoll)分离法。此处只介绍聚蔗糖-泛影葡胺分离法。 【实验原理】 血液中单个核细胞的分离常采用密度梯度离心法。市售淋巴细胞分离液是由聚蔗糖(Ficoll)和泛影葡胺(Hypaque) 按一定比例混合制成,20℃密度为1.077±0.001,单个核细胞包括淋巴细胞和单核细胞,其密度为1.050~1.077,而粒细胞和红细胞的密度为1.080~1.110。将待分离的细胞悬液小心铺于淋巴细胞分离液上,经离心后单个核细胞悬浮于分离液上层界面,而红细胞与粒细胞沉于管底。 【主要试剂和器材】 1.聚蔗糖-泛影葡胺分层液密度为1.077±0.001。 2.5g/L台盼蓝。 3.250U/ml肝素溶液用Hank,s液配制。 4.Hank,s液。 5.注射器、刻度离心管、吸管、滴管、血细胞计数板、载玻片、盖玻片。 6.水平离心机、显微镜。 【操作方法】 1.抽取静脉血2ml,注入含有0.2ml肝素溶液的无菌试管中摇匀,作白细胞计数和分类计数。再加入等量Hank,s液混匀。 2.取2ml分层液置于离心管中,将稀释血液沿管壁缓缓叠加于分层液上,形成清晰界面。稀释血液与分层液的容积比例以2∶1~3∶1为宜。 3.置水平离心机中,2000r/min离心20min。 4.离心后从离心管的底部到液面分为四层,依次为红细胞和粒细胞层、分层液层、单个核细胞层、血浆层(含血小板和破碎细胞)。 5. 用滴管直接吸出单个核细胞层,或吸去血浆层后再吸了该层,置于另一离心管中。 6.加入4倍量以上的Hank,s液,充分混匀,1000r/min离心l0min。离心后倾弃上清液,再用Hank,s液洗2次。 7.用含10%~20%灭活小牛血清的Hank,s液或培养液配制细胞悬液。计数,并分别计数粒细胞和单个核细胞数,同时用台盼蓝检测细胞活力,最后按实验要求将细胞悬液调整到适当浓度。【结果判断】 【注意事项】 1.将血液进行稀释可降低血液黏稠度和红细胞的聚集,提高单个核细胞的收获量。 2.温度变化可直接影响分层液的密度,即影响细胞的收获率和纯度。故应在室温(18~25℃)下进行实验,分层液使用前应预温至室温。温度过低,淋巴细胞丢失增多;温度过高,会影响淋巴细胞活性。
外周血单个核细胞
外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)即外周血中具有单个核的细胞,包括淋巴细胞和单核细胞。体外检测淋巴细胞首先要分离外周血单个核细胞,目前主要的分离方法是Ficoll-hypaque(聚蔗糖-泛影葡胺)密度梯度离心法,因为血液中各有形成分的比重存在差异,因此得以分离。红细胞和粒细胞密度大于分层液,同时因红细胞遇到Ficoll而凝集成串钱状而沉积于管底。血小板则因密度小而悬浮于血浆中,唯有与分层液密度相当的单个核细胞密集在血浆层和分层液的界面中,呈白膜状,吸取该层细胞递经洗涤离心重悬。本法分离单个核细胞纯度可达95%,淋巴细胞约占90%~95%,细胞获得率可达80%以上,其高低与室温有关,超过25℃时会影响细胞获得率。 ●人外周血单核细胞(PBMC)分离及培养 PBMC(peripheral blood mononuclear cell),外周血单个核细胞,顾名思义,其主要细胞类型为血液里边具有单个核的细胞,主要包括淋巴细胞(T\B),单核细胞,吞噬细胞,树突状细胞和其他少量细胞类型。其中淋巴细胞占很大一部分。分离PBMC的主要目的是为了将多核细胞和红细胞去除,从而能够很方便地模拟体外的血液免疫环境。 Ficoll是蔗糖的多聚体,呈中性,平均分子量为400,000,当密度为1.2g/ml仍未超出正常生理性渗透压,也不穿过生物膜。红细胞、粒细胞比重大,离心后沉于管底;淋巴细胞和单核细胞的比重小于或等于分层液比重,离心后漂浮于分层液的液面上,也可有少部分细胞悬浮在分层液中。吸取分层液液面的细胞,就可从外周血中分离到单个核细胞。 ●工具/原料 全血(以10ml为例) 无菌PBS溶液(pH7.4) 或者生理盐水 蔗糖溶液(FicollPague PLUS) (GE Healthcare Life Sciences #17-1440-02) RPMI 1640培养基(Invitrogen) 胎牛血清(FBS)(GIBCO) 双抗P/S (Penicillin/ Streptomycin) (GIBCO) 二甲亚砜(DMSO)(SIGMA)
人外周血单核细胞分离技术
人外周血单核细胞分离 1.抗凝血的预离心分别取正常人新鲜抗凝全血 A: 20 mL于50 mL离心管中,以2 000 r /min 离心20 min,吸弃上层血浆,获得下层沉淀细胞约10?12.5 mL 。 2.沉淀细胞的稀释与离心分离在所获取沉淀 A中的细胞中加入Hank s液(不含Ca2+、Mg 2+, pH 7.2 ?7.6)体积比仍未1:1 , 混匀,制成细胞悬液。 B:无菌抗凝血与Hank s液或PBS以1:1体积在试管中混匀。 另取一离心管,加入LTS1077淋巴细胞分层液,然后用毛细吸管距分层液上1cm处 将细胞悬液小心而缓慢地加于其上面,使稀释血液重叠于分层液上。此时稀释后的细胞悬液 分离液淋巴细胞体积为:1:1。与用水平离心机以2000 r /min 离心20min,离心结束后,取出离心管,可见管中液体已经分层。 管内可见分为4层:最上层是血浆,含部分血小板:第二层为薄薄的白膜层,主要台 单个核细胞,还混杂有少量血小板;第三层为分离液层;第四层为粒细胞及红细胞,红细胞 沉于管底,而粒细胞则紧贴在压积红细胞上呈一层很薄的白膜 3.单个核细胞的提取、洗涤与悬浮、贴壁 吸去最上层的血浆,收集血浆层和淋巴细胞分离液交界面的单个核细胞,尽量全部吸出PBMC。加3~4倍以上体积Hanks或PBS液于所得的单个核细胞中,用毛细吸管轻轻吹判均匀,避免产小气泡,液柱高度不超过离心管的 2 / 3。混匀后离心1500r/mi n 离心 10min,低速离心有利于去除细胞悬液中留存的血小板,去上清液。 注意:还可以先用吸管把雾状层上面的液体吸走,注意不要碰到雾状层,然后在把要的部分慢慢吸出来。第二种方法,比较简单一些。 再用同样洗涤液洗涤细胞2次,1500r/min 离心10min,洗去残留的淋巴细胞分离液。再以RPMI-1640 培养基离心洗涤1次,吸尽上清,以充分去除血小板等杂质。按每毫升血液标本加0.2 mL含20%小牛血清的Hank s液(或含10%胎牛血清及25 mmol /L hepas的RPMI-1640 液3?4 mL)重新混悬细胞37 C、5% C02孵育箱中培养2?3 h 后去除上清,得到贴壁的单核细胞。于各培瓶中分别加入含10%胎牛血清的RPMI-1640
费森尤斯维修手册精选.
Wo 名词缩写解释 HF Hemofiltration 血液滤过HDF Hemodiafiltration 血液滤透4008选件 BPM血压监测器 BTM血温监测器 BVM血容量监测器 OCM在线清除率监测 SN-Double Pump单针泵 DIASAFE plus Filter细菌过滤器 ONLINE plus在线血滤系统 Bibag(Standard)干粉 CDS中央供液系统 模组空间 Blood Pump血泵 Heparin Pump肝素泵 Level Detector空气监测器 Bibag/Conc.干粉
T1测试描述,包含错误信息 附注错误说明指定的数值是程序中使用的精确数值 具体数值和公差如下: 1. Arterial pressure 动脉压 3 mmHg/digit 和测定值的± 1位 2. Venous pressure 动脉压 3 mmHg/digit 和测定值的±1位 3. Dialysate Pressure 透析液压 粗略 6.0 mmHg/digit 和测定值的±1位 优良0.5 mmHg/digit 和测定值的±1位 4. CD resolution 0.06 mS/digit 和精确值的± 1位 5. T emperature 温度0.05 °C/digit和精确值的± 1位开始和运行测试的先决条件 错误信息描述 Power failure测试进行中的电源失败. Dialines not conn透析液管路没有插入到冲洗桥中. Shunt Cover open冲洗桥打开状态. Connect Conc.Line Wrong conc. Supply A液连接器在冲洗腔中或者完全没有连接. 该错误信息取决于中央供液系统预选中的设置菜单. Blood Sensed by OD光学探测器检测到系统中有血液. Flow alarm进或出透析器的线路打结, 故障发生在水路中. Water alarm供水中断. 单独测试步骤的描述 Bypass test (旁路测试)........................................................................ ........................................ . (6) Optical detector test (光学探测器测试)................................................................................ (8) Blood system test (血系统测试).............................................................................................. . (10) Venous pressure system test (静脉压系统测试)................................................................. . (13) Air detector test (空气探测器测试) (15) Display test (显示测试) (18) Arterial pressure system test (动脉压系统测试) (20) Battery test (蓄电池测试) (21) Blood leak test (漏血测试) (23) Temperature test (温度测试).................................................................................................... . (25) Negative pressure holding test (负压保持测试) (27) Positive pressure holding test (正压保持测试) (29) UF function test (超滤功能测试) (34) Conductivity test (电导率测试) (37) Diasafe/HDF filter test (细菌过滤器/血液滤透过滤器测试) (39)
人外周血单核细胞分离液使用说明
人外周血单核细胞分离液使用说明 产品内容: 试剂A200mL 试剂D200mL 样本稀释液(赠品)200mL 清洗液(赠品)200mL 保存:18℃-25℃保存,有效期两年。人外周血单核细胞分离液易感染细菌,需无菌条件下操作。无菌条件下操作,启封后常温保存。如4℃保存,本分离液易出现白色结晶,影响分离效果。 操作步骤: 全过程样本、试剂及实验环境均需在20±2℃的条件下进行。首先取抗凝血按体积比1:1的比例加全血及组织稀释液混匀,根据稀释后的样本量大小,分以下两种情况: 情况A:稀释后血液样本小于5mL时,实验方法如下: 1.取一支15ml离心管,依次小心加入试剂A、试剂D(体积比为3:2,试剂总量与稀释后的血液样本量相等。如稀释后的血液样本为5ml,则先后加入试剂A3ml、试剂D2ml),制成梯度界面,各液面分层一定要清晰。 2.用吸管小心吸取稀释后的血液样本加于分离液液面上,400-550g,离心20-30min(注:根据血液样本量确定离心条件,血液样本量越多,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果)。 3.离心后,此时离心管中由上至下分为五层。第一层为稀释液层。第二层为透明试剂D液层。第三层为环状乳白色单核细胞层。第四层为透明试剂A液层。第五层为红细胞层。 4.用吸管小心吸取第二层试剂D层和第三层乳白色细胞层到另一15ml离心管中,往所得离
心管中加入10ml清洗液,混匀细胞。 5.250g,离心10min。 6.弃上清。 7.用吸管以5ml清洗液重悬所得细胞。 8.250g,离心10min。 9.重复6、7、8,弃上清后以0.5ml后续实验所需相应液体重悬细胞。 10.差异贴壁法纯化细胞 (1)用单核细胞无血清培养基或单核细胞完全培养基以1.5-3×106个/ml的密度重悬细胞,将细胞铺于一次性细胞板或细胞瓶中,放于37℃二氧化碳培养箱中进行贴壁培养。(2)2-4小时内贴壁的为巨噬细胞前体(俗称为单核细胞)。 (3)10-24小时内贴壁的单个核细胞为内皮、内皮祖细胞、干细胞。 (4)不贴壁的为淋巴细胞。 注: a)无血清培养基中不含任何动物成分,为得到更佳培养效果可添加10%自体血浆或2-8%的胎牛血清。 b)完全培养基中含2-20%胎牛血清(血清具体含量由所培养的目的细胞而定)。 c)由于每种细胞的贴壁时间存在差异可将所得细胞分开已达简单的纯化目的,此法成本相对较低。如需获得高纯度目的细胞则需在使用分离液后选用免疫磁珠阳性或阴性分选。 情况B:血液样本大于等于5mL时,实验方法如下: 1.取一支适当的离心管,依次小心加入试剂A、试剂D(试剂A与试剂D体积比为5:3,试剂总量与稀释后的样本量相等),制成梯度界面。 2.将经稀释后的血液样本小心加于分离液之液面上,450-650g(最大离心力可至1000g),
人外周血单个核细胞分离液说明书
分离后分离前 水平离心血浆层单个核细胞层分离液层 红细胞层人外周血单个核细胞分离液说明书 货号:P9010/P9011 规格:200mL 产品简介: 本产品是一种用于分离人外周血单个核细胞的无菌、低内毒素水平的密度梯度分离液。外周血中单个核细胞(PBMC)包括淋巴细胞和单核细胞,其体积、形态和密度与其他细胞不同,红细胞和粒细胞密度较大,为1.090g/mL左右,淋巴细胞和单核细胞密度为1.075~1.090g/mL,血小板为1.030~1.035g/mL。为此利用一种密度介于1.075~1.092之间而近于等渗的溶液做密度梯度离心,使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。 产品指标: 密度 1.077±0.001g/mL 渗透压 290~350mOsm/kg H2O 无菌 0.1μm 滤膜过滤保存条件: 本产品对光敏感,应该室温避光储存,保质期2年。无菌开封后,保存于室温。 操作步骤: 1.取新鲜抗凝全血(EDTA、枸橼酸钠或肝素抗凝 均可)或者去纤维蛋白血液,用等体积的全血 及组织稀释液或者PBS稀释全血。 2.在离心管中加入适量分离液(当稀释后血液体 积小于3mL时,加入3mL分离液;大于等于3mL, 加入等体积分离液。但二者的总体积不能超过 离心管的三分之二,否则会影响分离效果), 将稀释后的血液平铺到分离液液面上方,注意
保持两液面界面清晰。(可以使用巴氏德吸管吸取血液,然后将血液小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。如果样品较多加样时间较长,在离心之前出现红细胞成团下沉属正常现象。) 3.室温,水平转子500~1000g,离心20~30min(血液的体积越大所需的离心力越大,离心时间越长,最佳 的分离条件需摸索,离心转速最大不超过1200g)。 4.离心后将出现明显的分层:最上层是稀释的血浆层,中间是透明的分离液层,血浆与分离液之间的白 膜层即为单个核细胞层,离心管底部是红细胞与粒细胞。 5.小心的吸取白膜层细胞到15mL洁净的离心管中,10mL PBS或细胞洗涤液洗涤白膜层细胞。250g,离心 10min。 6.弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。 7.重复步骤6 8.弃上清,细胞重悬备用。 注意事项: A.开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,避免微生物 污染。 B.分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。4℃或者是温度较 低的条件下离心,可能会导致白膜层中红细胞污染加重。 C.血液样本最好为新鲜抗凝血(采血2h以内),为保持单个核细胞的活性,应避免冷冻和冷藏。 D.稀释血液或洗涤细胞,不可使用含Ca、Mg离子的缓冲液及培养液,其成分会导致血细胞凝集,大大降 低细胞得率及纯度。 E.部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁,影响分离效果。 F.血液样本的粘稠度或者是温度差异,可能会影响分离效果,可以调节离心转数和离心时间,摸索最佳 的分离条件。 G.吸取过多的单个核细胞层及分离液层会导致分离液交界处的粒细胞被吸出从而使混杂的粒细胞数量增 加;吸取过多的血浆层可能会导致单个核细胞中血浆蛋白及血小板污染。
小鼠外周血淋巴细胞分离实验报告
小鼠外周血淋巴细胞分离实验报告 一、实验目的 1. 了解淋巴细胞分离的意义和原理 2. 掌握淋巴细胞分离的技术,为进行下一步生物实验奠定基础 二、实验材料 1.淋巴细胞分离液 2.EDTA抗凝剂 常用EDTA的钠盐或钾盐作为抗凝剂,能与血液中的钙离子结合成螯合物,而是钙离子失去凝血作用,从而阻止血液凝固 3.PBS缓冲液 PBS缓冲液一般作为溶剂,起溶解保护试剂的作用 4.戊巴比妥钠溶液 作用与苯巴比妥相同,为中时作用的巴比妥类催眠药,作用时间可维持3~6小时,显效较快。用作催眠和麻醉前给药,亦可用于治疗癫痫和破伤风的痉挛。 5.其他实验材料:健康的小白鼠一只、注射器(1ml,10ml)1ml、20ul的枪以及相应的枪头、滴管、水平离心机、医用镊子、EP管(5ml,10ml) 三、实验原理 外周血中各种细胞的密度不同。密度离心法的原理主要根据各类血细胞的比重差异,利用比重介于某两类细胞之间的细胞分离液对血液离心,使一定比重的血细胞依相应的密度梯度分布于不同的独立区带,从而达到分离的目的。 第一层为血浆层。第二层为环状乳白色淋巴细胞层。第三层为透明分离液层。第四层为红细胞层
图1 小鼠外周血离心前后示意图 四、实验步骤 1.给小鼠注射适量的戊巴比妥钠麻醉剂,使其麻醉 2.用镊子用力拉扯掉麻醉完全小鼠的其中一只眼睛,将血液滴入事先已经加入100ulEDTA抗凝剂的5mlEP管中,取足1ml新鲜血液 3.用滴管将抗凝后的血加入事先加入1mlPBS缓冲液的5ml的EP管中稀释(血液与PBS的比率为1:1) 4.用滴管将稀释后的1ml新鲜血液沿试管壁缓缓(一定要慢)加到含有2ml淋巴细胞分离液(事先要恢复到室温)的10mlEP管中(稀释血液:分离液=1:1),沿管壁流下的稀释血液叠加在分离液之上,并与分离液形成明显的界面 5.经水平式离心机离心(1500r/min)15分钟,小心取出试管 6.用平口滴管小心吸取中层呈白絮状的淋巴细胞,用PBS溶液洗涤两次,每次离心1800r/min,离心10min 7.弃上清液,加入4mlPBS待用
人外周血单核细胞分离技术
人外周血单核细胞分离 1. 抗凝血的预离心分别取正常人新鲜抗凝全血 A: 20 mL于50 mL离心管中,以2 000 r /min离心20 min,吸弃上层血浆,获得下层沉淀细胞约10~12.5 mL。 2. 沉淀细胞的稀释与离心分离在所获取沉淀 A 中的细胞中加入Hank′s液( 不含Ca2+、Mg2+, pH 7.2 ~7.6) 体积比仍未1:1,混匀,制成细胞悬液。 B: 无菌抗凝血与Hank′s液或PBS以1:1体积在试管中混匀。 另取一离心管,加入LTS1077淋巴细胞分层液,然后用毛细吸管距分层液上1cm处将细胞悬液小心而缓慢地加于其上面,使稀释血液重叠于分层液上。此时稀释后的细胞悬液分离液淋巴细胞体积为:1:1。与用水平离心机以2000 r /min 离心20min,离心结束后,取出离心管,可见管中液体已经分层。 管内可见分为4层:最上层是血浆,含部分血小板:第二层为薄薄的白膜层,主要台单个核细胞,还混杂有少量血小板;第三层为分离液层;第四层为粒细胞及红细胞,红细胞沉于管底,而粒细胞则紧贴在压积红细胞上呈一层很薄的白膜 3. 单个核细胞的提取、洗涤与悬浮、贴壁 吸去最上层的血浆,收集血浆层和淋巴细胞分离液交界面的单个核细胞,尽量全部吸出PBMC。加3~4倍以上体积Hanks或PBS液于所得的单个核细胞中,用毛细吸管轻轻吹判均匀,避免产小气泡,液柱高度不超过离心管的2/3。混匀后离心1500r/min离心 10min,低速离心有利于去除细胞悬液中留存的血小板,去上清液。 注意:还可以先用吸管把雾状层上面的液体吸走,注意不要碰到雾状层,然后在把要的部分慢慢吸出来。第二种方法,比较简单一些。 再用同样洗涤液洗涤细胞2次,1500r/min离心10min,洗去残留的淋巴细胞分离液。再以RPMI-1640 培养基离心洗涤1次,吸尽上清,以充分去除血小板等杂质。按每毫升血液标本加0.2 mL含20%小牛血清的Hank′s液( 或含10%胎牛血清及25 mmol /L
不同培养基对人外周血单核细胞来源树突状细胞发育的影响
文章编号(Article ID):1009-2137(2011)04-1010-05·论著· 不同培养基对人外周血单核细胞来源 树突状细胞发育的影响 陈晨,刘元林,梁晓雷,朱恒,李红,吴英,毛宁,张毅 军事医学科学院基础医学研究所细胞生物学研究室,北京100850 摘要本研究旨在探讨RPMI1640和IMDM两种培养液对诱导人外周血单核细胞向树突状细胞(DC)发育分化的影响。利用GM-CSF+IL-4细胞因子组合,在培养条件一致的前提下,改变培养液种类,通过对成熟、未成熟DC形态观察,用流式细胞术检测细胞表型和吞噬能力、应用混合淋巴细胞反应(MLR)检测其刺激T细胞的增殖能力,用悬浮芯片技术检测DC与同种异体T细胞共培养后上清中所含细胞因子的变化,分析不同培养液对DC功能的影响。研究结果表明,两种培养液培养所得的DC在形态上无显著差异,DC的吞噬能力以及CD14和CD83的表达亦无显著差异,但应用IMDM培养的DC的CD1a表达明显降低,且对T细胞增殖的刺激能力也显著降低;IMDM培养的DC高表达IL-6、IL-8和IL-10,而IL-12的表达则显著降低。结论:不同的培养体系可获得功能不同的DC,IMDM培养的DC可能与免疫耐受有关,本研究结果为DC在临床上的应用提供了新思路。 关键词RPMI1640;IMDM;单核细胞;树突状细胞 中图分类号R329.28文献标识码A Effect of Different Culture Mediums on the Development of Monocyte-derived Dentritic Cells CHEN Chen,LIU Yuan-Lin,LIANG Xiao-Lei,ZHU Heng,LI Hong,WU Ying,MAO Ning,ZHANG Yi Department of Cell Biology,Institute of Basic Medical Sciences,Beijing100850,China Corresponding Author:ZHANG Yi,Professor,Senior Scientific Researcher.Tel:(010)66931320.E-mail:zhangyi@nic.bmi.ac.cn Abstract This study was aimed to investigate the effect of RPMI1640and IMDM on the development of human peripheral blood monocyte-derived dendritic cells.Under the same cytokines and culture conditions,the different medium types were tested,and the morphology of mature and immature dendritic cells was observed by microscopy,the cell phenotype and endocytosis ability were detected by flow cytometry.Furthermore,the immunoregulatory function of various DC was analyzed by mixed lymphocyte reaction(MLR),the expression of cytokine in culture supernatant of MLR system was also analyzed by Bio-plex technology.The results showed that there were no difference in morphology,CD14,CD83 expression and endocytosis ability between IMDM-cultured DC and RPMI-1640medium-cultured DC,but there was a lower expression of CD1a in IMDM-cultured DC.Moreover,DC cultured with IMDM displayed a significant reduction in stimulating T cell proliferation,and highly expressed IL-6,IL-8and IL-10,but low expressed IL-12.It is concluded that the different cultural mediums can induce DC with different functions and DC cultured with IMDM may correlated with induction of immune tolerance.The results of this study will provide a new idea for DC clinical application. Key words RPMI1640;IMDM;monocyte;dentritic cell J Exp Hematol2011;19(4):1010-1014 树突状细胞(dendritic cells,DC)作为一种重要的免疫辅佐细胞,是体内最强的抗原呈递细胞。它最大的特点是能够显著刺激初始型T细胞,激发机体免疫反应,在诱导免疫应答中起关键作用[1]。因此DC在人类重大疾病(如肿瘤、移植免疫等)的发病和治疗中具有重要的研究价值。由于DC在体内含量很低,约占白细胞总数的1%-2%,且缺乏特异性的表面分子加以识别与纯化,因此近年来有关DC种类和功能的研究成为焦点。目前有关DC来2+造血干细胞来源的DC,另一种是外周血单核细胞来源的DC。体外培养DC的培养液为RPMI1640[2,3],结合粒巨噬细胞集落刺激因子(granulocyte-macrophage colony stimu-lating factor,GM-CSF)和白介素4(interleukin-4,IL-4),可诱导获得CD1a+CD83+具有抗原呈递功 基金项目:国家重点基础研究资助项目(编号2010CB833604);国家自然科学基金面上项目(编号31070996 通讯作者:张毅,教授、研究员.电话:(010)66931320.E-mail:zhangyi@nic.bmi.ac.cn 2011-02-14收稿;2011-03-29接受 · 0101 ·中国实验血液学杂志Journal of Experimental Hematology2011;19(4):1010-1014
费森尤斯维修介绍及说明
-_ Wo 名词缩写解释 HF Hemofiltration 血液滤过HDF Hemodiafiltration 血液滤透4008选件 BPM血压监测器 BTM血温监测器 BVM血容量监测器 OCM在线清除率监测 SN-Double Pump单针泵 DIASAFE plus Filter细菌过滤器 ONLINE plus在线血滤系统 Bibag(Standard)干粉 CDS中央供液系统 模组空间 Blood Pump血泵 Heparin Pump肝素泵 Level Detector空气监测器 Bibag/Conc.干粉
T1测试描述,包含错误信息 附注错误说明指定的数值是程序中使用的精确数值 具体数值和公差如下: 1. Arterial pressure 动脉压 3 mmHg/digit 和测定值的± 1位 2. Venous pressure 动脉压 3 mmHg/digit 和测定值的±1位 3. Dialysate Pressure 透析液压 粗略 6.0 mmHg/digit 和测定值的±1位 优良0.5 mmHg/digit 和测定值的±1位 4. CD resolution 0.06 mS/digit 和精确值的± 1位 5. T emperature 温度0.05 °C/digit和精确值的± 1位开始和运行测试的先决条件 错误信息描述 Power failure测试进行中的电源失败. Dialines not conn透析液管路没有插入到冲洗桥中. Shunt Cover open冲洗桥打开状态. Connect Conc.Line Wrong conc. Supply A液连接器在冲洗腔中或者完全没有连接. 该错误信息取决于中央供液系统预选中的设置菜单. Blood Sensed by OD光学探测器检测到系统中有血液. Flow alarm进或出透析器的线路打结, 故障发生在水路中. Water alarm供水中断. 单独测试步骤的描述 Bypass test (旁路测试)........................................................................ ........................................ . (6) Optical detector test (光学探测器测试)................................................................................ (8) Blood system test (血系统测试).............................................................................................. . (10) Venous pressure system test (静脉压系统测试)................................................................. . (13) Air detector test (空气探测器测试) (15) Display test (显示测试) (18) Arterial pressure system test (动脉压系统测试) (20) Battery test (蓄电池测试) (21) Blood leak test (漏血测试) (23) Temperature test (温度测试).................................................................................................... . (25) Negative pressure holding test (负压保持测试) (27) Positive pressure holding test (正压保持测试) (29) UF function test (超滤功能测试) (34) Conductivity test (电导率测试) (37) Diasafe/HDF filter test (细菌过滤器/血液滤透过滤器测试) (39)
鸡外周血淋巴细胞分离液说明书
鸡外周血淋巴细胞分离液说明书 【产品规格】200ml/Kit 【产品组成】 为方便广大用户使用,试剂内容如下: 名称 产品编号 规格200ml 200ml 200ml 1份 A B C D 鸡外周血淋巴细胞分离液样本稀释液(赠品)清洗液(赠品)2010C11192010X1118说明书 【实验前准备】A .适用仪器 最大离心力可达1200g 的水平转子离心机B .耗材 产品名称产品货号339650339651339652339653 产地15ml 离心管散装美国NUNC 15ml 离心管架装美国NUNC 美国NUNC 美国NUNC 50ml 离心管散装50ml 离心管架装无菌胶头滴管或塑料滴管【检验方法】 全过程样本、试剂及实验环境均需在20±2℃的条件下进行。 首先取抗凝血按体积比1:1的比例与样本稀释液(产品编号:2010C1119)混匀,根据稀释后的样本量大小,分以下两种情况: 情况A :稀释后的血液样本量小于5ml 时,实验方法如下: 1.取一支15ml 离心管,先加入与稀释后样本等量的分离液(注:分离液最少不得少于 3ml )。 2.用吸管小心吸取稀释后的血液样本加于分离液液面上,400-500g ,离心20-30min (注: 根据血液样本量确定离心条件,血液样本量越多,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果)。
3.离心后,此时离心管中由上至下分为四层。第一层为血浆层。第二层为环状乳白色淋巴 细胞层。第三层为透明分离液层。第四层为红细胞层。 4.用吸管小心吸取第二层环状乳白色淋巴细胞层到另一15ml离心管中,往所得离心管中 加入10ml清洗液(产品编号:2010X1118),混匀细胞。 5.250g,离心10min。 6.弃上清。 7.用吸管以5ml清洗液(产品编号:2010X1118)重悬所得细胞。 8.250g,离心10min。 9.重复6、7、8,弃上清后以0.5ml后续实验所需相应液体重悬细胞。 情况B:稀释后的血液样本量大于等于5ml时,实验方法如下: 1.取一支适当的离心管,先加入与稀释后样本等量的分离液。 2.将经稀释后的血液样本小心加于分离液之液面上,550-650g(最大离心力可至1000g), 离心20-30min。(注:根据血液样本量确定离心条件,血液量越多,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果。加入血液样本后,样本及分离液总体积不得超过离心管总体积的三分之二)。 3.剩余步骤同“情况A”中步骤3至步骤9。 【注意事项】 1.全过程样本、试剂及实验环境均需在20±2℃的条件下进行。为获得最佳的实验结果,最 好在取血2h内进行实验,血液存放时间越长,细胞分离效果越差。血液放置超过6h后分离效果更差甚至不能达到分离目的。 2.本实验最好不要使用高聚合材质(如聚苯乙烯)的塑料制品,应使用无静电、低静电离 心管及未经碱处理过后的玻璃制品,因为静电作用将导致细胞贴壁、碱处理的玻璃表面会变成毛面,影响细胞分离效果。 3.吸取过多的淋巴细胞层及分离液层会导致分离液交界处的粒细胞被吸出从而使混杂的粒 细胞数量增加。 4.吸取过多的淋巴细胞层上层溶液会导致血浆蛋白及血小板混杂。 5.如所实验后细胞得率或活性过低,请联系上海研谨生物以寻求技术支持帮助。 【储存条件及有效期】 18-25℃保存,有效期2年。本品易感染细菌,需无菌条件操作。无菌条件下操作,启
人外周血淋巴细胞分离液使用说明
人外周血淋巴细胞分离液使用说明 货号:P8610 规格:200ml 保存:室温避光储存,有效期至少2年。 产品简介: 外周血中单个核细胞包括淋巴细胞和单核细胞等细胞,其体积、形态和密度与其他细胞不同,红细胞和粒细胞密度较大,为1.090g/ml左右,而淋巴细胞和单核细胞密度为1.075~1.090g/ml,血小板为1.030~1.035g/ml。为此,将葡聚糖(右旋糖酐)和泛影酸葡甲胺按一定比例混合,调整比重、pH值和渗透压,经过澄清及过滤除菌后制成一种密度在1.077g/ml并且近于等渗的溶液(分层液),经过密度梯度离心使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。 人外周血淋巴细胞分离液为带有乳光或微乳光的注射水溶液,主要组成成份是葡聚糖(右旋糖酐)与泛影酸葡甲胺。适用于从人抗凝血液中分离单个核细胞(主要为淋巴细胞),无菌条件下所分离的细胞可用于免疫学检测。 分离液法说明及图例: 取新鲜抗凝血1ml,与生理盐水1:1混匀后,小心加于2ml细胞分离液之液面上;以400g(约1500转/分,半径15cm水平转子)离心20分钟,此时离心管中由上至下细胞分四层。第一层:为血浆层。第二层:为环状乳白色淋巴细胞层。第三层:为透明分离液层。第四层:为红细胞层。收集第二层细胞放入含生理盐水4-5ml的试管中,充分混匀后,以400g (约1500转/分)离心20分钟。沉淀经2次洗涤后即得所需淋巴细胞。 注:提取率约为80%。
注意事项: A.本分离液要求血液为新鲜抗凝血,避免冷冻和冷藏;在收集血液和分离过程中,应注意无菌操作,避免微生物污染。 B.本实验要求,在正常大气压下,分离液、分离样本以及分离环境温度为20℃±2℃。分离液在低温时呈较高密度,在高温时呈较低密度。细胞分离液从冰箱取出后,不可立即使用,操作前可将样本和分离液置于20℃水浴中复温20分钟以保证分离温度。 C.由于各品牌离心机的性能不同,国内南北地区温度环境和四季的差异,可能影响分离效果,用户可以调节离心转数和离心时间,摸索最佳的分离条件(具体分离条件各实验室自定)。 D.最好使用无静电反应的离心管,推荐使用未经过碱处理的玻璃离心管。 E.最优抗凝剂选择:EDTA、枸橼酸、肝素。应注意在血液稀释过程中应去除抗凝剂体积。 产品性能指标: 密度 1.077±0.001g/ml pH7.0-7.5
德国费森尤斯B血液透析机
德国费森尤斯B血液透 析机 集团企业公司编码:(LL3698-KKI1269-TM2483-LUI12689-ITT289-
德国费森尤斯4008B血液透析机 一、产品描述: 1、能够显示标准的治疗和操作过程、能够显示各种其他信息及指令。 2、具有碳酸盐,序贯透析、双针的透析功能。 3、透析液多种配方预设,可根据病人情况随意调整。 4、具有开机完备的自检功能,安全检测功能和报警功能。 5、具有空气检测器及漏血(破膜)监测器。 6、具有自动化操作程序:自动预冲、自动回血、自动复位,消毒后自动关机。 7、具有动脉压监测、静脉压监测、跨膜压监测功能。 8、具有血泵、肝素泵,血泵管径可调,方便各种管路的使用。肝素泵可选多种尺寸的注射器,可设定关机时间。 9、具有多种化学消毒方式,主要模式为热化学消毒。消毒、除钙一次完成,要求日常消毒花费时间不超过35分钟。※ 10、具有内置不间断电源,停电后可保存病人资料,保证血泵运转15分钟以上。 11、耗材(透析液、管路)采用通用型设计,可使用任何厂家的耗材。 12、具有自动监测电导度的功能。 13、具有压力衡定测试功能:每10-15分钟进行一次,即使在高通量透析时也能够保证安全性。※
14、可进行可调钠曲线治疗,具有多种可选择性/梯级自动调整程序,可实现个体化透析并保证病人的安全。※ 15、可进行曲线治疗模式进行超滤,具有多种可选择的线性/梯级自动调整程序,可实现个体化透析并保证病人安全,并可同时与可调钠曲线治疗模式联合使用。※ 16、可实现软硬件升级,安全水电分离设计,单独水路控制系统以增加安全性。※ 二、技术参数: 1、RO水供应:水路设计无死腔,供水条件0.07-0.3MP 2、血流量控制范围0-500ml/min 3、肝素泵注入速度0-10ml之间可调,可显示累计注入量,可设定肝素泵体提前停止时间。 4、透析液配比:开环式直接容量控制模式※ 5、超滤控制:容量控制,无死腔设计。 5.1、超滤量0-10ml\min之间可调 5.2、超滤率0-4ml\h精确度小于已选择的超滤率的±1% 5.3、显示参数,总的超滤量、时间、超滤率、已超率出的体积。 6、安全监测系统 6.1、漏血检测灵敏度0.5ml\min 6.2、气泡检测灵敏度0.02ml 6.3、静脉压监测-60-+520mmHg 6.4、动脉压监测-300-+280mmHg
