酵母生长曲线
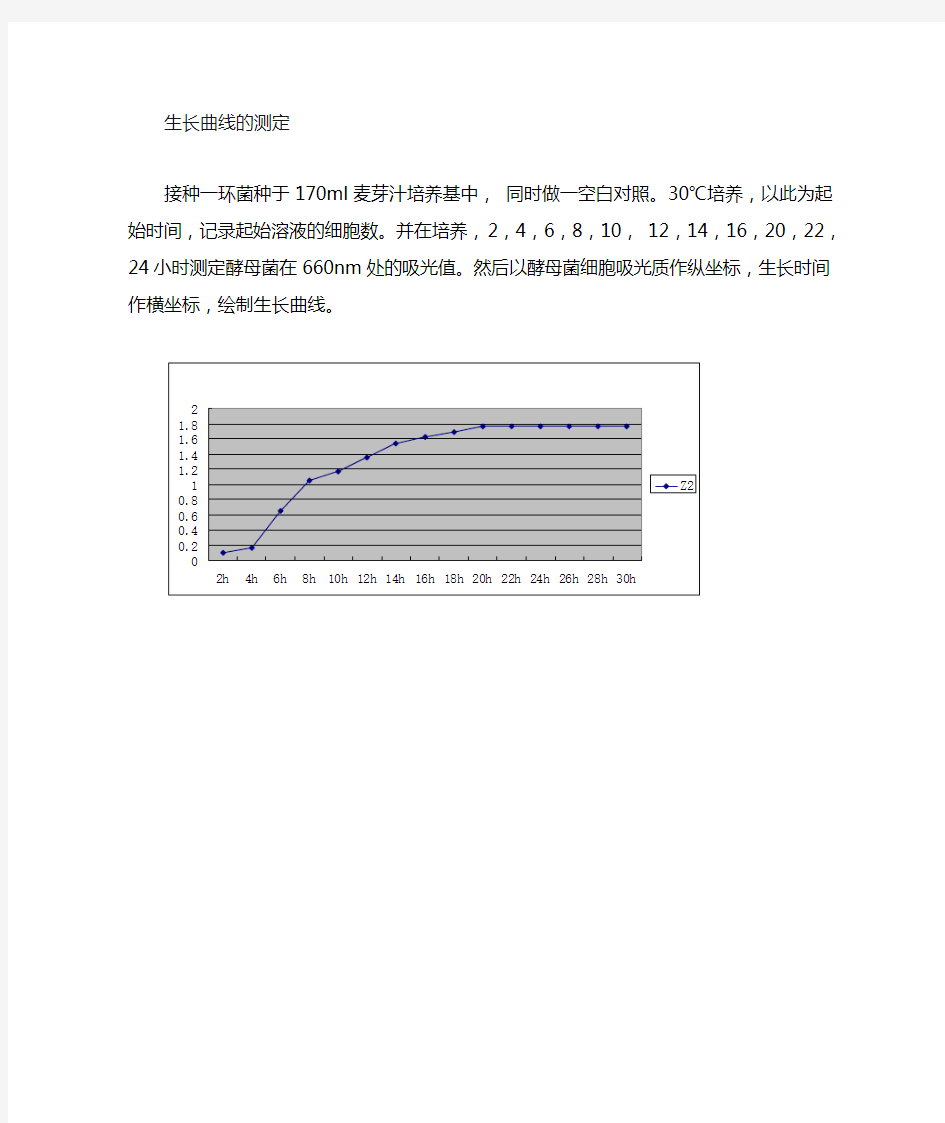
生长曲线的测定
接种一环菌种于170ml麦芽汁培养基中,同时做一空白对照。30℃培养,以此为起始时间,记录起始溶液的细胞数。并在培养,2,4,6,8,10, 12,14,16,20,22,24小时测定酵母菌在660nm处的吸光值。然后以酵母菌细胞吸光质作纵坐标,生长时间作横坐标,绘制生长曲线。
酵母发展和现状
酵母的发展和现状 一、活性酵母在国民经济中的作用 活性酵母: 是指以粮食、糖类等为原料,利用生物工程技术、发酵通风培养得到的、具有发酵活性的纯微生物制品。 1. 食用酵母 食用酵母一般是指用发酵法生产的供人类食用或食品加工用的活性酵母制品。产品含有丰富的蛋白质、B 族维生素、脂肪、核酸、固醇和多种酶类等物质,同时又具有将糖类发酵产生酒精和CO2的特性。 从酵母所含的蛋白质量来衡量,它高于大豆,为瘦猪肉、牛肉、鱼类鸡蛋的2 倍多。 2. 酵母抽提物 酵母抽提物(yeast extract ) ,又称为酵母浸出物。它是将具有活性的酵母细胞经过加工得到,是酵母细胞内物质的浓缩物,产品本身已不具备发酵活性。 国内酵母抽提物的商品名称有酵母精、酵母味素和酵母调味料等。 3. 药用酵母 一般是将酵母制成酵母片或酵母粉供人摄取。如在酵母培养过程中加人微量元素制成硒酵母、铬酵母等特种酵母制品,用于补充不同人群微量元素的不足,以预防一些特殊病症的发生。 如含硒酵母用于治疗克山病和大骨节病,并有一定的防止细胞衰老的作用;含铬酵母可用于治疗糖尿病等。 4 饲料酵母 饲料酵母是将培养的酵母,或从酿酒过程中回收的废酵母经过干燥制成的粉末状或颗粒状产品,一般不具备发酵活性。 它含有丰富的蛋白质(40 %一48 % )、B 族维生素、氨基酸等物质,广泛用作动物饲料的蛋白质补充剂。 二、活性酵母发展史 从酵母在人类历史的发展过程中的作用来看,可以分为3 个阶段: 1. 利用啤酒和酒精生产副产物―废酵母的阶段
1781 年,荷兰人用离心机将上面发酵啤酒中的酵母除去酒花苦味、采用螺旋压榨机压干的块状产品,第一次在市场销售。产品被称为压榨酵母(compressed yeast )或面包鲜酵母,这是最早出现的商品酵母。 2. 形成专业化商品活性酵母生产的阶段 从19 世纪末至20 世纪中期约50 年期间,压榨酵母的生产在欧洲得到了快速的发展,生产工艺和生产装备逐步完善,生产原料从粮食改为废糖蜜,使面包酵母的生产水平大幅度提高。 3 活性干酵母产业的发展 最早出现的活性干酵母(active dry yeast , ADY )起源于19 世纪上半世纪。 20 世纪60 年代末,荷兰Gist 公司首先开发成功并生产出发酵活性高、保质期长、可直接与面粉混合制成面团的干酵母,产品被称为高活性干酵母(high active dry yeast 或instant active dry yeast ) ,发酵活性一般可以保持在1 一2 年。 三、酵母生长与生产 1 面包酵母的生长特性和要求 面包酵母(顾名思义是制造面包用的)和酿造酵母(造酒用的)在酵母分类中都划分在一种,即Sacchromyces cerevisiae。 酵母的自然的生境(habitat)大都是含糖丰富的,通气不良的中温场所。通常在花的蜜腺,水果,甘蔗表面等地方。它们以发酵的方式生活,即由糖产生乙醇和CO2,可以用下式表述: C6H12O6→2C2H5OH+2CO2 由于酵母菌体是活性干酵母的生产原材料,因此活性干酵母工厂必须对酵母菌体的生产倍加注意。 酵母的耐干性或对制造活性干酵母时所施的烘干工艺的配套性和酵母细胞内所含的海藻糖的量呈正相关,因此菌种的选择至关重要,如中科院微生物所的X 8、美国ATCC的7752菌株都是可用的优良菌株,而且极易由商品自行分得。 2 酵母生长的动态 由酵母的生长曲线(图19-1)可以看到酵母的细胞增殖主要是在对数期完成的。而且酵母的培养工艺要求接种到生产罐的酵母立即进入对数增殖状态,即在生产罐以前就完成了迟缓期。
实验七 酵母菌细胞大小的测定
实验七酵母菌细胞大小的测定 一、实验目的 1.了解测量微生物大小的原理; 2.学习并掌握接目测微尺的校正方法及微生物大小的测定方法,增强微生物细胞大小的感 性认识。 二、实验材料 1.菌种:啤酒酵母(Saccharomyces cerevisiae)菌悬液,枯草芽孢杆菌(Bacillus subtilis) 染色标本片。 2.仪器或其他用具:显微镜,接目测微尺,镜台测微尺,载玻片,盖玻片 三、实验原理 微生物细胞的大小是微生物基本的形态特征,也是分类鉴定的依据之一。微生物细胞个体较小,需要在显微镜下借助于特殊的测量工具—测微尺来测定其大小。测微尺包括镜台测微尺和接目测微尺。 镜台测微尺是一张中央部分刻有精确等分线的载玻片,专门用于校定接目镜测微尺每小格的相对长度。通常,刻度的总长是1mm,被等分为100格,每格0.01mm(即10μm)。镜台测微尺不直接用来测量细胞的大小。 接目测微尺是一块可以放入接目镜的圆形小玻片,其中央有精确的等分刻度,有等分为50小格和100小格的两种。在测量时将接目测微尺放在目镜的隔板上,即可来测量经显微镜放大后的细胞物象。也有专用的目镜,里面已经安放好了接目测微尺。 由于接目测微尺所测量的是经显微镜放大后的细胞物象,因此,在不同的显微镜或不同的目镜和物镜组合放大倍数不同,接目镜测微尺每一小格所代表的实际长度也不一样。所以,在用接目测微尺测量微生物大小之前,必须先用镜台测微尺校定接目镜测微尺,以确定该显微镜在特定放大倍数的目镜和物镜下,接目镜测微尺每一小格所代表的实际长度,然后根据微生物细胞相当于的接目镜测微尺格数,计算出微生物细胞的实际大小。 图7-1测微尺的安装 图7-2目镜测微尺图7-3用镜台测微尺校正接目测微尺
微生物实验报告:测定细菌生长曲线
测定细菌生长曲线 一、实验目的 1.了解细菌生长曲线特征,测定细菌繁殖的代时; 2.学习液体培养基的配制以及接种方法; 3.反复练习无菌操作技术; 4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同; 5.掌握利用细菌悬液混浊度间接测定细菌生长的方法; 二、实验原理 将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。生长曲线可表示细菌从开始生长到死亡的的全过程动态。不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。 测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。 从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为: G=(t2-t1)/[(lgW1-lgW2)/lg2] 式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。 三、实验器材 大肠杆菌,枯草杆菌菌液及平板; 培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基; 取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计; 四、实验步骤 1.活化菌种 将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块; 2.接种 6人大组分为3个小组,按表1接种。 表1.各培养基接入菌种及培养条件
白酒的酿造发酵原理
白酒的酿造发酵原理 酒的酿造原理 酒的重要成分是醇,醇分乙醇和甲醇。甲醇有毒性。乙醇无毒性,但能刺激人的神经和血液循环,血 液中乙醇含量超出一定比例时,也会引起中毒。 乙醇的重要物理特征是:在常温下呈液态,无色透明,易燃,易挥发,沸点与汽化点是78.3 °c,冰点 为-114°c,溶于水。细菌在乙醇内不易繁殖。 乙醇在酒中的含量用酒精度数来表示。在国际酿酒业中,规定在温度为摄氏20°c 时,乙醇含量的百分 比为酒精度数,简称“酒度”。例如:某种酒在20°c 时含乙醇 26%,则酒精度数为 26 度。 酒的酿造过程分为发酵,蒸馏两大部分。发酵指的是发酵过程,发酵需要糖分和酶。糖分包括葡萄糖 和麦芽糖,果汁中通常含有大量的葡萄糖,可以直接发酵。谷物中含有大量的淀粉,淀粉进行工艺处理可 以生成麦芽糖。 糖分与酶发生化学反应,在一定的温度下,生成乙醇和二氧化碳,这个反应过程称为酒精发酵。酒精 发酵不需氧气也可以进行,大约每 100 克的糖分可产生 51 克酒精。酒精发酵的方法很多,但大多数都是在特制 的容器中进行的,例如缸,坛,桶等。 蒸馏是酿酒的重要过程,发酵只能使酒精含量达到 15%左右,再提纯或提高酒度就需要用蒸馏了。在经过 发酵的酒液中,不但含有酒精,还有原材料物质和一部分香型物质,但人们只希望获得含水酒精。酒 精的汽化温度为78.3 °c,只要将发酵过的原料加热到这个温度,就能获得气体酒精,冷却后就是液体酒精。 在蒸馏过程中,由于温度的作用,水分和其它杂质也会掺在酒精中。随着温度的变化,掺杂的情况也会 变化,因而形成不同质量的酒精液体。为了保证酒的质量,酿酒师通常根据不同的温度有选择地取酒。 白酒酿酒基本原理和过程主要包括:酒精发酵、淀粉糖化、制曲、原料处理、蒸馏取酒、老熟陈酿、 勾兑调味等。 (1)酒精发酵 酒精发酵是酿酒的主要阶段,糖质原料如水果、糖蜜等,其本身含有丰富的葡萄糖、果糖、蔗糖、麦 芽糖等成分,经酵母或细菌等微生物的作用可直接转变为酒精。 酒精发酵过程是一个非常复杂的生化过程,有一系列连续反应并随之产生许多中间产物,其中大约有 30多种化学反应,需要一系列酶的参加。酒精是发酵过程的主要产物。除酒精之外,被酵母菌等微生物合 成的其他物质及糖质原料中的固有成分如芳香化合物、有机酸、单宁、维生素、矿物质、盐、酯类等往往 决定了酒的品质和风格。 酒精发酵过程中产生的二氧化碳会增加发酵温度,因此必须合理控制发酵的温度,当发酵温度高于30~34℃, 酵母菌就会被杀死而停止发酵。除糖质原料本身含有的酵母之外,还可以使用人工培养的酵母发酵, 所以酒的品质因使用酵母等微生物的不同而各具风味和特色。 (2)淀粉糖化
细菌生长曲线测定方案
细菌生长曲线的测定 1 目的 1.1 了解细菌生长曲线特点及测定原理 1.2 学习用比浊法测定细菌的生长曲线 2 原理 将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。 测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。 3 材料 3.1菌种 某细菌 3.2培养基 液体培养基 3.3 仪器和器具 721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。 4 流程 种子液→标记→接种→培养→测定 5 方法 5.1种子液制备 取细菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液中(液体培养基接种法),静止培养24h作种子培养液。 5.2标记编号 取盛有50mL无菌肉膏蛋白胨培养液的250mL三角瓶11个,分别编号为0、1.5、3、4、6、8、10、12、14、16、20h。
5.3接种培养 用2mL无菌吸管分别准确吸取2mL种子液加入已编号的11个三角瓶中,于37℃下振荡培养。然后分别按对应时间将三角瓶取出,立即放冰箱中贮存,待培养结束时一同测定OD 值。 5.4生长量测定 将未接种的肉膏蛋白胨培养基(空白对照)倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在0.10.~0.65以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。 6 结果 6.1 将测定的OD值填入下表: 时间(h) 对照 0 1.5 3 4 6 8 10 12 14 16 20光密度值(OD600) 0 6.2 以上述表格中的时间为横坐标,OD600 值为纵坐标,绘制细菌的生长曲线。 Point: 1液体培养基的配制以及接种方法 2无菌操作技术 3直接计数法
温度对酿酒酵母的影响
温度对酿酒酵母的影响 酿酒是一个复杂的生化反应过程。影响微生物生长发育的环境因素很多,常见的有温度、pH、氧气、搅拌等环境因素。其中温度具有极其重要的作用。本实验探讨温度对酵母酿酒产酒量的影响,检验不同温度下酿酒酵母的出酒率。结果表明:酵母菌在28℃出酒率最高。低温下发酵品质好。 酿酒过程实质上是一个微生物摄取原料中的养分,通过体内的特定酶系,经过复杂的生化反应,把原料转化为酒精的过程。工业上主要是由薯类和谷类以及野生植物原料经过蒸煮,淀粉糊化成为溶解状态,再加入一定量的糖化剂,使溶解状态的淀粉,变为酵母能够发酵的糖类(糖化醪)。这一个由淀粉转变为糖的过程,称为糖化过程。糖化过程是由淀粉酶或酸水解的作用,使淀粉糖化转变为可发酵性糖。最后由酿酒酵母发酵产生酒精。生产上常用的糖化剂有麦芽和酒曲两种。我国普遍使用酒曲作为糖化剂。酒精是由微生物通过糖酵解(EMP)途径将葡萄糖分解而产生,是酵母菌的代谢产物。影响微生物生长的因素很多,其中环境因素对微生物的生长影响比较大。在生产上最常遇到的是温度、水分、氧气、pH、某些重金属离子、乙醇及发酵副产物等的影响。温度是影响微生物生长和存活的主要环境因素之一。对发酵的影响很大。温度对微生物生长发酵的影响具体表现在:①影响酶的活性。每种酶都有最适宜的酶促反应温度,温度的变化影响着酶促反应率,最终影响细胞物质合成。②影响细胞质膜的流动性。温度高细胞质流动性大,有利于物质的运输;温度低细胞质的流动性降低,不利于物质的运输。因此温度影响微生物对营养物质的吸收和代谢产物的分泌和运输。③影响物质的溶解度。物质只有溶于水才能被微生物吸收或分泌,除了气体外,物质随着温度的升高而溶解度增加,温度的降低,物质的溶解度也降低,最终影响微生物的生长。酿酒酵母是一种嗜温性微生物,它的最低温度是1—3℃,最高温度是54℃(几乎致死)。本实验目的在于探讨温度对酵母酿酒产酒量的影响,检验不同温度下酿酒酵母的出酒率。 可以看出,温度不仅影响着酒的颜色,还影响着酵母菌的酶促反应,最终影响代谢产物的类型及产量。温度高,颜色深;温度低,颜色浅。温度过高或过低,糖发酵不完全,糖度高,酒精相对含量少;温度在26℃~30℃之间,特别是在28℃,糖度低,酒精相对含量高。原因是温度对酶的结构和组成有较大的影响,它关系到代谢途径和代谢产物的生物合成。因此,根据不同的需要及发酵微生物的不同,可以通过调节温度来得出所需要代谢产物或提高产量。 有研究表明低温发酵最好。因为发酵过程比较缓慢,代谢产物反应完全、彻底。营养成分也发酵完全、彻底,脂化时间充分,营养价值高,有利于口感和品质的改善。这与本实验结果相一致,低温酿出来的酒, 清澈透明,香味浓溢,口感好。若要求酒质和口感更佳,发酵时间要延长到20~30天,因此低温发酵周期长。工业上常要求在高温下发酵,在高温下发酵具有反应迅速、发酵快、经济利益高等优点。但也影响了酒的口感和品质。寻求发酵周期短、经济利益高且酒的口感和品质好的最适条件,还有待进一步研究。
各种菌类的生长条件
霉菌应该是喜好潮湿,好氧,适宜生长温度25-30℃ 霉菌形成分枝菌丝的真菌的统称。不是分类学的名词,在分类上属于真菌门的各个亚门。构成霉菌体的基本单位称为菌丝,呈长管状,宽度2~10微米,可不断自前端生长并分枝。无隔或有隔,具1至多个细胞核。在固体基质上生长时,部分菌丝深入基质吸收养料,称为基质菌丝或营养菌丝;向空中伸展的称气生菌丝,可进一步发育为繁殖菌丝,产生孢子。大量菌丝交织成绒毛状、絮状或网状等,称为菌丝体。菌丝体常呈白色、褐色、灰色,或呈鲜艳的颜色,有的可产生色素使基质着色。霉菌繁殖迅速,常造成食品、用具大量霉腐变质,但许多有益种类已被广泛应用,是人类实践活动中最早利用和认识的一类微生物。 霉菌是丝状真菌的俗称,意即“发霉的真菌”,它们往往能形成分枝繁茂的菌丝体,但又不象蘑菇那样产生大型的子实体。在潮湿温暖的地方,很多物品上长出一些肉眼可见的绒毛状、絮状或蛛网状的菌落,那就是霉菌。 霉菌的菌丝。构成霉菌营养体的基本单位是菌丝。菌丝是一种管状的细丝,把它放在显微镜下观察,很像一根透明胶管,它的直径一般为3-10微米,比细菌和放线菌的细胞约粗几倍到几十倍。菌丝可伸长并产生分枝,许多分枝的菌丝相互交织在一起,就叫菌丝体。 根据菌丝中是否存在隔膜,可把霉菌菌丝分成两种类型:无隔膜菌丝和有隔膜菌丝。无隔膜菌丝中无隔膜,整团菌丝体就是一个单细胞,其中含有多个细胞核。这是低等真菌所具有的菌丝类型。有隔膜菌丝中有隔膜,被隔膜隔开的一段菌丝就是一个细胞,菌丝体由很多个细胞组成,每个细胞内有1个或多个细胞核。在隔膜上有1至多个小孔,使细胞之间的细胞质和营养物质可以相互沟通。这是高等真菌所具有的菌丝类型。 为适应不同的环境条件和更有效地摄取营养满足生长发育的需要,许多霉菌的菌丝可以分化成一些特殊的形态和组织,这种特化的形态称为菌丝变态。 酵母菌是一些单细胞真菌,并非系统演化分类的单元。目前已知有1000多种酵母,根据酵母菌产生孢子(子囊孢子和担孢子)的能力,可将酵母分成三类:形成孢子的株系属于子囊菌和担子菌。不形成孢子但主要通过芽殖来繁殖的称为不完全真菌,或者叫“假酵母”。目前已知大部分酵母被分类到子囊菌门。酵母菌主要的生长环境是潮湿或液态环境,有些酵母菌也会生存在生物体内。 生理 酵母营专性或兼性好氧生活,目前未知专性厌氧的酵母。在缺乏氧气时,发酵型的酵母通过将糖类转化成为二氧化碳和乙醇来获取能量。 C6H12O6(葡萄糖)→2C2H5OH + 2CO2 在酿酒过程中,乙醇被保留下来;在烤面包或蒸馒头的过程中,二氧化碳将面团发起,而酒精则挥发。 生殖 酵母可以通过出芽进行无性生殖,也可以通过形成子囊孢子进行有性生殖。无性生殖即在环境条件适合时,从母细胞上长出一个芽,逐渐长到成熟大小后与母体分离。在营养状况不好时,一些可进行有性生殖的酵母会形成孢子,在条件适合时再萌发。一些酵母,如假丝酵母(或称念珠菌,Candida)不能进行无性繁殖。 酵母菌的生长条件: 营养:酵母菌同其它活的有机体一样需要相似的营养物质,象细菌一样它有一套胞内和胞外酶系统,用以
霉菌与酵母菌计数方法(2015版药典)
霉菌与酵母菌计数方法 1试验菌液得制备与使用(以白色念珠菌为示例) 白色念珠菌(0)代 ↓ 传代培养 ↓ 实验菌液得制备:沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养 基,培养温度20~25℃,培养时间2~3天 ↓ 计数培养基适用性检查:胰酪大豆胨琼脂培养基,培养温度30~35℃, 培养时间不超过5天,接种量不大于100cfu ↓ 计数方法适用性试验:胰酪大豆胨琼脂培养基(MPN法不适用),培养温 度30~35℃,培养时间不超过5天,接种量不大于100cfu 注:当需用玫瑰红钠琼脂培养基测定霉菌与酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基 1.1菌种 试验用菌株得传代次数不得超过5代(从菌种保藏中心获得得干燥菌种为第0代),并采用适宜得菌种保藏技术进行保存,以保证试验菌株得生物学特性。 1。2菌液制备(按表1规定程序培养各试验菌株) 取白色念珠菌得新鲜培养物 ↓ 用pH7、0无菌氯化钠—蛋白胨缓冲液或0、9%无菌氯化钠溶液制成适宜浓度得菌悬液 取黑曲霉得新鲜培养物 ↓ 加入3~5ml含0.05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0、9%无 菌氯化钠溶液,将孢子洗脱 ↓ 采用适宜得方法吸出孢子悬液至无菌试管内 ↓ 用含0。05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0。9%无菌氯 化钠溶液制成适宜浓度得黑曲霉孢子悬液 菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用、稳定得黑曲霉孢子悬液可保存在2~8℃,在验证过得贮存期内使用、
1。3阴性对照 为确认试验条件就是否符合要求,应进行阴性对照试验,阴性对照试验应无菌生长。如阴性对照有菌生长,应进行偏差调查、 2、培养基适用性检查 按表1规定,接种不大于100cfu得菌液至沙氏葡萄糖琼脂培养基平板 ↓ 置表1规定条件下培养 ↓ 每一试验菌株平行制备2管或2个平皿 ↓ 同时,用相应得对照培养基替代被检培养基进行上述试验 ↓ 被检固体培养基上得菌落平均数与对照培养基上得菌落平均数得比值应在0。5-2范围内,且菌落形态大小应与对照培养基上得菌落一致;被检液体培养基管与对照培养基管比较,试验 菌应生长良好 3计数方法适用性试验 供试液制备:水不溶性非油脂类供试品 ↓ 取供试品,用pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7。2磷酸盐缓冲液,或胰酪大豆胨 液体培养基 ↓ 制备成1:10供试液。 ↓ 若需要,调节供试液pH值至6~8。必要时,用同一稀释液将供试液进一步10倍系列稀释、 ⒉接种与稀释 所加菌液得体积应不超过供试液体积得1%、为确认供试品中得微生物能被充分检出,首先应选择最低稀释级得供试液进行计数方法适用性试验。
酿酒酵母
酿酒酵母 酿酒酵母(saccharomyces cerevisiae)又称麫包酵母或者出芽酵母。 形态及大小:是一种直径为5微米 所属分类 域:真核域(Eukarya) 界:真菌界(Fungi) 门:子囊菌门(Ascomycota) 纲:半子囊菌纲(Hemiascomycetes) 目:酵母目(Saccharomycetales) 科:酵母科(Saccharomycetaceae) 属:酵母属(Saccharomyces) 种:酿酒酵母(S. cerevisiae) 酿酒酵母介绍 酿酒酵母(Saccharomyces cerevisiae),又称麫包酵母或者出芽酵母。酿酒酵母是与人类关系最广泛的一种酵母,不仅因为传统上它用于制作面包和馒头等食品及酿酒,在现代分子和细胞生物学中用作真核模式生物,其作用相当于原核的模式生物大肠杆菌。酿酒酵母是发酵中最常用的生物种类。酿酒酵母的细胞为球形或者卵形,直径5–10 μm。其繁殖的方法为出芽生殖。 酵母生活史 酵母的细胞有两种生活形态,单倍体和二倍体。单倍体的生活史较简单,通过有丝分裂繁殖。在环境压力较大时通常则死亡。二倍体细胞(酵母的优势形态)也通过简单的有丝分裂繁殖,但在外界条件不佳时能够进入减数分裂,生成一系列单倍体的孢子。单倍体可以交配,重新形成二倍体。酵母有两种交配类型,称作a和α,是一种原始的性别分化,因此很有研究价值。 酿酒酵母基因组 酿酒酵母是第一个完成基因组测序的真核生物,测序工作于1996年完成。 酿酒酵母的基因组包含大约1200万碱基对,分成16组染色体,共有6275个基因,其中可能约有5800个真正具有功能。据估计其基因约有23%与人类同源。酵母基因组数据库包含有酵母基因组的详细注释(annotation),是研究真核细胞遗传学和生理学的重要工具。另一个重要的酿酒酵母数据库[1]由慕尼黑蛋白质序列信息中心维护。 在科学中的作用 因为酿酒酵母与同为真核生物的动物和植物细胞具有很多相同的结构,又容易培养,酵母被用作研究真核生物的模式生物,也是目前被人们了解最多的生物之一。在人体中重要的蛋白质很多都是在酵母中先被发现其同源物的,其中包括有关细
(完整版)酵母菌实验
7.2 用酵母菌研究一个种群 实验原理 酵母菌繁殖快,是单细胞个体,常被用来研究种群。我们将观察在试管内肉汤培养基中的酵母菌种群的生长情况。 酵母菌的种群属于封闭种群类型。在自然条件下,开放种群的大小会随着生物个体的迁入或迁出而变大变小。在开放种群中,各种物质可通过种群进行循环。但在封闭种群中,情况有些不同,测定封闭种群的增长率比开放种群的增长率要容易得多。用浊度计测定培养液的浑浊度,就能知道酵母菌种群是如何随时间而发生变化的。通过细胞计数就可以知道酵母菌细胞的数量变化与浑浊度之间的关系。 目的要求 通过实验观察,说明种群是如何随时间而发生变化的。 学习酵母菌计数的方法以及取样法。 材料用具(2人一组) 2副护目镜;2支16mm×150mm有螺旋盖的试管,每支盛有10ml无菌肉汤培养液;2支18mm×150mm试管;盖玻片;有标尺的载玻片(2mm×2mm方格);有刻度的吸量管(1ml);滴管;比浊计或比色计;显微镜;试管架;玻璃标记笔;米尺;4张半对数坐标纸。 实验方法 请仔细阅读实验并提出3种假设,说明种群如何随时间而发生变化。把这些假设记在你的记录本上,并用你在实验中收集的数据对它们做出评价。 本实验采用的方法叫取样法—通过对样品中的酵母菌计数以估计试管中的种群大小。还可根据试管中培养液的浑浊度获得这一估算值。 实验步骤 实验从第0天—第7天。 (一)第0天: 1、在你的记录本上画好与表2.1类似的数据表。 2、用标记笔把两支螺旋盖的试管标上A和B,并在每支试管上标上你的组别。 表2.1酵母菌细胞的数目
3、教师将把0.1ml酵母菌贮存用培养物注入试管A中,轻轻倒转试管几次使酵母细胞分布均匀。试管B不加任何东西。将试管盖稍微拧松并将两支试管放在教师指定的地方。设置试管B的目的是什么? 4、试管A中为刚开始增长的酵母菌新种群。就下周期间你认为可能会发生的变化评论你的假设。 5、为了确定酵母菌种群的增长速率,必须在实验过程中对酵母菌进行计数。拧紧试管盖将试管A轻轻倒转几次使酵母菌细胞分布均匀,然后用滴管从试管A中取出一滴培养液移到载玻片方格上,小心盖上盖玻片,不要有气泡。在显微镜高倍镜下进行镜检。 注意:观察酵母菌细胞时光线不要太强。 6、为了计算中央方格内酵母菌细胞的数目,先将方格左上部置于高倍镜下并记下酵母菌细胞数目,接着按顺时针方向分别统计方格右上部、右下部和左下部的酵母菌数,直到把整个方格内全部酵母菌数量统计完为止。要确保你所观察到的是酵母菌细胞而不是其他的什么东西。酵母菌细胞常常粘附在一起,但可以数出任何一个分离团块中的每一个细胞,酵母菌出芽时的芽体也应算为独立的个体。 7、至少要数300个细胞,如果少于300就应在原方格周围的另一方格内进行计数,直到达到300为止。用细胞数除以方格数即可得到每方格内的平均数。 8、为了知道每立方厘米(cm3)体积(1ml)内的细胞数,可用计得的细胞数乘以2500。这是因为每方格的面积是2mm×2mm,盖玻片下的培养液厚度是0.1mm,所以每方格的体积就是 2mm×2mm×0.1mm=0.4mm3,而1cm3=1000mm3,因此:细胞数 1000mm32500×细胞数 为了知道试管A中的细胞总数,可将最终获得的细胞总数乘以10,因为试管A中含有10ml 培养液。 9、让同组的另一人对一个新样品做同样的工作,将结果写在记录本上并计算两次计数的平均值。把第0天观察到的种群大小填写在你的数据表中。 10、对试管B重复步骤5—9。 11、使用比浊计测定两试管的浑浊度。算出读数的平均值,并将第0天的平均值写入你的资料表和班长的表格中。当酵母菌种群增长时你预测会出现什么情况?把你的预测写入记录本。 (二)第1—7天 13、多次倒转试管A使酵母菌细胞分布均匀,测定浑浊度,将第1天的平均值记在你的资料表和班长的表格中,对试管B重复同样的工作。 14、分别使用试管A和试管B中的一滴培养液重复步骤5—9的计数工作,并将第1天的结果写入你的资料表和班长的表格中。
大肠杆菌生长曲线实验报告
一、实验方案设计
实验数据原始记录: 随时间的变化大肠杆菌液吸光度的数据(括号内数字表示稀释倍数)
3.5 曲线图时间/h 0 1 3.75 6 7 8 8.5 9 10 OD600 0.073 0.073 0.079 0.282 0.456 1.105 1.168 1.662 2.284 时间/h 11 12 13 14 18.33 20.5 23 24 OD b。 2.564 2.016 3.020 2.605 3.315 2.860 3.024 3.324 时间/h 0 1 3.75 6 7 8 8.5 9 10 11 13 18.33 20.5 0应0 0.073 0.073 0.079 0.282 0.456 1.105 1.168 1.662 2.284 2.564 3.020 3.315 2.86 时间/h 0 1 3.75 6 7 8 8.5 9 10 11 OD6b0 0.073 0.073 0.079 0.282 0.456 1.105 1.168 1.662 2.284 2.564 前小时的大肠杆菌的吸光度数据 六?参考文献 前12小时的大肠杆菌的生长曲线图 [1] .牛天贵?食品微生物学实验技术?第1版?北京:科学出版社,2010. [2] .杨革.微生物学实验教程.第2版.北京:科学出版社,2010. [3] .何国庆,贾英民,丁立孝等.食品微生物学.第2版.北京:中国农业大学出版社,2009. [4] .周德庆,胡宝龙.微生物学实验教程.第2版.北京:高等教育出版社,2006.
七?教师对实验方案设计的意见 签名: 年月日 、实验报告 宴验现象验现象、实验结果的分析及其结论 分随着培养时间的增加,培养基里的液体变得越来越混浊,所散发出来的味道也越来越浓,味道很难闻。实验结果随着培养时间的增加,培养基里的液体变得越来越混浊,所散发出来的味道也越来越浓,味道大肠杆菌难培养基因为大肠杆菌增长迅越来越后来数量达一定数量后此时培养基内的营养物质已被进行营尽,养和空间肠杆菌进行营些大肠杆间的死亡争,最后数量肠杆菌死亡,直最后数量不断减尙,。直至变为0。 ②通过对大肠杆菌生长曲线的测定,了解了细菌生长 的特点,是:刚开始时细菌缓慢增长,后来增 长迅速,呈“ J”型,最后细菌生长缓慢,数量达到顶峰,在一段时间内保持不变。 因实验测量的时间不够合理等各种因素,因此用原始数据绘制出来的大肠杆菌的生长曲线图不够有规律,经修正后生长曲线比较好。 结论: 细菌的生长曲线分为延缓期、生长期、稳定期和衰亡期。体内及自然界细菌的生长繁殖受机体 免疫因素和环境因素的多方面影响,不会出现象培养基中那样典型的生长曲线。掌握细菌生长规律,可有目的地研究控制病原菌的生长,发现和培养对人类有用的细菌。 这4个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所不同。因此通过测定微生物的生长曲线,可了解细菌的生长规律,对于科研和生产都具有重要的指导意义。
细菌生长曲线的测定实验报告
竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告 篇一:细菌生长曲线 实验九测定细菌生长曲线 [实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。3.学习液体种子和固体种子的不同接种方法和注意事项。4.利用细菌悬液浑浊度间接测定细菌生长。 [仪器和材料] 1.实验材料 (1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。 (2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。 2.实验仪器 取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml
玻璃或塑料比色皿4个,共用参比杯一个。 [实验原理] 将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。 单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。 生长曲线可表示细菌从开始生长到死亡的全过程动态。不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。 从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以g表示。其计算公式为;
细菌生长曲线之测定
實驗六細菌生長曲線之測定 ◎ Exp 11. Turbidity of bacteria 一、目的: 在進行細菌生長曲線之測定前,必須先了解 U-2001 Spectropho- tometer 操作方法,才能將細菌的數量以吸光值的方式表示出來。二、原理: 請詳讀整理 p. 90-92,學會調整 Optical density (O.D.) 【Exp 13.會用到】。 三、器材: 1. culture:(每組) 24 hr Escherichia coli (broth) 2. medium: (每組) Nutrient broth 3. equipment : 1 ml pipette,pipette aid,cuvette,拭鏡紙,廢菌液杯,裝蒸餾水的洗 瓶,滅菌空試管,U-2001 Spectrophotometer,振盪器。 四、實驗步驟 ※由助教先示範操作方法,再由學生自行操作與測量待測液之吸光值。 1. 了解 U-2001 Spectrophotometer 操作方法: a. 溫機約 15 分鐘。 b. MENU → (主目錄) 選 1. Photometer →輸入波長 600 nm 及 ABS → Forward → c. Nutrient broth 歸零 autozero → (前、後二支 cuvette) ※1 d. 取出後面之 cuvette ,倒入待測液※2,等到右上方數據穩定後,按 下 Start →記錄。 ※1 cuvette 有石英管 (測波長 340 nm 以下)、玻璃管、塑膠管等材質,本實驗使用塑膠材質之比色管。 ※2 每次測定前需先用蒸餾水滴洗cuvette,再以待測液潤濕,倒掉,再裝入待測液,測完倒掉,用蒸餾水滴洗。測定之前
实验6-2酵母菌等单细胞微生物生长曲线的测定
实验酵母菌等单细胞微生物生长曲线的测定 1 目的要求 (1)了解酵母菌、细菌等单细胞微生物生长曲线的特点及测定原理; (2)学习用血球计数板计数法和比浊法分别测定酵母和细菌的生长曲线。 2 基本原理 生长曲线是单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。测定时一般将一定数量的微生物纯菌种接种到一定体积的已灭菌的适宜的新鲜培养液中,在适温条件下培养,定时取样测定培养液中菌的数量,以菌数的对数为纵坐标,生长时间为横坐标,绘制得到生长曲线。不同的微生物其生长曲线不同,同一微生物在不同培养条件下其生长曲线亦不同。但单细胞微生物的生长曲线规律基本相同,生长曲线一般分为延迟期、对数期、稳定期和衰亡期四个时期。测定一定培养条件下的微生物的生长曲线对科研和实际生产有一定的指导意义。 测定生长曲线时需要对生长的单细胞微生物定时取样计数,对于酵母细胞和比较大的细菌细胞可采用血球计数板计数法计数,亦可采用比浊法计数,但对于小的细菌细胞一般采用比浊法。 比浊法是根据培养液中菌细胞数与混浊度成正比,与透光度成反比的关系,利用光电比色计测定菌悬液的光密度值(OD值),以OD值来代表培养液中的浊度即微生物量,然后以培养时间为横坐标,以菌悬液的OD值为纵坐标绘出生长曲线。此方法所需设备简单,操作简便、迅速。 血球计数板法是利用一块血球计数板来进行计数的。血球计数板是一块特制的厚玻璃片,中央平台比两边平台低0.1mm,上有两个被精细刻化为400个小方格的格网,面积为1mm2,加盖盖玻片后即构成0.1 mm3体积的计数室。血球计数板有两种规格:一种是将1 mm2面积的网格划分为25个大格,每个大格再分成16个小格,既25′16;另一种为16′25。计数时只需无菌操作将稀释到适宜浓度的菌悬液取一滴从盖玻片一侧渗入到计数室,待静置平衡后于显微镜高倍镜下计数,用下面公式算出菌液中细胞数。 单细胞微生物细胞数/mL=5个中格内细胞数?5′25(或16)′104′菌液稀释倍数 3 实验材料 3.1 菌种酵母菌和大肠杆菌。 3.2 培养基豆芽汁液体培养基、牛肉膏蛋白胨液体培养基、5倍浓缩的牛肉膏蛋白胨培养液。
酒类发酵机理
3.1酵母生长周期 3.2酒精发酵(AF) C6H12O6 → 2 CH3CH2OH + 2CO2 + Q 葡萄糖乙醇二氧化碳 除乙醇外, 在酒精发酵也会产生,其他几个化合物如高级醇、酯、甘油、丁二酸、双乙酰、乙偶姻、2,3-丁二醇。 3.3甘油丙酮酸发酵 甘油是干葡萄酒的第三个主要成分(次于水和乙醇)。它的浓度通常是6-10g/L,提高葡萄酒的质量,因为它带来甜蜜和口感的感觉。 甘油主要产生在酒精发酵的第一步,当酵母的增长,他们需要大量的丙酮酸增加生物量。 每次使用丙酮酸分子anabolically,NAD +赤字产生,必须通过甘油丙酮酸途径恢复。 此外,酵母生产甘油作为对高渗透压力的保护者。 甘油生产可能是由两个主要机制: (1)最初的乙醇脱氢酶缺乏,导致减少的不平衡的等价物(2) 必须的初始糖含量高(20%),导致渗透压力和甘油生产的反应。 甘油含量的增加经常需要,但酒菌株构建通常为此也生成醋酸,使其浓度增加。 3.4氮代谢 酿酒酵母只能使用氨和AA。脯氨酸可以吸收酿酒酵母只有在有氧条件下。 可同化氮(EAN):所有的氨和氨基酸、脯氨酸除外。这种EAN可以简单地利用甲醛指数决定的。 EAN < 130 mg / l严重影响酒精发酵的正确发展,过量的氮会导致不可吸收残留氮的存在(微生物不稳定、氨基甲酸乙酯&生物胺)。 迄今为止, 酿酒酵母中的15运输AA系统已利用原子吸收光谱法确定,耦合的进入一个质子。这种质子必须送到细胞外部以维持细胞自动调节。 铵和氨基酸的吸收:主动转运,因为它通过H + -ATP酶消耗ATP。 缺乏足够的EAN可以使酵母使用硫原子吸收光谱法(半胱氨酸和蛋氨酸),释放出氢亚硫酸盐和硫醇。 建议补充盐铵不仅避免发酵停滞和缓慢发酵,也减少异味。 AA组成之间的关系描述了葡萄和葡萄酒的最终的芳香成分 3.5氧气和脂类的生物合成 然而,有一些重要的生物合成途径,使用氧气作为基质,例如植物固醇和不饱和脂
细菌生长曲线
实验九测定细菌生长曲线 [实验目的] 1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。3.学习液体种子和固体种子的不同接种方法和注意事项。4.利用细菌悬液浑浊度间接测定细菌生长。 [仪器和材料] 1.实验材料 (1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。 (2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml 三角瓶X 4瓶/大组),配方:牛肉膏5g,蛋白胨10g,NaCl 5g,葡萄糖10g,加水至1000ml,pH7.5。 2.实验仪器 取液器(5000μl,1000μl,200tμl 各一支);培养箱.摇床,722s分光光度汁;1000μl 无菌吸头100个;5000μl 无菌吸头2个;1ml或4ml玻璃或塑料比色皿4个,共用参比杯一个。 [实验原理] 将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图9 1)。 单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。 生长曲线可表示细菌从开始生长到死亡的全过程动态。不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的. 测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。将所测得的光密度值(测OD550或OD620或OD600或OD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。 从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示。其计算公式为; G=(t2-t1)/[(1gW1—lgW2)/lg2] 式中tl和t2为所取对数期两点的时间;w1和w2分别为相应时间测得的细胞含量(g/L)或OD。 [实验步骤] 1.准备菌种:将大肠杆菌,枯草杆菌分别接种到装有牛肉膏蛋白胨葡萄糖培养基的三角瓶中,37℃,200r/min振荡培养14-18h.另外准备大肠杆菌单菌落平板l块(37'C培养24h)。 2.接种:分别将1.5ml(1%接种量)和4-5ml(3%接种量)大肠杆菌菌液和一个大肠杆菌单菌落接人含150ml培养液的三角瓶中.37℃,200r/min振荡培养;把4.5ml枯草杆菌(3%接种量)接入含150ml培养液的三角瓶中,37℃,200r/min振荡培养。 3.测量;每培养1h取样一次.净培养(不包括取样时间)10h结束培养,测量培养液pH值。零小时也要测。 如果选用4ml比色皿取500μl培养液到2000μl蒸馏水中(稀释5倍),以蒸馏水为对照,测OD650。或OD620或OD600或OD420任选一波长),如果选用lml比色皿,可以取1000μl培养液,以蒸馏水为对照,直接测OD620 、OD600或OD420(任选一波长),当OD值大于0.6时,下一样品要稀释1倍测量. [实验结果].
霉菌与酵母菌计数方法(2015版药典)
霉菌与酵母菌计数方法 1试验菌液的制备和使用(以白色念珠菌为示例) 白色念珠菌(0)代 ↓ 传代培养 ↓ 实验菌液的制备:沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养 基,培养温度20~25℃,培养时间2~3天 ↓ 计数培养基适用性检查:胰酪大豆胨琼脂培养基,培养温度30~35℃, 培养时间不超过5天,接种量不大于100cfu ↓ 计数方法适用性试验:胰酪大豆胨琼脂培养基(MPN法不适用),培养温 度30~35℃,培养时间不超过5天,接种量不大于100cfu 注:当需用玫瑰红钠琼脂培养基测定霉菌和酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基 1.1菌种 试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。 1.2菌液制备(按表1规定程序培养各试验菌株) 取白色念珠菌的新鲜培养物 ↓ 用pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液取黑 曲霉的新鲜培养物 ↓ 加入3~5ml含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化 钠溶液,将孢子洗脱 ↓ 采用适宜的方法吸出孢子悬液至无菌试管内 ↓ 用含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯 化钠溶液制成适宜浓度的黑曲霉孢子悬液
菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用。稳定的黑曲霉孢子悬液可保存在2~8℃,在验证过的贮存期内使用。 1.3阴性对照 为确认试验条件是否符合要求,应进行阴性对照试验,阴性对照试验应无菌生长。如阴 性对照有菌生长,应进行偏差调查。 2.培养基适用性检查 按表1规定,接种不大于100cfu的菌液至沙氏葡萄糖琼脂培养基平板 ↓ 置表1规定条件下培养 ↓ 每一试验菌株平行制备2管或2个平皿 ↓ 同时,用相应的对照培养基替代被检培养基进行上述试验 ↓ 被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应在0.5-2范围内,且菌落形态大小应与对照培养基上的菌落一致;被检液体培养基管与对照培养基管比较,试 验菌应生长良好 3计数方法适用性试验 供试液制备:水不溶性非油脂类供试品 ↓ 取供试品,用pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7.2磷酸盐缓冲液,或胰酪大豆胨 液体培养基 ↓ 制备成1:10供试液。 ↓ 若需要,调节供试液pH值至6~8。必要时,用同一稀释液将供试液进一步10倍系列稀 释。
