第五章酶的作用第二部分
第五章 酶的作用和本质

第五章第1节降低化学反应活化能的酶●三维目标1.知识与技能(1)细胞代谢的概念。
(2)酶的作用和本质。
(3)酶的特性。
(4)提高学生观察、分析、判断的思维能力,提高学生的实验操作能力。
2.过程与方法(1)通过本节课教学,让学生进行有关的实验和探索,学会控制自变量,观察和检测因变量的变化,以及设置对照组和重复实验。
(2)通过让学生了解酶的发现过程,使学生体会实验在生物学研究中的作用地位;通过讨论酶在生产、生活中的应用,使学生认识到生物科学技术与社会生产、生活的关系;体会科学、技术、社会之间相互促进的关系,进而体会研究生命科学价值。
(3)在实验能力提高的基础上,提高学生运用语言表达的能力和分享信息、分享实验成果的能力。
3.情感态度与价值观(1)通过学习生物学家研究酶的本质的过程,激励学生学习科学家实事求是的科学态度和勇于探索的科学精神。
(2)通过实验探究影响酶活性的条件,培养学生的探索精神、创新精神和合作精神。
●教学重点1.比较过氧化氢酶在不同条件下分解速率快慢的实验,并引导学生得出结论——酶的高效催化作用(酶的作用)。
2.酶的本质。
3.酶的特性。
●教学难点1.酶的活化能降低的原理。
2.实验中控制变量的科学方法。
●教具准备酶活性受温度、pH影响的示意图。
●课时安排建议课时:3课时第一课时酶的作用●教学过程[课前准备]教师准备实验器材,并设计好观察记录表;学生预习实验,掌握实验的原理并设计好实验的过程。
[情境创设]人不吃饭行吗?食物进入人体内发生了怎样的变化?这些问题在现在来说都已经十分清楚了。
这些变化过程在其他生物中有没有呢?早在二百多年前科学家就对此进行了探索。
实验介绍:1783年意大利科学家斯帕兰札尼将肉块放在小巧的金属笼中,然后让鹰吞下,过了一段时间,将笼子取出,肉块不见了。
[师生互动]问:(1)为何要将肉块放在笼子中?答:排除了胃对肉块的物理性消化。
问:(2)对肉起消化作用的是什么物质?答:一定是某些物质进入到金属笼中,使肉分解。
第5章 酶

目录
1.绝对特异性(absolute specificity):
一种酶只能作用于一种化合物,以 催化一种化学反应,称为绝对特异 性,如脲酶。
目录
绝对专一性
O 脲酶 H2N—C—NH2 + H2O 2NH3 + CO2
NH2 O C NH2 尿素 NH CH3 O C NH2 甲基尿素 + H2O
Km:米氏常数(Michaelis constant)
目录
(二)Km与Vmax的意义
Km值 ① Km等于酶促反应速度为最大反应速度一半 时的底物浓度。 ② 意义:
a) Km是酶的特征性常数之一;
b) Km可近似表示酶对底物的亲和力;
c) 同一酶对于不同底物有不同的Km值。
目录
Vmax
定义:Vm是酶完全被底物饱和时的 反应速度,与酶浓度成正比。 意义:Vmax=K3 [E] 如果酶的总浓度已知,可从Vmax
唾液淀粉酶丧失催化能力称酶失活 唾液淀粉酶
淀粉
底物
葡萄糖
产物 酶促反应
目录
二、 酶的化学组成★
(一)单纯酶 完全由蛋白质组成 (二)结合酶 蛋白质和非蛋白质 全酶 = 酶蛋白 + 辅助因子 酶蛋白:决定着反应的特异性, 辅助因子:决定着酶的催化反应 类型
目录
全酶
(辅助 因子是 金属)
金属酶
(金属离子与酶蛋白结合紧密)
2. 抑制作用的类型
(1)不可逆性抑制 (2)可逆性抑制
①竞争性抑制
②非竞争性抑制
③反竞争性抑制
目录
(二) 不可逆性抑制作用
1. 概念
抑制剂通常以共价键与酶活性中 心的必需基团相结合,使酶失活; 抑制剂不可用透析、超滤等方法 去除。
新教材2023年高中生物 第5章 第2课时 酶的特性 夯基提能作业 新人教版必修1

第5章第1节第2课时A 级·基础达标练一、选择题1.在验证酶的高效性活动中,下列有关叙述错误的是( B )A.本活动用鸡肝匀浆的目的是使酶从细胞中释放并与底物充分接触B.检测氧气产生量时用点燃后带明火的卫生香放在试管口,观察燃烧程度C.1、2号试管在反应时均需在试管口塞上橡胶塞D.该活动的自变量是催化剂的种类解析:用鸡肝匀浆的目的是使酶从细胞中释放并与底物充分接触,A正确;检测氧气产生量时用带火星的卫生香放在试管口,观察燃烧程度,B错误;1、2号试管在反应时均需在试管口塞上橡胶塞,防止空气进入,影响燃烧结果,C正确;该活动的自变量是催化剂的种类,D正确。
故选B。
2.下列与酶相关实验的叙述中,正确的是( D )A.探究酶的高效性时,自变量可以是酶的种类B.探究淀粉酶的专一性时,自变量只能是酶的种类C.探究pH对酶活性的影响时,自变量不止一种D.探究温度对酶活性的影响时,因变量不止一种解析:探究酶的高效性,自变量是催化剂的种类;探究淀粉酶的专一性,自变量也可以是底物种类;探究pH对酶活性的影响时,自变量就是pH;探究温度对酶活性的影响时,因变量可以是产物的生成速率或底物的消耗速率。
3.(2021·吉林省五地六校)如图为酶与底物结合示意图,下列有关叙述不正确的是( C )A.酶的形状在催化过程中会发生改变B.底物与酶特定部位的结合具有专一性C.此图可表示1分子蔗糖经酶催化后产生2分子葡萄糖的过程D.图示过程能够保证酶保持较高的催化活性解析:由图可知,酶在化学反应过程中,结构会发生变化,但数量不变,A正确;由图可知,底物需要与酶特定的位点结合,即具有专一性,B正确;蔗糖的水解产物是葡萄糖和果糖,C错误;图示过程体现了酶的专一性,能够保证酶保持较高的催化活性,D正确。
故选C。
二、非选择题4.取甲、乙两支洁净的试管,分别注入3 mL淀粉糊,然后在甲试管中注入2 mL新鲜的小麦淀粉酶滤液,在乙试管中加入2 mL清水。
第五章酶反应动力学

rS rS ,max
当CS<<Km时,是一级反应,反应速率与底 物浓度成正比,其反应式:
rS
rS max Km
CS
反应最大速率:
rS ,max, K2 E0 K+2——反应常数。 E0—酶总浓度。
二、反应时间计算 1、间歇操作反应器(BSTR)
对间歇搅拌反应器,可对整个反应器做 反应组分的物料衡算为:
r c c K c max m
S0
S
S0
S
m
S
(1)平推流式反应器(CPFR)
V
0
cS
V
0
(cS
dcS)
r
S
dV
R
dcS
dt
dV
R
连续稳态操作时, dcS 0 ,于是 dt
V 0dcS rS dVR
• 对整个反应器有,有
dc cSf
S VR 1
r dV cS0
对底物的物料衡算式有:
V
0
cS
0
V
0
cS
r
SV
R
dcS
dt
V
R
V 0 ——物料流量
c c、 S0 S
——进料、反应器中的底物浓度
V R ——反应器有效体积
在连续稳态时,dcS 0 ,并由上式可得: dt
V c c R S0 S
V m 0
rS
均相酶反应,符合M-M方程反应:
c c ( )
暂存罐 泵
淀粉糖生产的糖化罐
无菌空气
螺旋板换热器
糖化罐
对产物抑制酶反应,由于在CSTR中维持了比CPFR 中较高的产物浓度,因而在CSTR中产物的抑制作 用较大,此时显然应采用CPFR 更为有利于。
第五章酶的概念本质命名分类作用特点专一性结构与功能关系

3. 酶的活性部位并不是和底物的形状正好互补的,而是 需动态诱导契合(induced-fit).
4. 位于酶分子表面的一个裂隙(crevice)内.裂隙内是一 个相当疏水的环境,从而有利于同底物的结合。
5. 底物靠许多弱的键力与酶结合。
O
NH2
二、 酶的分类
(一)国际系统分类法
1. 氧化-还原酶类 Oxido-reductases
催化氧化-还原反应。 主要包括脱氢酶(dehydrogenase)和氧化酶
(Oxidase)。 如,乳酸(Lactate)脱氢酶催化乳酸的脱氢反应。
CH3CHCOOH NAD+ OH
CH3CCOOH NADH H+ O
His12, His119, Lys41
溶菌酶
129
Asp52, Glu35
胰凝乳蛋白酶
241
His57, Asp102, Ser195
胃蛋白酶
348
Asp32, Asp215
木瓜蛋白酶
212
Cys25, His159
羧肽酶A
307 Arg127, Glu270,Tyr248,Zn2+
酶活性中心的结构特点
酶活性中心示意图
牛胰蛋白酶
第四节、酶作用的专一性
酶的底物专一性即特异性(substrate specificity)一种酶只能作用于某一种或某 一类结构性质相似的物质。 类型: 结构专一性和立体化学专一性。
1. 结构专一性
(1)绝对专一性(Absolute specificity)
只作用于一个特定的底物。这种专一性称为绝 对专一性(Absolute specificity)。
生物必修一第五章知识点总结全

第五章细胞的能量供应和利用第一节降低反应活化能的酶1、细胞代谢:细胞内每时每刻进行着许多化学反应,统称为细胞代谢.2、活化能:分子从常态转变为容易发生化学反应的活跃状态所需要的能量。
3、酶的作用:催化作用4、使化学反应加快的方法:加热:通过提高分子的能量来加快反应速度;加催化剂:通过降低化学反应的活化能来加快反应速度;同无机催化相比,酶能更显著地降低化学反应的活化能,因而催化效率更高。
5、酶的概念:酶是活细胞产生的具有催化作用的有机物,绝大多数是蛋白质,少数是RNA。
6、酶的特性:高效性:酶的催化效率是无机催化剂的107-1013 倍专一性:每一种酶只能催化一种或一类化学反应酶的作用条件较温和:酶在最适宜的温度和PH条件下,活性最高。
7、影响酶促反应的因素(1)酶浓度对酶促反应的影响:酶促反应的速率与酶浓度成正比,如图1 所示。
图一图二图1 图2(2)底物浓度对酶促反应的影响:刚开始反应速度随底物浓度增加而加快,之后再增加底物浓度,反应速率也几乎不变,如图2所示。
(3)pH值对酶促反应影响:刚开始反应速度随着pH值升高而加快,达到最大值后反应速度随着pH值升高而下降。
反应速率最大时的pH值称为这种酶的最适pH 值。
如图3所示。
图三图四图3 图4(4)温度对酶促反应的影响:刚开始反应速率随温度的升高而加快;但当温度高到一定限度时,反应速率随着温度的升高而下降,最终,酶因高温使空间结构遭到破坏失去活性,失去了催化能力。
如图4所示。
8、实验:比较过氧化氢在不同条件下的分解比较过氧化氢酶在不同条件下的分解(1)实验分析:1号与2号比较自变量为水浴加热,1号与3号、4号比较自变量为3号加入三氯化铁、4号加入肝脏研磨液(即催化剂种类)(2)实验结论:酶具有催化作用,并且催化效率要比无机催化剂Fe3+高得多(3)控制变量:自变量(实验中人为控制改变的变量)因变量(随自变量而变化的变量)、无关变量(除自变量外,实验过程中还会存在一些可变因素,对实验结果造成影响)。
新教材高中生物第5章第2课时酶的特性pptx课件新人教版必修1
【教材微点发掘】 1 . 阅 读 教 材 第 84 页 , 说 出 酶 制 剂 适 于 在 低 温 (0 ~ 4 ℃) 下 保 存 的 原 因 :
__________________________________________________________________ __________________________________________________________________ ______________________。 答案:在0 ℃左右时,酶的活性很低,但酶的空间结构稳定,在适宜的温度 下酶的活性可以升高
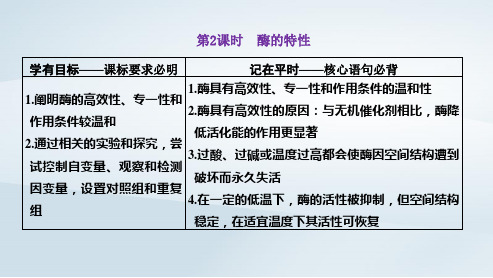
第2课时 酶的特性
学有目标——课标要求必明
记在平时——核心语句必背
1.酶具有高效性、专一性和作用条件的温和性 1.阐明酶的高效性、专一性和
2.酶具有高效性的原因:与无机催化剂相比,酶降 作用条件较温和
低活化能的作用更显著 2.通过相关的实验和探究,尝
3.过酸、过碱或温度过高都会使酶因空间结构遭到 试控制自变量、观察和检测
(2)设计方案ຫໍສະໝຸດ 项目 材料实验组对照组 等量的同一种底物
试剂
与底物相对应的酶 溶液
新知探究(一) 酶的高效性和专一性 【探究·深化】
[问题驱动] 1.验证酶的高效性 在比较肝脏研磨液(过氧化氢酶)和FeCl3对过氧化氢的 催化效率实验中(如图),试管甲产生的气泡比试管乙多, 说明 与无机催化剂相比,酶的催化作用具有高效性 。
2.验证酶的专一性 (1)实验验证:淀粉和蔗糖不是还原糖,但淀粉水解后会生成麦芽糖,蔗糖水 解后会产生葡萄糖和果糖,麦芽糖、葡萄糖、果糖都是还原糖。下表为比较新鲜 唾液(唾液淀粉酶)对淀粉和蔗糖的催化作用实验,请分析:
操作步骤 可溶性淀
《生物化学》-第五章 酶化学

—CH2—·O·:
H
底物中典 型的亲电 中心包括:
磷酰基
Cys-SH
—CH2—·S·:
H
脂酰基 糖基
His-咪唑基
—CH2—C=CH
HN N:
CH
(五)金属离子催化
金属离子作为酶的辅助因子起作用的方式:
1.与酶蛋白紧密结合稳定酶的天然构象,亲电催化 2.与酶结合较弱,作为激活剂存在。 3.通过价态的可逆变化,参与氧化还原反应。
其他成分的酶:
核酶(ribozyme) :具有催化活性的天然RNA。 近年还有DNA分子具有催化活性报道。
酶的概念: 酶是生物催化剂。由活细胞产生的具有高效催化能力 和催化专一性的蛋白质、核酸或其复合体。
脲酶:专一性水解尿素。
第一个被分离提取的酶,并证明其化学本质为蛋白质。 抗体酶:是用化学反应的过渡态类似物作免疫原产生 的催化性抗体,是一种具有催化能力的蛋白质,其本 质上是免疫球蛋白。
(6)对于结合酶,辅酶、辅基往往参与酶活中心的 组成。
第二节 酶催化作用的机制
一、酶与底物的结合——中间复合物学说
该学说认为,在酶促反应中,酶(E)总是先和底 物(S)结合生成不稳定的中间复合物(ES),再 分解成产物(P),并释放出酶(E)。 ——中间复合物学说能较好的解释酶为什么能降 低反应的活化能。
实际上,底物与酶结合是一种相互作用的过程, 底物可诱导蛋白质构象改变,蛋白质必需基团也可使 底物敏感键发生变化,更好“契合” 。 3.“三点附着”模型:该模型认为底物与酶活中心的 结合有三个结合位点,只有当这三个位点都匹配的时 候,酶才会催化相应的反应。
二、酶作用高效率机制
(一)底物与酶的邻近、定向效应
1)绝对专一性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶原或蛋白质前体激活举例
使蛋白质水解的消化酶,在胃和胰脏中刚合成时是 以酶原的形式存在,分泌到肠胃中被切割后才成为有 活性的酶。 血液凝固系统中许多酶都是以酶原的形式存在,到 需要血液凝固时才被激活。 胰岛素刚合成出来是前胰岛素原(preproinsulin), 经蛋白酶切割后成为有活性的胰岛素。 不溶性的胶原,是由可溶性的前胶原激活而成的。 在需要时,前胶原酶转变成活性的胶原酶,降解胶 原。如蝌蚪尾巴的消失。
乳酸脱氢酶催化的反应
乳酸脱氢酶同工酶
从 各 种 组 织 中 得 到 的 LDH 分 子 量 都 是
140×103 ,由4个亚基组成,亚基有两种,一种 为肌肉型(M),一种为心肌型(H),这两种 亚基在氨基酸组成上有较大差别,H型富含酸性 氨基酸,M型富含碱性氨基酸,因此很容易利用 电泳分开。
乳酸脱氢酶同工酶酶谱
第五章 酶的改性理论—— 酶的作用机制和调节
一、酶的组成与结构
二、酶的活性部位
三、影响酶催化效率的有关因素
四、酶催化反应机制的实例
五、酶活性的调节控制 六、同工酶
天冬氨酸转氨甲酰酶
(aspartate transcarbamylase,ATCase)
ATCase是嘧啶生物合成途径的第一个酶,底
物对酶的结合有正协同性。该反应途径的终产物
酶修饰反应的例子
Tyr、Ser、Thr、His
Tyr
Tyr
酶修饰反应的例子
Arg 、 Gln 、 Cys 、
白喉酰胺(一种修 饰的His)
Glu
六、同工酶
同工酶就是催化同一反应,但酶分子形式不同
的一组酶。酶分子不同可以表现为肽链的氨基酸序
列不同或寡聚酶的亚基组成不同。最典型的同工酶
是动物体内的乳酸脱氢酶(lactate dehydrogenase, LDH),它是亚基组成不同的一组酶。
可逆的共价修饰
有一些酶属于共价调节酶(covalently modulated
enzyme),通过其它酶对它进行可逆的共价修饰而在
活性与非活性之间互变。这种酶常是一些对代谢流量 并且可以级联放大,对输入的信息产生迅速的反应。 有些酶以修饰状态为活性形式,有些酶以脱修饰 状态为活性形式。
起调节作用的关键酶,或是需要迅速产生酶活性的酶,
CTP是ATCase的反馈抑制剂,抑制程度可达90%,
这种抑制是降低酶对底物的亲和力,但不影响最
大反应速度。而ATP是ATCase的激活剂,可增加
酶对底物的亲和力,也不影响最大反应速度。
脱敏反应
ATCase由催化亚基(catalytic subunit)和 调节亚基(regulatory subunit)组成。当用汞
修饰,这样就人工引进了报告基团。这种被修饰
的催化亚基不能与底物结合。
底物结合到ATCase上引起 高度协同的别构转变
用被修饰的催化亚基与正常的催化亚基及正
常的调节亚基重组成全酶(杂交酶),当加入天
冬氨酸的类似物琥珀酸时,琥珀酸结合到正常的
催化亚基上,改变了被修饰催化亚基上硝基酪氨 酸的吸收光谱。说明一个催化亚基与底物结合能 引起另一个催化亚基构象发生变化。
释放的因子Ⅲ(组织凝血激素)来参与因子Ⅹ的
激活的,称为外源性激活途径(extrinxic route),
如创伤出血后发生凝血的情况。
内源性途径
从因子Ⅻ(接触因子)的激活开始。血管
内膜下组织,特别是胶原纤维,与因子Ⅻ接触, 可使因子Ⅻ激活成Ⅻa。Ⅻa可激活激肽释放酶 原使之成为激肽释放酶;后者反过来又能激活 因子Ⅻ,这是一种正反馈,可使因子Ⅻa大量生 成。Ⅻa又激活因子Ⅺ成为Ⅺa。
凝血机制
凝血因子
(blood clotting factors)
编号
因子Ⅰ 因子Ⅱ 因子Ⅲ 因子Ⅳ 因子Ⅴ 因子Ⅶ 因子Ⅷ 因子Ⅸ 因子Ⅹ 因子Ⅺ
同义名
纤维蛋白原(fibrinogen) 凝血酶原(prothrombin) 组织凝血激素(tissue thromboplastin) Ca2+ 前加速素(proaccelerin) 前转变素(proconvertin) 抗血友病因子(antihemophilic factor,AHF) 血浆凝血激酶(plasma thromboplastin component,PTC) Stuart-Prower因子 血浆凝血激酶前质(plasma thromboplastin antecedent,PTA)
化物处理该酶时,则ATCase失去调节活性。用
汞化物处理过的ATCase,ATP和CTP不再影响
其催化活性,而且底物结合变为无协同性。但
并不影响酶的最大反应速率。
ATCase的亚基结合方式
三 维半 结分 构子 的
ATCase
酶与底物结合后的构象变化
底物与酶结合后,导致酶的沉降系数降低
3%,说明酶与底物结合后膨胀了。伴随着酶与 PALA的结合,酶的四级结构发生了大的变化,
外源性途径
由因子Ⅶ与因子Ⅲ组成复合物,在有Ca2+ 存
在的情况下,激活因子Ⅹ生成Ⅹa。因子Ⅲ,原名 组织凝血激酶,广泛存在于血管外组织中,但在 脑、肺和胎盘组织中特别丰富。因子Ⅲ为磷脂蛋 白质。Ca2+ 的作用就是将因子Ⅶ与因子Ⅹ都结合
于因子Ⅲ所提供的磷脂上,以便因子Ⅶ催化因子
Ⅹ的有限水解,形成Ⅹa。
生理止血过程Ⅰ
生理止血过程包括三部分功能活动。首先 是小血管受伤后立即收缩,若破损不大即可使 血管封闭。其次,更重要的是血管内膜损伤,
内膜下组织暴露,可以激活血小板和血浆中的
凝血系统;由于血管收缩使血流暂停或减缓,
有利于激活的血小板粘附于内膜下组织并聚集
成团,成为一个松软的止血栓以堵塞伤口。
生理止血过程Ⅱ
ATP和CTP与酶结合后酶的构象 及硝基Tyr吸收光谱的变化
标记三聚体
标记三聚体
酶原的激活
有些酶在刚合成出来时没有活性,称为酶原
(zymogen或proenzyme)。酶原经蛋白水解酶
在特定位点切割后,产生有活性的酶,这种方式
称为酶原的激活。有一些不是酶的蛋白质,也需 要经特定的蛋白酶水解才有功能,这些蛋白质在 没有活化之前称为前体(precursor)。
胰凝乳蛋白酶原的激活
胰凝乳蛋白酶原是胰腺分泌的、由245个氨基酸
残基组成的单链肽,有5对二硫键。经胰蛋白酶作用,
Arg15与Ile16之间的肽键断裂,才具有酶活性,这种
酶称为π-胰凝乳蛋白酶。π型酶活性最高,但不稳定,
它再作用于其它π型酶分子上,使之失去两个二肽 (Ser14-Arg15和Thr147-Asn148)后成为稳定形式α -胰凝乳蛋白酶。α型酶有3条肽链,A链和B链之间 以及B链和C链之间各有一对二硫键连接。
同工酶存在的意义
同工酶中的不同成员可在不同的组织中表达,
或在不同的发育阶段表达。虽然它们催化相同的反
应,但它们的酶学性质不同,在代谢中发挥着不同
的作用。同工酶还可用于遗传分析。
练习题
• 已知7肽:Gly,Phe(2),Tyr,Met,Asp, Arg。 • 1 胰凝乳蛋白酶 三肽 和 四肽,三肽组成 为Phe,Tyr,Asp • 2溴化氰、阳离子交换树脂洗脱三肽 Arg、 Phe、 Gly 3 胰蛋白酶水解得Phe,FDNP反应得DNPTyr 请写出全序列
胰凝乳蛋白酶原的激活
胃蛋白酶原的激活
胃蛋白酶原是由胃壁细胞分泌的,分子量为 38.9×103,由392个氨基酸残基组成。在胃酸H+的 作用下,低于pH5时,酶原自动激活,从氨基端失 去44个氨基酸残基的碱性片段,成为有活性的胃 蛋白酶。胃蛋白酶的最适反应pH为2,其活性部位 含有2个天冬氨酸残基,一个处于解离状态,一个 处于质子化状态。酶原碱性片段中的Lys与活性部 位的天冬氨酸残基有静电相互作用,使酶不能表 现出活性。去除碱性片段后,暴露出催化基团, 酶才表现出活性。胃蛋白酶还可以催化其它胃蛋 白酶原分子活化。
接着,在局部又迅速出现血凝块,即血浆中可 溶的纤维蛋白原转变成不溶的纤维蛋白分子多聚体, 并形成了由血纤维与血小板一道构成的牢固的止血
栓,有效地制止了出血。与此同时,血浆中也出现
了生理的抗凝血活动与纤维蛋白溶解活性,以防止
血凝块不断增大和凝血过程漫延到这一局部以外。
显然,生理止血主要由血小板和某些血浆成分共同 完成。
琥珀酸与杂交酶结合后硝基 Tyr吸收光谱的变化
天然三聚体
标记三聚体
NT:硝基酪氨酸 S:底物
别构剂对酶构象的影响
给杂交酶加ATP,硝基酪氨酸430nm的光吸 收增加,与加琥珀酸情况相同;而给杂交酶加
CTP,430nm的光吸收减少。此实验说明别构激
活剂和别构抑制剂都能引起构象变化,但变化的 结果不同。ATP的结合使酶的构象平衡向R型转 变,而CTP的结合使酶的构象平衡向T型转变。
胰蛋白酶原的激活
胰蛋白酶原由胰脏分泌,进入小肠后,在有
Ca2+ 的环境中受到肠一个6肽,成为
有活性的胰蛋白酶。活性的胰蛋白酶还可以激活 其它胰蛋白酶原、胰凝乳蛋白酶原、弹性蛋白酶 原及羧肽酶原等。
胰蛋白酶原的激活
胰蛋白酶对各种胰脏蛋白酶原 的激活作用
因子Ⅻ
接触因子(contact factor)
因子ⅩⅢ 纤维蛋白稳定因子(fibrin-stabilizing factor)
因子X激活的两种途径
因子Ⅹ(Stuart-Prower因子)的激活可以通
过两种途径。如果只是损伤血管内膜或抽出血液 置于玻璃管内,完全依靠血浆内的凝血因子逐步 使因子Ⅹ激活从而发生凝血的,称为内源性激活 途径(intrinsic route);如果是依靠血管外组织
两个催化三聚体分开了1.2nm,并转动了10°。
此外,每一调节亚基也绕其对称轴旋转了15°。
