原子结构与原子半径
原子半径-

原子半径原子半径是指原子的物理大小,即原子的电子云边缘到原子核的距离。
原子半径是原子结构和性质的重要参数,对于理解化学反应、物理性质和结构有着重要的意义。
原子半径的测量方法有很多种。
其中比较常用的有X射线衍射法、电子衍射法、原子力显微镜、光谱测量法等。
这些方法可以测量不同条件下的原子半径,如室温下、高温高压或在不同气氛下。
原子半径的大小受到原子核质子数、电子数量、原子的电子层数、电子构型、电子云分布的影响。
由于不同原子的电子结构不同,所以原子半径也不同。
普通原子的半径一般在0.1至0.5纳米之间,而金属原子的半径比非金属原子大。
原子半径的大小可以影响元素的性质,如半径较小的元素常常比半径较大的元素更容易发生电子亲和力和电离能等反应。
下面是常见元素的原子半径数据。
一、第一周期元素的原子半径氢(H):25 pm氦(He):31 pm由于第一周期只有2个元素,因此这个周期的元素半径相对较小,而且非常接近。
二、第二周期元素的原子半径锂(Li):152 pm铍(Be):111 pm硼(B):85 pm碳(C):77 pm氮(N):56 pm氧(O):48 pm氟(F):42 pm氖(Ne):38 pm在第二周期中,元素原子半径逐渐减小。
这是由于,在原子中,电子的数量和质子数相同,因此随着质子数增加,核和电子之间的吸引力增加,电子的近似半径变小。
三、第三周期元素的原子半径镁(Mg):160 pm铝(Al):143 pm硅(Si):118 pm磷(P):110 pm硫(S):104 pm氯(Cl):99 pm氩(Ar):94 pm在第三周期,原子半径的趋势与第二周期相同,均缩小,这是由于电子云进一步靠近原子核,同时原子核的电荷数量增加,因此质子对电子的吸引力变大,原子半径变小。
四、第四周期元素的原子半径钾(K):227 pm钙(Ca):197 pm钪(Sc):162 pm钛(Ti):147 pm钒(V):134 pm锰(Mn):127 pm铁(Fe):126 pm钴(Co):125 pm镍(Ni):124 pm铜(Cu):128 pm锌(Zn):134 pm镓(Ga):135 pm锗(Ge):125 pm砷(As):114 pm硒(Se):103 pm溴(Br):94 pm氪(Kr):88 pm在第四周期中,钠和镁元素的原子半径比其前面的元素要大,这是由于它们的电子云位于一个更远的层次上,离核更远,因此它们的原子半径增大。
原子半径的比较

原子半径的比较1 原子半径原子半径一直以来是一个非常重要的物理参数。
它由原子中心到外部电子部分之间的距离确定,在原子结构问题中有着重要的意义。
原子半径也是用来衡量原子大小的主要指标,它是一种盲目而简单的方法,通过它,可以比较不同原子之间的大小,从而深入了解更多关于原子结构的问题。
2 原子半径的测量原子半径的测量主要有两种方法:一种是利用现代的光谱仪来获得原子的能谱,通过精确计算能谱图中节点之间的距离,来直接计算原子半径;另一种方法是利用X射线散射实验,通过观察X射线在碰撞过程中的变化,从而确定原子半径。
但这两种方法都有其局限性,只能用来测量一定类型的原子,而且精度也比较低。
3 相对原子半径除了精确测量原子半径外,还有一种比较简单的方法,叫做“相对原子半径”。
它是利用已知的原子半径计算其他原子的半径。
由于不同原子的结构有所不同,因此它们的半径也并不一样,因此需要计算机来计算。
一般来说,这种方法计算出来的结果比较准确,但具有一定的误差。
4 原子半径的比较对比不同原子的原子半径是普及原子结构问题的一种重要方法。
有时一种元素的原子半径会比另一种元素的原子半径大,有时又会相反。
例如,氢原子的半径大约是孤子氖的三分之一,而氧原子的半径却大约是氦原子的一倍。
这些差别主要是由原子核大小的不同造成的,即原子的质量的不同导致电子密度的不同,进而影响原子半径的大小。
5 小结总之,原子半径是用来衡量原子大小的一个重要指标,具有重要的意义。
它的测量主要有两种方法:光谱法和X射线散射法,但有一定的局限性,也有一种较为简单的计算方法——“相对原子半径”。
原子半径的比较也是普及原子结构问题的重要方法,它也常常是由原子核大小的不同造成的。
各种原子半径

各种原子半径
原子半径是用来描述原子的大小的物理量之一,在化学和物理领域中具有重要
意义。
不同元素的原子半径差别很大,下面将介绍一些常见元素的原子半径。
氢原子的半径约为25皮米(1皮米等于10−12米)。
氢原子是最小的原子之一,由一个质子和一个电子组成,因此其原子半径非常小。
氦原子的半径约为31皮米。
氦原子由两个质子、两个中子和两个电子组成,
比氢原子稍大。
氧原子的半径约为60皮米。
氧原子有8个质子、8个中子和8个电子,大于
氦原子的原子半径。
碳原子的半径约为70皮米。
碳原子有6个质子、6个中子和6个电子,比氧
原子稍大。
金原子的半径约为140皮米。
金原子有79个质子、118个中子和79个电子,是一种较大的原子。
铀原子的半径约为180皮米。
铀原子是一种重元素,具有较大的原子半径。
总的来说,原子的大小与其构成元素的种类及原子核和电子结构有关。
不同元
素的原子半径差别较大,而同一元素的原子半径在不同化学环境下也可能有所改变。
对于化学反应和材料性质的研究,了解原子的大小是十分重要的。
在实验中,科学家通常使用X射线衍射等方法来测定原子的半径,以获取更精
确的数据。
原子半径除了在理论研究中有重要用途外,也在材料科学、纳米技术等领域具有广泛应用。
希望通过本文对各种原子的半径有一个基本了解,进一步研究可以探究更多有
关原子结构和性质的知识。
原子半径定义

原子半径定义原子半径是原子大小的量度,通常定义为原子核与最外层电子壳层之间的距离。
可以使用各种方法计算原子半径,包括实验测量和基于原子量子力学模型的理论计算。
一般来说,原子半径随着一个人向下移动到元素周期表的给定列而增加,并随着一个人移动穿过给定行而减小。
有几种不同的方法可以定义原子半径,根据所使用的方法,这可能会导致略有不同的值。
一些最常见的原子半径定义包括:•共价半径:这是通过共价键结合在一起的两个原子的核之间的距离。
共价半径通常大于孤立原子的原子半径,因为电子云在共价键中的两个原子之间共享。
•范德瓦尔斯半径:这是一个原子的电子云开始与另一个原子的电子云重叠的距离,导致原子之间产生范德瓦尔斯力。
范德华半径通常大于原子半径,因为它考虑了原子的电子云而不仅仅是原子核。
•金属半径:这是通过金属键结合在一起的两个原子的核之间的距离。
金属半径通常小于孤立原子的原子半径,因为金属键中的电子可以在整个金属晶格中自由移动。
影响原子半径的因素有几个因素会影响原子的大小及其原子半径,包括:•原子核中的质子数:原子序数,即原子核中的质子数,是决定元素性质的最重要因素。
随着原子序数的增加,原子核中的质子数增加,原子半径减小。
这是由于原子核的正电荷增加,它更强烈地吸引电子并导致更小的原子半径。
•电子壳配置:电子在原子最外层壳中的排列,也称为电子壳配置,也会影响原子的大小。
最外层电子数较多的原子通常会具有较大的原子半径,因为电子云更分散并且从原子核延伸得更远。
•内层电子壳的存在:内层电子壳的存在也会影响原子的大小。
具有较多内层电子壳层的原子通常具有较小的原子半径,因为原子核的正电荷被电子内层壳层有效屏蔽。
•化学键的类型:化合物中存在的化学键类型也会影响所涉及原子的大小。
例如,共价键倾向于产生较大的原子半径,而金属键倾向于产生较小的原子半径。
测量原子半径有几种方法可以用来测量原子的原子半径,包括实验技术和基于量子力学模型的理论计算。
1、原子结构与原子半径的大小的关系及原子半径呈周期性
【学习目标】1、原子结构与原子半径的大小的关系及原子半径呈周期性变化的规律;2、原子结构与电离能的关系及电离能呈周期性变化的原因;3、原子结构与电负性的关系及电负性呈周期性变化的原因。
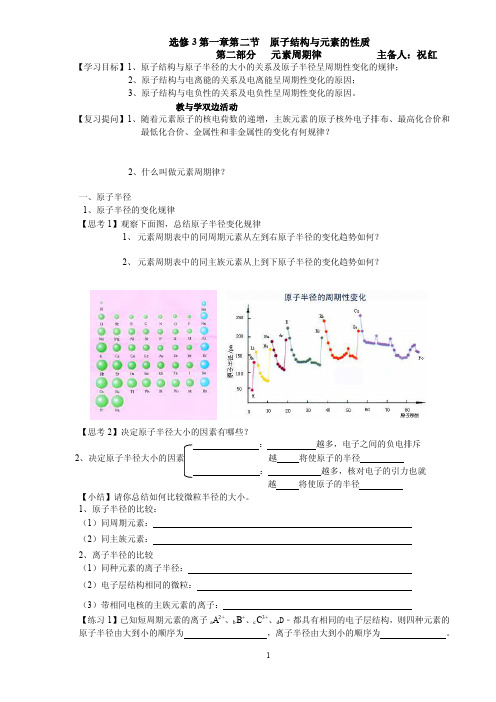
教与学双边活动【复习提问】1、随着元素原子的核电荷数的递增,主族元素的原子核外电子排布、最高化合价和最低化合价、金属性和非金属性的变化有何规律?2、什么叫做元素周期律?一、原子半径1、原子半径的变化规律【思考1】观察下面图,总结原子半径变化规律1、元素周期表中的同周期元素从左到右原子半径的变化趋势如何?2、元素周期表中的同主族元素从上到下原子半径的变化趋势如何?【思考2】决定原子半径大小的因素有哪些?:越多,电子之间的负电排斥2越将使原子的半径:越多,核对电子的引力也就越将使原子的半径【小结】请你总结如何比较微粒半径的大小。
1、原子半径的比较:(1)同周期元素:(2)同主族元素:2、离子半径的比较(1)同种元素的离子半径:(2)电子层结构相同的微粒:(3)带相同电核的主族元素的离子:【练习1】已知短周期元素的离子a A2+、b B+、c C3+、d D﹣都具有相同的电子层结构,则四种元素的原子半径由大到小的顺序为,离子半径由大到小的顺序为。
【阅读教材】P-17页完成定义二、电离能1、第一电离能定义:【思考3】请考察下面图,总结原子的第一电离能随核电荷数递增有什么规律?2、元素第一电离能的变化规律(1)同周期元素随着原子序数的递增,元素的第一电离能呈现趋势;(2)同主族元素从上到下逐渐。
3、元素第一电离能的意义衡量元素的原子的难易程度,第一电离能数值,原子越容易失去一个电子。
【思考4】根据第一电离能数值,回答:1、为什么N与O、Mg与Al、Zn和Ga的电离能出现反常?2、碱金属的电离能与碱金属的活泼性存在什么联系?【学与问】下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
4、电离能的应用(1)确定元素核外电子的排布。
高中化学第一章原子结构与性质22原子半径及金属性非金属性递变课件新人教版选修3

11.A、B、C、D、E 五种元素的原子序数依次递增,且均属 于短周期元素,已知 A 是非金属元素,其电子层数与最外层电子 数相等。Bn+和 C(n+1)+与氖原子具有相同的电子层结构,且 C 是两 性元素。Dn-、E(n-1)-与氩原子具有相同的电子层结构。
(1) 写 出 这 五 种 元 素 的 元 素 符 号 : A_____H_______ , B___M__g_______ , C____A__l ______ , D_____S_______ , E____C__l ______。
分别取少许 X、Y 于试管中,各加入少量 MnO2 粉末,迅速产生无 色气体的是 H2O2,无明显现象的是 H2O _______________________________________________________。
②F 与 C 组成的两种化合物 M 和 N 所含的电子数分别与 X、 Y 相等,则 M 为___N__H_3______,N 为____N_2_H_4_____。
径越小。
12.部分中学化学常见元素原子的结构及性质如表所示:
(1)A 元素在周期表中的位置为____第__四__周__期__第_Ⅷ__族____,离子半 径:B2+_____<_______(填“>”“<”或“=”,下同)C3-。
(2)简单气态氢化物的热稳定性:D______<______E。 (3)①F 与 E 可以形成原子个数比分别为 2∶1、1∶1 的两种化 合物 X 和 Y,区别 X 与 Y 的实验方法是
8.下列排列顺序正确的是( B ) ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③酸性: H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl- A.①② B.②④ C.①④ D.②③
元素周期表中各原子半径

元素周期表中各原子半径
元素周期表是对元素按照其原子序数排列的表格,其中包含了丰富的信息,如
原子量、原子半径等。
原子半径是一个重要的物理性质,它指的是原子核到最外层电子轨道外沿的距离,决定了原子的大小和化学性质。
不同元素的原子半径存在一定的规律性,下面将对部分元素的原子半径进行简要介绍。
1.氢(H)氢是元素周期表中第一位的元素,其原子半径较小,大约为
0.53埃。
2.氦(He)氦是稀有气体元素,原子结构稳定,原子半径约为0.31埃。
3.锂(Li)锂是周期表中第三组元素,原子结构较松散,原子半径大
约为1.23埃。
4.氧(O)氧是非金属元素,原子半径较小,大约为0.73埃。
5.氟(F)氟是有毒气体,原子半径较小,大约为0.64埃。
6.氯(Cl)氯是卤素元素,原子半径约为0.99埃。
7.钠(Na)钠是周期表中第三组元素,原子结构较宽松,原子半径大
约为1.54埃。
8.铁(Fe)铁是过渡金属元素,原子半径约为1.24埃。
以上是部分元素的原子半径数据,随着元素的变化,其原子半径也会发生相应
变化。
通过了解元素的原子半径,可以更深入地了解元素的性质和化学反应规律。
在化学研究和工程应用中,原子半径信息具有重要的指导意义。
原子半径变化规律

原子半径变化规律原子半径是指原子中心点到最外层电子轨道最远处的距离。
原子半径的变化规律主要受到原子的电子结构和周期表位置的影响。
随着周期表位置的改变,原子半径也会发生相应的变化。
下面,我们来具体了解一下原子半径的变化规律。
(一)周期表中的原子半径变化规律在周期表中,原子半径随着元素的原子序数增加而发生变化。
从左到右,原子半径逐渐缩小,从上到下,原子半径逐渐增大。
这个规律可以解释为原子中电子数的变化和核电荷数的变化。
1. 单位电荷对电子数量的增加逐渐增加的电子数量使电子云扩张,从而使原子半径增大。
2. 核电荷的増加随着核电荷的增加,原子的吸引力也随之增强,电子会更加向原子核集中,从而使原子半径变小。
因此,周期表中原子半径的大小顺序为:Fe < Cr < Mn < Ni < Co < Cu < Zn < Ga < Ge < As < Se < Br < Kr < Rb < Sr < Zr < Nb < Mo < Tc < Ru < Rh < Pd < Ag < Cd < In < Sn < Sb < Te < I < Xe < Cs < Ba < Lu < Y < La < Ac < Th < Pa < U < Np < Pu < Am < Cm < Bk < Cf < Es < Fm < Md < No < Lr(二)原子半径与价电子数的关系在同一周期中,由于原子核电荷不变,电子数量增加,电子云相互排斥作用增强,原子半径逐渐变小。
但在同一族中,由于原子核电荷增加,原子半径会逐渐增大。
因此,我们可以得出一个规律:在同一周期中,原子半径随着价电子数增加而逐渐缩小;在同一族中,原子半径随着原子核电荷的增加而逐渐增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素第一电离能的周期性变化
如:
Be(2s2) 899.5
B(2s22p1) 800.6
N(2s22p3) O(2s22p4) 1402.3 1314.0
I1(kJ· mol-1)
原因:Be和N的原子结构电子排布为全满、半满状 态,较稳定,难失去电子,电离能较大。
三、 电子亲和能 E 定义:基态的气态原子得到一个电子,生成氧化值为-1价的 气态负离子时所放出的能量称为第一电子亲和能E1,相应地 有第二、第三电子亲和能。 O(g) + e- = O-(g) E1 = 141 kJ· mol-1 O-(g)+ e- = O2-(g) E2 = -780 kJ· mol-1, 注:电子亲和能习惯上和 H符号相反,即放出能量用正值 表示
同一主族:从上到下,原子半径增大,则电子亲和能逐渐 减小。 但第二周期的F、O、N它们的电子亲和能反而比相应的第 三周期的元素小,这是因为其半径小,接受电子时所受的 斥力较大,从而放出的能量减小。
4. 电负性 电负性是指元素的原子在分子中吸引电子的能力。 元素的电负性越大,表示该原子在分子中吸引电子的能力 越强。
Zr(145pm) Nb(134pm) Mo(129pm) La-Lu Hf(144pm) Ta(134pm) W(130pm)
二、 原子结构与电离能 I
定义:元素的基态气态原子失去一个电子形成 +1价的气态离子所需 的能量称为该元素的第一电离能(I1)。 电离能的大小反映了原子失去电子能力的大小,电离能越小,原子 越易失去电子。
CH
4
无机化学
第十六讲 原子结构与元素基本性质 主讲人:彭艳芬
一、 原子结构与原子半径
元素的基本性质与原子结构密切相关,因而也呈现明显的周期性变 化规律。
1. 原子半径
电子在原子核外各处都有可能出现,单个原子没有明确界面,所谓 原子半径是根据相邻原子的核间距测出的。
共价半径:同种元素的原子以共价键结合时,它们核间距 离的一半。如Cl2
有多种标度电负性的方法,较为通用的是电负性标度。 (鲍林电负性值)。
变化规律: 主族元素:同一周期从左到右,元素的电负性逐
渐增大;同一族从上到下,元素的电负性逐渐减 小。
副族元素:变化不明显。素:有效核电荷增加不多,但电子层数逐
渐增加,故原子半径逐渐增大。
副族元素:原子半径一般也增大,但第五、六周
期同族元素原子半径相近,这是由于镧系收缩。
镧系收缩是指镧系元素整个系列原子半径缩小 的现象,镧系收缩使镧以后的元素原子半径都缩 小,使它们的半径和第五周期同族元素相近。
金属半径:金属晶体中,相邻两原子核间距离的一半。
范德华半径:分子晶体中非键的两个同种原子核间距离的一半
原子半径在周期表中的变化规律: (1)同一周期从左到右
主族元素:电子填充在最外层,有效核电荷增大,而电子 层数不变,故原子核对电子的吸引力增大,原子半径明显 减小。
副族元素:电子填充在次外层,有效核电荷增加不多,从 而原子半径减小较慢,且有例外。
一般第一电子亲合能为正,第二电子亲合能为负, 因为负离子带电排斥外来电子,要结合电子必须 吸收能量以克服电子的排斥。
电子亲和能的大小反映了原子得电子的难易, 电子亲和能越大,表示原子得到电子时放出的能 量越多,即越易得到电子。
变化规律:
同一周期:从左到右有效核电荷增大,原子半径减小,故 电子亲和能逐渐增大。
