第九章功能配合物之磁性配合物简介
第9章 9.7配合物的化学键理论
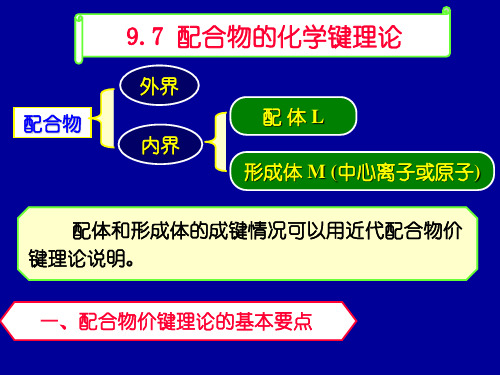
F-, H2O, OH-
常形成外轨型配离子 ( 因配位原子F, O电负性高)
配 CN-, CO
常形成内轨型配离子
体
(C的电负性较低,易给出孤对电子)
NH3, Cl-
内, 外轨型配离子均可形成 ( 由中心离子决定)
4、内轨型和外轨型配合物的稳定性和磁性
1)稳定性(解离程度)
一般来说 , 内轨型配 离子比外轨型配离子稳 定,解离程度小。
常见的轨道杂化类型与配合物几何构型的对应关系
杂化类型 配位数 几何构型
实例
spp ssp2 spp33 dspp22 dspp33 sp33dd22 d22sp33
2
直线型
[Ag(NH3)2]+,[Cu(NH3)2]+
3 平面正三角形
[ CuCl3]-
4
正四面体
[Ni(NH3)4]2+,[Zn(NH3)4]2+
4
正方形
[Cu(NH3)4]2+,[Ni(CN)4]2-
5
三角双锥
[Fe(CO)5]
6
正八面体
[FeF6]3-,[Co(NH3)6]2+
6
正八面体
[Fe(CN)6]3-,[Co(NH3)6]3+
sp, sp2, sp3, sp3d2杂化 形成外轨型配合物
dsp2,dsp3,d2sp3杂化 形成内轨型配合物
正八面体
配体 中心离子
三角双锥
[Zn(NH3)4]2+是正四面体
Zn2+
Fe3+
[FeF6]3-是正八面体
Ni2+
[Ni(CN)4]2-是正方形
Ni2+
F e
配合物的结构理论

释配离子的几何构型及某些化学性质和磁性 等。
缺陷:孤立地看到配体与中心原子的成键,
忽略了成键过程中配体电场对中心原子d轨道
的作用,因而不能定量地说明配合物的其他
一些性质,如离子的颜色,特征光谱,稳定
性等。
h
26
二、晶体场理论
中心思想——静电理论
视中心离子和配体为点电荷,带正电荷的 中心离子和带负电荷的配体以静电相互吸引, 配体间相互排斥。
n—未成对电子数
h
18
h
19
中心原子(或离子)用外层轨道接纳配体电子, 得到外轨型配合物。
[FeF6]3– sp3d2杂化, 八面体构型, 外轨型配合物
h
20
中心原子(或离子)用部分内层轨道接纳配体 接纳配体电子,得到内轨型配合物。
d2sp3杂化, 八面体构型,内轨型配合物
h
21
Co(NH3)63+: Co3+ 3d6 内轨型配合物,低自旋 = 0
3d
4s 4p
[CoF6]3- 3d [Co(CN)6]3-—— 正八面体
F-
sp3d2
3d d2sp3
h
4d
10
轨道杂化类型与配位个体的几何构型
h
11
配位键类型——内轨配键、外轨配键
内轨配键: (n-1)d,ns,np杂化形成配位键。 内轨型配合物:由内轨配键形成的配合物 如 [Fe(CN)6]3-,[Co(NH3)6]3+,[Ni(CN)4]2-
这个顺序称为光谱化学序。
在序列中,配位体可分为强场和弱场。一般羟基,水及卤素
离子都是弱场配体。 越大—强场, 越小—弱场
无机化学-配合物

此外,还有其它类型的配体,如两个原子与中心 原子形成一个配键(含π电子的烯烃)、一个原 子同时与两个中心原子配位的桥连配体等。
3.配位数与配体数
配合物中与中心原子相连的配体的数目称为配体 数,而与中心原子相连的配位原子的总数称为 配位数。很显然,对于单齿配体,配位数与配 体数相同,而对于多齿配体来说,二者则不相 同。例如[Fe(CN)6]3+中Fe3+的配体数和配位数都 为6;[Cu(cn)2]2+中Cu2+的配体数为2,配位数为 4。
Ag+
杂化 成键
4d10 4d10 4d10
5s
5p
sp杂化轨道
5p
spsp3
5p
2个电子对由
NH3分子中N 原子提供
[Ag(NH3)2]+ 配离子的空间构型为直线形; 为外轨型配合物;配位数为2;由于没有单电 子,所以[Ag(NH3)2]+配离子为抗磁性。
其它如[Ag(CN)2]-、[Cu(NH3)2]2+等,情况也 都类似。
天蓝色
深蓝色
[Cu(NH3)4]2++4OH-(少量)
深蓝色
在水溶液中SO42-是自由的,能独立地显示其 化学性质(如与BaCl2生成白色沉淀)。但 这时化合物中的Cu2+和NH3已经结合为 Cu(NH3)42+离子了,从而在一定程度上丧失 了Cu2+和NH3各自独立存在时的化学性质, 实际上它们形成了稳定性很高的新的结构,
H3N H3N
Cl NH3
Co NH3
Cl
第二节 配合物的化学键理论
• 有关配合物的结构问题,实质是中心原子 与配体之间靠什么结合在一起以及配合物 的空间构型问题。这个问题有不少科学家 提出了各种各样的理论,其中1893年维尔 纳提出的主、副价说最有代表性,维尔纳 也被称为近代配合物化学的创始者。他认 为在配离子如PtCl62-中,Pt4+除了以主价 (符合经典化合价理论的价)与4个Cl-结合 以外,还能以副价同额外的两个Cl-结合成 PtCl62-。
配合物的基本概念以及应用

同一种离子稳定性:内轨型>外轨型
什么情况下形成内轨型或外轨型配合物,价键理论不能判断。 只能以磁矩为依据测磁矩。
磁矩: n(n 2)
由测的磁矩求出未成对电子数n,若n与其离子的未成对电子 数相同,则为高自旋,反之为低自旋。
如实验测得[Fe(H2O)6]3+ µ=5.25,则求得n=4
配位原子:配体中提供孤电子对的原子。
如上述X、N、O、C、S等 。
单基(单齿)即只有一个配位原子
配体 多成基键(的多配齿体)。即如同H2时O 有两个以上配
位原子成键的配体。如乙二胺等。
注:常见配位体的齿数见P862表19-1。
3、配位数与中心离子配位的配位原子数即齿数
[Ag(NH3)2]+ [Cu(NH3)4]2+ [Cu(en)2] CuY2-
C 在空间构型不同的配合物中配体形成 不同的晶体场,对中心原子d轨道的影响也 不同。
八面体场
在八面体场中沿坐标轴方向伸展的dz2,dx2-y2 轨道,与配体处于迎头相碰状态,故受配体电 场的强烈排斥而能差升高,而夹在坐标轴之间 的dxy,dxz,dyz轨道则受到的排斥力较小,能 差上升较少,由于这三个轨道对配体有相同的 空间分布,因此能差相同,形成一组三重简并 轨道。称为dε轨道。而dz2,dx2-y2在八面体场 中具有相同的能量,所以形成另一组二重简并 轨道称dr轨道。
2
4
4
6
配位数与中心离子(原子)的电荷、半径有关。电荷增加, 配位数增加;半径增加,配位数减小。但半径太大配位数 反而减小,因为引力减小。
4、离子电荷
等于中心离子(原子)和配位体总电荷数之和。 如:[Ag(NH3)2]+ 、 [Cu(NH3)4]2+、
配合物知识简介

配合物知识简介第一节配合物的概念硫酸铜与氢氧化钠反应生成氢氧化铜[Cu(OH)2]沉淀。
如果再沉淀中加入氨水并加以振动,沉淀很快溶解,溶液呈深蓝色。
这是由于生成了一种复杂离子[Cu(NH3)4]2+,这个离子在水溶液里很难电离,因此,水溶液里的Cu2+大大减少了,当再加入氢氧化钠时,就不能生成氢氧化铜沉淀了。
如果把这种溶液浓缩、结晶,就得到了深蓝色的晶体,称为硫酸四氨合铜(Ⅱ)。
这是一种复杂的化合物[Cu(NH3)4]2+,这种由一种正离子跟一定数目的分子或负离子所形成的一类复杂离子,叫做配离子。
像硫酸四氨合铜(Ⅱ)这样含有配离子的化合物,叫做配合物(也称络合物)。
第二节配合物的组成配合物的结构比较复杂,但一般说来,它都有一个金属离子作为整个配合物的核心,称作中心离子。
在中心离子周围结合着一定数目的中性分子或负离子,称为配位体。
例如,硫酸铜氨[Cu(NH3)] SO4这种配合物里,Cu2+是中心离子,氨分子叫做配合物的配位体。
中心离子和配位体结合在一4起就构成了配离子。
SO42-距中心离子较远,跟中心离子的关系不像配位体那么密切。
把中心离子合配位体一起构成的配离子叫做配合物的内界,在分子式中常用方括号[]把它们括起来,而把其他部分,如SO42-离子,叫做配合物的外界。
配合物的中心离子也叫配合物的形成体,一般都是阳离子。
配合物的配位体可以是分子,也可以是阴离子。
配离子是带有电荷的,而配合物不显电性。
因此,组成配合物的外界离子、中心离子和配位体离子电荷代数的和为零。
一个中心离子所能结合的配位体总数,叫做中心离子的配位数,例如在[Cu(NH3)4]2+中,Cu2+的配位数是4。
影响中心离子配位数的因素有很多,常见中心离子配位数用表5—1表示。
凡是可作为配位体(或含有可作配位体的离子)的物质,叫做配合剂。
配合物的命名方法服从一般无机化合物的命名原则。
如果化合物的酸根是一个简单离子,就叫某化合物(如氯化钾),如果酸根是一个复杂阴离子便叫某酸某(硫酸铜),不同点在于必须标明配离子的情况。
(完整版)无机及分析化学第九章答案

第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成分别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全部的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将0.10mol·L-1ZnC12溶液与1.0mol·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解:Zn2++ 4NH3= [Zn(NH3)4]2+平衡浓度/mol·L -1 x 0.5-4×0.05+4x ≈0.3 0.05-x ≈0.0594342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=2.13×10-9mol·L -15.在100mL0.05mol·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 0.05 0.01 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在0.1mol·L -1氨水中的溶解度。
无机化学中的配合物的磁性性质研究

无机化学中的配合物的磁性性质研究磁性是物体自然具备的性质之一,所谓磁性,就是指物体受到磁场的作用时所表现出来的行为。
磁性被广泛运用于各个领域,如医学、工业、能源等。
在无机化学研究中,配合物的磁性性质是一个重要的研究课题。
配合物是由金属离子和配体结合而成的化合物,它的磁性性质与其成键方式、电子构型等有着密切的关系。
I. 配合物的磁性分类在无机化学中,根据配合物的磁性表现,可以将其分为三类,分别是顺磁性、反磁性和抗磁性。
1. 顺磁性顺磁性是指物质在外加磁场下,其磁偶极矩与磁场方向相同并且强度增大。
顺磁性物质中的电子轨道填充状态是不对称的,这导致一部分电子不成对,形成自旋磁量子数为1/2的自由电子。
顺磁性物质中的金属离子具有未配对电子,磁场作用下这些电子会导致金属离子的总磁矩增强,从而增强配合物的磁性。
例如,Fe2+、Ni2+和Cu2+等金属离子在配位化合物中具有顺磁性。
2. 反磁性反磁性是指物质在外加磁场下,其磁偶极矩与磁场方向相反并且强度减小。
反磁性物质中的电子轨道填充状态是对称的,即其电子成对存在。
反磁性物质中的金属离子具有配对电子,在磁场作用下这些电子会对配合物的磁性产生抵消作用,从而减弱配合物的磁性。
例如,Zn2+、Cd2+和Hg2+等金属离子在配位化合物中具有反磁性。
3. 抗磁性抗磁性是指物质在外加磁场下,其磁偶极矩与磁场方向垂直,且强度基本不变。
抗磁性物质中的电子轨道填充状态是对称的,但是这些电子的自旋方向和运动方向不对称,导致其总磁矩为零,并对配合物的磁性不产生影响。
例如,Be2+、Mg2+和Ca2+等金属离子在配位化合物中具有抗磁性。
II. 研究顺磁性和反磁性配合物的方法研究顺磁性和反磁性配合物的方法有许多,其中最为常用的就是磁学法。
磁学法的原理是利用电子自旋与轨道角动量相互作用的规律,通过测量磁化强度和磁场之间的关系,确定金属离子是否存在未配对电子。
磁化强度指的是一个系统在外加磁场作用下所表现出来的极化程度。
功能配合物、MOFs讲解

李 洋 问研良
中北大学
Contents
CPs简介
CPs的合成、表征
CPs的应用 CPs的发展前景
Introduction MOMs
金属有机材料(Metal-Organic Materials, MOMs)是
在超分子自组装和晶体工程基础上发展起来的,是通过 有机配体和金属离子之间的超分子作用而形成的具有不 同维度结构的化合物,包括零维的分立结构(Discrete 0D)及多维配位聚合物(Coordination Polymers, CPs)等。 范德华力、氢键、堆积作用 超分子作用 配位键
直线链结构的配位聚合物[Ag(4,4’-bpy) ]NO2
Synthesis And Characterization 合成策略
单齿配位的直线型配体 4,4’-联吡啶(4,4’-bpy) 易形成平面四边 形配位的CuII离子
正方形网格型 的二维聚合物
Synthesis And Characterization 合成策略
Application
有机催化
90º C, 140 mg 甲酸 在20mgAu-Pd/EDMIL-101催化剂中,
65min完全转化为
H2和O2
பைடு நூலகம்
催化活性高(Au-Pd
交互作用),且不因 CO失活(由于Au的
存在)
Outlook
根据所需功能的不同,精确控制MOFs 材料的组装,推动合成化学领域的进步
溶 剂 1、直接影响反应物、产物的溶解度 2、与
可以作为模板剂 3、是聚合物自组装过程的
反应环境
CuCO3(OH)2+Heim(2-乙基咪唑) 环己烷 水 得一之字链状聚合物(α相),分子 式为[Cu(eim)] 产物分子式与α相一致,但超分子结 构为三螺旋(β相)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(9-21)
式中,BJ(y)为布里渊函数:
(9-22) 其中, 当H/kT和y值较小时, 当H/kT非常大时,M趋近饱和磁化强度值: (9-24) (9-23)
表9-3-2 具有3dn高自旋过渡金属离子的基态原子谱项、 exp 单电子自旋-轨道耦合参数ζ3d、S、2[S(S+1)]1/2和 eff
(9-6)
当θ为负值时,为反铁磁性耦合 当θ为正值时,为铁磁性耦合 (9-7)
有效磁矩的定义为:
eff 3kT / N 2 g J ( J 1)
式中 g是朗德(Landé )因子;k是玻耳兹曼常数;
N是阿伏伽德罗常数;β是玻尔磁子
3、范弗列克方程与磁化率
物质在磁场中产生的磁场强度与分子能态的关系为:
①在295 K下测定
3.2、 磁化率
Heisenberg-Dirac-Van Vleck (HDVV) 哈密顿算符 H = ̶ J SA ·SB J为交换常数,表示磁耦合作用的强度 J值为负时,表示反铁磁性耦合作用 J值为正时,表示铁磁性耦合作用 体系的总自旋为: S2 = SA2 + SB2 + 2SA ·SB 哈密顿算符可变换为 H = ̶ J (S2 - SA2 - SB2)/2 (9-26) (9-27) (9-25)
M E / H
(9-8)
如果在磁场中每个分子具有不同的能级分布En (n = 1, 2, …) 则每一个能级可定义一个微观磁矩: n En / H 磁性粒子在每个能级上的分布符合玻耳兹曼(Boltzmann) 分布规律:
(9-9)
Ni / N j exp(Ei / kT )
1S 0 2F 5/2 3H 4 4I 9/2 5I 4 6H 5/2 7F 0 8S 7/2 7F 6 6H 15/2 5I 8 4I 15/2 3H 6 2F 7/2 1S 0
625 758 884 1000 1157 1326 1450 1709 1932 2141 2369 2628 2870
2S+1L J
ζ4f /
cm-1
gJ
6/ 4/ 8/ 7 5
gJJ
15/ 16/ 36/ 7 5
gJ
[J(J+1)]1/2 0 2.535 3.578 3.618 2.683 0.845 0 7.937 9.721 10.646 10.607 9.581 7.561 5.436 0
exp eff
①
19世纪末 皮埃尔∙居里:磁性物体会因温度的增加而减少其磁性
型
1988年
一、 磁性的基本概念
在磁场中,物质的磁化强度M与外加均匀磁场H的关系: (9-1) M H 式中χ为摩尔磁化率。 当磁场足够弱,χ不依赖于外加磁场H时
M=χH 磁化率是无量纲的数值 体积磁化率表示为emu cm–3 摩尔磁化率表示为emu mol–1或cm3 mol–1 (9-2)
11 3/ 5 2/ 7
0 2 3/ 2 4/ 3 5/ 4 6/ 5 7/ 6 8/ 7
11 12/ 5 5/ 7
0 7 9 10 10 9 7 4
2.3~2.5 3.4~3.6 3.4~3.5 2.9 1.6 3.5 7.8~7.9 9.7~9.8 10.2~10.6 10.3~10.5 9.4~9.5 7.5 4.5
其中,ΔEi为能级i和基态j之间的能级间距
宏观摩尔磁化强度: N n (En / H ) exp En / kT M n exp En / kT
(9-10)
3.1、van Vleck方程
1923年,范弗列克(van Vleck)对此提出了两点假设: ①假设外磁场中的能级En按级数展开:
Ln3+ La3+ Ce3+ Pr3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+ Tb2+ Dy3+ Ho3+ Er3+ Tm3+ Yb3+ Lu3+ 4fN 4f0 4f 1 4f 2 4f 3 4f 4 4f 5 4f 6 4f 7 4f 8 4f 9 4f 10 4f 11 4f 12 4f 13 4f 14
ζ3d / cm-1 154 209 167 273 230 352 347 (460) 410 (580) 533 (715) 649 829
S 1/ 2 1 3/ 2 3/ 2 2 2 5/ 2 5/ 2 2 2 3/ 2 3/ 2 1 1/ 2
2[S(S+1)]1/2 1.73 2.83 3.87 3.87 4.90 4.90 5.92 5.92 4.90 4.90 3.87 3.87 2.83 1.73
参考书
[1]刘伟生 主编,配位化学,化学工业出版社,2013
[2] Carlin R L. Magnetochemistry. Berlin, Heidelberg, New York,
Tokyo: Springer-Verlag, 1986. [3] Kahn O. Molecular Magnetism. New York, Weinheim, Cambridge: VCH Publishers Inc, 1993. [4] 理查德 L 卡林著,万纯娣,臧焰,胡永珠,万春华译,王国雄 校. 磁化学. 南京: 南京大学出版社, 1990. [5] 章慧等编著,陈耐生主审. 配位化学—原理与应用. 北京: 化学工 业出版社, 2008. [6] 游效曾著. 分子材料—光电功能化合物. 上海: 上海科学技术出版 社, 2001. [7] 姜寿亭,李卫编著. 凝聚态磁性物理. 北京: 科学出版社, 2003.
1.65~1.79 2.75~2.85 3.80~3.90 3.70~3.90 4.75~4.90 4.90~5.00 5.65~6.10 5.70~6.00 5.10~5.70 5.30 4.30~5.20 2.80~3.50 1.70~2.20
exp ① eff
①在295 K下测定
表9-3-3 镧系离子的基态原子谱项、单电子自旋-轨道耦合 exp 参数ζ4f、gJ、gJJ、gJ[J(J+1)]1/2和 eff
N n (En / H ) exp En / kT M n exp En / kT
对于考虑轨道贡献的一个任意体系来说,由电子
的轨道角动量和自旋角动量耦合形成的总角动量
和总磁矩在外磁场中的取向是量子化的,其磁矩
的绝对值为:
(9-20) 式中
在外磁场中的能级为
从式(9-10)不经任何近似推导出体系的总磁化强 度M为:
磁的历史简介
春秋时代《管子∙地数》和战国时代《鬼谷子》中有磁石和磁石取针的 记载 公元前3世纪 利用天然磁石制成了司南 1819年 1831年 1845年 1907年 1928年 汉斯∙奥斯特:电流可以使小磁针偏转 迈克尔∙法拉第:电磁感应现象 迈克尔∙法拉第:提出顺磁性与抗磁性的概念 皮埃尔∙外斯:分子场自发磁化假说和居里-外斯定律 维尔纳∙海森伯:自发磁化来源于量子力学中交换的理论模 阿尔贝∙费尔和彼得∙格林贝格尔分别独立发现了巨磁阻效应
例:2,2'-联吡啶的抗磁磁化率
D bipy 10D Cring 2D Nring 8D H 2pyridine Ar - Ar
= [10*(–6.24) + 2*(–4.61) + 8*(–2.93) + 2*(0.5) + (–0.5ห้องสมุดไป่ตู้] 10–6 emu mol-1 = –95 10–6 emu mol–1
中性原子
Ag Al As(III) As(V) B Bi Br C –31.0 –13.0 –20.9 –43.0 –7.0 –192.0 –30.6 –6.0 C(ring) Ca Cl F H Hg(II) I K –6.24 –15.9 –20.1 –6.3 –2.93 –33.0 –44.6 –18.5 Li Mg N(ring) N(open chain) Na O P Pb(II) –4.2 –10.0 –4.61 –5.57 –9.2 –4.6 –26.3 –46.0 S Sb(III) Se Si Sn(IV) Te Tl(l) Zn –15.0 –74.0 –23.0 –13 –30 –37.3 –40.0 –13.5
只有未成对电子的物质才具有顺磁性 正值,其数值一般为10–4 10–2 emu mol–1数量级 通常与场强无关,而与温度有关 居里(Curie)定律:
C P T
式中 C为居里常数 的自由离子
(9-5)
居里定律仅可适用于顺磁性离子之间没有磁耦合作用
当顺磁性离子之间存在着磁相互作用时,在较高温度 区间服从居里-外斯(Curie-Weiss)定律: C P T 式中θ为外斯常数
1、抗磁性
抗磁性:在与外磁场相反的方向诱导出磁化强度 抗磁性是所有物质的一个根本属性 抗磁磁化率是负的
数值很小,一般只有10–5 emu mol-1
与场强和温度无关 帕斯卡(Pascal)常数法:分子抗磁磁化率等于组成该 分子所有原子(χDi)和化学键(λi)的抗磁磁化率之和
表9-3-1 帕斯卡常数(摩尔磁化率 10–6 emu mol-1)
(9-15)
将式(9-15)代入式(9-14),并仅保留H的一次项
(9-16) 此式就是著名的范弗列克方程
需确定假设条件在此体系中是适用的
磁化率仅在M与H呈线性时的磁场范围内
适用。
范弗列克方程应用举例: 最简单情况:没有轨道角动量贡献的唯自旋型顺磁
离子,且基态和激发态能级间隔较大,其耦合作用
式中 SA,SB为顺磁离子A和B的自旋角动量算符
能量的本征值为:
