精选-基础化学答案第08
基础化学课后答案chapter8_answer

Chapter 8 Reodx reactions and electrode potentials习题1、K2CrO4: +6;Na2S2O3: +2Na2SO3: +4ClO2: +4N2O5: +5NaH: -1K2O2: -1K2MnO4: +62、(1)2MnO4- + 5H2O2 + 6H+ 2Mn2+ + 5O2 + 8H2O(2)Cr2O72- + 3SO32- + 8H+ 2Cr3+ + 3SO42- + 4H2O(3)3As2S3 + 14ClO3- + 8H2O 14Cl- + 6H2AsO4 + 9SO42- + 18H+ 4、(1)Zn2+<Fe3+<MnO2<Cr2O72-<Cl2<MnO4-(2)Cl-<Cr3+<Fe2+<H2<Li5、(-) Zn(s) | Zn2+ (aq) || Ag+ (aq) | Ag(s) (+)(-) Pt(s) | Cr2O72-(aq), Cr3+(aq), H+(aq) || Cl-(aq) | Cl2(g)| Pt (+)(-) Pt(s) | I2(s)| IO3-(aq), H+(aq) || Fe3+(aq), Fe2+(aq) | Pt(s) (+)(1)、(2)反应正向自发;(3)反应逆向自发。
7、两个半反应相减得:2H2O2(aq) 2H2O(aq) + O2(g) 0θVV..=VE.=10816951>776-在标准状态下,H2O2能自发分解成H2O和O2。
8、(1)V kPakPa V c c P P VH H H H H H 068.010.0100/200lg 205916.00)/(/lg205916.0)/()/(22222-=-=-=+++θθθϕϕ(2)V V c c c c c c VCr O Cr Cr O Cr Cr H O Cr 818.0)0010.0lg(605916.0232.1)/()/)(/(lg 605916.0)/()/(14214327232723272=+=+=++-+-+-θθθθϕϕ(3)V V V c c V Br Br Br Br Br 107.120.01lg 205916.0066.1)/(1lg 205916.0)/()/(2222=+=+=---θθϕϕ9、pHV c c c c c c V Mn MnO Mn MnO Mn H MnO 09466.0507.1)/()/)(/(lg 505916.0)/()/(2482424-=+=++-+-+-θθθθϕϕ (1)pH=0.0,0507.109466.0507.1)/(24=-=+-pH V Mn MnO ϕ )/()/()/(2224--+->>I I Br Br Mn MnO θθϕϕϕMnO 4-离子能氧化Br -离子和I -离子。
基础化学李保山第二版8-氧化还原反应习题答案

8 氧化还原反应习题解答(p222-226)1. 用氧化值法配平下列各氧化还原方程式。
(1)3Cu 2S +22HNO 3 = 6Cu(NO 3)2 +3H 2SO 4 +10NO+8H 2O (2)NH 4NO 2 = N 2 + 2H 2O(3)(NH 4)Cr 2O 7 = N 2 + Cr 2O 3 +4H 2O(4)3As 2S 3 + 28HNO 3+4 H 2O = 6 H 3AsO 4 + 9H 2SO 4 +28 NO (5)K 2Cr 2O 7 + 3H 2S +4 H 2SO 4 = Cr 2(SO 4)3 + 3S + 7H 2O + K 2SO 4 (6)2Na 2S 2O 3 + I 2 = Na 2S 4O 6 + 2NaI (7)2 MnO 4-+3 Mn 2++2 H 2O =5 MnO 2 +4 H +(8)4[Co(NH 3)6]2++ O 2 +2H 2O = 4 [Co(NH 3)6]3++ 4OH -2. 用离子-电子法配平下列方程式。
(1-11)为酸性介质,(12-14)为碱性介质 (1) Cr 2O 72-+ 3H 2O 2 + 8H += 2 Cr 3++ 3O 2 +7 H 2O (2) 2 MnO 4-+5 SO 32-+6 H += 2Mn 2++ 5 SO 42-+3 H 2O (3) ClO 3-+ 6I - + 6H += Cl - +3 I 2 + 3H 2O(4) 5NaBiO 3(s) + 2Mn 2++14 H += 5Na ++5 Bi 3++ 2 MnO 4-+7 H 2O (5) H 2S +2 Fe 3+= S +2Fe 2++ 2H +(6) 3P 4(s)+20HNO 3(浓)+8 H 2O =12H 3PO 4+20NO (7) 2FeS 2+30HNO 3Fe 2(SO 4)3+30NO 2+H 2SO 4+14H 2O (8) 7PbO 2+2MnBr 2+14HNO 37Pb(NO 3)2+2Br 2+2HMnO 4+6H 2O(9) 28HNO 3+3As 2S 3+4H 2O 9H 2SO 4+6H 3AsO 4+28NO (10) As 2S 5+10NO 3-+10H +2H 3AsO 4+10NO 2+5S+2H 2O (11) 2Bi 3++3S 2O 32-+3H 2O Bi 2S 3+3SO 42-+6H + (12) Cl 2 + 2OH -== Cl - + ClO -+ H 2O(13) 2[Cr(OH)4]-+ 3H 2O 2 + 2OH -== 2 CrO 42-+8H 2O (14) SO 32-+ Cl 2 +2OH -==2 Cl - + SO 42-+ H 2O3. (1)逆向进行(2) )(0=θ/Sn n θ+24V E E 15.=++S)(=θ/MgMg θ-V E E 37.22-=+)(2.370.15=-θ-θ+θV E E E 52.2=+=∴正向进行(3) )1.09(==θ/Br Br θ+-2V E E)(77.0==θ/Fe e F θ-+2+3V E E )(32.0=0.77-1.09=-=θ-θ+θV E E E∴正向进行(4) )(=θ/Pbθ+2V E E 13.0-=+Pb )(=θn/Z n θ-2V E E 76.0-=+Z )(0-0.13=-θ-θ+θV E E E 63.076.=+=∴正向进行4.(1)V n n E 55.1100.1)0.1(10.0lg 50592.051.1)M /O M (4824=⨯⨯+=-+-(2)V E 67.110.00.1lg 10592.072.1)Ce /Ce (34=+=++(3)VcK E E HAc 17.01075.110.0lg 0592.000.0lg 10592.0)/H H ()HAc/H (522-=⨯⨯+=+=-+θθ(4)Vc K g E E Cl sp 341.0100.1108.1lg 0592.0799.0lg 10592.0/Ag)A ()AgCl/Ag (210+=⨯⨯+=+=--+-θθ(5)Vc c c c c c E E 40.018.058.0)100.1(0.10.1lg 40592.058.0)/)(/()/(lg 40592.0)O /S SO ()O /S SO (6226OH O S 2SO 232232322323223-=+-=⨯⨯+-=+=--------θθθθ(6)Vc c p p E E O 564.0)100.1(100/0.10lg 40592.0401.0)/(/lg 40592.0)/OH O ()/OH O (434OH 222=⨯+=+=----θθθ5. 解答:(1)2Ag +(0.10 mol·L -1) + Cu(s) ==2Ag(s) + Cu 2+(0.010 mol·L -1) 电池符号: (-) Cu|Cu 2+(0.010 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) 电极反应: (+) Ag ++e = Ag(s) (-) Cu-2e = Cu 2+电动势∶V c c g E A g E Ag 740.010.0lg 0592.0799.0lg 10592.0/Ag)A ()g /A (+=+=+=+++θθV c c C Cu E C Cu E Cu 278.0010.0lg 20592.0337.0lg 20592.0)u /()u /(222+=+=+=+++θθV C Cu E A g E E 462.0278.0740.0)u /()g /A (2=-=-=++(2)MnO 2(s)+ 2Cl -(12 mol·L -1) + 4H +(12 mol·L -1) = Mn 2+(1.0 mol ·L -1) + Cl 2(100kPa) + 2H 2O(l) 电池符号:(-) Pt, Cl 2(100kPa)|Cl -(12.0 mol·L -1)||Mn 2+(1.0mol·L -1),H +(12.0 mol·L-1)|MnO 2(s),Pt(+) 电极反应:(+) MnO 2+ 4H ++2e== Mn 2++ 2H 2O\(-) 2Cl —2e== Cl 2 电动势∶Vc c c c E E Mn 36.10.112lg 20592.023.1/)/(lg 20592.0)/Mn MnO ()/Mn MnO (44H 22222+=+=+=++++θθθV c c p p E E Cl 30.1121lg 20592.036.1)/(lg 20592.0)/Cl Cl ()/Cl Cl (22Cl 222+=+=+=--θθθV E 06.030.136.1=-=(3)H 3AsO 3(0.10 mol·L -1)+ I 2(s) + H 2O(l) = H 3AsO 4(1.0 mol·L -1) + 2I -(0.010 mol·L -1) +2H +(0.10 mol·L -1) 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1), H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010mol·L -1)|I 2(s), Pt (+) 电极反应: (+) I 2+2e =2I -(-) H 3AsO 3+ H 2O-2e = H 3AsO 4+2H +电动势∶34332H AsO H 34333433H AsO 2(/)(/)0.0592(H AsO /H AsO )(H AsO /H AsO )lg2/0.0592 1.0(0.10) 0.559lg 0.52920.10c c c c E E c c Vθθθθ+=+⨯=+=+22222I 0.059210.05921(I /I )(I /I )lg 0.536lg 0.6542(/)2(1.010)E E V c c θθ----=+=+=⨯E = 0.654-0.529=0.125V(4)Cr 2O 72-(1.0 mol·L -1) + 6Fe 2+(0.10 mol·L -1) +14H +(1.0 mol·L -1) = 2Cr 3+(0.10 mol·L -1) + 6Fe 3+(1.0 mol·L -1) + 7H 2O(l) 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1), Cr 3+(0.10mol·L -1), H +(1.0 mol·L -1)|Pt (+) 电极反应:(+) Cr 2O 72-+14H ++6e = 2Cr 3++ 7H 2O(-) Fe 2+-e = Fe3+电动势∶227314Cr O H 232327272Cr (/)(/)0.0592(Cr O /Cr )(Cr O /Cr )lg 6(/)c c c c E E c c θθθθ-++-+-+=+1420.0592(1.0)(1.0)1.33lg 1.356(0.10)V =+= 323232Fe Fe /0.0592 1.0(Fe /Fe )(Fe /Fe )lg 0.7710.0592lg 0.8301/0.10c c E E Vc c θθθ++++++=+=+=+E =1.35-0.830=0.52V6. 解答:(1) E =E (+)-E (-)θθθc c c c E E E /lg 20592.0440.0/lg 20592.0)/Fe Fe ()/Fe Fe ()(22Fe Fe 22+++-=+==+++ Vc c E E E 822.0100.1lg 20592.0763.0/lg 20592.0)/Zn Zn ()/Zn Zn ()(2Zn 222-=⨯+-=+==--+++θθ 0.293= -0.440+(0.0592/2)lg c (Fe2+)+0.822 c (Fe2+)=1.0×10-3(mol ·L -1) (2)(-)Ag ∣Ag +(y mol·L -1)‖Ag +(1.0×10-1mol·L -1)∣Ag (+) E =0.0592V ,求负极Ag +的浓度。
基础化学(人卫第8版)课后习题参考答案

13g 9.0g L1
1.4L
12、 nI2
m(I2 ) M (I2)
0.508g 254g mol 1
2.00 103 mol
nKI KMnO4 2n(I 2 ) 2 2.00 103 mol 4.00 103 mol
Exercises 2. 29.837 29.24 0.018618 0.19
1.89mol
8、 n(ZnCl2 )
m(ZnCl2 ) M (ZnCl2 )
350 g 136.3g mol 1
2.57mol
此溶液的物质的量浓度为:
c(ZnCl 2 )
n(ZnCl 2 ) V
2.57mol 739.5mL
3.48mol
L1
此溶液的质量摩尔浓度为:
b(ZnCl 2 )
n(ZnCl 2 ) m(H 2O)
2.57mol 650g
3.95mol
kg 1
m(K )
20mg
9、 c K n(K ) M (K ) 39.0g mol 1 5.1mmol L1
V
V
100mL
m(Cl )
366mg
c Cl n(Cl ) M (Cl ) 35.5g mol 1 103mmol L1
V
V
100mL
10、 m(C6 H12O6 ) 50.0g L1 500mL 25.0g
m(C6 H12O6
H 2O)
25.0g
M (C6 H12O6 H 2O) M (C6 H12O6 )
《基础化学》课后习题参考答案(有机部分)
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
基础化学第8版-自测题及课后习题解答-第2章

3
2. 稀溶液的依数性包括 (4) 、 (5) 、 (6) 和 (7) 。 3. 产生渗透现象的必备条件是 (8) 和 (9) ; 水的渗透方向为 (10) 或 (11) 。 四、问答题 1. 何谓 Raoult 定律?在水中加入少量葡萄糖后,凝固点将如何变化?为什么? 2. 在临床补液时为什么一般要输等渗溶液? 五、计算题 1. 临床上用来治疗碱中毒的针剂NH4Cl (Mr= 53.48),其规格为 20.00mL一支,每支含 0.160 0g NH4Cl,计算该针剂的物质的量浓度及该溶液的渗透浓度,在此溶液中红细胞的行为如何? 2. 溶解 0.113 0g磷于 19.04.0g苯中,苯的凝固点降低 0.245 ℃ ,求此溶液中的磷分子是由几个磷原子 组成的。(苯的Kf = 5.10 K·kg·mol-1,磷的相对原子质量为 30.97)
3.与难挥发性非电解质稀溶液的蒸气压降低、沸点升高、凝固点降低有关的因素为( )
A. 溶液的体积
B. 溶液的温度
C. 溶质的本性
D. 单位体积溶液中溶质质点数
E. 以上都不对 4. 50g水中溶解 0.5g非电解质,101.3kPa时,测得该溶液的凝固点为-0.31 ℃ ,水的Kf = 1.86K·kg·mol-1, 则此非电解质的相对分子质量为( )
A. ② >①>③
B. ①>②>③
C. ② >③>①
D. ③>②>①
E. ① >③>②
2.下列几组用半透膜隔开的溶液,在相同温度下水从右向左渗透的是( )
A. 5%的C6H12O6|半透膜|2%的NaCl B. 0.050 mol·kg-1的NaCl|半透膜|0.080 mol·kg-1的C6H12O6 C. 0.050 mol·kg-1的尿素|半透膜|0.050 mol·kg-1的蔗糖 D. 0.050 mol·kg-1的MgSO4|半透膜|0.050 mol·kg-1的CaCl2 E. 0.90% 的 NaCl|半透膜|2%的 NaCl
基础化学第八版习题答案

基础化学第八版习题答案由于我无法提供具体的习题答案,因为它们通常需要针对特定的习题集或书籍。
但我可以提供一些基础化学习题的解题技巧和方法,这些技巧可以帮助你解决大多数基础化学习题。
# 开头化学是一门以实验为基础的科学,它涉及到物质的性质、组成以及它们之间的变化。
基础化学习题通常要求学生运用化学原理来解决问题。
以下是一些解题的基本步骤和技巧。
# 解题步骤1. 理解题目要求:仔细阅读题目,弄清楚题目要求你解决什么问题。
2. 识别关键信息:找出题目中给出的所有相关信息,如化学方程式、摩尔质量、反应物和生成物的量等。
3. 应用化学原理:根据题目类型,应用适当的化学原理,如摩尔浓度、化学平衡、氧化还原反应等。
4. 列出方程式:如果可能,写出相关的化学方程式或数学公式。
5. 计算:使用适当的数学方法进行计算,确保单位一致。
6. 检查答案:计算完成后,检查答案是否合理,是否符合化学原理。
# 解题技巧- 平衡化学方程式:确保所有化学反应的方程式都是平衡的。
- 使用摩尔概念:摩尔是化学中的基本单位,用于表示物质的量。
- 注意单位转换:在进行计算时,确保所有的单位都是一致的。
- 利用图表:如果题目中提供了图表,如pH曲线或浓度-时间图,要善于利用它们来辅助解题。
- 练习和复习:通过大量练习来熟悉不同类型的习题和解题方法。
# 结尾解决基础化学习题需要耐心和细致的分析。
通过不断练习和应用上述技巧,你将能够提高解题能力,并在化学学习中取得更好的成绩。
记住,化学不仅仅是记忆公式和事实,更是一种解决问题的方法和思维方式。
请注意,具体的习题答案需要根据实际的习题内容来提供,上述内容仅供参考。
如果你有具体的习题需要帮助,请提供题目的详细信息。
基础化学第8版-自测题及课后习题解答-第12章

0.05000mol ⋅ L−1 × 22.14 ×10−3 L × 252 g ⋅ mol−1
2. ω(C6H8O6 ) =
2 0.1988g
= 0.7045
章后习题解答
习题
1. 下列数据,各包括几位有效数字?
(1) 2.0321 (4) 0.01﹪
(2) 0.0215 (5) 1.0×10-5
(3) pKHIn = 6.30
学生自测答案
一、判断题 1.√ 2.× 3. √ 4.× 5.×
4
二、选择题
1.B 2.A 3.B 4.B 5.A
三、填空题
1. (1)酸碱浓度 2. (2)浓 HCl 易挥发 3. (3)10mL (4)40mL 四、问答题
1.答(1)H 2 C 2 O 4 ·H 2 O风化后会失去结晶水,使H 2 C 2 O 4 ·H 2 O变为H 2 C 2 O 4 ,由于H 2 C 2 O 4 的相对分 子质量小于H2C2O4·H2O,会使标定的NaOH溶液浓度偏低。(2)用于含有少量杂质,使所称的邻苯二 甲酸氢钾的物质的量减少,会使测定结果偏高。
3. 两人分析同一试样中的含铜量,其结果质量分数(ω)如下:
甲 0.3610
0.3612
0.3603
乙 0.364l
0.3642
0.3643
巳知此试样中含铜量的真实值为 0.3606。试问何人所得结果的准确度高?何人的结果精密度高?
为什么?
解 甲的 X = (0.3610 + 0.3612 + 0.3603)/3 = 0.3608
2.某一弱酸型指示剂HIn的pKHIn=4.1,那么它的理论变色范围是( )
A. 3.1∼5.1 B. 2.1∼3.1 C. 3.2∼6.2
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
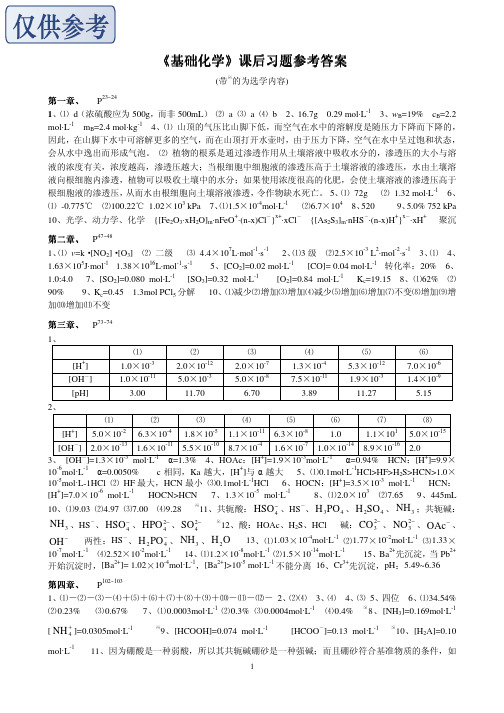
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
章后习题解答[TOP]1、指出下列化合物中划线元素的氧化值:K2CrO4、Na2S2O3、Na2SO3、ClO2、N2O5、NaH、K2O2、K2MnO4解划线元素的氧化值分别为:+6;+2;+4;+4;+5;-1;-1;+6。
2、利用离子-电子法配平下列各反应方程式:(1)MnO4-(aq) + H2O2(aq) + H+(aq)→ Mn2+(aq)+ O2 (g)+ H2O(l)(2)Cr2O72- (aq)+ SO32-(aq)+ H+(aq)→ Cr3+(aq)+ SO42-(aq)+ H2O(l)(3) As2S3 (s)+ ClO3-(aq)+ H+(aq) → Cl-(aq)+ H2AsO4(sln) + SO42-(aq)-解 (1) 2MnO4-(aq) + 5H2O2(aq) + 6H+(aq)→2 Mn2+(aq)+ 5O2 (g)+8 H2O(l)(2) Cr2O72- (aq)+ 3SO32-(aq)+ 8H+(aq)→ 2Cr3+(aq)+ 3SO42-(aq)+4 H2O(l)(3) As2S3 (s)+ 5ClO3-(aq) +5H2O(l)→ 5Cl-(aq)+ 2AsO42-(sln) +3SO42-(aq)- +10H+(aq)3、在原电池中盐桥的作用是什么?是否可以取消?解盐桥的主要作用是:离子导体及中和半电池中的电荷,维持电中性。
盐桥不能取消。
4、根据标准电极电位(强酸性介质中),按下列要求排序:(1)按氧化剂的氧化能力增强排序:Cr2O72-、MnO4-、MnO2、Cl2、Fe3+、Zn2+(2)按还原剂的还原能力增强排序:Cr3+、Fe2+、Cl-、Li 、H2解(1)氧化剂能力增强顺序:Zn2+、Fe3+、MnO2、Cr2O72-、Cl2、MnO4-(2) 还原剂能力增强顺序: Cl-、Cr3+、Fe2+、H2、Li5、根据标准电极电位,判断标态时下列反应的自发方向是否正确,并写出正确的电池组成式。
(1) Zn(s) + Ag+(aq) → Zn2+(aq) + Ag(s)(2) Cr3+(aq) +Cl2(g) → Cr2O72- + Cl-(aq)(3) IO3-(aq) + Fe2+(aq) → Fe3+(aq) + I2(s)解 (1)(-)Zn(s)│Zn2+(aq)‖Ag+(aq) │Ag(s) (+)(2)(-)Pt(s)│Cr3+(aq) , Cr2O72-(aq), H+(aq) ‖Cl-(aq) │Cl2(g)│Pt(s) (+)(3)(-)Pt(s)│Fe2+(aq), Fe3+(aq) ‖IO3-(aq),H+(aq) │I2(s) │Pt (s) (+)6、根据标准电极电位,分别找出满足下列要求的物质(在标态下):(1)能将Co2+还原成Co,但不能将Zn2+还原成Zn;(2)能将Br-氧化成Br2,但不能将Cl-氧化成Cl2。
解 只要找到的氧化还原电对的电极电位处于两个电对的电极电位之间即可。
如(1)Fe 粉; (2) MnO 27、根据下列半反应,说明在标态下H 2O 2能否自发分解成H 2O 和O 2 。
H 2O 2(aq)+ 2 H +(aq) +2e -12 H 2O (l) θϕ= 1.776V O 2 (g) + 2 H + (aq)+2e -1 H 2O 2 (aq) θϕ= 0.695V解 将以上两个电极组成电池,电极电位高的作正极,正极发生还原反应:H 2O 2(aq) + 2 H +(aq) +2e -12 H 2O(l) 负极发生氧化反应:H 2O 2(aq)O 2(g) + 2 H + (aq)+2e -1 电池反应为: 2 H 2O 2 (aq) O 2 (g) + 2 H 2O (l) θE >0 说明在标准状态下H 2O 2能自发分解成H 2O 和O 2 。
8、根据标准电极电位和电极电位Nernst 方程计算下列电极电位:(1) 2H +(0.10 mol ·L -1) + 2 e - H 2(200kPa), (2) Cr 2O 72-(1.0 mol ·L -1) +14 H +(0.0010 mol ·L -1) + 6e -2Cr 3+(1.0mol ·L -1) + 7H 2O, (3) Br 2(l) +2e -2 Br —(0.20 mol ·L -1) 解 (1) n=2,θϕϕ=+2H 2][H lg 20.05916V P += -0.068 V (2) n=6,θϕϕ=+2327214][Cr ]O [Cr ][H lg 60.05916V +-+= 1.232v-0.414v =0.818 V (3) n=2,θϕϕ=+2][Br 1lg 20.05916V - = 1.066v+0.0414v =1.1074 V 9、设溶液中MnO 4-离子和Mn 2+离子的浓度相等(其它离子均处于标准状态),问在下列酸度:(1) pH =0.0, (2) pH = 5.5, MnO 4- 离子能否氧化 I - 和 Br - 离子。
解 已知θϕ(MnO 4-/Mn 2+)=1.507V ,θϕ(Br 2/Br -)=1.066V ,θϕ(I 2/I -)=0.5355V(1) pH=0.0 时,即为标准状态,MnO 4-离子能氧化 I - 和 Br - 离子。
(2) pH=5.5 时 ϕ(MnO 4-/Mn 2+)=θϕ(MnO 4-/Mn 2+)+][Mn ]][H [MnO lg 50.05916V 284++-=1.507 V -0.059 16 V×5.5×8/5=0.986 V故此时,MnO 4-离子只能氧化 I -离子不能氧化Br -离子。
10、二氧化氯常作为消毒剂用于水的净化处理,(1) 二氧化氯的生成反应为:2NaClO 2(sln) + Cl 2(g) = 2ClO 2(g)+ 2NaCl(sln),已知: ClO 2 (g)+ e -ClO 2- (aq) θϕ=0.954V Cl 2 (g)+ 2e - 2Cl - (aq) θϕ=1.358V , 计算该反应的E θ、θm r G ∆和θK 。
(2) 二氧化氯的消毒作用在于:ClO 2(g)ClO 3-(aq) + Cl -(aq),请配平该反应式。
解 (1) 反应的离子方程式为:2ClO 2-(aq)+Cl 2(g) = 2ClO 2(g)+2Cl -(aq)E θ=θϕ+ -θϕ- =1.358V-0.954V = 0.404VθG ∆=-nF E θ=-2×96 500 C·mol -1×0.404V=-77 972 J·mol -1lg θK = n E θ/0.05916v = 2×0.404V/0.059 16V,θK = 4.5×1013(2) 配平得:6ClO 2(g)+ 3H 2O == 5ClO 3-(aq) + Cl -(aq) +6H +(aq)11、已知:Co 3+(aq) +3e -Co(s) θϕ=1.26V ;Co 2+(aq)+ 2e -Co(s) θϕ= -0.28V, 求: (1)当钴金属溶于1.0 mol ·L -1硝酸时,反应生成的是Co 3+还是Co 2+(假设在标准状态下); (2)如改变硝酸的浓度可以改变(1)中的结论吗?已知θϕ(NO 3-/NO )= 0.96V 。
解 (1) 标准状态下,当钴金属溶于1.0 mol·L -1硝酸时,反应生成的是Co 2+ 。
(2) 电极电位相差0.3V ,故改变硝酸的浓度也难改变(1)中的结论。
12、实验测得下列电池在298.15K 时,E = 0.420V 。
求胃液的pH 值(SCE 的电极电位为0.2412V )。
(-) Pt(s) │H 2(100KPa) │胃液│SCE (+) 解 )/H (H )/H (H 2θ2++=ϕϕ+2H 2][H lg 20.05916V P +, E =H SCE ϕϕ-=0.241 2V -0.059 16V(-pH) = 0.420 V得 pH =3.02。
13、在酸性介质中,随pH 值升高,下列氧化型物质中,哪些离子(物质)的氧化能力增强?哪些离子(物质)的氧化能力减弱?哪些离子(物质)的氧化能力不变?Hg 22+、Cr 2O 72-、MnO 4-、Cl 2、Cu 2+、H 2O 2。
解 pH 升高,H +浓度下降。
在半反应中,没有H +参与的电对氧化能力不变;Hg 22+、Cl 2、Cu 2+ ;H +在氧化型一边的电极电位下降,氧化能力减弱;Cr 2O 72-、MnO 4-、H 2O 2;H +在还原型一边的电极电位上升,氧化性增强。
14、求298.15K ,下列电池的电动势,并指出正、负极:Cu(s) │ Cu 2+(1.0⨯10-4 mol ·L -1)‖Cu 2+(1.0⨯10-1 mol ·L -1) │ Cu(s) 解 ϕ右=θϕ(Cu 2+/ Cu)+lg 20.05916V (1.0⨯10-1)=θϕ(Cu 2+/ Cu)-0.029 6V ϕ左=θϕ(Cu 2+/ Cu)+ lg 20.05916V (1.0⨯10-4)=θϕ(Cu 2+/ Cu)-0.118 4V 右边为正极,左边为负极。
E = 0.118 4V -0.029 6V = 0.088 8 V15、已知298.15K 下列原电池的电动势为0.388 4V :(-)Zn(s)│Zn 2+(x mol ·L -1) ‖Cd 2+(0.20 mol ·L -1) │Cd (s)(+) 则Zn 2+离子的浓度应该是多少?解 查表知 θϕ(Cd 2+/Cd) = - 0.403V ;θϕ(Zn 2+/Zn) = - 0.762V θE =θϕ(Cd 2+/Cd) -θϕ(Zn 2+/Zn) = -0.403V - (-0.762V) = 0.359V由E =θE - lg 20.05916V Q =0.388 4V = 0.359V -lg 20.05916V 0.2][Zn 2+ 得 [Zn 2+] = 0.021 mol·L -116、298.15K , Hg 2SO 4(s) + 2e -2Hg(l) + SO 42-(aq) θϕ=0.6125 V Hg 22+ (aq) + 2e -2Hg(l) θϕ= 0.7973 V 试求Hg 2SO 4的溶度积常数。
