第十三章氢和稀有气体
氢和稀有气体

这一发觉惊动了科学界,因为当初普遍以为空气已研究得够 清楚了,所以 Ramsay 旳工作具有划时代旳历史意义。
2 氙旳氟化合物旳生成 氙旳氟化物能够由两种单质直接化合生成,反应在一定旳温 度和压强下,在镍制旳容器中进行。为何在镍制容器中进行?
Xe ( g ) + F2 ( g ) ——— XeF2 ( g ) Xe 大过量,防止 XeF4 旳生成 ;
Xe ( g ) + 2 F2 ( g ) ——— XeF4 ( g ) F2 过量,但反应时间应短些,防止 XeF6 旳生成; Xe ( g ) + 3 F2 ( g ) ——— XeF6 ( g ) F2 大过量,反应时间长。 F2 和 Xe 旳混合气体在光照下,也能够直接化合成 XeF2 晶体 。
认识到 “ 惰气 ” 也不是绝对惰性旳。他旳工作为开拓 “ 惰气 ” 元 素化学Ba打rt下let了t 基曾础使。O2 同六氟化铂反应,而生成一种新旳化合物 O2+ [ PtF6 ]- 。他联想到 “惰气” 氙 Xe 旳第一电离能 ( 1171.5 kJ·mol-1 ) 同 O2 分子旳第一电离能 ( 1175.7 kJ·mol-1 ) 相近旳 事实,由此推测到 PtF6 氧化 Xe 旳可能性 。
杂化方式 sp3 不等性
杂化方式 sp3 等性
分子构型 三角锥
分子构型 正四面体
XeOF4 价层电子总数
对数 电子对构型
无机化学第13章_氢和稀有气体

⑤野外工作,用硅等两性金属与碱液反应
0.63kg Si可制取1m3H2 :
Si+2NaOH+H2O→Na2SiO3+2H2(g)
或 LiAlH4+4H2O→Al(OH)3+LiOH+4H2(g)
19
Light work with water, NATHAN S. LEWIS Nature 414, 589 - 590 (December 6, 2001) Direct splitting of water under visible light irradiation with an oxide semiconductor photocatalyst, ZHIGANG ZOU, JINHUA YE, KAZUHIRO SAYAMA & HIRONORI ARAKAWA Nature 414, 625 - 627 (December 6, 2001)
11
11/20/2020
性质: a. 溶解性 273K时1体积水仅能溶解0.02体积氢 b. 可燃性 燃料
c. 氢的化学性质:还原剂原料
冶金
加氢反应等
Vegetable oil to fat 植物油 氢化到 脂肪
人造黄油
肥料
12
检验反应:PdCl2(aq) + H2 → Pd(s) + 2HCl(aq)
11/20/2020
第13章 氢和稀有气体
“机遇号”重大发 现
1
11/20/2020
序言
从本章开始学习元素部分。HUMPHREYO说:“真正的化学 是叙述性化学,即元素化学。只有理论没有性质那就不是化 学。”F A COFTON说:“我们确信象其他教科书那样,没有 或几乎没有包含实际内容的无机化学,就好象没有乐器演奏 的一张乐谱。”因此,我们的学习就是要掌握重要元素及其 化合物的重要性质。
氢和稀有气体
2 氢气的制备
(1) 实验室制法 实验室制 H2 常采用稀盐酸与金属锌反 应的方法。
但是由于金属锌中有时含有砷化物、磷
化物等杂质,致使制得的 H2 不纯。
O
N
C
CH
R
N
长链的蛋白质分子自身可以形成螺旋 形构型,这种结构就是靠分子内氢键来稳 定的。 DNA 的双螺旋是两条螺旋形分子通
过氢键结合起来的超分子结构。
18-1-2 氢气的性质与制备
1 氢气的性质
氢有三种同位素:氕 H 、氘 D 和氚 T。
普通的氢和氘有稳定的核,氚是一种不 稳定的放射性同位素,发生 衰变,其半衰 期为 12.26 年:
似之处,但又不完全相同。
氢是唯一值得单独考虑的元素。
稀有气体
稀有气体基态的价电子构型除氦的 ns2 以外,其余均为 ns2 np6 。 在接近地球表面的空气中,1 000 dm3 空 气中约含有 9.3 103 cm3 氩、18 cm3 氖、 5.2 cm3 氦、 1.14 cm3 氪和 0.086 cm3 氙。
主要内容
11
氢 稀有气体
主族元素总结
2 2
33
通常列于碱金属 IA 族顶端
H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢
H
大气中少量的氢气,H2O,及其他无机化
合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是
最丰富的元素
氢
H
氢 稀有气体
用途
燃
料
燃烧值/kJ· -1 kg
氢 气(H2)
戊硼烷(B5H9) 戊 烷(C5H12)
120918
64183 43367
2、氢化物
(1)氢化物的合成
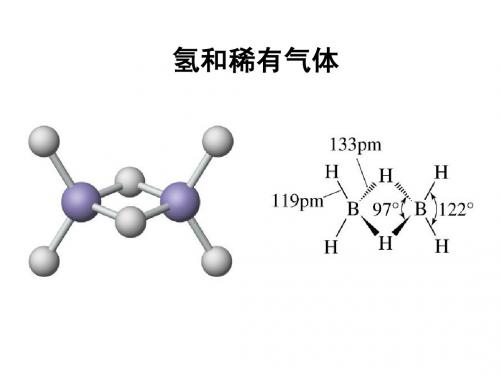
合成二元氢化物的三种常用方法是: 元素直接化合:2E + H2(g) → 2 EH 例如,2Li(l) + H2(g) → 2LiH(s) BrØnsted 碱的加合质子:E- + H2O(ag) → EH + OH例如,Li3N(s) + 3 H2O(l) → 3Li(OH) (aq) + NH3(g) 卤化物或拟卤化物与氢化物之间的复分解: E’H + EX → E’X + EH 例如,LiAlH4 + SiCl4 → LiAlCl4 + SiH4
(kJ•mol–1)
H2O和D2O之间沸点的差异反映了O· · —O 氢 ·H 键不如 O··· D—O氢键强。相同化学环境下键焓高于 键焓的现象在很大程度上是由零点能(指量子在绝对 温度的零点下仍会保持震动的能量 )的差别引起的。 零点能低时键焓相对比较高,零点能高时键焓相对比 较低。氢同位素造成的性质差别大得足以找到某些实 际应用。例如,由于D2O中D–O键的键焓相对比较高 ,电解速率应当低,其结果是在电解水而得到的残液 中得以富集。 利用重水与水的差别,富集重水,再以任一种从 水中制 H2 的方法从 D2O 中获得 D。 慢中子轰击锂产生T:
【思考】潜在储氢材料——化合物 A 是第二周期两种氢化物形成 的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温 下为白色晶体,稳定而无毒。刚刚融化的 A 缓慢释放氢气,转变 为化合物B(乙烯的等电子体)。B 不稳定,易聚合成聚合物 C (聚乙烯的等电子体)。C 在155oC释放氢气转变为聚乙炔的等电 子体,其中聚合度为3的化合物 D 是苯的等电子体。高于500oC时 D 释放氢气,转变为化合物 E,E 有多种晶型。 (1)写出 A、B、C、D、E 的化学式。
无机化学

第13章氢和稀有气体1.用VSEPR理论判断XeF2、XeF4、XeF6、XeOF6、ClF3的空间构型。
通式为AXnEm m+n的数目为价层电子对数M=(A的族价-X的化合价*X的个数+/-离子电荷相应是电子数)/2物质通式m m+n 空间结构XeF2AX n Em 3 5 直线型XeF4AX n Em 2 6 平面四方形XeF6AX n Em 1 7 变形八面体XeOF6AX n Em 1 6 四方锥ClF3AX n Em 2 5 平面三角形第14章卤素1. 根据电势图计算在298K时,Br2在碱性水溶液中歧化为Br-和BrO3-的反应平衡常数。
2通Cl2于消石灰中,可得漂白粉,而在漂白粉溶液中加入盐酸可产生Cl2,试用电极电势说明这两个现象。
.第16章氮磷砷1.如何除去N2中少量NH3和NH3中的水气?将含有少量NH3的N2气体通入水中。
就可除去NH3,将含有少量H2O的NH3通入CaCl2中,就可除去其中少量的H2O。
2.如何除去NO中微量的NO2和N2O中少量的NO?将含有少量NO2的NO气体通入热水中3NO2+H2O=2HNO3+NO这样就可除去其中的气体。
将N2O和少量的NO气体通入水中。
就可除去其中少量的NO。
3.给下列物质按碱性减弱顺序排序,并给予解释:NH3 N2H4 NH3OH PH3 AsH3答:NH3是所有气态氢化物中唯一显碱性的物质,按N—P—AS 顺序,其气态氢化物的碱性依次减弱,酸性依次增强,故碱性NH3>PH3>ASH3,而同一种元素的氢化物,化合价越低,碱性越强,故NH3>N2H4>NH2OH ,综上可知碱性顺序为NH3>N2H4>NH3OH(碱性)>PH3(酸性)>AsH3 (酸性)4.为了测定铵态氮肥中的含氮量,称取固体样品0.2471g,加过量NaOH溶液并进行蒸馏,用50.00mL 0.01050mol/L HCl吸收蒸出的氨气,然后用0.1022mol/L NaOH溶液滴定吸收液中剩余的HCl,滴定中消耗了11.69mL NaOH溶液,试计算肥料中氮的百分含量。
13第十三章 氢和稀有气体-

Elements chemistry
元素化学
元素化学—也称描述化学,即周期系中 各族元素的单质及其化合物的化学。 它是无机化学的中心内容,下一阶段将 分区分族简要介绍元素及其常见化合物的特 点、性质、 制备和用途。 丰富多彩的物质世界是由基本的元素及 其化合物所组成的。目前,教科书公布的已 发现元素为112种(实际已达到117种,甚至 更多),其中,有94种存在于自然界,人工 合成元素20多种,人体中含有其中60多种。
热力学、动力学、物质微观结构:G、K、 四大平衡、、原子结构、杂化轨道理论、 价层电子对互斥理论、分子轨道理论、晶体 结构、配位键理论等
第十三章
氢和稀有气体
第十三章 氢和稀有气体
勘误:
P324 倒数第12行 离子型、氢化物改 为离子型氢化物
自学内容:
13.1 氢
一、氢的发现
1、氢的发现
原 子 氢 的 性 质
三、氢的制备
实验室制备
实验室由活泼金属和稀酸 反应或两性金属与碱反应 制备,也可用电解法制备 由两性金 属与碱反 应或电解 法得到的 氢气纯度 更高
Zn + 2H+ = H2↑+ Zn2+ Zn + 2H2O + 2OH- = Zn(OH)42- + H2↑ 电解法 阴极: 2H2O + 2e =H2↑ + 2OH阳极: 4OH- - 4e ==O2↑ + 2H2O
1894年,Ramsay
Ar
Ne、Xe:1898年,Ne、Xe
Rn:1900年,Dorn,Rn;1908年,Ramsay和 Gray分离
二、制备——分馏空气
每 1000 dm3 空气中约含 9.3 dm3 氩, 18 cm3 氖, 5 cm3氦和0 .8 cm3氙
第四篇 元素化学(一) 非金属

三. 稀有气体
He
2.用途:
超低温冷却剂;填充气球;作惰性保护气用于核 反应堆热交换器;液氦在温度小于2.2K时,是一 种超流体,具有超导性和低粘性,对于研究和验 证量子理论有重要的意义。
Ne Ar
氖的导电性是空气的75倍,用于放电管中发射红光, • 也用于作金属焊接的保护气。
氩 氩的导热性很差,用于填充灯泡,也 用作焊接的保护气。
第十三章 氢和稀有气体
制作人 何晓燕
• [教学要求]
1.了解氢及氢化物的物理和化学性质。 2.了解稀有气体的发现简史,单质、化合 物的性质、结构及用途。
• [教学重点]
1.氢化物的化学性质。 2.稀有气体化合物的结构及性质。
• [教学难点]
VSEPR理论判断稀有气体化合物的结构。
[主要内容]
1.氢的存在,氢气的性质,氢 化物。 2.稀有气体的存在、性质、制 备和应用,稀有气体的化合物。
早在1785年,英国著名科学家Cavendish H.在研究空气 组成时,就发现在电火花作用下,用缄液吸收了氮和 氧化合生成的氧化氮后,仍然有近1%的残存气体,但 这并未引起重视,谁也没有想到,就在这少量气体里 竟藏着整整一个族的化学元素。
100多年后,英国物理学家瑞利(Rayleigh J.W.S.)在研究氮气时发现,从氮的化合物中 分离出来的氮气每升重1.2508g,而从空气中 分离出来的氮气在相同情况下每升重1.2572g, 瑞利无法解释,于是写信给《自然》,遍请 读者回答,但无复信。 1894年,他与Ramsay合作,把空气中的氮气 和氧气除去,用光谱分析鉴别剩余气体时发 现了氩。由于氩和许多试剂都不发生反应, 极不活泼,故命名为 Argon(在希腊文中是 “懒惰”的意思,中译为氩,元素符号是 Ar)
无机化学(第四版)课后答案

无机化学课后答案 第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Xe + F2 ============XeF2
1 : 5
Xe + F2 ============XeF2
1 : 20 573K,6.18×105 Pa
希有气体化 合物主要是 氙的氟化物 和氧化物
10
2、氟化物的性质
<1>强氧化性: 氧化能力按XeF2——XeF4——XeF6顺序递增
Ne
氖的导电性是空气的75倍,用于放电管中 发射红光,• 也用于作金属焊接的保护气。 氩 氩的导热性很差,用于填充灯泡,也 用作焊接的保护气。 氪和氙 导热性均很差,用于填充灯泡,用 氙制的电光源氙灯有“小太阳”之称。 9
Ar
Kr
Xe
2-4
希有气体化合物
O2+PtF6=O2+[PtF6]-
希有气体化合物是1962年 才开始制得成功,是巴特 列在发现O2和六氟化铂能 发生反应的实验事实后受 到启发。
如出现奇数电子时,将此电子也当作电子对来对待。
AsO43-的电子对构型是四面体,由于配位原子数 (氧)也是4,所以它的分子构型也是四面体
15
当配位原子数与价电子对数不相等时,就有可能存在多 种构型,应用下列方法判断出最稳定构型
3、绘出构型图 每一电子对连一个配位原子,余 下的是孤电子对。 4、确定稳定构型 根据成键电子对、孤电子对之间 相互作用的大小,确定排斥力最小的构型为稳定构型。 (1) 相距角度最小的孤电子对-孤电子对的数目越 少,其构型越稳定。 (2) 如果(1)的判断还不能确定,• 则由相距角度最小 的孤电子对-成键电子对数目最少的作为稳定 构型。 (3) 如果(2)还不能确定,• 则由成键电子对-成键电 子对最少的构型作为稳定构型。
5
二、氢气的制备 实验室制备
实验室由活泼金属和稀酸 反应或两性金属与碱反应 制备,也可用电解法制备 由两性金属与 碱反应或电解 法得到的氢气 纯度更高
Zn + 2H+ = H2↑+ Zn2+
Zn + 2H2O + 2OH- = Zn(OH)42- + H2↑
阴极 : 2H O + 2e ======H ↑ + 2OH 电解法 2 2 阳极: 4OH- - 4e ======O2↑ + 2H2O
NaBrO3+XeF2+H2O → NaBrO4+2HF+Xe 高溴酸钠就是用 XeF2作氧化剂才首 XeF2 + H2 →2HF + Xe 次制得成功的 XeF2 + 2Cl- →2F- + Xe + Cl2 XeF4+ Pt →2PtF4 + Xe <2>与水反应 氙氟化物与水反应活性不同
2XeF2 + 2H2O = 2Xe + 4HF + O2 (在碱中迅速反应)
>C=C< + H2 高温 >CH-CH<
3、生成金 属氢化物
Na + H2 ====2NaH
高温
Li + H2 ====2LiH
高温
7
第二节
希有气体 (0 族元素)
*2-1 希有气体的发展简史(自学) 2-2 希有气体的物理性质和用途 价电子 层结构
H e 1s2 N e 2s22p6 A r 3s23p6 K r 4s24p6 X e 5s25p6 R n 2s22p6
4
1-2
氢的化学性质和氢化物
H
↑
1s1
一、氢的成键特点
1. 离子键
Na H Na+ H-
H- 半径较大,有很强的还原性,仅存在于离子 化合物中,水溶液中很快与不反应放出氢气 H- + H2O = H2↑+OH-
2.共价键
H—Cl
H—O
共价键是氢最谱遍的成键方式。
3.氢键和氢桥键
这是氢特殊的成键方式
16
例
试根据上述原则判断XeF4的稳定构型
构 型: (a) (b)
价电子对数=(8+4)÷2=6 价电子对构型为八面体 XeF4可能的构型有两种:
90°孤—孤: 0
90°孤—成: 8 90°成—成: 4
1
6 5
F
F Xe F
F
F
Xe
F
F
(a)
所以XeF4的 分子构型是 平面四面形
F (b)
17
2-6 希有气体化合物的结构
一、VSEPR理论的基本要点 1、分子的几何图形 取决于中心原子的价电子对的几
何构型。中心原子周围的价电子对总是按彼此间斥力最小 的构型(电子对间最大远离)排列,
价电子对数=单键电子对数+未成键的孤电子Байду номын сангаас数 价电子对数 价电子对几何构型
注意:在出现奇数电 BeF2: 2 直线型 BF3: 3 平面三角形 子时,此电子也当作 电子对对待.双键电 CH4: 4 四面体 子对数不计. CO2: 2 直线型 13 不同电子对的几何构型列于表9-• • 4(page 350)
D
3
分之一,主要是核衰变的产物。
二、氢的物理性质
• • • • 氢是密度最小的无色无味的气体 扩散速度快,因而具有很高的导热性 微溶于水(一体积水在273K时溶解0.02体积氢) 沸点低,是 20.4K ,液态氢可以把除氦以外的 所有气体冷却为固体 • 易被钯、铂、镍等金属吸收,其中钯的吸氢能 力最强,室温下一体积的粉末状钯可吸收 900 体积的氢。因此这些金属是有关于氢反应的优 良催化剂。
氢气的工业制备
水煤气法: C + H2O ==== CO↑ + H2↑ 催化剂 CH4 ====== C + 2H2 天然气裂解法: 水蒸气转化法: CH4 + H2O
1073~1273 K
催化剂
1273 K
CO + 3H2(g)
6
三、氢气的化学性质
1、少数常温反 应例子:
2、高温还原反应
作为能源:
元素符号
He
Ne
Ar
Kr
Xe
Rn
沸点/K
4.2
27
87
120
166
211
第一电离能 2372 2033 1523 1351 1171 1038 -1 mol·kJ
19
氟化氙的结构
XeF2
XeF4
XeF6
20
XeO3 的结构
Xe O O 三氧化氙 O
21
氢的发现 早在16世纪就有人发现了氢气体, 它是硫酸与铁反应生成的一种气 Cavendish(17311810) 体,1766年英国物理学家卡尔文 迪西确认它是一种易燃气体,并 称为“易燃空气”。而到1787年, 拉瓦锡才将其命名为“Hydrogen”, “Hydro”是希拉文“水”的意思, 指出,水是氢和氧的化合物。 Laviusiser(174
3-1794)
22
表9-4 根据价电子对互斥理论的理想几何构型
180° —M— 90° M M
2电子对 直线型
四电子对 四面体 M 120 ° 3电子对 平面三角形
6电子对 用八面体 M
5电子对 三角双锥
23
氢桥键和氢键
24
XeF4, XeF6 在水中反应 生成氧化物
6XeF4+12H2O=2XeO3+4Xe+3O2+24HF XeF6+3H2O=XeO3+6HF XeF6+H2O=XeOF4+2HF (不完全水解)
11
二、氧化物 氙的氧化物是无色、易潮解、易爆炸
的晶状固体。由氟化物水解制备。
氧化物XeO3,在酸性溶液中具有强氧化性:
分子 价电子对数 价电子对构型 可能构型 最稳定构型
XeF2
XeF4
5
6
三角双锥
八面体
三种
二种
直线型
平面四面形
XeF6
XeOF4 XeO3 XeO4
7
6 4 4
变形八面体
八面体 四面体 四面体
二种
二种 一种 一种
变形八面体
四方锥形 三角锥形 正四面体
作业: page 355
2, 3, 6, 8
18
希有气体的一些物理性质
由于O2的第一电离能(1175.7kJ·mol-1) 和氙的第一电离能(1171.5kJ·mol-1) Xe+PtF6=Xe+[PtF6]非常接近,于是想到用氙代替氧可能 会发生同样的反应。结果它成功了。
一、氟化物 Xe + F2 ==========XeF2
氙和氟在密 闭的镍反应 器中加热就 可得到氙氟 化物
还原金属 氧化物 加氢还原
氢气的键能很大(436kJ·mol-1) 主要反应是高温反应
H2+F2=2HF
2H2+O2 ==== 2H2O
Pd
燃烧 2H2 + O2 ====H2O(g)
高温 高温
H =241.8 kJ· mol-1
WO3 + 3H2 = ===W + 3H2O
Fe2O3 + 3H2 =====2Fe + 3H2O
2
第一节
1-1 氢的存在和物理性质 存在 氢的发现 氢的同位素
氢
主要以化合态存在于水、石油、天然气 以及生物的组织中。由光谱数据分析表 明,太阳和其他一些星球的大气中含有 大量的氢。
T H
1 H——又称氕,符号为H,占99.98%
2H——又称为氘,符号为D,占0.02% 3H——又称为氚,符号为T,是H的1017
