弱电解质的电离平衡和PH计算1
酸碱平衡及其PH值计算

c(H 3O ) c(NH 3 )
c(
NH
4
)
5.6
1010
HS- + H2O
H3O+ + S2-
K
a
(HS
)
c(H 3O ) c(S c(HS )
2
)
7.1 1015
K
a
越大,酸的强度越大,由
K
a
(HAc)
>
K
a
(NH
4
)
>
K
a
(HS
由二级平衡: HS平衡浓度: 1.1 10-4
H+ + S2-
1.1 10-4
y
K1/K2>102 可做一元
弱酸处理
Ka2 = [H+][S2-]/[HS-] = 7.1 10-15 y = Ka2 = [S2-] = 7.1 10-15
酸根离子浓度 近似等于二级
电离常数
结论:
多元弱酸中,若K1K2K3…,通常K1/K2>102,求[H+] 时, 可做一元弱酸处理。
加入1滴(0.05ml) 1mol·L-1 NaOH
50ml纯水pH = 7
pH = 3
pH = 11
50mLHAc—NaAc
[c(HAc)=c(NaAc)=0.10mol·L-1]
pH = 4.74
pH = 4.73
pH = 4.75
缓冲溶液:具有能保持本身pH值相对稳定性能的溶液 (也就是不因加入少量强酸或强碱而显著改变pH值的溶液)。
称为碱的解离常数。K
b
越大,碱的强度越大。一
水的电离和pH值的计算

水的电离和pH值的计算水是生命的基本物质,也是化学反应中最常见的溶剂。
在水中,发生着水的电离反应,产生氢离子(H+)和氢氧根离子(OH-)。
这一过程可以通过pH值来进行量化。
本文将探讨水的电离和pH值的计算方法。
一、水的电离反应水的电离反应可以用如下方程式表示:H2O ⇌ H+ + OH-在纯净水中,水分子会偶尔发生这样的反应,一部分水分子会分解成氢离子和氢氧根离子。
这表明水是一个弱电解质。
二、pH值的定义pH值是用来表示溶液酸碱性的度量指标。
它的定义是负对数函数,通过测量氢离子的浓度来判断溶液的酸碱性。
pH值的计算公式如下:pH = -log[H+]其中[H+]表示溶液中氢离子的浓度。
三、pH值的计算1. 对于酸性溶液如果溶液为酸性,那么pH值一定小于7。
在酸性溶液中,氢离子的浓度高于氢氧根离子的浓度。
举例来说,如果一个溶液的氢离子浓度为10^-3 mol/L,那么pH值的计算公式为:pH = -log(10^-3) = 3因此,这个溶液的pH值为3,属于酸性溶液。
2. 对于碱性溶液如果溶液为碱性,那么pH值一定大于7。
在碱性溶液中,氢离子的浓度低于氢氧根离子的浓度。
举例来说,如果一个溶液的氢离子浓度为10^-10 mol/L,那么pH 值的计算公式为:pH = -log(10^-10) = 10因此,这个溶液的pH值为10,属于碱性溶液。
3. 对于中性溶液如果溶液为中性,那么pH值等于7。
在中性溶液中,氢离子的浓度等于氢氧根离子的浓度。
举例来说,如果一个溶液的氢离子浓度为10^-7 mol/L,那么pH值的计算公式为:pH = -log(10^-7) = 7因此,这个溶液的pH值为7,属于中性溶液。
四、pH值的应用pH值不仅可以用来表征溶液的酸碱性,还可以用来控制化学反应的进行。
许多化学实验和工业生产过程中,都需要在特定的pH值下进行反应。
例如,酶是生物体内的一种特殊催化剂,在特定的pH值下才能发挥最佳催化作用。
小测 弱电解质的电离平衡 水的电离 溶液的PH计算

一、弱电解质的电离1、弱电解质的电离平衡移动规律遵循平衡移动原理。
以CH 3COOHCH 3COO -+H +ΔH >0为例:2、对于一元弱酸HA :HA H ++A -,电离平衡常数K= 3、对于一元弱碱BOH :BOHB ++OH -,电离平衡常数K =二、强、弱电解质的比较以一元强酸(HCl)与一元弱酸(CH 3COOH)的比较为例。
相同pH三、强、弱电解质的判断方法(以HA 为例)(1)从一定pH 的HA 溶液稀释前后pH 的变化判断如将pH =3的HA 溶液稀释100倍后,再测其pH ,若pH =5,则为 ,若pH<5,则为 。
(2)从升高温度后pH 的变化判断若升高温度,溶液的pH 明显减小,则是 。
因为弱酸存在电离平衡,升高温度时,电离程度增大,c (H +)增大。
而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH 变化幅度小。
四、酸、碱、盐溶液中水电离的定量计算。
(列表比较如下:)x表示溶液中的氢离子浓度由上表可得重要规律:(1)在任意温度、任意物质的水溶液中(含纯水)的水本身电离出的[H+]水________[OH—]水(2)酸和碱对水的电离均起________作用①只要碱的pH值相等(不论强弱、不论几元)对水的抑制程度相等,碱也同理。
②若酸溶液的pH值与碱溶液的pOH值相等,则两种溶液中水的________相等。
(4)较浓溶液中水电离出[H+]的大小:①酸溶液中[OH—]等于________电离的[H+]②碱溶液中[H+]等于________电离的[H+]2、PH计算25°时有pH = 12的NaOH溶液100 mL ,欲使它的pH降为11.①如果加入蒸馏水,就加入 mL;②如果加入pH = 10的NaOH溶液,应加入 mL③如果加入0.008 mol/L HCl溶液,应加入 mL④某温度(T℃)时,测得0.01 mol/L NaOH溶液的pH为11,则该温度下水的K W= . 则该温度(填“大于”,“小于”或“等于”)25℃,其理由是 .。
高中化学---水的离子积及PH值计算

高中化学---水的离子积及PH值计算一、水的电离平衡(属于弱电解质的电离)1.平衡常数表达式:水的离子积常数Kw=C(H+).C(OH-);其中,C(H+)与C(OH-)为溶液中H+和OH-的总浓度,不可片面理解为水电离产生的H+与OH-的浓度。
2.Kw的影响因素:只与温度有关;一般我们认为,常温下25°C时,Kw=10-14;100°C时,Kw=10-12。
3.水的电离平衡移动影响因素(1)温度:温度升高,Kw变大,平衡右移(2)外加酸、碱,可抑制水的电离(相当于“同离子效应”):如在水中加入盐酸、氢氧化钠、硫酸氢钠等,可使水的电离程度变小,但不影响Kw的大小。
(3)外加可水解的盐,可促进水的电离(相当于“离子反应效应”):如在水中加入醋酸钠、氯化铵等,可使水的电离程度变大,但不影响Kw的大小。
(4)加入强酸的酸式盐,相当于加入酸,抑制水的电离;加入弱酸的酸式盐,对水的电离越促进还是抑制作用,则要看是水解程度大,还是电离程度大。
4.水的离子积常数的应用(1)求PH=1的盐酸溶液中,水电离产生的H+浓度;(2)求PH=1的氯化铵溶液中,水电离产生的H+浓度;(3)求PH=13的氢氧化钠溶液中,水电离产生的OH-浓度;(4)求PH=13的醋酸溶液中,水电离产生的OH-浓度(以上溶液均为常温时的溶液)结论:水电离产生的氢离子浓度为10-13的溶液,可能是酸溶液,也可能是强溶液;这一点在离子共存问题中,通常构成隐含条件。
5.PH值的大小与溶液酸碱性(1)溶液的酸、碱性,由C(H+)与C(OH-)的相对大小共同决定的;而溶液的PH=-lg(H+),只与C(H+)有关。
两者没有必然的联系,因此,不能说PH=7的溶液一定是中性的,也不能说PH=6的溶液一定是酸性的。
当溶液温度不是常温时,中性溶液的PH≠7(因Kw≠10-14)。
(2)例题:改变温度,下列溶液的PH值基本不变的是()A.NaOH溶液B.NaCl溶液C.稀硫酸D.NH4Cl溶液6.PH的相关计算(1)单一溶液PH求算(略)(2)溶液的稀释:对于强酸和强碱溶液来说,体积稀释为原来的10n倍,则PH变化值为n,但要注意“无限稀释7为限”例如:pH=6的HCl溶液稀释100倍,混合PH≈7;对于弱酸和弱碱溶液来说,体积稀释为原来的10n倍,则PH变化值小于n。
弱电解质的电离平衡及溶液的PH值的计算

4、弱电解质电离方程式书写规律:
1.弱电解质在溶液中部分电离,用“ ”
2.强酸酸式盐电离时H+分开写,弱酸酸式盐电离时 H+不能拆开.
3.多元弱酸的电离 应分步完成电离方程式,多元 弱碱则一步完成电离方程式。
写出电解质NaCl、 NaHSO4、NaHCO3、 CH3COOH、 H3PO4的电离方程式 NaCl = Na++Cl- NaHSO4= Na++ H ++ SO42NaHCO3= Na++HCO3CH3COOH H3PO4 H++CH3COO- H ++H2PO42-
练习
PH=10的氢氧化钠溶液与PH=10的氨水,稀释 NaOH < NH3 H 相同倍数,其PH大小关系是______________· 2O ,
即弱碱在稀释时电离平衡被破坏,要不断电 离出OH-,所以稀释相同倍数后,其碱性应 比强碱强一些,因而PH值应大一些 如稀释后溶液的PH值仍然相同,则稀释 NaOH<NH3· 2O H 倍数大小关系是_______
例:在一定温度下,冰醋酸加水稀释的过程中,溶液的 导电能力如图所示,请回答:(1)“o”点导电能力为 0的理由是 在O点处醋酸没电离,无离子存在 。
(2) a、b、c三点溶液PH由大到小的顺序是 C、a、b 。 导 C 。 电 (3) a、b、c三点中电离程度最大的是 能 力 b (4)若使c点溶液中C(Ac-)增大,
关键:抓住氢离子进行计ቤተ መጻሕፍቲ ባይዱ!
b、
强碱与强碱混合
例题:在25℃时,pH=9和pH=11的两种氢
氧化钠溶液等体积混合pH值等于多少? 关键:抓住氢氧根离子离子进行计算!
C、强酸与强碱混合
051弱电解质的电离平衡及PH计算

弱电解质的电离平衡及PH计算考点一、电解质溶液导电能力的强弱1、①电解质溶液的导电机理:。
②溶液的导电能力:。
③溶液导电能力的影响因素:内因:。
外因:。
2、问题讨论:几个一定和几个不一定:①溶液的导电性与溶液中自由移动离子的浓度成正比②相同温度,相同浓度的强电解质溶液的导电性强于弱电解质溶液的导电性③强电解质的导电性强(如硫酸钡,碳酸钡等难溶性盐溶液),弱电解质的导电性弱④强电解质溶液的导电性就比弱电解质溶液的导电性强,反之亦然.3、归纳总结:电解质非电解质(如氨气)金属导电条件导电微粒影响因素考点二、弱电解质的电离平衡(1)电离平衡的特点:(2)影响电离平衡的因素:越热越电离: 电离是(吸热或放热)过程,因此,升高温度使平衡向移动。
越稀越电离: 稀释弱电解质溶液,平衡向移动。
同离子效应:增大阴、阳离子的浓度,平衡向移动;减小阴、阳离子的浓度,平衡向移动。
加入能反应的物质:平衡向移动。
解决问题:考点三、电离方程式和离子方程式1、电离方程式:强电解质完全电离,书写时用“”号;弱电解质部分电离,书时用“”号。
多元弱酸是分步电离;所以应当分步书写电离方程式。
多元弱碱也是分步电离,但可按一步电离写出。
2、离子分程式书写时,强电解质(除难溶性盐)一律写符号;弱电解质,不论是在反应物中,还是在生成物中,都一律写其。
考点四、电离平衡常数1、定义:。
2、电离常数的意义:。
3、电离常数的影响因素:。
4、多元弱酸的电离常数之间关系:一般K1K2K3,因此,计算多元弱酸溶液的C(H+)或比较弱酸酸性相对强弱时,通常只考虑电离。
[例1]在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是( )(A)n100% (B)n100%/2 (C)(n-1)100% (D)n%考点五、金属与酸的反应问题(1)相同物质的量浓度、相同体积的一元强酸(如烟酸)与一元弱酸(如醋酸)的比较:C(H+)pH 中和碱的能力与足量活泼金属产生H2的量开始与金属反应的速率一元强酸一元弱酸(2)相同pH、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较:C(H+)C(酸) 中和碱的能力与足量活泼金属产生H2的量开始与金属反应的速率一元强酸一元弱酸[例2]在同体积pH=3的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量锌粉,下列说法正确的是:( )A H2SO4中放出H2最多B 醋酸中放出H2最多C HCl和HNO3放出H2一样多D HCl比HNO3放出H2少[例3]、取pH均等于2的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是()A.醋酸与锌反应放出氢气多B.盐酸和醋酸分别与锌反应放出的氢气一样多C.醋酸与锌反应在速率大D.盐酸和醋酸分别与锌反应的速率一样大[例4]浓度与体积都相同的盐酸和醋酸,在相同条件下分别与足量的碳酸钙固体(颗粒大小均相同)反应,下列说法中正确的是()pH相同、体积相同的盐酸和醋酸,在相同条件下分别与足量的碳酸钙固体(颗粒大小均相同)反应,下列说法中正确的是()(A)刚开始反应时,盐酸的反应速率大于醋酸的反应速率(B)刚开始反应时,盐酸的反应速率等于醋酸的反应速率(C)盐酸产生的二氧化碳气体比醋酸更多(D)盐酸与醋酸产生的二氧化碳气体一样多考点六、酸碱稀释问题[例5]pH相同的盐酸和醋酸两种溶液,它们的( )A.H+的物质的量相同B.物质的量浓度相同C.H+的物质的量浓度不同D.H+的物质的量浓度相同[例6]常温下:(1)将pH=1的HCl溶液加水稀释10倍后,溶液pH= ;稀释100倍,pH= ;稀释10n倍后,pH= 。
【知识解析】弱电解质的电离平衡
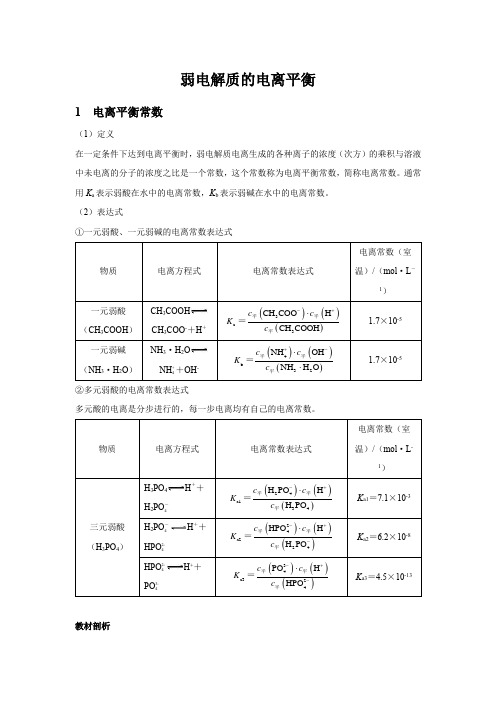
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。
3.2弱电解质的电离

平衡移动。
条件 移动方向
加热
右移
加水
加冰醋 酸
右移 右移
加浓盐 左移
酸
NaOH
(固)
右移
加醋酸 钠(固)
左移
电离 度
增大 增大 减小
减小
增大
减小
[CH3COO-] n(H+)[H+]
增大 增大 增大 减小 增大 减小 增大 增大 增大
减小 增大 增大 增大 减小 减小 增大 减小 减小
一元强酸和一元弱酸的比较 1.相同浓度 2.相同PH
教材P80 Ka(HCN)=6.2×10-10 mol/l Ka(CH3COOH)=1.7×10-5mol/l Ka(HF)=6.8×10-4mol/l
酸性:HF>CH3COOH>HCN
用电离平衡常数K计算溶液[H+] 教材P82
2.多元弱酸是分步电离的,Ka 逐渐减小, 且相差很大,所以其水溶液中的酸性主 要是由第一步电离决定的
练习:H2S,H2SO3 的电离
电离度α
已电离的分子数
α=
弱电解质分子总数
×100%
电离度实质上是一种平衡转化率
与电离平衡常数一样都可以表示弱电解 质的电离程度,电离度越大,电离平衡 常数越大
三.影响电离平衡的条件
(1)内因:电解质本身的性质。
同化学平衡一样,当外界条件改变时符合勒理。
(2) 影响电离平衡移动的条件——外因 ①温度:电离过程是吸热过程,温度升高,平衡向电离 方向移动。 越热越电离 ② 浓度:溶液稀释平衡向电离方向移动 越稀越电离 ③加入试剂:改变弱电解质电离中分子或离子的浓度,
H2CO3 HCO3-
H++HCO3H++CO32-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.下列物质的水溶液能导电,但属于非电解质的是()
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.S02
2.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是()
A.中和时所需NaOH的量B.电离程度
C.H+的物质的量浓度D.CH3COOH的物质的量
3.已知HClO的酸性比H2CO3弱,下列反应Cl2+H2O HCl + HClO达到平衡后,要使平衡体系中HClO的浓度增大,应采取的方法是()
A.光照B.加入石灰石C.加入固体NaOH D.加水
4.将0.lmol·1
L 醋酸溶液加水稀释,下列说法正确的是()
A.溶液中c(H+)和c(OH-)都减小B.溶液中c(H+)增大
C.醋酸电离平衡向左移动D.溶液的pH增大
5.某无色透明溶液中,由水电离出来的c(H+)=1×10-3mol/L,能大量共存的离子组是()A.K+、Na+、MnO4-、NO3- B.Fe3+、A13+、Cl-、HS-
C、NH4+、A1O2-、Na+、CH3COO-D.K+、Na+、SO42-、NO3-
6.向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,
其电流强度(D随加入氨水的体积(V)变化的曲线关系是下图中的()
7.同物质的量浓度,同体积的HCl和醋酸,分别与过量同情况的Na2CO3 固体反应时,下列叙述正确的是()
A.反应速率HCl>CH3COOH B.气泡逸出速率CH3COOH >HCl
C.在相同条件下两酸产生的CO2的体积相同
D.如果两酸的C(H+)同时,两酸物质的量浓度HCl >CH3COOH
8.将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,
基本上不影响水的电离平衡的是()
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
9. 25℃时H2S饱和溶液1 L,其浓度为0.1 mol·L-1,其电离方程式为H2S H++HS-,
HS-H++S2-,若要使该溶液中H+浓度增大,S2-浓度减小,可采取的措施是()
A.加入适量的水 B.加入适量的NaOH固体
C.加入适量的SO2 D.加入适量的CuSO4固体
10.在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列各项中
始终保持增大趋势的是()
A. c(H+)/ c(CH3COOH) B. c(CH3COO-)/ c(H+)
C. c(CH3COOH)/ c(CH3COO-) D. c(H+)·c(CH3COO-)/ c(CH3COOH)
11.PH=2的A、B两种酸溶液各1ml,分别加水稀释到
积V的关系如右图所示,则下列说法正确的是()
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后A酸溶液的酸性比B酸溶液的强
C、a=5 时,A是弱酸,B是强酸
D、若A、B都是弱酸,则5>a >2
12.浓度均为0.1mol/L的下列溶液中由水电离出的c(H+)水大小关系为:
①盐酸②醋酸溶液③硫酸溶液④氢氧化钠溶液
13.H2S溶于水的电离程式_____________________________________________________。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向_____移动,c(H+)______,c(S2-)_______。
(2)向H2S溶液中加入NaOH溶液时,电离平衡向_____移动,c(H+)______,c(S2-)_______。
(3)若将H2S溶液加热至沸腾,c(H2S)______。
(4)若增大H2S溶液中c(S2-),最好加入_______。
14.25℃、A、B、C 三种溶液,其中A中c(H+) = 10—3mol/L ,B 中c(OH-) = 5×10—7mol/L,C中c(H+) / c(OH-) = 106,则三种溶液的酸性由强到弱的顺序为
15.现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”,“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将__________(填“增大”,“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲,乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”,“小于”或“等于”,下同)。
(3)各取25 mL的甲,乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH 溶液的体积大小关系为:V(甲)________V(乙).
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+),c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。
