金属流程图推断题
专题04 推断题、流程图(20题)(人教版)(解析版)

专题04 推断题、流程图1.以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去),如下图所示。
下列说法不正确...的是()A.X是N2 B.分离空气属于物理变化C.尿素属于氮肥D.煤与氧气的反应吸收热量【答案】D【解析】A、空气主要含氮气和氧气,所以X化学式为N2,正确,不符合题意;B.分离液态空气属于物理变化,正确,不符合题意;C.尿素含有氮元素,属于氮肥,正确,不符合题意;D.煤与氧气反应是一个燃烧反应,是放热反应,错误,符合题意;故选D。
2.空气中氧气约占21%,利用分离液态空气的方法得到氧气是工业上制取氧气的重要途径,下面是工业上制氧气流程图:(1)工业上分离液态空气制氧气的变化属于_____(填“物理变化”或“化学变化”);(2)氮气的沸点-196℃,氩气的沸点-186℃,氧气的沸点-183℃,在蒸发的过程中先被蒸发出来的是_____(填化学符号);(3)这样制得的氧气是_____(填“纯净物”或“混合物”);(4)任何物质我们都要辩证的看待,氧气既有利的一面,也有有害的一面请各写出一点:有利的一面(用途)__ ___,有害的一面__ ___。
【答案】(1)物理变化;(2)N2;(3)混合物;(4)供给呼吸(或支持燃烧或医疗急救等);食物变质(或金属生锈等)(答案合理即可)【解析】(1)工业上分离液态空气制氧气的变化过程是利用空气中各成分的沸点不同,可先后挥发而分离,没有新的物质生成,是物理变化;(2)氮气的沸点-196℃,氩气的沸点-186℃,氧气的沸点-183℃,在蒸发的过程中先被蒸发出来的是氮气:N2;(3)这样制得的氧气是混合物,含有空气中其他物质;(4)任何物质我们都要辩证的看待,氧气既有利的一面,也有有害的一面请各写出一点:有利的一面(用途)供给呼吸,支持燃烧,有害的一面:食物变质(或金属生锈等)(答案合理即可)。
3.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。
专题18 工艺流程题和物质推断题(第02期)(学生版) 2024年中考化学真题分类汇编(全国通用)

专题18 工艺流程题和物质推断题考点01 工艺流程题考点02 物质推断题考点01 工艺流程题1.(2024·吉林省吉林市)食品加工、制药等领域广泛使用二水合氯化钙(22CaCl 2H O ×)。
工业上生产22CaCl 2H O ×的主要流程如如图所示,下列说法正确的是A .石灰石的主要成分是2CaCl B .粉碎可以增大反应物间的接触面积C .搅拌可以提高22CaCl 2H O ×的产量D .反应器中生成的气体具有可燃性2.(2024·黑龙江大庆)碳酸锂Li 2CO 3是制备新能源汽车电池的重要原料。
下图是模拟提纯碳酸锂的工艺流程图。
已知:Ⅰ、锂辉矿主要成分为Li 2CO 3,含泥沙等杂质。
Ⅱ、Li 2CO 3(化学性质与Na 2CO 3类似)为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是A .X 可以是稀硫酸,常用澄清石灰水检验气体YB.将滤液2蒸发,当有较多固体出现时,停止加热C.②中适宜用冷饱和Na2CO3溶液D.此工艺可获得副产品Na2SO4K CO)的水溶液中加入贝壳烧成的灰3.(2024·湖南长沙)《周礼·考工记》中记载,古人曾在草木灰(含23(主要成分为CaO),利用生成物中能够去污的成分来清洗丝帛。
为了得到该去污液,某兴趣小组同学在老师的指导下设计了以下实验流程。
回答下列问题:(1)操作I的名称为;(2)该流程中涉及到所有的基本反应类型有分解反应、;(3)该去污液能消洗丝帛。
请你根据流程推测,该去污液中所含溶质的可能组成为(用化学式表示)。
4.(2024·湖北武汉)硫酸钡是白色固体,医疗上常用作透视肠胃的内服剂。
以毒重石(主要成分是碳酸钡,还含少量氧化铁和二氧化硅)为原料生产硫酸钡的工艺流程如图所示。
回答下列问题:(1)二氧化硅属于(填“单质”或“化合物”)。
(2)上述流程中涉及过滤,该操作用到的玻璃仪器有。
金属与金属材料流程图题型(人教版初中化学)

金属与金属材料流程图题型一、流程题1.某兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:(1)金属X是___;步骤Ⅱ中发生反应的化学方程式为___(2)加入过量的金属X的目的是___.【答案】铁 Fe+H2SO4=FeSO4+H2↑把铜全部置换出来或得到全部的铜【解析】【详解】(1)根据活泼金属可以将不活泼金属溶液中置换出来,铁和锌都能除去硫酸亚铁中硫酸铜杂质,但除杂时要注意“除去杂质,不引入新的杂质”的原则,因此应该加入铁,不会引入新的杂质;步骤Ⅱ是将铁和铜分离,稀硫酸和铁反应产生硫酸亚铁和氢气,反应的方程式为:Fe+H2SO4=FeSO4+H2↑;(2)加入过量的金属 X 的目的是把铜全部置换出来或得到全部的铜。
2.发展利用太阳能可以推进节能减排,晶体硅是制造太阳能电池板的重要原料图是工业上以石英砂(SiO2)为主要原料制取纯硅的一种方法,请回答以下问题。
(1)地壳中硅元素的含量仅次于____元素(填元素符号)。
(2)将石英砂粉碎的目的是____。
(3)写出步骤②的化学方程式:___,步骤③反应过程中若混入氧气,可能发生的后果是____。
(4)上述流程三个步骤中发生置换反应是____(填序号)。
(5)写出副产品CO的一种用途:____。
(6)根据上述流程制取5.6t纯硅,则石英砂中至少含____二氧化硅。
【答案】O 增大接触面积,使反应更充分 Si+2Cl 2= SiCl 4 爆炸 ①③ 燃料或冶炼金属 12t 【解析】 【详解】(1)地壳中硅元素的含量仅次于氧元素;(2)将石英砂粉碎的目的是增大与焦炭的接触面积,使反应更充分; (3)步骤②是硅和氯气反应生成四氯化硅,化学方程式为:Si+2Cl 2= SiCl 4,步骤③反应过程中若混入氧气,由于氢气是可燃性气体,高温条件下可能发生爆炸;(4)三个步骤的反应方程式分别为:①2SiO +2CSi+2CO 高温;②Si+2Cl 2=SiCl 4;③42SiCl +2H Si+4HCl 高温;其中①③的反应物和生成物都是单质和化合物,属于置换反应;(5)CO 有可燃性、还原性,可以用作燃料或冶炼金属;(6)纯硅中的硅元素来源于二氧化硅,设二氧化硅的质量为x ,x ×28100%=2832⨯+ 5.6t ,x=12t 。
中考之金属流程图推断题答题技巧

中考之金属流程图推断题答题技巧
一、解决此题型的知识要求
1、金属的化学性质
2、典型的实验现象、金属的颜色、含某金属离子溶液的颜色。
二、解决此题型的一般方法
1、明确目的是前提。
2、寻找突破口是关键。
3、分析细节是要点。
4、关注答题要求是根本。
三、例题解析
例1、某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属,设计如图所示流程.
请回答:
(1)步骤①的操作是,步骤③使用的方法是。
(2)滤液A的成分是,固体B的成分是。
(3)步骤④中反应的化学方程式是。
例2、实验室废水随意排放会造成环境污染。
某校实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,该校实验小组设计实验从该废水中回收银,并得到副产品硫酸亚铁晶体。
实验方案如下所示。
(实验过程中未引入其他的金属元素)
(1)实验室常用_____________的方法分离固体甲和溶液乙,该操作需要使
用的仪器有______ _____。
(2)固体甲中含有的物质是__________。
(填化学式)
(3)步骤①向废水中加入过量A。
检验A是否过量的方法是_____________。
高考化学铁及其化合物推断题-经典压轴题附详细答案
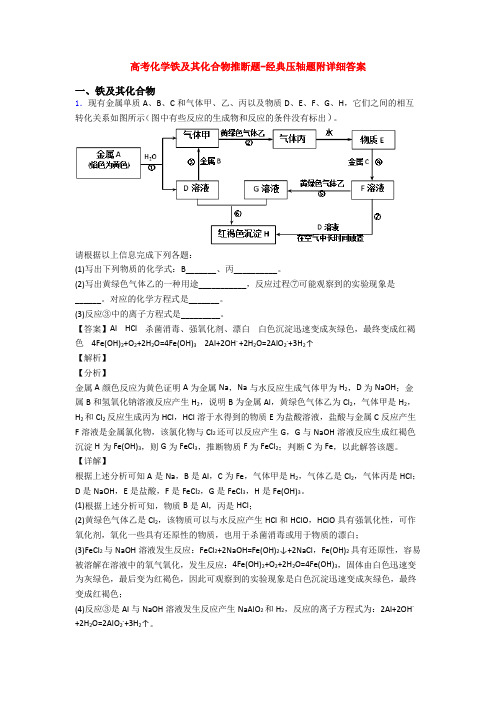
【答案】2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O温度升高,H2O2受热易分解,造成浸出率偏低;加入稀硫酸时,c(H+)增大,平衡向形成Ce3+的方向移动,4Ce3++O2+12OH-+2H2O=4Ce(OH)496%8B使Fe3+、Mn2+完全除去,并防止Eu3+被萃取导致损失
(5)已知含Ce3+溶液也可以先加碱调pH后再通入氧气氧化可得到Ce(OH)4。298K时,Ksp[Ce(OH)3]=5×10-20,若溶液中c(Ce3+)=0.05mol•L-1,加碱调节pH到_____时Ce3+开始沉淀(忽略加碱过程中溶液体积变化).
(6)萃取剂对金属离子的萃取率与pH的关系如图所示.流程中为了用萃取剂除去金属杂质离子,进行萃取2最适宜的pH是_______(填选项序号).其原因是_____。
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比( )对溶液中Ni2+、Fe2+的萃取率影响如图所示, 的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;
高中金属及其化合物物质推断题集合(含答案)

高中金属及其化合物推断题(含答案)1.有A、B、C、D、E五种物质,其中A为浅黄色粉末,B为无色液体,C、E为无色气体,D为金属。
A跟B反应可生成C,D在C中燃烧生成A,D跟B反应可生成E,E和C化合生成B。
由此可推断(用化学式填空):A ,B ,C ,D ,E 。
A及B反应的化学方程式为,此反应中是氧化剂,是还原剂。
2.某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式B ;C ;D ;E 。
(3)写出①、②、③、④四个反应方程式3.已知有以下物质相互转化。
试回答:(1)写出B的化学式 D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
4.如图,已知有以下物质相互转化(1) A转化为B及气体这步反应中应加入的试剂是(填化学式)。
(2)写出B的化学式,F的化学式。
(3)写出由G转变成H的化学方程式。
(4)写出检验I溶液中阳离子的离子方程式;向I溶液中加入A的有关离子反应方程式是。
5.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式固体B ;沉淀C ;沉淀D ;溶液E 。
(3)写出①、③、④三个反应方程式和②离子方程式。
①____;② _____;③ ____ ;④ ___。
6.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.试推断:(1)写出物质的化学式:A:____________、C:____________、I:____________.(2)写出下列反应的方程式:C→F的离子方程式______________________________________________.H→I的化学方程式________________________________________________.7.物质有以下转化关系:根据上图和实验现象,回答下列问题:(用化学式表示)(1)A是,B是,C是,X粉末是。
化学流程图推断题5

6.(龙岩)下图是氧化沉淀法生产复印用高档Fe3O4粉的部分工 艺流程简图。
氢氧化钠 过滤 (1)试剂I和操作Y的名称分别为________、___________。 (2)硫酸与氧化铁的反应为 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ____________ ______________________。 (3)往铁粉(含少量氧化铁)中加入硫酸,除铁、氧化铁与硫酸 发生反应外,一定还发生其它反应。作出这种判断的依据是 生成物只有FeSO4一种 _______________________。 (4)某铁矿主要成分为Fe3O4,利用CO将该物质中铁还原出来的 高温 Fe3O4+4CO===3Fe+4CO2 方程式为 ___________ 。
适量 稀硫酸
(1)操作Ⅰ的名称是 过滤 ;该操作需用到的铁制仪器 铁架台 。 为 (2)固体A的成分是 铁、铜 ; 操作Ⅱ反应的化学方程式为Fe + H2SO4 = FeSO4 + H2↑ 。 (3)黑色固体C加适量稀硫酸反应的方程式 CuO + H2SO4 = CuSO4 +H2O 为 。 (4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途 径是 Ⅱ (填:“Ⅰ”或“Ⅱ”), 理由是 途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液 。
CuSO4的溶液 过滤
滤液
液
铁晶体
不溶性杂质 (1)废液在加入金属X前需进行过滤,目的是将其中的__________ 除去。进行过滤操作所需的玻璃仪器有漏斗、烧杯、玻璃棒 。 铁(或Fe) (2)金属X是________, 其加入废液后发生反应的化学方程式 为___CuSO4+Fe=FeSO4+Cu _______; 稀硫酸(或稀H 溶液Y是____________,2SO4) 利用其除去铜中杂质,有关反应的化学方程式为 H2SO4+ Fe= FeSO4 +H2↑ _____________________________。
中考化学题型突破练四 流程图题
镁镁。
化
类型 4:海水资源的利用 10.★(2016·重庆 A)海水中含有丰富的镁,目前世界上生产的镁 60%来 自于海水。分离出食盐的海水称作苦卤水,其中含有丰富的 MgCl2。工业 上以苦卤水为原料制取金属镁的流程如图:
(1) 写出沉淀槽中发生反应的化学方程式:CCaaOO++HH22OO======CCaa((OOHH))2 2 ,
(1)研磨是为了_增_增大大__(选填“增大”或“减小”)反应物的接触面积, 使反应更充分。 (2)溶液 A 中的阳离子有_C_uC2u+2+、、HH++__(填符号),气体 B 的化学式为 _C_COO22__。 (3)矿物颜料用于画作能避免虫蛀的主要原因_C_C__(填序号)。 A.炭黑有吸附性 B.赭石有吸水性 C.孔雀石有毒性 (4) 反 应 ② 能 一 步 完 成 , 并 有 水 生 成 , 该 反 应 的 化 学 方 程 式 为 __CCuu22((OOHH))2C2OC3O+3+C=高C==温==22CCuu++HH22OO++22CCOO22↑__。
钙
11.(2022·东营)海洋是人类巨大的资源宝库,如图为某课题小组模拟 从海水中提取金属镁的简易流 程图。
【信息】某品牌不同碱的价格 试剂 NaOH Ca(OH)2 KOH
价格(元/吨) 3 100 670 7 000
请分析:
(1)海水和母液都可以作为制取氯化镁的原料,小真同学提出选择母液更
好,小组同学一致同意他的观点,理由是母母液液中中的氯的化氯镁化浓度镁更浓高。 (2)在工业生产中为了降低成本,步骤Ⅰ度中的更试高剂①最好选择表格中的
类型 2:物质的回收和利用 4.(2022·济宁)某工业废液中主要含有 CuCl2、NaCl,为防止废液直接 排放对环境造成危害,课外探究小组经采样分析,尝试利用这种工业废 液回收金属铜。实验设计流程如图:
