药物分析绪论、第一章1
药物分析重点思考题

药物分析重点思考题绪论第一章1、中国药典内容分哪几部分?正文部分包括哪些项目?答:中国药典的内容分为:正文、附录、凡例正文部分包括:品名(中文名,汉语拼音名与英文名)、有机药物的结构式、分子式与分子量、来源或有机药物的化学名称、含量或效价、处方、制法、性状、鉴别、检查、含量或效价测定、类别、规格、贮藏、制剂等。
2、在药分工作中可参考的国外药典有哪些?答:美国药典与美国国家处方集(USPNF) 、英国药典(BP) 、日本药局方(JP) 、欧洲药典(Ph.Eup) 、国际药典(Ph.Int)3、溶液的百分比用%表示,单位是什么?答:g/g是指溶液100ml中含有溶质若干克。
4、中国药典的附录包括哪些内容?答:附录组成:制剂通则、通用检测方法和指导原则除另有规定外,正文中所用试药,均应按附录要求规定选用。
所用试液、缓冲液、指示剂与滴定液等也应按附录规定配制。
试验用水除另有规定外均系指纯化水。
5、试述药品检验程序及各项检验的意义。
药品检验工作的基本程序一般为取样、检验(鉴别、检查、含量测定)、留样、写出报告。
第二章1、药物鉴别的意义是什么?答:药物鉴别是利用物理的、化学的、物理化学或生物学的手段来辨别药物的真伪的试验,收载在药品质量标准的鉴别项下,在药物分析工作中属首项工作。
辨别药品的真伪是保证安全有效的前提条件。
2、什么是一般鉴别试验和专属鉴别试验?答:根据反应的专属性可将鉴别试验分为一般鉴别试验和专属鉴别试验。
一般鉴别试验是以某一类药物的化学结构及其物理化学性质为依据,通过化学反应来鉴别该类药物真伪的方法。
专属鉴别试验是根据每一种药物化学结构的差异及其所引起的物理化学特性的不同,选用某些灵敏的定性反应来区分同类药物中的各个药物单体,达到确证药物真伪的目的。
中国药典采用红外法鉴别药物时,试样的制备方法有哪些?答:压片法、糊法、膜法、溶液法如何利用色谱法鉴别药物?答:色谱鉴别法是利用不同物质在不同色谱条件下,产生各自的特征色谱行为进行鉴别试验,采用与对照品在相同的条件下分离、并进行比较,根据两者保留行为和检测结果是否一致来验证药物真伪。
药物分析绪论

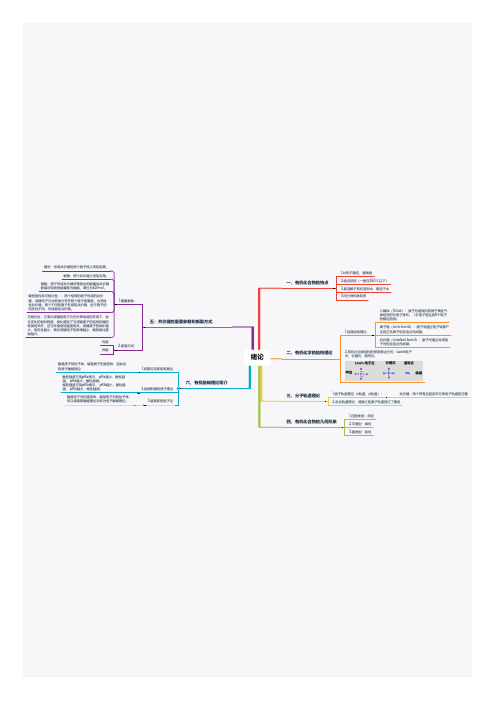
五、药品质量标准主要内容: 1名称 2形状 3鉴别 4检查 5含量测定 6类别 7贮藏
第一章 绪论
一、药物分析的性质 药物分析是运用化学、物理化学或生物 化学的方法和技术,研究化学结构已经 明确的合成药物或天然药物及其制剂的 质量控制方法,也研究有代表性的中药 制剂和生化药物及其制品在临床应用过程中 的有效性和安全性。 三、质量标准 评价药品的质量从两方面考虑: 1、药物的疗效和毒副作用。 2、药物的纯度。 四、分类:国家药品标准——《中国药 典》、《局颁药品标准》
绪论第一节药物分析在药学领域中的地位和任务

红外光谱法(IR)
IR可用于药物的定性鉴别和结构解析,通过比较药物的红外光谱图与标准品或文献数据,可以确 定药物的化学结构。
原子吸收光谱法(AAS)
AAS主要用于药物中金属元素的定量分析,如钙、镁、铁等,具有选择性好、灵敏度高等优点。
鉴别试验
通过化学反应、光谱分析等手段, 对制剂中的成分进行定性鉴别, 确保其真实性。
杂质检查
采用色谱法、光谱法等方法,对 制剂中的杂质进行定性和定量分 析,控制其质量。
性状检查
观察制剂的外观、颜色、气味等 性状,判断其是否符合规定要求。
含量测定
运用滴定法、比色法、色谱法等 手段,准确测定制剂中有效成分 的含量,保证其符合质量标准。
药物分析在制剂生产过程中,通过对制剂的性状、鉴别、含量测定等 方面的研究,确保制剂的质量稳定可控,保障用药安全有效。
药品贮藏过程中的质量监控
药物分析通过对药品在贮藏过程中的稳定性、降解产物等方面 的研究,为药品的贮藏条件和使用期限的制定提供科学依据。
03 药物分析任务与方法
原料药物质量控制任务及方法
药物分析目的
确保药物质量,保障用药安全,促进 药物研发与创新,提高药物治疗效果。
药物分析历史与发展
药物分析历史
自古以来,人们就有对药物进行鉴别和质量控制的需求。随着科学技术的发展,药物分析方法不断改 进和完善,从传统的感官鉴别、物理和化学方法,逐渐发展到现代仪器分析和生物分析方法。
药物分析发展
近年来,药物分析领域发展迅速,新方法、新技术不断涌现。例如,色谱法、光谱法、质谱法、生物 芯片技术等在药物分析中得到了广泛应用。同时,随着计算机技术和人工智能的发展,药物分析的自 动化、智能化水平不断提高。
药物分析第一章绪论练习题与答案

第一章药物分析绪论练习题一、填空题1.“精密称定”系指称取重量应准确至所取重量的;“称定”系指称取重量应准确至所取重量的;取用量为“约”若干时,系指取用量不得超过规定量的。
2药物分析主要是采用或等方法与技术,研究化学结构已知的合成药物与天然药物及其制剂的组成、理化性质、真伪鉴别、纯度检查以及有效成分的含量测定等。
所以,药物分析是一门的方法性学科。
3.判断一个药物质量是否符合要求,必须全面考虑______、______、______三者的检验结果。
4.药物分析的基本任务是检验药品质量,保障人民用药_____、_____、____的重要方面。
5. 药物分析的任务是(药品质量常规检查)、(治疗药物监测)、(新药质量研究)。
1、千分之一百分之一±10%2、物理化学生物化学研究与发展药品质量控制3、鉴别,检查,含量测定4、安全,合理,有效二最佳选择题(选择一个最佳答案)1.关于中国药典,最恰当的说法是( D )。
A.关于药物分析的书B.收载我国生产的所有药物的书C.关于药物的词典D.国家监督管理药品质量的法定技术标准E.关于中草药与中成药的技术规范2.美国药典的英文缩写是( C )。
A.BP B.JP C.USPD.ChPE.以上都不是3.中国药典中既对药品具有鉴别意义,又能反映药品的纯杂程度的项目是( B )。
A.外观B.物理常数C.鉴别D.检查E.含量测定4.中国药典规定取某药2.0g,系指称取的质量应为( C )。
A.1~3g B.1.5~2.5g C.1.95~2.05gD.1.995~2.005g E.1.9995~2.0005g5.中国药典规定,乙醇未指明浓度时,是指浓度为( C )。
A.100%(mL/mL) B.99.5%(mL/mL) C.95%(mL/mL)D.75%(mL/mL) E.50%(mL/mL)6.中国药典规定,“精密称定”时,系指称取重量应准确至所取质量的( C )。
药学导论第1章-绪论

多种,97%的化学药品为仿制
制剂水平低:缺少高技术含量的定时、定位、定量释 放药物的制剂,蛋白质、多肽生物大分子制剂以及新 剂型的辅料研究与生产水平较低
第六节 21世纪药学发展趋势
四、我国药学发展的热点方向
健康
狭义:人体各器官系统发育良好,功能正常,体质健壮, 精力充沛。 WTO:健康不仅是免于疾病和衰弱,而且是个体在体格方 面、精神方面和社会方面的完美状态。
第五节 现代药学的概念与特点
疾病
《辞海》:疾病是人体在一定条件下,由致病因素所 引起的一种复杂而有一定表现的病理过程。
致病因素:外在原因、内在原因、自然环境与社会心
共同发展
第五节 现代药学的概念与特点
三、现代药学发展的特征
高科技特征 数学与计算机技术的大量应用,高分子材料科学、分 子生物学等高科技成果的广泛应用 学科分化、综合、交叉发展的特征 社会化发展的特征 药学行业已成为各国国民经济的支柱产业 发展模式转变的特征 分子生物学和生物技术的广泛应用使化学-药学模式转 变为化学-生物学-药学模式
流传最广:中、日、法、英、德、俄
前无古人,后无来者
第三节 近代药学发展
一、近代药学相关学科的发展
近代化学的发展:原子分子学说、元素周期表、无机 化学与有机化学、分析化学 近代生物学的发展:林耐的动植物分类系统与命名方 法
近代医学的发展:微生物学与细菌学
第三节 近代药学发展
二、近代药学的发展
药学进步:医药化学运动 药理学形成:大量生物碱被提取出来,研究了它们与
药理学等
专业应用 药剂学 药物分析学等 药事管理法 人文交叉 医药文献学 医药伦理学等
第1章绪论

1.新药
新药 是指未曾在中国境内上市销售的 已上市药品改变剂型、 药品 。已上市药品改变剂型、改变给 药途径的,按照新药管理。 药途径的,按照新药管理。
返回
2.化学药品注册分类
1、未在国内外上市销售的药品: 未在国内外上市销售的药品: 2、改变给药途径且尚未在国内外上市销售的制剂。 改变给药途径且尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药品: 已在国外上市销售但尚未在国内上市销售的药品: 4、改变已上市销售盐类药物的酸根、碱基(或者金 改变已上市销售盐类药物的酸根、碱基( 属元素),但不改变其药理作用的原料药及其制剂 属元素),但不改变其药理作用的原料药及其制剂 。 ), 5、改变国内已上市销售药品的剂型,但不改变给药 改变国内已上市销售药品的剂型, 途径的制剂。 途径的制剂。 6、已有国家药品标准的原料药或者制剂
2.药物的质量要求 药物的质量要求
requirement of drugs 从化合物→药 从化合物→药 药理、 有效性 药理、药效试验 安全性 急性毒性试验 老鼠 长期毒性试验 狗
LD50
3.中华人民共和国药品管理法 中华人民共和国药品管理法
(1984年9月20日第六届全国人民 1984年 20日第六届全国人民 代表大会常务委员会第七次会议通过 2001年 28日第九届全国人民代 2001年2月28日第九届全国人民代 表大会常务委员会第二十次会议修订) 表大会常务委员会第二十次会议修订)
思考题
查咖啡因、头孢唑啉钠、维生素 的质量标准 查咖啡因、头孢唑啉钠、维生素C的质量标准 比较四个主要项目的方法 比较上述药物2000年版与 年版与2005年版质量标准 比较上述药物 年版与 年版质量标准 有何不同
3.附录 附录
药物分析-绪 论

第一节 药品质量标准的研究目的
药品质量的内涵包括三个方面: 真伪、纯度、品质
决定在使用过程中的有效性和安全性 用药品质量标准控制(原料、制剂)
中 国 药 典
第二节 药品质量研究的主要内容
药典采用的计量单位、符号与专业术语
法 定 长度: 米m
分米dm 厘米cm
计
毫米mm 微米μm 纳米nm
量
单 位
体积: 升L
毫升mL 微升μL
和
符 波数: 厘米的倒数cm-1
号
药典采用的计量单位、符号与专业术语
法 质(重)量:千克kg 克g 毫克 mg
定 计
微克μg 纳克ng
量
单 位
压力 : 帕Pa 千帕kPa 兆帕MPa
和
符 号 密度: 千克每立方米 Kg/m3
药典采用的计量单位、符号与专业术语
1、溶解度
试验中的供试品与试液等“称重”或“量 取” 的量均以阿拉伯数码表示,其精确度可根 据数据值的有效数位来确定。
药典采用的计量单位、符号与专业术语
称取“0.1g”,系指称取重量可为0.06-0.14g 称取“2g”,系指称取重量可为1.5-2.5g 称取“2.0g”,系指称取重量可为1.95-2.05g 称取“2.00g”,指称取重量可为1.9952.005g
溶解. 几乎不溶或不溶 系指溶质(1g或1ml)能在溶剂10000ml
中不能完全溶解.
药典采用的计量单位、符号与专业术语
实验法 除另有规定外,称取研成细粉的供 试品或量取液体供试品,置于25±2℃一定 溶剂中,每隔5min强力振摇30秒,观察30分 内的溶解情况,如不见溶质颗粒或液滴 即为完全溶解
第五节、主要国外药典简介
药物分析 第一章 绪论 思维导图
共价键(covalent bond):原子间通过共用电 子对相互结合而成键。
2.有机化合物结构的常用表达方式:Lewis电子 式、价键式、缩写式。
三、分子轨道理论
1.原子轨道理论(s轨道、p轨道):
共价键:两个带有自旋反平行单电子轨道的交叠
2.杂化轨道理论:成键之前原子轨道进行了重组
四、有机化合物的几何形象
可极化性:它表示成键的电子云在外界电场的作用下,发 生变化的相对程度。极化度除了与成键原子的结构和键的 种类有关外,还与外接电场强度有关。成键原子的体积越 大,电负性越小,核对成键电子的束缚越小,键的极化度 就越大。
均裂
异裂
1.重要参数: 2.断裂方式:
五:共价键的重要参数和断裂方式
酸是质子的给予体,碱是质子的接受体,因此也 称质子酸碱理论
绪论
一、有机化合物的特点
1.对热不稳定,易燃烧 2.熔点较低(一般在250℃以下) 3.易溶解于有机溶剂中,难溶于水 3.同分异构体较多
二、有机化学的结构理论
八隅体(Octet):原子总是倾向获得于惰性气 体相同的价电子排布。(价电子层达到8个电子 的稳定结构)
1.经典结构理论:
离子键(ionic bond):原子间通过电子转移产 生的正负离子相互结合而成键。
1.四面体型:烷烃 2.平面型:烯烃 3.直线型:炔烃
酸的强度可用pKa表示, pKa越小,酸性越 强。 pKa越大,酸性越弱。 碱的强度可用pKb表示, pKb越小,碱性越 强。 pKb越大,碱性越弱。
酸是电子对的接受体,碱是电子对的给予体, 所以路易斯酸碱理论亦称论 3.路易斯的电子论
六、有机酸碱理论简介
键长:形成共价键的两个原子核之间的距离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三) 附 录
制剂通则 通用检测方法 药典附录 指导原则
生物制品通则
第二节 国外药典简介
一、美国药典 (USP(29)-NF(24))
凡例 (General Notices) 正文 (Monographs ) 附录 (Appendices)
收载品种 37777种
美国药典正文药品名录分别按法定药名字母顺序排列,各药 品条目大都列有药名、结构式、分子式、CA登记号、成分和 含量说明、包装和贮藏规格、鉴定方法、干燥失重、炽灼残 渣、检测方法等常规项目,正文之后还有对各种药品进行测 试的方法和要求的通用章节及对各种药物的一般要求的通则。 可根据书后所附的USP和NF的联合索引查阅本书。
The International Pharmacopoeia Ch.Int
绪 论
三、药品质量管理规范
GLP (Good Laboratory Practice ) GMP (Good Manufacture Practice ) GSP (Good Supply Practice) GCP (Good Clinical Practice)
GAP《中药材生产质量管理规范》 GUP《医疗机构药剂质量管理规范》 GPP 《优良药房工作规范》 AQC 《分析质量管理》
第一章 药典概况
1
《中国药典》
2
国外药典简介
3
药检工作的基本程序
第一节 中国药典
一、基本概念
1.药品质量标准
国家对药品质量及检验方法所作的技术规定,是药品生产、 经营、使用、检验和监督管理部门共同遵循的法定依据。
使用非成熟(非法定)方法 标准规格高于法定标准
各 国 药 典
Chinese Pharmacopoeia Ch.P The United States Pharmacopoeia USP The National Formulary NF British Pharmacopoeia BP Japan Pharmacopoeia JP European Pharmacopoeia Ph.Eur
(一) 凡 例
4.标准品、对照品 用途:用于鉴别、检查、含量测定的标准物质。 特点:由国务院药品监督管理部门指定单位制备、标定和供应。
标准品:用于生物检定、抗生素或生化药品中含量或效价测定;
按效价单位(或μg)计,以国际标准品标定。
对照品: 用于结构确切物质(如化学药)分析。按干燥品(或无
水物)进行计算后使用。
药物分析
药物分析教研室
绪 论
一、药物分析的性质与任务
以化学、物理化学及生物化学的方法和技术对药物 的质量进行全面控制的学科。
‘
方法学科
化学 分析
药物分析
光谱
色谱
化纯有质 学度效量 结测成标 构定分准 确 测制 证 定定
指临药治 导床物疗 临药相药 床物互物 用试作监 药验用测
药物 研制 药物 分析
一部为化学药品、抗生素、放射性药品及制剂 二部收载生药、生物制品、调剂用附加剂等 索引:日本名、英文名和拉丁名索引三种。 质量标准主要内容:鉴别、检查、含量测定。
三、药检基本程序
取样
检验报告 书写
• 科学性 • 真实性 • 代表性
药品检验 工作
鉴 别
含量测定
检查
2. 药典
① ② ③
记载药品质量标准的法典; 国家监督、管理药品质量法定技术标准; 具有法律的约束力。
3500 3000 2500 2000 1500 1000 500 0 1953 1963 1977 2000 531 1310 1925 2691
3214
2005
一部(药材、饮片、植物油脂、成方和单方制剂)
母体的选定应与CA 一致。
化学结构式——按WHO推荐的 “药品化学结构式书
写指南”书写。
(一) 凡 例
2.项目与要求 3.检验方法与限度
标准中规定的各种纯度和限度数值以及制剂的重(装)量 差异,系包括上限和下限两个数值本身及中间数值,均为有效
数字。
原料药的含量(%),除另有注明者外,均按重量计。如 规定上限为100%以上时,系指用本药典规定的分析方法测定时 可能达到的数值,为药典规定的限度或允许偏差,并非真实含 有量;如未规定上限时,系指不超过101.0%。
药物 生产
药中生制 物间产剂 质体工质 量 艺量 优 化
临床 药学
药物 流通
药假 物冒 稳伪 定劣 性检 验
绪 论
二、国家药品标准
《中华人民共和国药品管理法》 中国药典 (2005版) Ch.P 药 品 质 量 标 准 国家 标准 局颁标准 企业 标准
临床研究用标准(临床研究) 暂行标准(试生产) 试行标准(正式生产初期) 地方标准整理提高后的品种
(二) 正 文
正文收载药品或制剂的质量标准,按中文药品名称笔画顺 序编排,单方制剂排在原料药后面;生物制品集中排列。
每一品种项含: ⑴品名(包括中文名,汉语拼音名与英文名) ⑵有机药物的结构式;⑶分子式与分子量; ⑷来源或有机药物的化学名称;⑸含量或效价规定;⑹ 处方;⑺制法;⑻性状;⑼鉴别;⑽检查;⑾含量或效 价测定;⑿类别;⒀规格;⒁贮藏;⒂制剂
二、英国药典 (BP 2005) 原料药
2
BP 2005
CD版
药物制剂、血液制品、 免疫制品、放射性药物 制剂、手术材料
红外参考光谱、 附录、增补内容、 索引
5
兽药的原料、制 剂和疫苗标准
三、欧洲药典 (Ph.Eur 2005) 四、日本药局方 (JP 15)
凡例、正文、附录和索引等内容组成
05版 药典
化学药品、抗生素、生化药物、放射性药品
二部
药用辅料
三部 (生物制品)
二、药典内容
解释、使用药典基本原则
凡
例
规定正文、附录共性问题 药品质量标准
药 典 内 容
正
文
制剂质量标准 生物制品质量标准
制剂通则
附
录
通用检测方法 指导原则 中文索引
索 引
英文索引
(一) 凡 例 1.名称
中文药名——《中国药品通用名称》 英文名称——《国际非专利药品》 (INN) 化学名称—— 《有机化学命名原则》,
(一) 凡 例
5.计量 6.精密度
试验中供试品与试药等“称重”或“量取”的量,以阿拉伯 数字表示, 精确度根据数值的有效数位来确定 。
精密称定: 称取重量准确至所取重量千分之一 称定: 称取重量应准确至所取重量的百分之一 精密量取:量取体积的准确度应符合国家标准中对该体积
移液管的精密度要求.
量取:用量筒或按照量取体积的有效位数选用量具 “约”: 所取量不得超过规定量±10%
