分光光度测弱电解质的电离常数
物化实验六:分光光度法测溴酚蓝的电离平衡常数

分光光度法测溴酚蓝的电离平衡常数紫外—可见(UV)分光光度法提供了一种测量弱电解质电离平衡常数的简便方法——通过测量不同pH条件下溶液的吸光度A,得到A ~ pH的关系曲线,然后可以间接的计算出该电解质的电离平衡常数。
本实验测定溴酚蓝(BPB)溶液的吸光度,以及相应的PH值,并籍此计算其Ka 。
2、实验部分:2.1 仪器与药品溴酚蓝电离平衡常数紫外—可见分光光度法722光栅分光光度计超级恒温水浴pHS-3B精密电子pH计移液管,量筒,滴管,容量瓶等5E-5 mol /L BPB溶液0.1 mol /L 邻苯二甲酸氢钾溶液(缓冲剂)HCl溶液(0.1mol /L,1 mol /L)NaOH溶液(0.1mol /L,0.2mol /L)2.2 实验过程1、准备工作:打开超级恒温水浴恒温25℃,打开分光光度计预热仪器,掀开样品室盖。
2、确定溶液的最大吸收波长。
(1)准确移取5×10-5mol /L的BPB溶液20mL,置于100mL容量瓶中,并准确加入50mL 0.1mol /L的邻苯二甲酸氢钾缓冲溶液,稀释到刻度。
得1×10-5mol /L BPB溶液。
(2)取1cm厚度的比色皿二只,润洗后分别装入H2O,1.0×10-5mol /L BPB 溶液,以H2O作空白溶液校正仪器。
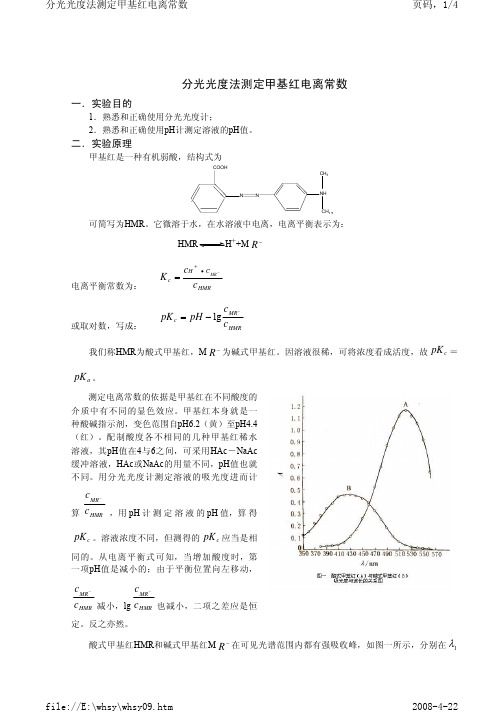
(3)在480 ~ 630nm波长范围内,从低到高逐一选择仪器的入射光波长,用空白溶液蒸馏水在T档校正仪器的0点和100点,并用吸光旋钮调节H2O的吸光度为0,再测量1.0×10-5mol /L BPB溶液的透光率T——在480 ~ 560nm 的范围内每隔10nm测一次,在560 ~ 600nm范围内每隔5nm测一次。
将所得的结果以吸光度D对 作图,读出最大吸收波长。
3、不同酸度下,溴酚蓝溶液吸光度D的测定。
(1)取7只100mL容量瓶,分别加入20mL 5×10-5mol /L的BPB溶液,再分别加入50mL 0.1mol /L邻苯二甲酸氢钾溶液。
分光光度法测解离常数

分光光度法测解离常数分光光度法测解离常数是一种常用的化学分析方法,它基于溶液中离子生成化合物时所产生的吸收光谱变化,通过测量溶液的吸光度来确定离子的浓度,从而计算出其解离常数。
在分光光度法测解离常数中,常用的测量仪器是分光光度计。
分光光度计通过将一束白光通过光束分离器分成两束光,其中一束通过待测溶液,另一束通过参比溶液,然后测量两束光通过溶液后的吸光度差异。
这种方法的关键在于找到与所测离子有化学反应的试剂,使其在特定的条件下形成化合物,其吸收光谱具有可测的吸光度。
常用的试剂有一个化学反应物和一个指示剂。
分光光度法测解离常数的基本原理是比较溶液中阴离子与阳离子的摩尔吸光度的差异。
当哈伯德滥觞法则成立时,假设物质完全解离,可以得到如下平衡方程:AX ⇌A+ + X–在溶液中,阴离子与阳离子的浓度分别为cA和cX,摩尔吸光度分别为εA和εX。
当溶液被分光光度计通过时,吸光度的变化ΔA与溶液浓度变化Δc之间的关系为:ΔA = εAΔcA + εXΔcX其中,ΔcA和ΔcX分别为阴离子和阳离子浓度的变化量,εA 和εX分别为阴离子和阳离子的摩尔吸光度。
根据比例:cA/cX = εA/εX通过测量吸光度的变化,可以得到阴离子和阳离子浓度的变化量,从而计算出解离常数。
在实际应用中,为了测量离子的解离常数,需要选择适当的试剂和满足一定条件的反应体系。
同时,还需要进行一系列的标准曲线测量和数据处理,以获得准确的测量结果。
此外,还需要注意溶液的温度、pH值等条件对测量结果的影响。
分光光度法测解离常数广泛应用于分析化学、环境监测、生物化学等领域。
它具有灵敏度高、测量范围广、结果准确等优点,但也存在实验操作复杂、实验条件要求严格等问题。
因此,在实际应用中需要根据具体情况进行选择和优化,以获得可靠的测量结果。
分光光度法测溴酚蓝的电离平衡常数

分光光度法测溴酚蓝的电离平衡常数摘要:溴酚蓝是一种弱电解质,可以作为酸碱指示剂。
溶液pH 不同,溴酚蓝电离程度亦不同,从而显示出不同的颜色。
溴酚蓝的分子和离子对光的最大吸收的位置是不同的,根据这一性质,用分光光度法测定不同酸碱条件下溶液的吸光度,再根据溶液浓度与吸光度的关系,求得溴酚蓝的电离平衡常数。
关键词:溴酚蓝,弱电解质,平衡常数,分光光度法Measurement of equilibrium constant of bromophenol blue by Uv-Vis SpectrophotometryAbstract :Bromophenol blue is a kind of weak electrolyte, and can be used as acid-base indicator. The ionization of bromophenol blue varies with the pH of the solution, resulting in different colors. Different types of bromophenol blue have diverse maximum absorption wavelength, according to which the absorbance of the bromophenol blue solution is acquired by Spectrophotometry. And the equilibrium constant is obtained based on the relationship between the absorbance and the concentration of the solution.Keyword:bromophenolblue,weakelectrolyte,equilibriumconstant,Spectrophotometry1、序言弱电解质在水溶液中不能完全电离,因此无法准确获得溶液中各组分的浓度,在求算弱电解质的电离平衡常数时比较困难。
分光光度法测定甲基红电离常数
file://E:\whsy\whsy09.htm
2008-4-22
(2)用移液管准确吸取10ml甲基红标准溶液移入100ml容量瓶中,加入25ml0.04mol/LNaAc溶 液,用水稀释至刻度。此溶液pH值约为8,甲基红绝大部分以MR-存在,称为B液,颜色为黄色;
31 (3)用0.01mol/LHCl溶液和0.01mol/LnaAc溶液分别准确稀释A液和B液至原刻度的 4 、 2 、和
四.实验步骤
1.722型分光光度计的调节和使用
file://E:\whsy\whsy09.htm
2008-4-22
分光光度法测定甲基红电离常数
页码,3/4
2.吸光系数 K1,HMR 、 K1,MR− 、 K 2,HMR 、 K 2,MR− 的测定
(1)用 移 液 管 准 确 吸 取 10ml 甲 基 红 标 准 溶 液 移 入 100ml 容 量 瓶 中,加 入 10ml0.1mol/LHCl 溶 液,用水稀释至刻度。此溶液pH值约为2,甲基红绝大部分以HMR存在,称为A液,颜色为深红;
c MR − 计算出 cHMR 。
2.不同酸度甲基红溶液吸光度和pH值测定结果及计算
样品号
1
2
3
4
file://E:\whsy\whsy09.htm
2008-4-22
分光光度法测定甲基红电离常数
页码,4/4
A1
A2
c MR
−
lg cHMR
pH pKc
3.25℃时pKc的文献值为4.95,求各测定值的相对误差。
性,当溶液中含有多种组分时,总吸光度等于各组分吸光度之和。现溶液中HMR和M R − 的浓度分
别为 cHMR 和 cMR− ,A1和A2为在波长 λ1 和 λ2 下测得的总吸光度,则
弱电解质电离平衡常数的测定实验报告

弱电解质电离平衡常数的测定实验报告实验目的:测定弱电解质电离平衡常数实验原理:弱电解质的电离平衡可以用离子平衡法求解。
在该法中,电解质溶液中的每个电离平衡都可以表示为以下反应:HA ⇌ H+ + A-其中,HA表示弱电解质分子,H+表示氢离子,A-表示相应的阴离子。
在电解质的溶液中,HA的浓度通常很大,而H+和A-的浓度就相对较小。
电离常数(Ka)表示为:Ka = [H+][A-]/[HA]其中,Ka表示弱电解质的离解常数,[H+]表示氢离子的浓度,[A-]表示相应的阴离子的浓度,[HA]表示弱电解质分子的浓度。
由于[H+]和[A-]的浓度很小,所以我们通常用pKa表示指数:pKa = -logKa实验步骤:1.按照实验要求,通过称量固体试剂来制备弱电解质溶液。
2.使用pH计测量弱电解质溶液的pH值,记录下数据。
3.将氧化还原电极放入溶液中,测量电势值。
4.利用计算机或手动计算法,计算出弱电解质的电离常数和pKa值。
实验数据记录:试验物质 | 原始质量(g) | 成功制备量(g) | 浓度(mol/L) | pH值 | 电势值(mV)甲酸 | 5.0g | 4.8g | 0.2mol/L | 3.64 | 195.2计算结果:由于pH计测量时存在一定误差,我们使用电极法来计算电离平衡常数。
对于甲酸,Ka = 1.77 × 10^-4,pKa = 3.75。
结论:通过实验,我们成功地测定了甲酸这一弱电解质的电离平衡常数。
这项实验不仅让我们更好地理解了离子平衡法,还让我们掌握了一种可以用于测定化学平衡的实验方法。
弱电解质电离常数的测定实验报告

弱电解质电离常数的测定实验报告实验报告:弱电解质电离常数的测定摘要:本实验采用了电导法和pH法,测定了弱电解质乙酸的电离常数。
实验结果表明,在本实验条件下,乙酸的电离常数(K)为1.42×10^-5。
引言:弱电解质的电离常数是描述其电离程度的重要参数。
而弱电解质的电离程度又对其化学性质和物理性质的表现产生重要影响。
因此,测定弱电解质的电离常数是化学实验中非常重要的一项内容。
本实验采用了两种方法测定弱电解质电离常数:电导法和pH 法。
电导法是通过测量溶液电导率的方式,求出电离度,再根据电离度求出电离常数。
而pH法则是引入指示剂,通过观察溶液酸碱指示剂的颜色变化,来测定溶液的pH值,再根据酸碱平衡理论求出电离常数。
两种方法各具特点,都有其适应性较广的实验条件。
实验方法:1. 电导法:实验准备:分别将乙酸(CH3COOH)和氯化钠(NaCl)粉末称取适量加入两个干燥的量筒中。
在称量过程中,要求精确且取样量应相同。
将两个量筒分别加入水后摇匀,使其完全溶解,制成1 mol/L的标准溶液。
实验过程:(1)实验前,使用电导仪对电极进行标定,并检查仪器应用状态是否正常。
(2)将不同体积的乙酸溶液加入电导池中,测定每个体积下的电导率,记录数据。
(3)将不同体积的氯化钠溶液加入电导池中,测定每个体积下的电导率,记录数据。
实验准备:分别将pH值各不相同的缓冲溶液制备好,乙酸和氯化钠的标准溶液也需要提前制备好。
实验过程:(1)将乙酸标准溶液倒入盛有相同体积缓冲溶液的比色皿中,然后将一定体积的NaOH溶液导入其中,观察pH值变化,并记录所导入NaOH溶液的体积。
这样做是为了制备满足pH值要求的乙酸缓冲溶液。
(2)当制作好乙酸缓冲溶液后,将其与NaCl混合制成一定浓度的混合溶液,并在其中加入酸碱指示剂,以观察其pH值的变化,并记录所导入NaOH溶液的体积。
(3)根据获得的数据,计算出乙酸的电离度和电离常数。
实验结果:1. 电导法:可计算出不同体积下的溶液电导率,进而计算出溶液的电离度。
常见弱电解质电离平衡常数表

弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L—1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O—5 4.75 碳酸H2CO3K1=4.3O×lO-76。
37K2=5.61×1O-111O.25 草酸H2C2O4K1=5。
9O×lO-2 1.23K2=6。
4O×lO-54。
19 亚硝酸HNO24。
6×1O-4 (285。
5K) 3.37 磷酸H3PO4K1=7。
52×lO—3 2.12K2=6.23×1O-87.21K3=2。
2×lO-13 (291K) 12。
67 亚硫酸H2SO3 K1=1。
54×lO—2(291K) 1.81K2=1.O2×lO—76。
91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢H2S K1=9.l×lO-8 (291K)7.O4K2=l。
l×1O—1211.96 氢氰酸HCN4。
93×1O-1O9。
31 铬酸H2CrO4K1=1.8×lO—1O。
74K2=3。
2O×1O—76。
49 *硼酸H3BO3 5.8×1O-1O9。
24 氢氟酸HF3。
53×1O-43。
45 过氧化氢H2O22。
4×1O—1211。
62 次氯酸HClO 2.95×1O-5(291K)4。
53 次溴酸HBrO2。
O6×1O-98.69 次碘酸HIO 2.3×1O—111O.64 碘酸HIO3 1.69×1O-1O。
77 砷酸H3AsO4 K1=5.62×lO-3(291K) 2。
25K2=l。
7O×lO-7 6.77K3=3.95×1O-1211。
4O 亚砷酸HAsO26×1O—1O9.22 铵离子NH4+5。
用分光光度法测定弱电解质的电离常数

溶液b的吸收光谱曲线,求出最大吸收峰的波长λa 和λb。 2. 实验步骤3中得到四组A-C关系图,从图上可求得 单组分溶液a和溶液b在波长各为λa和λb时的四个 吸光系数 3. 由实验步骤4所测得的混合溶液的总吸光度,根据 (8)、(9)两式,求出各混合溶液中[MR-]、 [HMR]值。 4. 根据测得的pH值,按(2)式求出各混合溶液中甲基 红的电离平衡常数,对4个K值求平均。
【仪器试剂】
752分光光度计1台;精密pH计1台;pH 复合电极;容量瓶;烧杯;移液管。
95%乙醇(A.R.);HCl(0.1mol· dm-3);甲 基红(A.R.);醋酸钠(0.05mol· dm-3、 0.01mol· dm-3);醋酸(0.02mol· dm-3) 。事项】
甲基红溶液、甲基红标准溶液配好后应盛于棕 色瓶中。 使用分光光度计时,先接通电源,预热20min。 为了延长光电管的寿命,在不测定时,应将暗 盒盖打开;注意拉杆的使用(光路不通?)。 使用精密pH计前应预热,使仪器稳定,然后 标定。使用中注意保护电极,使用后套上装有 电极补充液的电极套。 本实验数据处理可用Excl处理,但要设计好页 面。
接通电压,预热仪器。测定溶液a和溶液b的吸收光谱
曲线,求出最大吸收峰的波长λa和λb。
波长从360nm开始,每隔20nm测定一次,在吸收高
峰附近,在40nm范围内,每隔5nm测定一次,每改 变一次波长都要用空白溶液校正,直至波长为620nm 为止。作A-λ曲线。
求出波长λa和λb值。
【数据处理】
【目的要求】
1. 用分光光度法测定弱电解质的电离常 数。 2. 掌握分光光度法测定甲基红电离常数 的基本原理。 3. 掌握分光光度计及pH计的正确使用方 法。
