有机物的相互转化
酸醇醛三者转化关系

酸醇醛三者转化关系1. 引言在化学领域,酸、醇和醛是三种重要的有机化合物。
它们拥有不同的分子结构和化学性质,但也存在一定的转化关系。
本文将深入探讨酸、醇和醛之间的相互转化关系,以及这些转化在有机合成和生物化学中的应用。
2. 酸、醇和醛的基本概念2.1 酸酸是指具有产生氢离子(H+)的能力的物质。
它可以根据酸的强弱分为强酸和弱酸。
强酸可以完全解离生成H+离子,而弱酸只能部分解离。
2.2 醇醇是一类含有羟基(-OH)的有机化合物。
它可以根据羟基的位置分为一元醇、二元醇和多元醇。
醇的命名通常以烷基名词结尾,如乙醇、甲醇等。
2.3 醛醛是一类含有羰基(C=O)的有机化合物。
它的羰基结构在碳链上是以两个单键连接两个其他原子或基团。
醛的命名通常以醛作为后缀,如甲醛、丙醛等。
3. 酸、醇和醛的相互转化关系酸、醇和醛之间存在着相互转化的关系,这些转化在有机合成和生物化学中起着重要作用。
3.1 酸转化为醇酸可以通过还原反应转化为醇。
常见的酸还原反应包括氢化反应、金属还原反应和催化还原反应。
这些反应中,还原剂可以是氢气、金属或催化剂等。
3.1.1 氢化反应氢化反应是将酸转化为醇的常见方法。
在氢化反应中,酸与氢气在催化剂的作用下发生反应,生成相应的醇。
催化剂通常是铂、钯、铑等贵金属。
氢化反应的机理: 1. 酸与催化剂中的氢气吸附在表面上。
2. 酸的羰基与氢气发生氢化反应,生成醇。
3. 醇从催化剂表面脱附。
3.1.2 金属还原反应金属还原反应是将酸转化为醇的另一种方法。
在金属还原反应中,酸与金属发生反应,生成相应的醇。
常用的金属还原剂包括锂铝氢化物(LiAlH4)和甲基镁卤化物(Grignard试剂)等。
金属还原反应的机理: 1. 酸与金属发生反应,生成金属酸盐。
2. 金属酸盐与水反应,生成相应的醇。
3.1.3 催化还原反应催化还原反应是将酸转化为醇的另一种常见方法。
在催化还原反应中,酸与催化剂发生反应,生成相应的醇。
高中化学各类有机物之间的相互转化关系
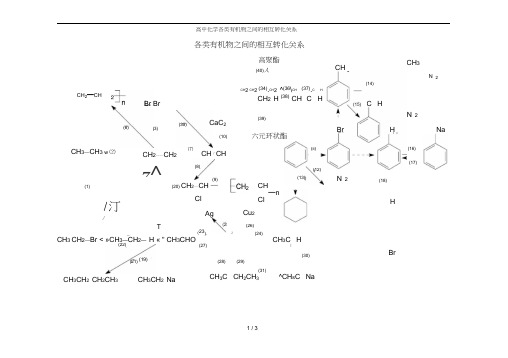
+3HO—NO2——a-
CH3
I NO2
Il+3H2O
CH2=CH2+Br2”CH2BrCH2Br
CH2=CH2+HBr尸CH3CH2Br
CH2=CH2+H2O浓H2S°4- CH3CH2OH
催化剂.
n CH2=CH2-^CH2—CH2十
催化剂
CH三CH+H2催化-CH2=CH2
CH三CH+HCl催化剂■CH2=CHCl
(30)
(28)
(29)
CH
(14)
C°°H
°H
(16)
(17)
N°2
(18)
N°2
Br
°H
Br
n°2
°Na
(31)
CH3C°°CH2CH3^CHsC°°Na
高中化学各类有机物之间的相互转化关系
光昭
CH3CH3+Br2光昭.CH3CH2Br+HBr
CH2=CH2+H2
催化剂
△
-CH3CH3
(14)
CH3
n CH2=CH
Cl
(15)
CH3
I酸性KMnO4
COOH
I I或酸性K2Cr2o7 I I
(16)
OH+NaOH
OH+Na2CO3
ONa+HCI
催化剂-一CH2—CH
_n
Cl
ONa+CO2+H2O
CaC2+2H2O» CH三CHf+Ca(OH)2
+Br2
催化剂*
A
HBr
(18)
+HO—NO2
重要有机物之间的相互转化

脂肪与脂肪酸之间的相互转化
01
脂肪酸合成
02
β-氧化
脂肪由甘油和脂肪酸合成,其中甘油部分来自糖酵解,脂肪酸部分来 自乙酰CoA。
脂肪在β-氧化过程中被分解为甘油和脂肪酸,其中甘油部分进入糖异 生途径合成糖,脂肪酸部分进一步被分解为乙酰CoA供能。
03
氨基酸之间的相互转化
通过脱氨基作用实现的氨基酸转化
04
重要有机物之间的相互转 化总结
糖类、脂肪、脂肪酸、氨基酸之间的相互转化关系
01
糖类和脂肪的相互转化
糖类在体内经过一系列反应可以转化为脂肪,脂肪经过β-氧化也可以产
生糖类。这种相互转化主要发生在碳水化合物代谢和脂肪代谢的过程中
。
02
糖类和氨基酸的相互转化
糖类可以经过氨基化作用转化为氨基酸,氨基酸也可以经过脱氨基作用
脂肪酸分解过程中的物质变化
脂肪酸的活化
脂肪酸在胞质中通过脂酰CoA合成酶的催化被活化为脂酰 CoA。
β-氧化
脂酰CoA进入线粒体中,通过β-氧化过程逐步被分解为乙 酰CoA和比原来少两个碳原子的脂酰CoA。
产物利用
乙酰CoA进入三羧酸循环被利用,脂酰CoA在β-羧化酶和 脱水酶的作用下生成烯醇式羧基酯,并进一步裂解生成不 饱和脂肪酸。
转化为糖类。这种相互转化主要发生在碳水化合物代谢和蛋白质代谢的
过程中。
03
脂肪酸和氨基酸的相互转化
脂肪酸可以经过β-氧化转化为氨基酸,氨基酸也可以经过合成作用转化
为脂肪酸。这种相互转化主要发生在脂肪酸代谢和蛋白质代谢的过程中
。
有机物相互转化过程中的能量变化
有机物相互转化过程中能量的储存和释放
有机物相互转化过程中,能量的储存和释放是密切相关的。在糖类转化为脂肪的过程中,能量以脂肪的形式储存 起来;在脂肪酸氧化产生能量的过程中,能量以ATP的形式释放出来。
有机物间的相互转化

例2:用化合物A和乙醇可制备某种新型材料W,W的表示式为:
下列是有关的各步转化关系(其中所有的无机产物已略去):
回答下列问题: (1)化合物D与H中含有的官能团是_______________(写名称)。
③卤代烃的水解(碱性) C2H5Br+NaOH ④酯的水解 CH3COOC2H5 + H2O
C2H5OH + NaBr CH3COOH+C2H5OH
△
⑷引入醛基或羰基
①醇催化氧化 2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
②烯烃与O2反应
③炔烃与水加成
催化剂 2CH2=CH2+O2 △
CH3COOCH2CH3 + H2O
转化方法之—官能团性质
官能团性质
具有酸性
官能团
—COOH、酚羟基
C=C
—C C—
官能团性质
与新制
Cu(OH)2反应
官能团
—CHO —COOH —CHO —OH —COOH
—X、 —COO—、 —COOH、酚羟基
能发生加成 反应
能发生消去 反应 能发生水解 反应 KMnO4(H ) 溶液褪色 溴水褪色
有机化合物之间的转 化关系
CH3CH3 加成 CH2=CH2 加成
取代
CH3CH2Br
消去 水解 取代 氧化 氧化
加成
消去
CH3CH2OH
加成
CH3CHO
酯化
CH3COOH
还原
CH≡CH
CH3COOCH2CH3
乙醛乙醇乙酸的转化

乙醛乙醇乙酸的转化乙醛乙醇乙酸的转化是一种重要的有机化学反应,这三种化合物之间的相互转化常常在生物化学和工业化学领域中得到广泛应用。
乙醛是一种有机化合物,化学式为C2H4O,它是一种无色液体,有刺激性气味,易挥发。
乙醛可以通过一系列化学反应转化为乙醇和乙酸。
其中最常见的反应是乙醛和水的加成反应,生成乙醇。
这个反应可以用化学式CH3CHO + H2O → CH3CH2OH表示。
这个反应也是乙醇的最主要工业化生产方法之一。
乙醛还可以通过氧化反应转化为乙酸。
氧化反应可以通过空气中的氧气或其他氧化剂引发。
其中最常见的方法是通过将乙醛溶于氢氧化钾溶液中,然后加热至70-80℃。
在这个条件下,乙醛会被氧化成乙酸,反应的化学式为CH3CHO + 2[O] → CH3COOH。
与乙醛不同,乙醇是一种无色、有刺激性气味的液体,化学式为C2H6O。
乙醇可以通过水和乙烯的加成反应或乙醛和水的加成反应生成。
此外,乙醇还可以通过脱水反应转化为乙烯。
脱水反应可以通过将乙醇和浓硫酸或浓磷酸混合加热,使其中的水分离出来,生成乙烯,反应的化学式为CH3CH2OH → CH2=CH2 + H2O。
乙酸是一种有机化合物,化学式为C2H4O2,它是一种无色、有刺激性气味的液体。
乙酸是一种常见的化学品,广泛应用于涂料、塑料、橡胶、纺织、医药、食品等领域。
乙酸可以通过氧化反应或还原反应转化为其他有机化合物。
其中最常见的反应是将乙酸加热至470℃以上,将其分解为乙烯和水。
此外,乙酸还可以通过还原反应转化为乙醇,反应的化学式为CH3COOH + 2[H] → CH3CH2OH。
总的来说,乙醛、乙醇和乙酸之间的转化是一种重要的有机化学反应。
这些化合物在生物和工业化学领域中得到广泛应用,研究这些化合物之间的转化机理对于我们更好地理解这些领域的应用非常重要。
官能团的性质和有机物相互间的转化

KMnO4 侧链与苯环相连的碳 不反应,溶液分层, 不反应,溶液分层,上层无色 上有氢, (H+) (苯层),下层紫色(水层) 上有氢,侧链一律被 苯层),下层紫色(水层) ),下层紫色
+3H2
Ni
苯环上加成
苯与苯的同系物化学性质对比: 苯与苯的同系物化学性质对比: 侧链影响苯环, (1)侧链影响苯环,使苯环上的氢原子比苯更易被取代 苯环影响侧链, (2)苯环影响侧链,使侧链能被强氧化剂氧化 有机物分子中基团之间存在相互影响。《步步高》p187(典例1) 有机物分子中基团之间存在相互影响。 步步高》p187(典例1 思考】如何鉴别苯和苯的同系物? 【思考】如何鉴别苯和苯的同系物? 酸性高锰酸钾,若褪色为苯的同系物。 酸性高锰酸钾,若褪色为苯的同系物。
二、烷烃
通式: 饱和) 1、通式: CnH2n+2 (饱和) 不饱和度: 2、不饱和度: 0 官能团: 3、官能团: 无 4、空间结构特点:链状单键 空间结构特点: CH4:正四面体 【思考】二氯甲烷的空间结构?有多少种同分异构体? 思考】二氯甲烷的空间结构?有多少种同分异构体? 四面体结构,只有一种结构。 四面体结构,只有一种结构。 思考】 含有的共价键数目是多少? 【思考】1mol CnH2n+2含有的共价键数目是多少? (3n+1)NA 3n+1)
通式: 1、通式: CnH2n 不饱和度: 2、不饱和度: 1 官能团: 3、官能团: 碳碳双键 空间结构特点: 4、空间结构特点:链状双键 C2H4:平面四边形 【思考】丙烯有多少个原子处于同一平面? 思考】丙烯有多少个原子处于同一平面? 7个 。 5、主要化学性质
(1) 氧化反应 燃烧:火焰明亮, ①燃烧:火焰明亮,伴有黑烟
重要有机物之间的相互转化

重要有机物之间的相互转化
课题20学案:重要有机物之间的相互转化(P85-86)一、有机物之间的转化关系:
二、有机合成的常规方法
1.官能团的引入
①引入双键(C=C或C=O)
1)某些醇的消去引入C=C举例:1
2)卤代烃的消去引入C=C举例:2
3)炔烃加成引入C=C举例:3
4)醇的氧化引入C=O举例:4
②引入卤原子(—X)
1)烃与X2取代举例:5
2)不饱和烃与HX或X2加成举例:6
3)醇与HX取代举例:7
③引入羟基(—OH)
1)烯烃与水的加成举例:8
2)醛(酮)与氢气加成举例:9
3)卤代烃的水解(碱性)举例:10
4)酯的水解
2.官能团的消除
①通过加成消除不饱和键;
②通过消去或氧化或酯化或取代等消除羟基;
③通过加成或氧化消除醛基;
④通过消去反应或水解反应可消除卤原子;3.官能团的衍变
a.官能团种类变化:举例:11
b.官能团数目变化:举例:12
c.官能团位置变化:举例:13。
最新苏教版选修五《醛 羧酸》(第3课时重要有机物之间的相互转化)教案

最新苏教版选修五《醛 羧酸》(第3课时重要有机物之间的相互转化)教案1.掌握有机化学反应的主要类型的原理及应用,2.3.在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
人类运用有机化学手段合成出许许多多的物质,合成有机化合物需要考虑哪些问题呢?①CH3CH3+Br2−→−光CH3CH2Br+HBr②CH2==CH2+H2−−→−催化剂CH3CH3CH ≡CH+2H2−−→−催化剂CH3CH3④CH ≡CH+H2−−→−催化剂CH2==CH2⑤CH3CH2Br+NaOH CH2===CH2↑+NaBr+H2O⑥CH3CH2Br+NaOHCH3CH2OH+NaBr⑦CH3CH2OH+HBr CH3CH2Br+H2O⑧CH3CH2OHCH2==CH2↑+H2O⑨2CH3CH2OH+O22CH3CHO+2H2O⑩CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O○11 CH3CHO+2Cu (OH )2Cu2O ↓+CH3COOH+2H2O若由乙醇制备乙二酸乙二酯(),提示:乙醇−−→−消去乙烯−−→−加成1,2-二溴乙烷−−→−水解乙二醇−−→−氧化乙二醛−−→−氧化乙二酸课堂师生互动知识点11.(1)CH3CH3+Cl2−−→−光照HCl+CH3CH2Cl(还有其他的卤代烃)(还有其他的氯代苯甲烷)CH2==CH —CH3+Cl2−−−−→−600℃~500℃CH2==CH —CH2Cl+HCl(2)CH2==CHCH3+Br2−→−CH2Br —CHBrCH3CH2==CHCH3+HBr −→−CH3—CHBrCH3CH ≡CH+HCl −−→−催化剂CH2==CHCl (3)R —OH+HX R —X+H2O2.(1CH2==CH2+H2OCH3CH2—OHCH3CH2—Br+H2O −−→−NaOHCH3CH2—OH+HBrCH3CHO+H2CH3CH2—OHCH3COCH3+H2CH3COOCH2CH3+H2O CH3COOH+CH3CH2—OH(2①酚钠盐溶液中通入CO2②苯的卤代物水解生成苯酚,3. (1)①醇的消去反应引入CH3CH2OH CH2==CH2↑+H2O②卤代烃的消去反应引入。
