玻尔的氢原子模型-完整版
合集下载
氢原子光谱和玻尔的原子模型ppt课件

爱因斯坦的光量子论
玻尔原子结构假说
假说1:
P86
+
n=1
n=2
n=3
n=4
n=∞
rn
v
-
轨道半径:
rn =n2r1
(r1 =0.53×10-l0 m)
P87
内层轨道能量低
+
n=1
n=2
n=3
n=4
n=∞
rn
v
-
P87
P87
5
43Βιβλιοθήκη 2E∞E5
E4
E3
高能级
(En)
辐射光子,原子能量减少
吸收光子克服库仑引力做功,
又无法解释原子光谱的分立特征。
经典理论的困难
核外电子绕核运动
(变化的电磁场)
辐射电磁波(能量减少)
电子轨道半径连续变小
原子不稳定
事实上:原子是稳定的
辐射电磁波频率连续变化,连续光谱
辐射电磁波频率只是某些确定值,线状谱
经典理论无法解释原子的稳定性和光谱的分立性
P85-86
①
②
普朗克黑体辐
射的量子论
②吸收能量
② hv ≥13.6ev的光子(吸收光子发生电离)
实物粒子碰撞:入射粒子能量大于两个能级差
即可吸收
全吸收 或 部分吸收
电离:电子获得能量脱离原子核束缚成为自由电子( n=∞ )的现象。
电离能:氢原子从某一状态跃迁到n=∞时所需吸收的能量
电离能大小 = 氢原子处于各定态时的能级值的绝对值
电子从低能级(如基态)向高能级(如第一激发态)跃迁时,需要
理论的基本假设
规律
以简洁的形式反映了氢原子的线状光谱的特征.
氢原子光谱玻尔氢原子理论

根据电子绕核作圆周运动的模型及角动量 量子化条件可以计算出氢原子处于各定态时的 电子轨道半径。
玻尔的氢原子理论
rn n2 (m0he22 ),n 1,2,3,
r1 0.5291010m 玻尔 半径
电子处在半径为 rn的轨道上运动时,可以计
算出氢原子系统的能量 En为
En
1 n2
பைடு நூலகம்
(8m0e2h4 2 ), n
● 量子化条件的引进没有适当的理论解释。 ● 对谱线的强度、宽度、偏振等无法处理。
氢原子光谱
例题18-6 在气体放电管中,用能量为12.5eV的电子通 过碰撞使氢原子激发,问受激发的原子向低能级 跃迁时,能发射那些波长的光谱线?
解: 设氢原子全部吸收电子的能量后最高能激发到第n
个能级,此能级的能量为
态跃迁到另一能量为 Ek的定态时,就要发射
或吸收一个频率为 kn 的光子。
kn
En
Ek h
玻尔频率公式
玻尔的氢原子理论
(3)量子化条件 在电子绕核作圆周运动中,
其稳定状态必须满足电子的角动量 L等于 h
的整数倍的条件。
2
L n h , n 1,2,3,
2
n为量子数
角动量量子化条件
3. 氢原子轨道半径和能量的计算
§18-4 氢原子光谱 玻尔的氢原子理论
1. 氢原子光谱的规律性
原子发光是重要的原子现象之一, 光谱学 的数据对物质结构的研究具有重要意义。
氢原子谱线的波长可以用下列经验公式表示:
~
R(
1 k2
1 n2
)
~ 1
k 1,2,3, n k 1, k 2, k 3,
波数
R 1.096776 107 m-1 里德伯常量
氢原子光谱和波尔的原子结构模型
3d54s2 3s23p4 5s25p5
我们知道了核外电子排布,那核外电子 是如何运动的呢?
模
型
原子中心有一个带正电荷的核,它的质量几 乎等于原子的全部质量,电子在它的周围沿着不同 的轨道运转,就象行星环绕太阳运转一样。
卢瑟福的原子结构理论遇到的问题
根据已经知道的电磁运动的规律,电子在运动的时候会放出电 磁波(能量)。因此,绕着原子核旋转的电子,因为能量逐渐减小 ,应当沿着一条螺旋形的轨道转动,离中心的原子核越来越近,最 后碰在原子核上。这样一来,原子就被破坏了。
100年后:汤姆逊用发现了电子,并且在各种元素的 原子中都有电子。这样看来,原子就不是不可再分的 了!也就是说,原子不是最最基本的物质粒子了!
1903
汤 姆 逊( 原 子年 模) 型
原子是一个平均分布着正电荷的粒子,其中镶嵌 着许多电子,中和了正电荷,从而形成了中性原子。
1911
卢
瑟
福(
原
子
年 )
3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不 同的轨道,且自旋状态相同
练习:写出:碳、硫、钛(22Ti)的轨道表示式
练习:请写出下列元素原子的电子排布图。
钪21Sc, 铬24Cr, 铁26Fe, 铜29Cu, 砷33As
洪特规则的特例:
对于能量相同的轨道(同一电子亚层),当电子排布处 于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全 空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。
【现学现用】焰火、霓虹灯探密
用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放 时,焰火发出五颜六色的光,请用原子结构的知识解释 发光的原因: __燃__烧__时__,__电__子__获__得__能__量__,__从__能__量__较__低__的__轨__道__向__能__量__较__ _高__的__轨__道__跃__迁__,__跃__迁__到__能__量__较__高__的__轨__道__的__电__子__处__于__一___ _种__不__稳__定__的__状__态__,__它__随__即__就__会__跃__达__到__能__量__较__低__的__轨__道___ _,__并__向__外__界__以__光__能__的__形__式__释__放__能__量_。
我们知道了核外电子排布,那核外电子 是如何运动的呢?
模
型
原子中心有一个带正电荷的核,它的质量几 乎等于原子的全部质量,电子在它的周围沿着不同 的轨道运转,就象行星环绕太阳运转一样。
卢瑟福的原子结构理论遇到的问题
根据已经知道的电磁运动的规律,电子在运动的时候会放出电 磁波(能量)。因此,绕着原子核旋转的电子,因为能量逐渐减小 ,应当沿着一条螺旋形的轨道转动,离中心的原子核越来越近,最 后碰在原子核上。这样一来,原子就被破坏了。
100年后:汤姆逊用发现了电子,并且在各种元素的 原子中都有电子。这样看来,原子就不是不可再分的 了!也就是说,原子不是最最基本的物质粒子了!
1903
汤 姆 逊( 原 子年 模) 型
原子是一个平均分布着正电荷的粒子,其中镶嵌 着许多电子,中和了正电荷,从而形成了中性原子。
1911
卢
瑟
福(
原
子
年 )
3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不 同的轨道,且自旋状态相同
练习:写出:碳、硫、钛(22Ti)的轨道表示式
练习:请写出下列元素原子的电子排布图。
钪21Sc, 铬24Cr, 铁26Fe, 铜29Cu, 砷33As
洪特规则的特例:
对于能量相同的轨道(同一电子亚层),当电子排布处 于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全 空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。
【现学现用】焰火、霓虹灯探密
用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放 时,焰火发出五颜六色的光,请用原子结构的知识解释 发光的原因: __燃__烧__时__,__电__子__获__得__能__量__,__从__能__量__较__低__的__轨__道__向__能__量__较__ _高__的__轨__道__跃__迁__,__跃__迁__到__能__量__较__高__的__轨__道__的__电__子__处__于__一___ _种__不__稳__定__的__状__态__,__它__随__即__就__会__跃__达__到__能__量__较__低__的__轨__道___ _,__并__向__外__界__以__光__能__的__形__式__释__放__能__量_。
氢原子光谱和玻尔的原子结构模型

互补性原理还指出电子在原子中的运动状态是不可观测的因为观测会干扰电子的运动状态。
Hale Waihona Puke 内容:无法同时精确测量粒子的位置和动量 提出者:海森堡 意义:否定了经典物理学的确定性和因果关系 对玻尔原子结构模型的影响:解释了原子光谱的离散性
光的波粒二象性:光既具有波动特性又具有粒子特性 德布罗意波长公式:λ=h/p其中λ是波长h是普朗克常数p是动量 光的粒子性:光子是光的基本单位具有能量和动量 光的波动性:光在空间中传播形成电磁波具有频率和波长
受普朗克、爱因斯坦等物理学家的量子理论启发玻尔提出了自己的原子结构模型。
PRT FIVE
对应原理是玻尔原子结构模型的理论基础它认为电子只能在特定的轨道上运动每个轨道对应 一定的能量。 玻尔引入了量子化的概念认为电子只能存在于具有确定能量的稳定状态中这些状态称为定态。
对应原理还指出当电子从一个定态跃迁到另一个定态时会释放或吸收一定频率的光子。
,
汇报人:
CONTENTS
PRT ONE
PRT TWO
发现者:罗伯特·米立根 时间:19世纪末 实验装置:真空管和棱镜 意义:揭示了氢原子光谱的存在和特征
稳定性:氢原子光谱具有高度的稳定性是研究原子结构的重要手段。 连续性:氢原子光谱线覆盖了从长波到短波的连续范围为研究原子能级提供了重要信息。
PRT SIX
1913年玻尔提出了原子结 构模型
模型基于经典力学和量子 化假设
模型成功解释了氢原子光 谱线
模型为后续原子结构研究 奠定了基础
提出假设:玻尔在1913年提出了氢原子光谱的假设奠定了玻尔原子结构模型的基础。
解释实验现象:玻尔的原子结构模型能够解释氢原子光谱的实验现象如巴尔末公式和里德伯公式等。
Hale Waihona Puke 内容:无法同时精确测量粒子的位置和动量 提出者:海森堡 意义:否定了经典物理学的确定性和因果关系 对玻尔原子结构模型的影响:解释了原子光谱的离散性
光的波粒二象性:光既具有波动特性又具有粒子特性 德布罗意波长公式:λ=h/p其中λ是波长h是普朗克常数p是动量 光的粒子性:光子是光的基本单位具有能量和动量 光的波动性:光在空间中传播形成电磁波具有频率和波长
受普朗克、爱因斯坦等物理学家的量子理论启发玻尔提出了自己的原子结构模型。
PRT FIVE
对应原理是玻尔原子结构模型的理论基础它认为电子只能在特定的轨道上运动每个轨道对应 一定的能量。 玻尔引入了量子化的概念认为电子只能存在于具有确定能量的稳定状态中这些状态称为定态。
对应原理还指出当电子从一个定态跃迁到另一个定态时会释放或吸收一定频率的光子。
,
汇报人:
CONTENTS
PRT ONE
PRT TWO
发现者:罗伯特·米立根 时间:19世纪末 实验装置:真空管和棱镜 意义:揭示了氢原子光谱的存在和特征
稳定性:氢原子光谱具有高度的稳定性是研究原子结构的重要手段。 连续性:氢原子光谱线覆盖了从长波到短波的连续范围为研究原子能级提供了重要信息。
PRT SIX
1913年玻尔提出了原子结 构模型
模型基于经典力学和量子 化假设
模型成功解释了氢原子光 谱线
模型为后续原子结构研究 奠定了基础
提出假设:玻尔在1913年提出了氢原子光谱的假设奠定了玻尔原子结构模型的基础。
解释实验现象:玻尔的原子结构模型能够解释氢原子光谱的实验现象如巴尔末公式和里德伯公式等。
玻尔的氢原子理论

玻尔的氢原子理论
为此,J.汤姆孙在1904年提出了原子结构的枣糕式模型.该模型认 为,原子可以看作一个球体,原子的正电荷和质量均匀分布在球内, 电子则一颗一颗地镶嵌其中.1909年,J.汤姆孙的学生卢瑟福为了验证 原子结构的枣糕式模型,完成了著名的α粒子散射实验.实验发现α粒 子在轰击金箔时,绝大多数α粒子都穿透金箔,方向也几乎不变,但 是大约有1/8 000的α粒子会发生大角度偏转,即被反弹回来.这样的 实验结果是枣糕式模型根本无法解释的,因为如果说金箔中的金原子 都是枣糕式的结构,那么整个金箔上各点的性质应该近乎均匀,α粒 子轰击上去,要么全部透射过去,要么全部反弹回来,而不可能是一 些穿透过去,一些反弹回来.
玻尔的氢原子理论
二、 原子结构模型
1897年,J.汤姆孙发现了电子.在此之前,原 子被认为是物质结构的最小单元,是不可分的,可 是电子的发现却表明原子中包含带负电的电子.那 么,原子中必然还有带正电的部分,这就说明原子 是可分的,是有内部结构的.执着的科学家就会继 续追问:原子的内部结构是什么样的?简洁的里德 伯光谱公式是不是氢原子内部结构的外在表现?
玻尔的氢原子理论
三、 玻尔的三点基本假设
为了解决原子结构有核模型的稳定性和氢原子光谱的分 立性问题,玻尔提出以下三个假设:
(1)定态假设.原子中的电子绕着原子核做圆周运动, 但是只能沿着一系列特定的轨道运动,而不能够任意转动, 当电子在这些轨道运动时,不向外辐射电磁波,原子系统处 于稳定状态,具有一定的能量.不同的轨道,具有不同的能 量,按照从小到大的顺序记为E1、E2、E3等.
玻尔的氢原子理论
可是这个模型却遭到很多物理学家的质疑.因为按照当时的物 理理论(包括经典力学、经典电磁理论及热力学统计物理),这 样一个模型是根本不可能的,原因有以下两个:
17-3玻尔的氢原子模型

矛盾:经典理论不能解释电子绕核运动的原子的稳定性
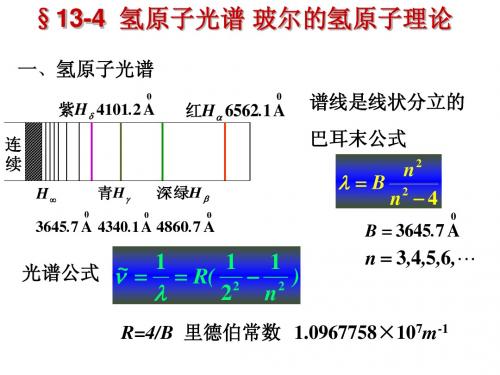
1、氢原子光谱规律
1 1 RH ( 2 2 ) m n 1
H H H
H
原子光谱是分立的线状谱
实验取,里德堡常数 RH =1.0967758×107 m-1 当 m = 2,取 n = 3,4,5,6,…,对应巴尔末线系 1908,红外区,发现帕邢线系,对应 m =3,取 n =4,5,6,…
•
爱因斯坦与玻尔围绕关于量子力学理论基础 的解释问题,开展了长期而剧烈的争论,但他们 始终是一对相互尊敬的好朋友。玻尔高度评价这 种争论,认为它是自己“许多新思想产生的源 泉”,而爱因斯坦则高度称赞玻尔: • “作为一位科学思想家,玻尔所以有这么惊人的 吸引力,在于他具有大胆和谨慎这两种品质的难 得融合;很少有谁对隐秘的事物具有这一种直觉 的理解力,同时又兼有这样强有力的批判能力。 他不但具有关于细节的全部知识,而且还始终坚 定地注视着基本原理。他无疑是我们时代科学领 域中最伟大的发现者之一。”
N. 玻尔,18851962,丹麦物理 学家,哥本哈根学 派领袖。对应原理, 互补原理。获 1922年诺贝尔物 理学奖. 玻尔对量子理论最大的贡献是:提出了定态和 能级这两个概念。玻尔理论是从经典物理通向 量子物理的桥梁。
17. 3 玻尔的氢原子模型
历史背景 经典物理 原子光谱规律 如何协调和发展? 量子论 原子结构行星模型
• 曾经有人问玻尔:“你是怎么把那么多有 才华的青年人团结在身边的?”,他回答 说:“因为我不怕在年青人面前承认自己 知识的不足,不怕承认自己是傻瓜。”实 际上,人们对原子物理的理解,即对所谓 原子系统量子理论的理解,始于本世纪初, 完成于20年代,然而“从开始到结束,玻 尔那种充满着高度创造性,锐敏和带有批 判性的精神,始终指引着他的事业的方向, 使之深入,直到最后完成。”
玻尔的氢原子理论
~ T( k ) T( n ) T( k )
R R ,T ( n ) 2 称为光谱项 2 k n
从氢原子光谱规律可以看出:
1、光谱是线状的,谱线对应一定的位置,不因观 察方式不同而改变顺序;
2、谱线间有一定的关系,各系可用一个公式表示, 不同线系有共同的光谱项; 3、每一谱线的可以用两光谱项之差表示;
2、频率假设
原子从一较大能量En的定态向另一较低能量Ek的定 态跃迁时,辐射一个光子
h En Ek
跃迁频率条件
原子从较低能量Ek的定态向较大能量En的定态 跃迁时,吸收一个光子 3、轨道角动量量子化假设
h Ln 2
轨道量子化条件
n为正整数,称为量子数
基本假设应用于氢原子:
(1)轨道半径量子化
由图可知,可见光的谱线为 n=4和n=3跃迁到n=2的两条
1 1 ~ 42 R( 2 2 ) 2 4 1 1 1.097 107 ( ) 4 16 0.21 107 m 1
n4 n3 n2 n1
42
o 1 ~ 4861 A 42
1 1 ~ 32 R( 2 2 ) 2 3
2 h rn n 2 ( 0 2 ) me
1 me4 En 2 ( 2 2 ) n 8 0 h
基态能级
(n 1, 2,3, )
E1 13.58 eV
激发态能级 En E1 13.58 eV n2 n2 氢原子的电离能
E电离 E E1 13.58 eV
二、玻尔氢原子理论 原子的核式结构的缺陷:
无法解释原子的稳定性 无法解释原子光谱的不连续性 玻尔原子理论的三个基本假设: 1、定态假设
原子系统存在一系列不连续的能量状态,处于这些状态
氢原子的玻尔理论

物理学
第五版
15-4 氢原子的玻尔理论
1)斯特藩—玻尔兹曼定律
M (T )
0
M
(T
)d
T
4
2)维恩位移定律 mT b
3) 普朗克假设 nh (n 1,2,3, )
4) 普朗克黑体辐射公式
M
(T )d
2π h c2
3d
eh / kT 1
第十五章 量子物理
0h2
π me 2
n2
r1n2
(n 1,2,3, )
n 1 , 玻尔半径 r1
0h2
π me 2
5.29 10 11 m
第n 轨道电子总能量
En
1 2
mvn2
e2
4π 0rn
第十五章 量子物理
10
物理学
第五版
15-4 氢原子2
假设三 当原子从高能量
要发射频率为 的光 子.
Ei
的定态跃迁到低能量的定态E
f
时,
频率条件 h Ei E f
第十五章 量子物理
9
物理学
第五版
15-4 氢原子的玻尔理论
氢原子能级公式
由牛顿定律
e2
4π 0rn2
m vn2 rn
由假设 2 量子化条件 mvnrn
n
h 2π
+r
n
rn
1
物理学
第五版
15-4 氢原子的玻尔理论
4) 光电效应
爱因斯坦方程 h 1 mv2 W
2
5) 光的波粒二象性
描述光的 粒子性
E h
p h
第五版
15-4 氢原子的玻尔理论
1)斯特藩—玻尔兹曼定律
M (T )
0
M
(T
)d
T
4
2)维恩位移定律 mT b
3) 普朗克假设 nh (n 1,2,3, )
4) 普朗克黑体辐射公式
M
(T )d
2π h c2
3d
eh / kT 1
第十五章 量子物理
0h2
π me 2
n2
r1n2
(n 1,2,3, )
n 1 , 玻尔半径 r1
0h2
π me 2
5.29 10 11 m
第n 轨道电子总能量
En
1 2
mvn2
e2
4π 0rn
第十五章 量子物理
10
物理学
第五版
15-4 氢原子2
假设三 当原子从高能量
要发射频率为 的光 子.
Ei
的定态跃迁到低能量的定态E
f
时,
频率条件 h Ei E f
第十五章 量子物理
9
物理学
第五版
15-4 氢原子的玻尔理论
氢原子能级公式
由牛顿定律
e2
4π 0rn2
m vn2 rn
由假设 2 量子化条件 mvnrn
n
h 2π
+r
n
rn
1
物理学
第五版
15-4 氢原子的玻尔理论
4) 光电效应
爱因斯坦方程 h 1 mv2 W
2
5) 光的波粒二象性
描述光的 粒子性
E h
p h
