滴定管的使用与校正 实验报告

滴定管的使用与校正实验报告
四川农业大学理学院郑蓉周静*
摘要:滴定管是滴定时用来准确测量流出的操作溶液体积的量器。一般分为两种:一种是具塞滴定管,常称酸式滴定管;另一种是无塞滴定管,常称碱式滴定管。酸式滴定管用来装酸性及氧化性溶液,不用于盛装碱性溶液。对于滴定管一类具有较高精密度的玻璃仪器,由于玻璃本身具有热胀冷缩的性质和其他一些因素,实际容积与标出数并非完全相符。因此,校准是一项对于提高准确度的必要操作。
关键词:酸式滴定管碱式滴定管使用校正
The use of burettes and calibration
Zheng Rong; Zhou Jing*
Abstract: Burettes are used to measure the outflows truly at the time of titration, generally divided into two kinds. One is with plug often called acid burette, the other is without plug often called base buret. Acid is used for acidic and oxidizing solution but not for alkaline solution. For glassware with high precision as a buret, the actual volume is not completely consistent with the standard volume due to the glass has the nature of expansion and contraction. Therefore, calibration is a necessary operation to improve the accuracy.
Key words: acid burette base buret use calibretion
仪器与试剂:50ml酸式滴定管50ml碱式滴定管滴定管架烧杯50ml磨口锥形瓶分析天平温度计蒸馏水
滴定管的使用:
1.检漏。使用前,应检查酸式滴定管旋塞是否灵活,是否漏水;后用自来水装满滴定管,将其固定在滴定管架上静置1~2min,观察是否有水滴滴下,如有漏液情况,需要重涂凡士林。(碱式滴定管乳胶管和玻璃珠是否完好。若乳胶管已老化,玻璃珠过大或过小,应予以更换)
2.洗涤。根据滴定管玷污的程度,可采用以下多种方法洗涤。注意用各种洗涤剂洗涤后,必须用自来水充分洗净,并将滴定管外壁擦干,以便观察其内壁是否挂水珠。
A.用自来水冲洗。
B.用滴定管刷蘸合成洗涤剂刷洗,但铁丝部分不得碰到管壁。
C.用前法不能洗净时,可用铬酸洗液洗。加入5~6ml洗液,边转动边将滴定管放平,并将滴定管口对着洗液瓶口,以防洗液流出。洗净后将一部分洗液从管口放回原瓶,最后打开旋塞,将剩余的洗液从出口管放回原瓶,必要时可加满洗液进行浸泡。如内壁留有残存的二氧化锰时,可选用亚铁盐溶液或过氧化氢加酸溶液进行清洗。被油等玷污的滴定管可采用适合的有机溶剂清洗。
3.待装溶液润洗。用待装溶液将滴定管润洗2~3次(第一次10ml,大部分润
洗后溶液由上口倒出;第二,三次各5ml,润洗后溶液可由管尖放出)。
注意,一定要使待装溶液将全部内壁润洗干净,并使溶液接触管壁1~2min。
4.装溶液和赶气泡。将待装溶液直接装入滴定管(注意为了保持溶液浓度不变,不能使用其他容器转移待接溶液),将滴定管倾斜30°,迅速旋转旋塞,放出溶液,以赶走气泡。
实验步骤:
1.将洁净的50ml滴定管垂直稳妥地至于滴定管架上,加纯净水至零刻度线上5mm处,擦去滴定管外表面的水。缓慢调节弯月面至零刻度,排出尖嘴部分的气泡,擦去尖嘴外的水滴。
2.取外表干燥的50ml磨口锥形瓶,进行空称量平衡。
3.让纯水以小于10ml/min的流速从滴定管尖嘴流出,当液面降至被检刻度线5mm处时,等待30s,然后在10s内将液面调至被检刻度线,随即用磨口锥形瓶移去尖嘴处的最后一滴水。注意整个过程中,滴定管尖嘴不应接触磨口锥形瓶。
4.在调整液面的同时,应观察水温,读数准确至0.1℃。
5.再次称量,得到放出水的质量。
6.根据放出水的质量和水在该温度下的相对密度,计算被检滴定管在标准温度20℃时的实际容量,并进行误差计算。
7.一般检定次数至少2次,2次检定数据的差值应小于0.02ml,并取2次的平均值。
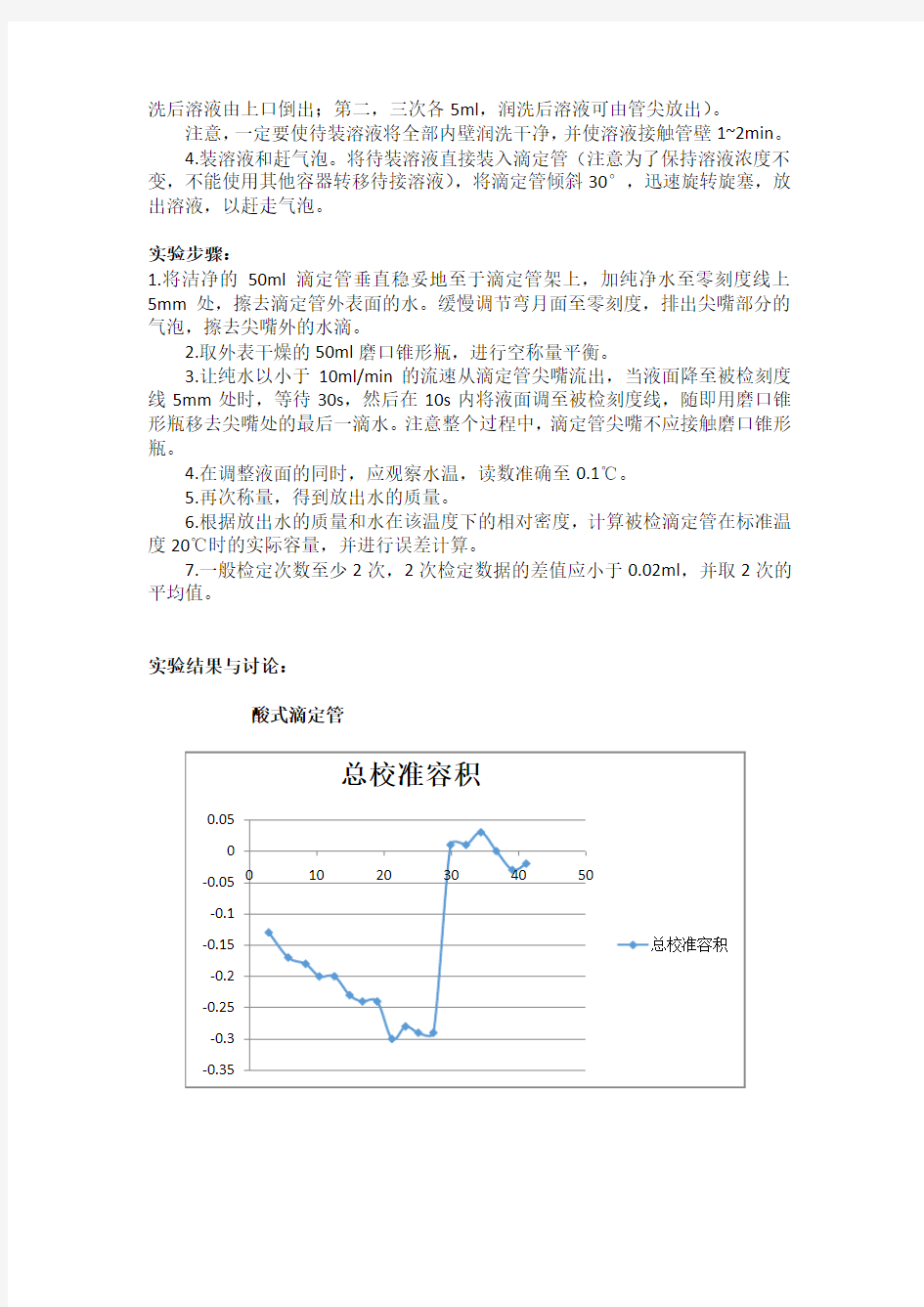
实验结果与讨论:
酸式滴定管
碱式滴定管
由实验数据和图可知,酸式滴定管在30~40ml范围内的误差不大。在滴定要求不高时可正常使用。碱式滴定管在0~10ml范围内的误差不大。在滴定要求较低时可正常使用。
感谢四川农业大学吴明君老师的指导和四川农业大学11教分析实验室所提供的试剂与仪器
【1】四川大学化学工程学院,浙江大学化学系编《分析化学实验》
高等教育出版社
【2】武汉大学主编《分析化学》
高等教育出版社
滴定管使用方法
一、关于滴定管 1.酸式滴定管涂油的方法是什么? 答:?将活塞取下,用干净的纸或布把活塞和塞套内壁擦干,用手指蘸少量凡士林在活塞的两头涂上薄薄一圈,在紧靠活塞孔两旁不要涂凡士林,以免堵住活塞孔,涂完,把活塞放回套内,向同一方向旋转活塞几次,使凡士林分布均匀呈透明状态,然后用橡皮圈套住,将活塞固定在塞套内,防止滑出. 2.酸式滴定管如何试漏? 答:关闭活塞,装入蒸馏水至一定刻线,直立滴定管约2min,仔细观察刻线上的液面是否下降,滴定管下端有无水滴滴下,及活塞隙缝中有无水渗出,?然后将活塞转动180°等待2min再观察,如有漏水现象应重新擦干涂油 3.碱式滴定管如何试漏? 答:?装蒸馏水至一定刻线,直立滴定管约2min,仔细观察刻线上的液面是否下降,或滴定管下端尖嘴上有无水滴滴下,如有漏水,则应调换胶管中玻璃珠,选择一个大小合适比较圆滑的配上再试,玻璃珠太小或不圆滑都可能漏水,太大操作不方便. 4.酸式滴定管如何装溶液? 答:装之前应将瓶中标准溶液摇匀,使凝结在瓶内壁的水混入溶液,?为了除去滴定管内残留的水分,确保标准溶液浓度不变,应先用此标准溶液淋洗滴定管2--3次,每次用约10mL,从下口放出少量(约1/3)?以洗涤尖嘴部分,应关闭活塞横持滴定管并慢慢转动,使溶液与管内壁处处接触,最后将溶液从管口倒出弃去,但不要打开活塞,?以防活塞上的油脂冲入管内.尽量倒空后再洗第二次,每次都要冲洗尖嘴部分,?如此洗2--3次后,即可装入标准溶液至"0"刻线以上. 5.碱式滴定管如何赶气泡? 答:碱式滴定管应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,以排除气泡.碱式滴定管的气泡一般是藏在玻璃珠附近, 必须对光检查胶管内气泡是否完全赶尽,???赶尽后再调节液面至 0.00mL处,或记下初读数. 6.滴定管使用注意事项? 答:?(1)用毕滴定管后,倒去管内剩余溶液,用水洗净,装入蒸馏水至刻度以上,?用大试管套在管口上,这样,下次使用前可不必再用洗液清洗.(2)酸式滴定管长
滴定管的使用和校正练习
滴定管的使用和校正练习 应用化学2009级刘延 指导老师吴明君 摘要:本文介绍了滴定管的常用校正方法,说明了玻璃仪器在使用过程中产生误差的原因。并对50mL的酸式和碱式滴定管进行校正,得出了两只滴定管的校正曲线。 关键词:校正,酸式滴定管,碱式滴定管,误差 The Burette’s corrective and exercise LIU Yan Apply Chemistry,Grade 2009 Directed by WU Ming-jun Abstract:This essay introduced burettes the commonly corrective method,showed the glassware has error's reason and in the use process acidicand the basic burets correcte bereette to 50mL carries on the adjustment,And Has obtained the calibration curve which two buret. 综述: 容量器皿的容积与其所标出的体积并非完全相符。因此,在准确要求较高的分析的工作中,必须对容量器皿进行校准。由于玻璃仪器具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同,所以在校准容量器皿时必须在一个共同的温度下进行。 容量器皿常用两种校准方法:相对校准和绝对校准。 相对校准时要求对两种容器之间的容积有一定的比例关系时常采用的方法;绝对校准是测定容量器皿的实际容积,常用称量法。 1 实验部分 1.1仪器和试剂: 50mL滴定管,酸式、碱式各一支;锥形瓶(50mL,具有玻璃磨口)一只;温度计一支;蒸馏水;分析天平,凡士林。 1.2试验方法: 1.2.1 酸式滴定管的校正首先把滴定管洗净,检查是否漏液,如果漏液则把滴定管的活塞取出,用吸水纸把活塞和插活塞的孔的水吸干,再在活塞上均匀的涂抹上少量凡士林,切记活塞上有孔的几个面不能涂抹,否则会将孔堵住。当活塞旋转灵活无噪音即可。不再漏液后装入蒸馏水,再排气,并使液面位于零刻度线处。记录实验温度,把锥形瓶洗干净,并把瓶外壁的水分擦干,用分析天平称量后记下空瓶的质量(保留3为小数)。依次将滴定管内的水放进锥形瓶,用分析天平称量其质量,精确到小数点后三位并记录。分别将几次的数据记录并分析。将上述实验重复做3次,并取平均值。 1.2.2碱式滴定管的校正先洗净滴定管,检查是否漏液,如果漏液,更换乳胶管和其中的玻璃球。。其余操作与酸式滴定管相同。 2 结果与讨论: 2.1酸式滴定管的校正将三次的数据归纳统计记入下表,用滴定管的读数减去上一次的滴定管的读数,算出读出总体积。用分析天平的读数减去上一次的读数,得到总水的体积。实验温度为17.2°C,查表得此温度下水的密度为0.9976g.cm-1[1]。利用V=m/ρ算出水的实际体积。再用实际容量值减去读出总容积,得到总校准值。如表1‐1,表1‐2,表1‐3。 表1‐1式滴定管第一次校正数据 初读数/mL 读出体 积/mL 瓶+水质 量g 实际水 质量g 实际体 积/mL 校正值总校正值 0.00 0.00 53.286 8.00 8.00 61.193 7.91 7.93 -0.07 -0.07
滴定管的使用方法
滴定管是滴定操作时准确测量标准溶液体积的一种量器。滴定管的管壁上有刻度线和数值,最小刻度为0.1毫升,“0”刻度在上,自上而下数值由小到大。滴定管分酸式滴定管和碱式滴定管两种。酸式滴定管下端有玻璃旋塞,用以控制溶液的流出。酸式滴定管只能用来盛装酸性溶液或氧化性溶液,不能盛碱性溶液,因碱与玻璃作用会使磨口旋塞粘连而不能转动,碱式滴定管下端连有一段橡皮管,管内有玻璃珠,用以控制液体的流出,橡皮管下端连一尖嘴玻璃管。凡能与橡皮起作用的溶液如AgNO3、KMnO4、I2溶液,均不能使用碱式滴定管。 一、酸式滴定管的使用方法 (1) 洗涤。通常滴定管可用自来水或管刷蘸洗涤剂(不能用去污粉)洗刷,而后用自来水冲洗干净,去离子水润洗3次。有油污的滴定管要用铬酸洗液洗涤。 (2) 给旋塞涂凡士林(起密封和润滑的作用)。将管中的水倒掉,平放在台上,把旋塞取出,用滤纸将旋塞和塞槽内的水吸干。用手指蘸少许凡士林,在旋塞芯两头薄薄地涂上一层(导管处不涂凡士林),然后把旋塞插入塞槽内,旋转几次,使油膜在旋塞内均匀透明,且旋塞转动灵活。 (3) 试漏。将旋塞关闭,滴定管里注满水,把它固定在滴定管架上,放置10分钟,观察滴定管口及旋塞两端是否有水渗出,旋塞不渗水才可使用。 (4) 滴定管内装入标准溶液后要检查尖嘴内是否有气泡。如有气泡,将影响溶液体积的准确测量。排除气泡的方法是:用右手拿住滴定管无刻度部分使其倾斜约30°角,左手迅速打开旋塞,使溶液快速冲出,将气泡带走。 (5) 装标准溶液。应先用标准液(5-6ml)润洗滴定管3次,洗去管内壁的水膜,以确保标准溶液浓度不变。方法是两手平端滴定管同时慢慢转动使标准溶液接触整个内壁,并使溶液从滴定管下端流出。装液时要将标准溶液摇匀,然后不借助任何器皿直接注入滴定管内。(6) 进行滴定操作时,应将滴定管夹在滴定管架上。左手控制旋塞,大拇指在管前,食指和中指在后,三指轻拿旋塞柄,手指略微弯曲,向内扣住旋塞,避免产生使旋塞拉出的力。向里旋转旋塞使溶液滴出。滴定管应插入锥形瓶口1-2cm,右手持瓶,使瓶内溶液顺时针不断旋转。掌握好滴定速度(连续滴加,逐滴滴加,半滴滴加),终点前用洗瓶冲洗瓶壁,再继续滴定至终点。 (7) 滴定管使用完后,应洗净打开旋塞倒置于滴定管架上。 二、碱式滴定管的使用方法 (1) 试漏。给碱式滴定管装满水后夹在滴定管架上静置5分钟。若有漏水应更换橡皮管或管内玻璃珠,直至不漏水且能灵活控制液滴为止。 (2) 滴定管内装入标准溶液后,要将尖嘴内的气泡排出。方法是:把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴快速喷出,气泡即可随之排掉。 (3) 进行滴定操作时,用左手的拇指和食指捏住玻璃珠中部靠上部位的橡皮管外侧,向手心方向捏挤橡皮管,使其与玻璃珠之间形成一条缝隙,溶液即可流出。 其他操作同酸式滴定管。三、使用滴定管时还应注意以下几点: (1) 滴定管使用前和用完后都应进行洗涤。洗前要将酸式滴定管旋塞关闭。管中注入水后,一手拿住滴定管上端无刻度的地方,一手拿住旋塞或橡皮管上方无刻度的地方,边转动滴定管边向管口倾斜,使水浸湿全管。然后直立滴定管,打开旋塞或捏挤橡皮管使水从尖嘴口流出。滴定管洗干净的标准是玻璃管内壁不挂水珠。 (2) 滴定管必须固定在滴定管架上使用。读取滴定管的读数时,要使滴定管垂直,视线应与弯月面下沿最低点在一水平面上,要在装液或放液后1-2分钟进行。有色溶液应使眼睛的视线与滴定管内溶液面两侧的最高点呈水平处。第一次读数时必须先调整液面在0.00刻度
化学实验报告 实验__盐酸标准溶液的配制与标定1
实验报告 姓名:班级:同组人:自评成绩: 项目:盐酸标准溶液的配制与标定课程:学号: 一、实验目的 1. 掌握减量称量法称取基准物质的方法,巩固称量操作。 2. 掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法。 3. 正确判断甲基红-溴甲酚绿混合指示剂的滴定终点。 二、实验原理 由于浓盐酸易挥发放出HCl气体,直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。标定盐酸的基准物质常用无水碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,终点颜色由绿色变为暗紫色。 用Na2CO3标定时反应为: 2HCl + Na2CO3 ══2NaCl+H2O + CO2↑ 注意事项: 由于反应产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,在接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。 三、仪器和药品 仪器:分析天平,称量瓶,酸式滴定管(50mL),锥形瓶(250mL),量筒(50mL),吸量管(2mL),试剂瓶(250mL),烧杯(250mL),电炉子,石棉网。 试剂:盐酸(A.R),无水碳酸钠(基准物质),甲基红-溴甲酚绿混合指示剂。 四、内容及步骤 1. 盐酸溶液(0.1mol/L)的配制 用移液管移取盐酸1.8mL,加水稀释至200mL,混匀,倒入细口瓶中,密塞,备用。 2. 盐酸溶液(0.1mol/L)的标定 用减量称量法称取在270~300℃灼烧至恒重的基准无水碳酸钠三份,每份重 0.15~0.22g,称至小数点后四位,分别置于三个已编号的250mL锥形瓶中,以50mL蒸馏水溶解,加甲基红-溴甲酚绿混合指示剂10滴,用0.1mol/L盐酸溶液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温后继续滴定至溶液呈暗紫色为终点,记下消耗HCl标准溶液的体积。平行测定3次,以上平行测定3次的算术平均值为测定结果。 五、实验结果记录与计算 1. 数据记录
滴定管的使用
滴定管的使用 方法 一、滴定管的构造及其准确度 (1)构造滴定管是容量分析中最基本的测量仪器,它是由具有准确刻度的细长玻璃管及开关组成。滴定管是容量分析中最基本的测量仪器,是在滴定时用来测定自管内流出溶液的体积。 (2)准确度常量分析用的滴定管为50ml或25ml,刻度小至0.1ml,读数可估计到 0.01ml,一般有±0.02ml的读数误差,所以每次滴定所用溶液体积最好在20ml以上,若滴定所用体积过小,则滴定管刻度读数误差影响增大。 二、滴定管的种类 (1)酸式滴定管(xx滴定管) 酸式滴定管的玻璃活塞是固定配合该滴定管的,所以不能任意更换。要注意玻塞是否旋转自如,通常是取出活塞,拭干,在活塞两端沿圆周抹一薄层凡士林作润滑剂,然后将活塞插入,顶紧,旋转几下使凡士林分布均匀(几乎透明)即可,再在活塞尾端套一橡皮圈,使之固定。注意凡士林不要涂得太多,否则易使活塞中的小孔或滴定管下端管尖堵塞。在使用前应试漏。 一般的标准溶液均可用酸式滴定管,但因碱性滴定液常使玻塞与玻孔粘合,以至难以转动,故碱性滴定液宜用碱式滴定管。但碱性滴定液只要使用时间不长,用毕后立即用水冲洗,亦可使用酸式滴定管。 (2)碱式滴定管 碱式滴定管的管端下部连有橡皮管,管内装一玻璃珠控制开关,一般用做碱性标准溶液的滴定。其准确度不如酸式滴定管,只要由于橡皮管的弹性会造成液面的变动。具有氧化性的溶液或其他易与橡皮起作用的溶液,如高锰酸钾、碘、硝酸银等不能使用碱式滴定管。在使用前,应检查橡皮管是否破裂或老化及玻璃珠大小是否合适,无渗漏后才可使用。
三、使用前的准备 1、在装滴定液前,须将滴定管洗净,使水自然沥干(内壁应不挂水珠),先用少量标准溶液荡洗三次,(每次约5~10ml),除去残留在管壁和下端管尖内的水,以防装入标准溶液被水稀释。 2、标准溶液装入滴定管应超过标线刻度零以上,这时滴定管尖端会有气泡,必须排除,否则将造成体积误差。如为酸式滴定管可转动活塞,使溶液的急流逐去气泡;如为碱式滴定管,则可将橡皮管弯曲向上,然后捏开玻珠,气泡即可被溶液排除。 3、最后,再调整溶液的液面至刻度零处,即可进行滴定。 四、操作注意事项 1、滴定管在装满标准溶液后,管外壁的溶液要擦干,以免流下或溶液挥发而使管内溶液降温(在夏季影响尤大)。手持滴定管时,也要避免手心紧握装有溶液部分的管壁,以免手温高于室温(尤其在冬季)而使溶液的体积膨胀,造成读数误差。 2、使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作。在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出。 3、每次滴定须从刻度零开始,以使每次测定结果能抵消滴定管的刻度误差。 4、在装满标准溶液后,滴定前“初读”零点,应静置1~2分钟再读一次,如液面读数无改变,仍为零,才能滴定。滴定时不应太快,每秒钟放出3~4滴为宜,更不应成液柱流下,尤其在接近计量点时,更应一滴逐滴加入(在计量点前可适当加快些滴定)。滴定至终点后,须等1~2分钟,使附着在内壁的标准溶液流下来以后再读数,如果放出滴定液速度相当慢时,等半分钟后读数亦可,“终读”也至少读两次。
滴定分析基本操作实验报告
酸碱中和滴定实验报告 时间: 组别:第组指导教师:组长:组员: 一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测溶液)浓度【本实验氢氧化钠为待测溶液】 二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】 三、实验仪器和药品 酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、0.1000mol/L盐酸(标准液)、未知浓度的NaOH溶液(待测液)、酚酞(变色范围8~10)、甲基橙(3.1~4.4) 四、实验步骤 (一)滴定前的准备阶段 1、检漏:检查滴定管是否漏水 2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次 3、量取:用碱式滴定管量出一定体积的未知浓度的NaOH溶液,注入锥形瓶中,并往 锥形瓶中滴加几滴酚酞,现象为。用酸式滴定管量取标准液盐酸,使液面恰好在01 (二)滴定阶段 1、把锥形瓶放在酸式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴盐酸后溶液变为无色且半分钟内不恢复原色。此时,氢氧化钠恰好完全被盐酸中和,达到滴定终点。记录滴定后液面刻度V2。 2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复2~3次。(三)数据处理 注意:取两次测定数值的平均值,计算待测液的物质的量浓度 (四)误差分析 1、来自滴定管产生的误差: ①滴定管用蒸馏水洗后,未用标准液润洗②滴定管未用待测液润洗 ③盛标准液的滴定管滴定前有气泡,滴定后无气泡 ④盛标准液的滴定管滴定前无气泡,滴定后有气泡 ⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡 2、来自锥形瓶中产生的误差 锥形瓶用蒸馏水洗后又用待测液润洗 3、读数带来的误差 如:标准液读数时①先俯视后仰视②先仰视后俯视
滴定管使用方法及注意事项
滴定管使用方法及注意 事项 标准化管理部编码-[99968T-6889628-J68568-1689N]
滴定管的使用方法 一、滴定管的构造及其准确度? (1)构造滴定管是容量分析中最基本的测量仪器,它是由具有准确刻度的细长玻璃管及开关组成。滴定管是容量分析中最基本的测量仪器,是在滴定时用来测定自管内流出溶液的体积。? (2)准确度常量分析用的滴定管为50ml或25ml,刻度小至0.1ml,读数可估计到 0.01ml,一般有±0.02ml的读数误差,所以每次滴定所用溶液体积最好在20ml以上,若滴定所用体积过小,则滴定管刻度读数误差影响增大。 二、滴定管的种类? (1)酸式滴定管(玻塞滴定管)? 酸式滴定管的玻璃活塞是固定配合该滴定管的,所以不能任意更换。要注意玻塞是否旋转自如,通常是取出活塞,拭干,在活塞两端沿圆周抹一薄层凡士林作润滑剂,然后将活塞插入,顶紧,旋转几下使凡士林分布均匀(几乎透明)即可,再在活塞尾端套一橡皮圈,使之固定。注意凡士林不要涂得太多,否则易使活塞中的小孔或滴定管下端管尖堵塞。在使用前应试漏。一般的标准溶液均可用酸式滴定管,但因碱性滴定液常使玻塞与玻孔粘合,以至难以转动,故碱性滴定液宜用碱式滴定管。但碱性滴定液只要使用时间不长,用毕后立即用水冲洗,亦可使用酸式滴定管。? (2)碱式滴定管? 碱式滴定管的管端下部连有橡皮管,管内装一玻璃珠控制开关,一般用做碱性标准溶液的滴定。其准确度不如酸式滴定管,只要由于橡皮管的弹性会造成液面的变动。具有氧化性的溶液或其他易与橡皮起作用的溶液,如高锰酸钾、碘、硝酸银等不能使用碱式滴定管。在使用前,应检查橡皮管是否破裂或老化及玻璃珠大小是否合适,无渗漏后才可使用。? 三、使用前的准备(以酸式滴定管为例) 1滴定管的洗涤 1.1无明显油污的滴定管,直接用自来水冲洗或用肥皂水或洗衣粉水泡洗,但不能用去污粉洗以免划伤内壁,影响体积的准确测量。 1.2有油污不易洗净时,用铬酸洗液洗涤。洗时应将管内的水尽量除去,关闭活塞,倒入10~15毫升洗液于滴定管中,两手端住滴定管,边转动边向管口倾斜,直至洗液布满全部管壁为止。立起后打开活塞,将洗液放回原瓶中。 1.3油污严重时,需用较多洗液充满滴定管浸泡十几分钟或更长时间,甚至用温热洗液浸泡一段时间。洗液放出后,先用自来水冲洗,再用蒸馏水淋洗3-4次,洗净的滴定管其内壁应完全被水均匀地润湿而不挂水珠。 2、滴定管的涂油 涂油的方法是:把滴定管平放在桌面上,将固定活塞的橡皮圈取下,再取出活塞,用干净的纸或布将活塞和塞套内壁擦干(如果活塞孔内有旧油垢塞堵,可用金属丝轻轻剔去,如果管尖被油脂堵塞可先用水充满全管,然后将管尖置热水中,使溶化,突然打开活塞,将其冲走)。用手指蘸少量凡士林(或真空脂)在活塞孔的两头沿圆周涂上薄薄一层,在紧靠活塞孔两旁不要涂凡士林,以免堵住活塞孔。涂完,把活塞放回塞套内,向同一方向转
滴定管的使用与校正 实验报告
滴定管的使用与校正实验报告 四川农业大学理学院郑蓉周静* 摘要:滴定管是滴定时用来准确测量流出的操作溶液体积的量器。一般分为两种:一种是具塞滴定管,常称酸式滴定管;另一种是无塞滴定管,常称碱式滴定管。酸式滴定管用来装酸性及氧化性溶液,不用于盛装碱性溶液。对于滴定管一类具有较高精密度的玻璃仪器,由于玻璃本身具有热胀冷缩的性质和其他一些因素,实际容积与标出数并非完全相符。因此,校准是一项对于提高准确度的必要操作。 关键词:酸式滴定管碱式滴定管使用校正 The use of burettes and calibration Zheng Rong; Zhou Jing* Abstract: Burettes are used to measure the outflows truly at the time of titration, generally divided into two kinds. One is with plug often called acid burette, the other is without plug often called base buret. Acid is used for acidic and oxidizing solution but not for alkaline solution. For glassware with high precision as a buret, the actual volume is not completely consistent with the standard volume due to the glass has the nature of expansion and contraction. Therefore, calibration is a necessary operation to improve the accuracy. Key words: acid burette base buret use calibretion 仪器与试剂:50ml酸式滴定管50ml碱式滴定管滴定管架烧杯50ml磨口锥形瓶分析天平温度计蒸馏水 滴定管的使用: 1.检漏。使用前,应检查酸式滴定管旋塞是否灵活,是否漏水;后用自来水装满滴定管,将其固定在滴定管架上静置1~2min,观察是否有水滴滴下,如有漏液情况,需要重涂凡士林。(碱式滴定管乳胶管和玻璃珠是否完好。若乳胶管已老化,玻璃珠过大或过小,应予以更换) 2.洗涤。根据滴定管玷污的程度,可采用以下多种方法洗涤。注意用各种洗涤剂洗涤后,必须用自来水充分洗净,并将滴定管外壁擦干,以便观察其内壁是否挂水珠。 A.用自来水冲洗。 B.用滴定管刷蘸合成洗涤剂刷洗,但铁丝部分不得碰到管壁。 C.用前法不能洗净时,可用铬酸洗液洗。加入5~6ml洗液,边转动边将滴定管放平,并将滴定管口对着洗液瓶口,以防洗液流出。洗净后将一部分洗液从管口放回原瓶,最后打开旋塞,将剩余的洗液从出口管放回原瓶,必要时可加满洗液进行浸泡。如内壁留有残存的二氧化锰时,可选用亚铁盐溶液或过氧化氢加酸溶液进行清洗。被油等玷污的滴定管可采用适合的有机溶剂清洗。 3.待装溶液润洗。用待装溶液将滴定管润洗2~3次(第一次10ml,大部分润
滴定管的使用要求
滴定管的使用要求 一、目的:建立滴定管使用的标准操作规程,保证正确使用。 二、适用范围:适用于滴定管的使用。 三、职责:质量检验员对本标准的实施负责。 四、正文: 1 滴定管的选择: 1.1 A 级滴定管的容量允差仅为 B 级的二分之一,在滴定分析要求较高时 应选用 A 级。 1.2 同等级滴定管规格越大,容量允差也越大,因而选用适当规格的滴定管,可减小量器的误差,提高量器的准确度。例如:50mlB级滴定管允差为±0.10ml,而10ml B级滴定管允差有±0.050ml。假如滴定时耗用 5ml 溶液,则使用 10ml 滴定管的相对误差为1%,而50ml的为2%,相差1倍。同时,还因为10ml滴定管的内径比50ml的要小得多,其读数误差相应也小,所以应选10ml滴定管。 1.3 应根据溶液性质来选用滴定管: 1.3.1 酸式滴定管不适于盛装碱性溶液,否则时间一长,玻璃活塞的磨口会 被腐蚀而粘住,以致不能转动,凡是与橡皮起反应的溶液,如酸、高锰酸钾、碘及硝酸银等 溶液,都不能装入碱式滴定管。 1.3.2见光易分解的溶液,如硝酸银、高锰酸钾等溶液,应选用棕色管。 1.4 使用滴定管应是经过检定合格的,具备检定合格证书,不合格的不能使 用。 1.5 水的流出时间超过允许范围的或流液口破损的滴定管不能使用。 2 滴定管的清洗:用自来水冲洗。用清洁液洗液浸泡,必要时可加满洗液 浸泡过夜。 用上述方法洗涤后,用自来水充分清洗,洗净的滴定管内壁应能被水均匀润湿,而无挂水珠现象。用水清洗碱式滴定管时,应特别注意清洗玻璃珠下方部位,不断改变捏动橡皮管的位置,以便玻璃珠四周都能洗到。用蒸馏水洗3次,应洗遍整个内壁,并做到每次冲洗时都打开活塞或捏动橡皮管冲洗流液口。 3 使用前检漏:活塞密合性检定合格的滴定管,使用时由于凡士林涂抹不当也会造成漏水;无塞滴定管的玻璃珠不圆整,或大小不合适,橡皮管老化等,都可能引起漏 3.1水。因此使用前应按下述方法进行检漏:将水充满滴定管至零位标线,
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对 氢氧化钠溶液的滴定 一.实验目的:1.培养同学们“通过实验手段用已知测未知”的实验思想。 2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤. 3.实现学习与实践相结合。 二.实验仪器及药品: 仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL 锥形瓶两个。 药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。 三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手 段,用已知测未知。即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。本实验用草酸(二水草酸)作基准物。 ⑴氢氧化钠溶液标定:H2C2O4+2NaOH=Na2C2O4+2H2O 反应达到终点时,溶液呈弱碱性,用酚酞作指示剂。(平行滴定两次) ⑵盐酸溶液标定:HCl+NaOH=NaCl+H2O 反应达到终点时,溶液呈弱酸性,用甲基橙作指示剂。(平行滴定两次) 四.实验内容及步骤: 1.仪器检漏:对酸(碱)滴定管进行检漏 2.仪器洗涤:按要求洗涤滴定管及锥形瓶,并对滴定管进行润洗 3.用移液管向两个锥形瓶中分别加入10.00mL草酸(二水草酸),再分别滴入两滴酚酞.向碱式滴定管中加入药品至零刻线以上,排尽气泡,调整液面至零刻线,记录读数。 4.用氢氧化钠溶液滴定草酸(二水草酸)溶液,沿同一个方向按圆周摇动锥形瓶,待溶液由无色变成粉红色,保持30秒不褪色,即可认为达到终点,记录读数。 5.用移液管分别向清洗过的两个锥形瓶中加入10.00 mL氢氧化钠溶液,再分别滴入两滴甲基橙。向酸式滴定管中加入盐酸溶液至零刻线以上2—3cm,排尽气泡,调整液面至零刻线,记录读数。 6.用盐酸溶液滴定氢氧化钠溶液,待锥形瓶中溶液由黄色变为橙色,并
滴定管的校准实验报告
滴定管的校准实验报告 摘要:本文介绍了滴定管的常用校正方法,说明了玻璃仪器在使用过程中产生误差的原因。并对50mL的酸式和碱式滴定管进行校正,得出了两只滴定管的校正曲线。 关键词:校正,酸式滴定管,碱式滴定管,误差。 综述:容量器皿的容积与其所标出的体积并非完全相符。因此,在准确要求较高的分析的工作中,必须对容量器皿进行校准。由于玻璃仪器具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同,所以在校准容量器皿时必须在一个共同的温度下进行。 容量器皿常用两种校准方法:相对校准和绝对校准。相对校准时要求对两种容器之间的容积有一定的比例关系时常采用的方法;绝对校准是测定容量器皿的实际容积,常用称量法。 实验部分: 1.仪器和试剂: 50mL滴定管,酸式、碱式各一支;锥形瓶(50mL,具有玻璃磨口)一只;温度计一支;蒸馏水;电子天平,凡士林。 2.试验方法:酸式滴定管的校正:首先把滴定管洗净,检查是否漏液,如果漏液则把滴定管的活塞取出,用吸水纸把活塞和插活塞的孔的水吸干,再在活塞上均匀的涂抹上少量凡士林,切记活塞上有孔的几个面不能涂抹,否则会将孔堵住。当活塞旋转灵活无噪音即可。不再漏液后装入蒸馏水,再排气,并使液面位于零刻度线处。记录实验温度,把锥形瓶洗干净,并把瓶外壁的水分擦干,用分析天平称量后记下空瓶的质量(保留3位小数)。依次将滴定管内的水放进锥形瓶,用分析天平称量其质量,精确到小数点后三位并记录。分别将几次的数据记录并分析。将上述实验重复做2次,并取平均值。 碱式滴定管的校正:先洗净滴定管,检查是否漏液,如果漏液,更换乳胶管和其中的玻璃球。。其余操作与酸式滴定管相同。 结果与讨论:酸式滴定管的校正,将二次的数据归纳统计记入下表,用滴定管的读数减去上一次的滴定管的读数,算出读出总体积。用分析天平的读数减去上一次的读数,得到总水的体积。实验温度为18°C,查表得此温度下水的密度为0.9975g.cm-1。利用V=m/ρ算出水的实际体积。再用实际容量值减去读出总容积,得到总校准值。表格见数据记录本。 酸式滴定管校正曲线
滴定管的使用方法
滴定管的使用方法 一.简介 定管(burette)分为碱式滴定管和酸式滴定管。前者用于 量取对玻璃管有侵蚀作用的液态试剂;后者用于量取对 橡皮有侵蚀作用的液体。滴定管容量一般为50mL ,刻度的每一大格为1mL ,每一大格又分为10小格,故每一小格为 0.1mL 。精确度是百分之一。即可精确到0.01ml . 滴定管为一细长的管状容器,一端具有活栓开关,其上具有刻度指示量度。一般在上部的刻度读数较小,靠底部的读数较大。 二.分类 滴定管为一细长的管状容器,一端具有活栓开关,其上具有刻度指示量度。一般在上部的刻度读数较小,靠底部的读数较大。 酸式滴定管的下端为一玻璃活塞,开启活塞,液体 即自管内滴出。使用前,先取下活塞,洗净后用滤纸 将水吸干或吹干,然后在活塞的两头涂一层很薄的凡 士林油(切勿堵住塞孔)。装上活塞并转动,使活塞与 塞槽接触处呈透明状态,最后装水试验是否漏液。 碱式滴定管的下端用橡皮管连接一支带有尖嘴的小玻璃管。橡皮管内装有一个玻璃圆球。用左手拇指和食指轻轻地往一边挤压玻璃球外面的橡皮管,使管内形成一缝隙,液体即从滴管滴出。挤压时,手要放在玻璃球的稍上部。如果放在球的下部,则松手后,会在尖端玻 滴
璃管中出现气泡。 三.使用方法 滴定时,加入的液体量不必正好落于刻度线上,只要能正确的读取溶液的量即可。实验时将滴定前管内液体的量减去滴定后管内液体的存量即为滴定溶液的用量。底部的开关可有效的控制滴定液的流速,使滴定完全时,可适时地停止滴定液流入其下的锥形瓶中。在远离滴定终点时可快速的添加滴定液,节省实验所需的时间。若滴定管在欲使用时并未先完全晾干,则在正式添加滴定液前,滴定管应以待填充的滴定液涮洗两次,避免附着在管壁的液体污染滴定液。滴定管因管口狭小,填充滴定液时,宜细心充填,以防止滴定液漏出。必要时可辅以漏斗放于管口上端帮助充填。滴定管于装入液体后管中不可有气泡,若有气泡应用橡皮或其它不会敲破玻璃的物品轻敲管壁,让气泡浮出液面。活栓开关的信道内也可能会有空气存在,此时应快速地扭转活栓数次,则气泡即可排出。滴定管于使用时应保持在垂直的位置,不宜倾斜,以免读取刻度时发生误差。 使用的技巧:用碱式滴定管,不能按玻璃珠以下部位,否则放开手时易形成气泡. 滴定管使用前检漏:向滴定管加适量水,用滴定管夹将滴定管固定在铁架台上,观察是否漏水,若不漏水,对于酸式滴定管将活塞旋转180?,对于碱式滴定管轻轻挤压玻璃球,放出少量液体,再次观察滴定
滴定管校正方法
滴定管校正方法 滴定管的校正方法 将欲校准的滴定管充分洗净,装入蒸馏水至刻度零处,记录水的温度。然后由滴定管放出10ml水(放出速度:10ml/min )至预先称过质量的具塞瓶中,该盖上瓶塞,再称出它的质量(精确到0.01g)?两 次质量之差即为放出水的质量。用同样的方法称出滴定管从0到20ml, 0到30ml, 0到40ml,0到50ml刻度间水的质量,用实验温度时水的质量来除相对应水的体积换算校正值(非密度值),即可得到相当于滴定管各部分容积的实际毫升数。 例如在15C由滴定管中放出10.03ml水,其质量为10.04g,又此算出水的实际体积为:10.04/0.99792=10?06(ml),因此,滴定管这段容积的误差为10.06-10?03=+0?03ml。使用时应将视容量为10.03 ml, 加上校正值+0.03ml,才等于真实容量(10.03+0.03=10?06ml)b V沪V書-V進 卄罠tk 式中V冲一校准点的楼正值,ml V L校准点实际容积,mt V L校准点放出体积的读数* m! 校准点放岀水的嚏量,g M医校准点放岀水和瓶的重量* g 空瓶的重量+ g
举例:阶段放出体积校正法g,举例说明: 表3 50ml滴宜營校准实例
表2 不同温度时水的密度与校正值(2(TC)
25ml滴定管校正举例(总体积校正法) 水温25度校正值0.99612g/ml 滴定管体积 读数ml 放出体积数 ml 瓶重+水重g 水重g 实际容积ml 总校正值ml 0.00 / 50.00 / / 0.00 5.02 5.02 55.00 5.00 5.02 0.00 10.01 10.01 59.98 9.98 10.02 0.01 15.03 15.03 64.96 14.96 15.02 -0.01 20.04 20.04 69.95 19.95 20.03 -0.01 25.00 25.00 74.94 24.94 25.04 0.04 滴定管校正曲线的绘制 滴定管校正曲线 12 0. 05 0、04 0. 03 0. 02 0. 01 0. 00 7 01
滴定分析法实验报告
滴定分析法实验报告 滴定分析基本操作及酸碱浓度的比较实验报告 实验目的就不写出来了大家肯定都有 一实验原理 1.酸碱指示剂有其变色范围(pH),甲基橙的变色范围是3.1-4.4,0-3.1为红色, 3.1- 4.4为橙色,4.4-14为黄色。酚酞的变色范围是8.2-10.0,0-8.2为无色,8.2-10.0为浅红色,10.0-14为红色 2.盐酸和氢氧化钠的反应方程式为:HCl+NaOH=NaCl+H2O 在中和反应过程中,溶液的pH会发生突变,可以通过溶液的颜色变化判断滴定终点,之后测定出消耗的酸或者碱的体积,就可以利用公式: VB*cB*νA=VA*cA*νB
求出碱和酸的浓度之比(ν代表化学计量数,对于盐酸和氢氧化钠的反应盐酸和氢氧化钠的化学计量数均为1) 3.滴定分析法是将滴定剂(已知准确浓度的标准溶液)滴加到含有被测组分的溶液中,直到达到滴定终点,然后根据滴定剂的浓度和消耗的体积计算被测组分含量的一种方法 4,。标准溶液的配置方法一般有两种:直接配制法和间接配制法,本实验是用间接配制法,以酚酞或甲基橙为指示剂来确定滴定终点 二实验步骤 1. 实验试剂 浓度为cNaOH=1mol/LNaOH溶液(要求不含碳酸根离子) 浓度为cHCl=1mol/LHCl溶液 0.1%酚酞指示剂 0.1%甲基橙指示剂
2. 实验仪器的准备 (1)酸式、碱式滴定管各一支,洗涤至内壁不挂水珠。然后涂油,试漏, 最后用5-10ml去离子水润洗三次备用 (2)锥形瓶三个,称量瓶两个,细口试剂瓶两个,用自来水洗至不挂水珠, 再用少量去离子水润洗三次,备用。称量瓶洗净后倒扣在干净的表面皿或滤纸上,令其自然干燥,以备下次实验用 3. 酸碱溶液浓度的比较 (1)用量筒分别量取40ml浓度为cNaOH=1mol/LNaOH溶液和浓度为 cHCl=1mol/LHCl溶液,分别倒入两个试剂瓶中,再用量筒分别量取
滴定管的校正
滴定管的使用及校正练习 摘要:在化学仪器使用过程中,容量器皿的容积与其所标出的体积并非完全相符,在使用过程中,也会有各种误差的出现。本实验对使用的酸式及碱式移液管进行了绝对校正,采用衡量法,用天平称得滴定管放出的纯水的质量,然后根据水的质量和密度,计算出滴定管在标准温度20℃时的实际容积。 关键词:滴定管分析天平绝对校正 前言: 容量器皿的容积与其所标出的体积并非完全相符。因此,在准确度要求较高的分析工作中,必须对容量器皿进行校正。 由于玻璃具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同。因此校准玻璃容量器皿是,必须规定一个共用的温度值,这一规定温度值称标准温度,国际上规定玻璃容量器皿的标准温度为20℃,即在校准时都将玻璃容量器皿的容积校准到20℃是的实际容积。 容量器皿常应用两种校准方法:相对校准和绝对校准。 本实验对滴定管的校正就是采用绝对校准法。 1.实验部分 1.1仪器设备 1)50ml滴定管,酸式、碱式各一支 2)称量瓶一只 3)普通温度计(公用) 4)容量瓶(50ml)一只 5)分析天平 1.2实验方法 1.2.1 滴定管的使用 1)清洗酸式滴定管和碱式滴定管各一支; 2)用自来水充满酸式滴定管,将其放在滴定管架上静置约2min,观察有无水滴漏下。然后
将旋塞选择180°,再如前检查; 3)用蒸馏水润洗滴定管2—3次; 4)装入蒸馏水; 5)排气泡; 6)调节滴定管至10.00刻度线左右,记录初读数; 7)按正确的操作,放出3-5ml 水于准备好的称量瓶中称量; 8)继续按以上操作往称量瓶中放水,每3-5ml 称量一次,直至滴定管到40ml 刻度线左右。 1.2.2分析天平的使用 1. 将洁净的称量瓶放在分析天平上,清零; 2. 待滴定管中放入纯水后,拿出称量瓶,再放至分析天平上称量,记录此次天平读数。 1.2.3 平行测定 酸式及碱式滴定管分别重复操作3次,将称量结果记录在表格内。 2.结果与讨论 14T =℃时,10.9980.g ml ρ-= 2.1 酸式滴定管的校正 将三次校正数据记录表中 表1 第一次酸式滴定管校正表 V 读/ml V 表/ml 水重/g V 计/ml /ml 酸式A 10.12 13.20 3.08 3.1004 3.11 0.03 16.05 5.93 5.9043 5.92 -0.01 19.00 8.88 8.9012 8.92 0.04 22.00 11.88 11.8994 11.92 0.04 25.01 14.89 14.9122 14.94 0.05 28.00 17.88 17.8925 17.93 0.05 30.98 20.86 20.8598 20.90 0.04 表2 第二次酸式滴定管校正表 V 读/ml V 表/ml 水重/g V 计/ml V 总校/ml 酸式B 10.05 13.00 2.95 2.9644 2.97 0.02 16.00 5.95 5.9284 5.94 -0.01 19.07 9.02 9.0457 9.06 0.04 22.00 11.95 11.9852 12.01 0.06 25.10 15.05 15.0575 15.09 0.04
滴定管的正确使用方法
滴定管的正确使用方法 滴定管的使用 滴定管是滴定操作时准确测量标准溶液体积的一种量器。滴定管的管壁上有刻度线和数值,最小刻度为0.1毫升,“0”刻度在上,自上而下数值由小到大。滴定管分酸式滴定管和碱式滴定管两种。酸式滴定管下端有玻璃旋塞,用以控制溶液的流出。酸式滴定管只能用来盛装酸性溶液或氧化性溶液,不能盛碱性溶液,因碱与玻璃作用会使磨口旋塞粘连而不能转动,碱式滴定管下端连有一段橡皮管,管内有玻璃珠,用以控制液体的流出,橡皮管下端连一尖嘴玻璃管。凡能与橡皮起作用的溶液如AgNO 3、KMnO 4、I2溶液,均不能使用碱式滴定管。 一、酸式滴定管的使用方法 (1)洗涤。通常滴定管可用自来水或管刷蘸洗涤剂(不能用去污粉)洗刷,而后用自来水冲洗干净,去离子水润洗3次。有油污的滴定管要用铬酸洗液洗涤。 (2)给旋塞涂凡士林(起密封和润滑的作用)。将管中的水倒掉,平放在台上,把旋塞取出,用滤纸将旋塞和塞槽内的水吸干。用手指蘸少许凡士林,在旋塞芯两头薄薄地涂上一层(导管处不涂凡士林),然后把旋塞插入塞槽内,旋转几次,使油膜在旋塞内均匀透明,且旋塞转动灵活。 (3)试漏。将旋塞关闭,滴定管里注满水,把它固定在滴定管架上,放置10分钟,观察滴定管口及旋塞两端是否有水渗出,旋塞不渗水才可使用。 (4)滴定管内装入标准溶液后要检查尖嘴内是否有气泡。如有气泡,将影响溶液体积的准确测量。排除气泡的方法是: 用右手拿住滴定管无刻度部分使其倾斜约30°角,左手迅速打开旋塞,使溶液快速冲出,将气泡带走。
(5)装标准溶液。应先用标准液(5-6ml)润洗滴定管3次,洗去管内壁的水膜,以确保标准溶液浓度不变。 方法是两手平端滴定管同时慢慢转动使标准溶液接触整个内壁,并使溶液从滴定管下端流出。装液时要将标准溶液摇匀,然后不借助任何器皿直接注入滴定管内。 (6)进行滴定操作时,应将滴定管夹在滴定管架上。左手控制旋塞,大拇指在管前,食指和中指在后,三指轻拿旋塞柄,手指略微弯曲,向内扣住旋塞,避免产生使旋塞拉出的力。向里旋转旋塞使溶液滴出。滴定管应插入锥形瓶口1-2cm,右手持瓶,使瓶内溶液顺时针不断旋转。掌握好滴定速度(连续滴加,逐滴滴加,半滴滴加),终点前用洗瓶冲洗瓶壁,再继续滴定至终点。 (7)滴定管使用完后,应洗净打开旋塞倒置于滴定管架上。 二、碱式滴定管的使用方法 (1)试漏。给碱式滴定管装满水后夹在滴定管架上静置5分钟。若有漏水应更换橡皮管或管内玻璃珠,直至不漏水且能灵活控制液滴为止。 (2)滴定管内装入标准溶液后,要将尖嘴内的气泡排出。方法是: 把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴快速喷出,气泡即可随之排掉。 (3)进行滴定操作时,用左手的拇指和食指捏住玻璃珠中部靠上部位的橡皮管外侧,向手心方向捏挤橡皮管,使其与玻璃珠之间形成一条缝隙,溶液即可流出。 其他操作同酸式滴定管。 三、使用滴定管时还应注意以下几点: (1)滴定管使用前和用完后都应进行洗涤。洗前要将酸式滴定管旋塞关闭。管中注入水后,一手拿住滴定管上端无刻度的地方,一手拿住旋塞或橡皮管上方无刻度的地方,边转动滴定管边向管口倾斜,使水浸湿全管。然后直立滴定
EDTA标准溶液的配制与标定实验报告.doc
EDTA标准溶液的配制与标定 一、实验目的 (1)、掌握EDTA标准溶液的配制与标定方法。 (2)、掌握铬黑T指示剂的应用条件和终点颜色变化。 二、实验原理 EDTA(Na2H2Y)标准溶液可用直接法配制,也可以先配制粗略浓度,再用金属Zn、ZnO、CaCO3或MgSO4· 7H2O等标准物质来标定。当用金属锌标定时,用铬黑T(H3In)做指示剂,在pH=10的款冲溶液中进行,滴定到溶液呈蓝色时为止。滴定反应式: 指示剂反应 Hln2- + Zn2+ = Znln- + H+ 滴定反应 H2Y2- + Zn2+ = ZnY2- + 2H+ 终点反应 Znln- + H2Y2-?ZnY2- + Hln2- + H+ 二、实验注意事项 (1)、称取EDTA和金属时,保留四位有效数; (2)、控制好滴定速度; (3)、加热锌溶解时,用表面皿盖住以免蒸发掉。 三、主要仪器与药品 仪器:酸式滴定管、25ml移液管、250ml容量瓶、250ml锥形瓶、250ml烧杯、表面皿。 药品:EDTA二钠盐、金属锌、1:1的氨水、1:1的HCl 、铬黑T指示剂、氨水—NH4Cl缓冲液(PH=10) 四、实验过程及原始数据记录 (1)、称取分析纯EDTA二钠盐1.9g左右,配制成500ml溶液。 (2)、称取0.15~0.2g金属Zn,加入1:1 HCl 5ml,盖好表面皿,使锌完全溶解,用水冲洗表面皿及烧杯内壁,然后将溶液移入250ml容量瓶中,再加水至刻度摇均,用25ml移液管吸此溶液置于250ml锥形瓶中,滴加1:1 氨水至开始出现Zn(OH)2白色沉淀,再加PH=10的缓冲溶液10ml ,加水稀释至100ml ,加入少许(约0.1g)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变 为纯蓝色,即为滴定终点。 EDTA的标定[ m(Zn) = 0.1815g ] 试验次数ⅠⅡⅢ V初 EDTA /ml 0 0 0 V末 EDTA /ml 29.70 29.65 28.60 V EDTA (mol/L) 29.70 29.65 28.60 c EDTA (mol/L) 0.0094 0.0094 0.0098 C EDTA(mol/L)平均值0.0095 相对平均偏差 1.7544%
