HPV基因诊断试剂盒
HPV分型试剂盒及市场各产品比较
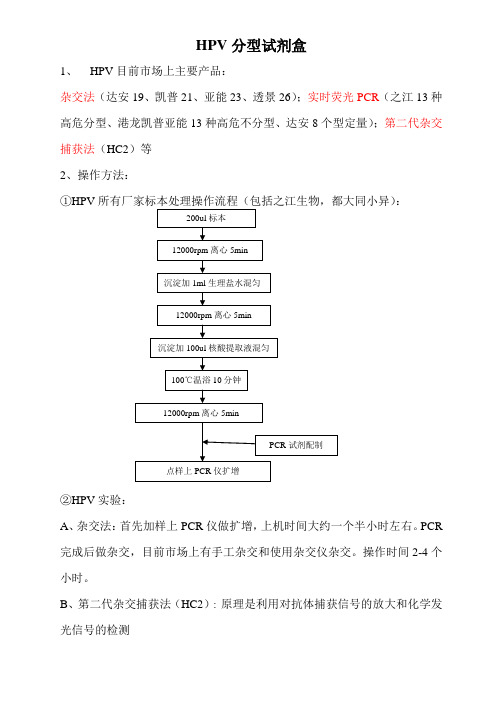
HPV分型试剂盒1、HPV目前市场上主要产品:杂交法(达安19、凯普21、亚能23、透景26);实时荧光PCR(之江13种高危分型、港龙凯普亚能13种高危不分型、达安8个型定量);第二代杂交捕获法(HC2)等2、操作方法::①HPV②HPV实验:A、杂交法:首先加样上PCR仪做扩增,上机时间大约一个半小时左右。
PCR 完成后做杂交,目前市场上有手工杂交和使用杂交仪杂交。
操作时间2-4个小时。
B、第二代杂交捕获法(HC2):原理是利用对抗体捕获信号的放大和化学发光信号的检测,C、荧光定量PCR:直接上机通过荧光信号累积实时监测整个PCR进程,之江生物是用多重PCR对标本进行准确的13个高危型的具体分型,其他不具体分型。
举例之江产品:之江八管双通道仪器(双色荧光PCR仪器都可以用):1 2 3 4 5 6 7 8 9 10 11 12A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4E Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5F Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6G Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7H Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8一排八管做一个标本即可具体分型!HPV核酸荧光PCR检测混合液若FAM通道Ct值≤35,结果判断为若VIC通道Ct值≤35,结果判断为Mix1 16+56 HPV16 HPV56Mix2 18+45 HPV18 HPV45Mix3 35+59 HPV35 HPV59Mix4 39+51 HPV39 HPV51Mix5 58+52 HPV58 HPV52Mix6 31 HPV31Mix7 33 HPV33Mix8 68 HPV68②四管四通道仪器(ABI7500、罗氏480、伯乐CFX96、SLAN96孔等四色荧光PCR仪器):A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4结果判断:3、产品分析比较:4、上海之江HPV优劣势:•优点:①闭管PCR操作,避免扩增污染②能够对13个高危型精确分型③灵敏度高,操作简单,减少了杂交的操作程序,一个实验大约2个小时内完成④针对开放荧光PCR检测系统,无需额外增加设备,有人员培训基础。
04-HPV 人乳头瘤病毒核酸检测试剂盒-产品介绍13-12-17

14
形态学筛查存在的问题
1、假阴性结果(10-30%)面临医疗纠纷;
2、重复性不好;
3、经验性:需要富有经验的专家; 4、增加筛查成本:复诊率过高; 5、在等待复查中承受焦虑和精神压力;
2014年11月2日星期日
15
宫颈癌临床主要检测方法(二)
HPV DNA分型检测方法
---荧光PCR法(默乐生物) ---杂交信号放大法 (HC2)
1、竞争性内标技术:
监测整个核酸抽提和检测过程是 否有误,有利于消除反应出现的 假阴性,结果更可靠。
2014年11月2日星期日
20
产品特点——独特探针引物设计
高保守
无交叉 阴阳性
无漏检
基于HPV分型原理: 根据HPV L1区基因保守序列设计一系列扩增引物富集24种型别的HPV
PCR产物,再针对不同亚型设计不同探针,进行荧光PCR反应,通过荧光信
2014年11月2日星期日
10
宫颈癌前病变各期及宫颈癌的病理模式图
正常宫颈
轻度不典型增生 中度不典型增生 CIN I CIN II
重度不典型增生 CIN III/CIS
浸润癌 Invasive CA
2014年11月2日星期日
11
宫颈癌筛查方案
• 权威组织一致推荐:采用细胞学检 查和HPV DNA联检进行宫颈癌筛查。
2014年11月2日星期日 31
产品市场容量分析
HPV检测试剂 盒未来的市场 规模达222亿元
我们默乐 HPV产品市 场占有率
?
2014年11月2日星期日 32
2014年11月2日星期日
33
CIN1、CIN2、CIN3:子宫颈上皮内瘤变
ASC-US:意义不明确的非典型鳞状细胞
凯普21种基因型HPV分型与其它比较

交叉污染
多次开关管盖,完 全手工操作,需要 向外倾倒液体,易 污染;有同一容器 内洗涤过程,容易 交叉污染
无效复性
高
杂交效率
低
导流杂交法 10分钟
目的DNA可与杂交膜 表面及孔径中的探针 进行杂交反应,立体 式杂交
低(浅)
实验全过程在隔离的 反应室内完成,通过 外部负压吸引,分子 不易向外扩散,不易 交叉污染。
• 在HC-II的说明书中有提及高危型探针可能会与细 菌的PBR322质粒发生交叉反应(24)。
来源:内部研究资料198例HC-2阳性样本的研究 &. limitations of the procedure DIGENE high-risk HPV DNA Test hybrid capture-II,P24
来源:limitations of the procedure DIGENE high-risk HPV DNA Test hybrid captureII,P24 &. Mario Poljak, Irena J. Marin, Katja Seme, Hybrid Capture II HPV Test detects at least 15 human papillomavirus genotypes not included in its current high-risk probe cocktail. Adriana Vince Journal of Clinical Virology 25 (2002) 89--97
98.48%
特异性
95.74%
87.61%
来源:临床考核报告
HC-II的交叉 反应
• 在HC-II检测为阳性的198例样本,有18例样本不 能用其他方法(PCR-测序)证实存在其检测的13 种高危型HPV。 其中有8例样本检出13种高危型之外的其他 HPV基因型,分别为3例HPV66,1例HPV53,1 例HPV53/66,1例CP8304 ,1例HPV82 ,1例 55型。
三家国产试剂盒HPV分型检测结果一致性比较分析

三家国产试剂盒HPV分型检测结果一致性比较分析余红;陆其兵【摘要】目的比较分析三家国产试剂盒HPV分型检测结果的一致性.方法收集近2个月来由之江检测的阳性标本82份,阴性标本10份,分别用3家国产试剂进行HPV基因分型检测2次,并进行比较.结果三家试剂结果重复性分别是之江95.6%,凯普96.7%,安普利95.6%.三家试剂检测结果完全一致率为51.1%(47/92),部分一致率为24.9%(22/92),不一致率为25.0%(23/92).单一型感染的一致率86.4%(32/37),多重感染完全一致率为22.2%(10/45),部分一致率为48.9%(22/45).结论三家国产试剂检测结果一致性不理想.建议患者进行前后治疗的效果对比,最好选在同一家医院进行检测,这样才具有可比性.【期刊名称】《临床输血与检验》【年(卷),期】2019(021)003【总页数】3页(P320-322)【关键词】人乳头瘤病毒;国产试剂盒;结果一致性【作者】余红;陆其兵【作者单位】224400 江苏省阜宁县人民医院检验科;224400 江苏省阜宁县人民医院检验科【正文语种】中文【中图分类】R373.9;R446.11人乳头瘤病毒(HPV)是常见的一种性传播疾病的病原体,分为高危型和低危型,其中高危型HPV感染已被证实与宫颈癌的发生密切相关,HPV检测在宫颈癌筛查中越来越受到重视[1]。
目前HPV检测主要采用分子生物学方法,我国注册的HPV检测试剂盒大部分检测L1基因序列,也有检测全基因组或HPV E6/7序列,但分子生物学方法检测技术也并不完美,这些设计无法顾全到HPV型别全覆盖和型别特异等问题。
本文选用了三家国产试剂进行HPV分型检测并进行比较,发现三家国产试剂检测结果的一致性很不理想。
材料与方法1 仪器与试剂仪器为上海复星SLAN-96S实时荧光扩增仪,三家国产试剂分别是上海之江生产的HPV分型试剂:6+11、16、18、31、33、35、39、45、51、52、56、58、59、66、68、82,其中两个低危不分型。
检测试剂盒反向斑点杂交法

人乳头瘤病毒基因分型(32型)检测试剂盒使用说明书(PCR-反向斑点杂交法)【产品名称】通用名称:人乳头瘤病毒基因分型(32型)检测试剂盒(PCR-反向斑点杂交法)英文名称:Human Papillomavirus Genotyping Kit For 32 Types(PCR-RDB)【包装规格】25人份/盒【预期用途】本试剂盒用于检测宫颈脱落细胞是否感染人乳头瘤病毒(Human papillomavirus,HPV)并加以分型,对宫颈癌的早期诊断有重要意义。
【检测原理】反向斑点杂交法本试剂根据HPV基因组的特点设计生物素标记的引物,PCR扩增各基因型HPV的目的片段。
将32型HPV特异性寡核苷酸探针固定在尼龙膜上。
根据生物素-亲和素系统(Biotin-avidin system,BAS)原理,将PCR扩增产物与固化在膜条上的探针杂交,洗膜后加入辣根过氧化合物酶标记的亲和素(POD),与PCR产物上的生物素结合。
加入显色液(TMB,H2O2),辣根过氧化物酶催化其底物H2O2分解,TMB作为供氢体参与反应后产生蓝色的斑点。
根据杂交信号斑点的有无来判断样本中是否存在HPV的基因型。
本试剂盒能有效检测WHO确认的32种HPV的基因型,其中包括19种高危亚型:HPV16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82、83型;13种低危亚型:HPV6、11、40、42、43、44、55、61、67、69、70、72、81型。
【主要组成成分】【自备试剂】1、20×SSC:称取175.3gNaCl和88.2g枸橼酸钠二水,用800mL双蒸水溶解,浓HCl调节pH值至7.0,定容至1000mL,高压灭菌,室温保存。
2、10%SDS:将20gSDS溶解在180mL双蒸水中,浓HCl调节pH值至7.0,定容至200mL,高压灭菌,室温保存。
3、1M柠檬酸钠:294.1g柠檬酸钠加纯水800mL溶解,用浓HCl调pH值至5.0,定容至1000mL,室温保存。
HPV SOP - 不带提取

人乳头瘤病毒核酸分型检测试剂盒(荧光PCR 法)标准操作流程一、目的:规范实验室操作,正确使用PCR扩增仪进行HPV-DNA扩增分析,以保证实验结果的准确性。
二、适用范围:人乳头状瘤病毒(HPV)基因分型检测试剂盒在扩增仪上进行扩增以及分析。
三、职责:由临床分子生物实验室专业技术人员制定程序文件,实验室负责人审核,科室主任批准实施。
四、程序:【检验方法】1. 试剂准备(试剂准备区)a) 从-20℃取出试剂盒,将各试剂融化混匀并短暂离心后备用。
计算需要进行的反应份数n (n=待测样本数+空白对照1份+阳性对照1份)。
b) 取出8个离心管分别标记1#、2#、3#、4#、5#、6#、7#和8#,分别加入n×10μl 核酸扩增反应液,然后对应每个编号离心管分别加入n×8μl A反应液(1#)、n×8μl B反应液(2#)、n×8μl C反应液(3#)、n×8μl D反应液(4#)、n×8μl E反应液(5#)、n×8μl F反应液(6#)、n×8μl G反应液(7#)、n×8μl H反应液(8#)。
c) 混匀并短暂离心后,依次分装至对应编号PCR八联管中,每管18μl,总共分装n排PCR 反应八联管,1排PCR八联管为1人份。
2. 加样(1)小心打开PCR八联管盖,每份待测样本核酸溶液、空白对照按照2μl/管依次加入对应编号含有A-H反应体系的PCR八联管中,1排PCR八联管为1人份,阳性对照(A-H组)同样按照2μl/管分别加入对应的A-H反应体系的PCR八联管中,总体积为20μl/管。
(2)盖紧PCR八联管盖,低速短暂离心。
3. PCR扩增检测(核酸扩增区)3.1 将反应管放入荧光PCR 扩增仪进行扩增检测。
4. 结果分析4.1 杭州博日Linegene 9600荧光定量PCR仪:反应结束保存结果,根据分析后图像调节基线的起始循环、终止循环(可以根据实际情况自行调整,起始循环可以在3~15、终止循环可设在5~20,调整空白对照的扩增曲线平直或低于阈值线;也可由仪器进行自动判读,起始循环为3、终止循环为15),点击确定自动获得分析结果,在同一界面的显示区察看结果。
HPV分型试剂盒及市场各产品比较

HPV分型试剂盒1、HPV目前市场上主要产品:杂交法(达安19、凯普21、亚能23、透景26);实时荧光PCR(之江13种高危分型、港龙凯普亚能13种高危不分型、达安8个型定量);第二代杂交捕获法(HC2)等2、操作方法::①HPV②HPV实验:A、杂交法:首先加样上PCR仪做扩增,上机时间大约一个半小时左右。
PCR 完成后做杂交,目前市场上有手工杂交和使用杂交仪杂交。
操作时间2-4个小时。
B、第二代杂交捕获法(HC2):原理是利用对抗体捕获信号的放大和化学发光信号的检测,C、荧光定量PCR:直接上机通过荧光信号累积实时监测整个PCR进程,之江生物是用多重PCR对标本进行准确的13个高危型的具体分型,其他不具体分型。
举例之江产品:之江八管双通道仪器(双色荧光PCR仪器都可以用):1 2 3 4 5 6 7 8 9 10 11 12A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4E Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5F Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6G Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7H Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8一排八管做一个标本即可具体分型!HPV核酸荧光PCR检测混合液若FAM通道Ct值≤35,结果判断为若VIC通道Ct值≤35,结果判断为Mix1 16+56 HPV16 HPV56Mix2 18+45 HPV18 HPV45Mix3 35+59 HPV35 HPV59Mix4 39+51 HPV39 HPV51Mix5 58+52 HPV58 HPV52Mix6 31 HPV31Mix7 33 HPV33Mix8 68 HPV68②四管四通道仪器(ABI7500、罗氏480、伯乐CFX96、SLAN96孔等四色荧光PCR仪器):A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4结果判断:3、产品分析比较:4、上海之江HPV优劣势:•优点:①闭管PCR操作,避免扩增污染②能够对13个高危型精确分型③灵敏度高,操作简单,减少了杂交的操作程序,一个实验大约2个小时内完成④针对开放荧光PCR检测系统,无需额外增加设备,有人员培训基础。
HPV基因分型检测试剂盒常见问题

方便工作
基因扩增检验实验室工作流程
进入各个工作区必须遵循严格 的单一方向顺序!
最佳的HPV基因分型实验室布局
工作流 向
PCR后区域
PCR前区域
临床 样本 收集 与 储存
出口
入口
最佳的HPV基因分型实验室布局
每间房间必须有其专用的工作服及一次性手套; 每个工作区都应有独立的一套仪器设备及耗材; 不同区域的仪器设备及耗材不能混用;
临床试验结果分析及常见问题
九、封阻液抽不动 可能原因: ①仔细观察封阻液是否有絮状微 生物或澄淀,如果有则证明封阻 液有发霉迹象,是由于操作中没 有使用灭菌枪头而造成的。 重新购买封阻液,同时确保试验中使用已灭菌 的移液枪头
临床试验结果分析及常见问题
HPV基因分型检测项目 临床试验实际问题
目 录
试验开展实验室要求 HPV临床样本的采集方法及注意事项 临床试验操作注意事项 临床试验结果分析及常见问题
HPV基因分型检测试验项目
——试验开展实验室要求
临床基因扩增实验室设置的一般原则
各区独立 注意风向 因地制宜
“十六字方针”
临床试验结果分析及常见问题
402721 403022 403040 403078
稀释 1:10 DNA模板重复PCR
HPV 58
HPV 18
IC (+) HPV 51
弱 IC, HPV 52
临床试验结果分析及常见问题
三、杂交结果中IC点没有,同时阳性点淡或不清楚; 可能原因:① 样本中含有抑制PCR反应的物质; ② 样本中HPV DNA浓度较低,同样本中 含有抑制PCR反应的物质; ③ 病人样本不符合凯普分型试验要求,样本本身 为阴性结果,但因为样本中有抑制PCR反应的物 质,同时操作人员对杂交温度又控制不当,出 现非特异性杂交点; 建议增加用于扩增DNA浓度,重新PCR扩增及杂交反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国内对不同亚型感染致病性研 究近况
北京大学第一临床医院赵健等对1715例患者研 究表明:在高危型中,致癌性最强的是16型, 其次是33和31型。(十五攻关资助项目)。
在北京中日友好医院进行的591例研究中,发 现多重感染患者发生宫颈癌的危险性明显高于 单一感染者,对放疗敏感性差,无进展生存期 和带瘤生存期比单一感染者明显缩短。
型)。其中超过35种可以感染人类的生殖器官,约30种及肿瘤有关。
1)低危型:宫颈上皮内低度病变,引起外生殖器湿疣等良性性病(HPV 6、11、42) ; 2)高危型: 宫颈上皮内高度病变,与宫颈癌的发生有关(HPV 16、 18、 31、 33、35、 39 、45、 51、 52、 53、56、 58、59、 66及 68);
--- 99.7%的宫颈癌患者都能发现高危型HPV感染。
7
二、HPV的生物学研究
8
人乳头瘤病毒(Human Papillomaviruses, HPV)
双链DNA无包膜病毒 环状DNA,约8Kb; 病毒颗粒直径为50~55nm; 依靠宿主细胞进行复制、转录和
翻译。
HPV病毒电镜图
9
型别及分布
型别:已发现100多种不同的亚型(如果DNA序列同源性小于90%,则定为新的亚
14
HPV基因结构
按功能可分为早期区(E区)、晚期区 (L区)和非编码区 ( LCR)三个区域。
E区分为E1~E7开放阅读框架,主要编码 及病毒复制、转录、调控和细胞转化有关的 蛋白( HPV无E3)。
L区分L1和L2,分别编码主要衣壳蛋白和 次要衣壳蛋白。
LCR是E区与L区间-6.4~1.0Kb的DNA片 段,可负责转录和复制的调控
15
HPV的致癌机理
HPV以游离态感染上皮细胞后,可以持续存在于染色体外,不引起 任何病变,或引起良性病变和低度病变,如尖锐湿疣或轻度不典型 增生等。而癌变则及病毒DNA整合入宿主染色体密切相关。 高危型HPV DNA链通常在E1或E2的开放读码框内断裂,使HPV DNA 整合入染色体脆弱区。E6和E7具有促进和维持整合状态的功能。 HPV E6蛋白间接抑制 p53活性,阻碍细胞对DNA损伤的反应。(负 向调节细胞的生长和分化) HPV E7蛋白与pRb结合后使其功能失活,改变细胞周期的正常调控。
%, 所有亚型检出次数为226。
2. 本表统计数据由WHO深圳项目提供,HPV分型基因检测试剂由亚能生物技术(深圳)有限公司提供。
13
浙江12000例HPV检测初步结果
分型情况:16型占26%左右,其他依次 为58、33、52、45、18。及其他地区的 统计有明显差异。 高危人群阳性率在30%左右,普通人群 在11%左右。 温州地区丽水地区阳性率明显高于省内 其他地区。 进一步的研究正在进行中。
最常见的高危型
53%
HPV16
(HPV16、18、31、
33、45、58 )
宫颈癌患者中高危型HPV感染率(欧州2000年资料)
12
深 圳 不 同 HPV 亚 型 的 检 出 频 率 统 计 (WHO项目)
注:1.本表统计样本数为1153例,其中阳性样本数为119例; 由于检测样本中存在复合感染,故亚型的检出频率=(该亚型的检出次数 / 所有亚型的检出次数)×100
HPV基因诊断试剂盒
一、宫颈癌的概述及其病因学研究进展 二、HPV的生物学研究 三、宫颈癌的早期筛查 四、宫颈病变的治疗
2
一、宫颈癌的概述及其病因学研究进展
3
宫颈癌--最常见的妇科恶性肿瘤
据世界范围内统计,每年大约有50万左右的宫颈癌新发病例,占所有癌症新发 病例的5%,其中80%的病例发生在发展中国家。我国每年宫颈癌新发病例约13.15 万,占世界宫颈癌新发病例总数的28.8% ,发病率仅次于乳腺癌位居第二。
宫颈病变 湿疣,CIN I CIN, CIN CIN CIN CIN I CIN I 正常宫颈上皮 尖锐湿疣 鲍温样丘疹病 VIN VaIN 鳞癌 外阴乳头状瘤
11
HPV在欧洲的常见分型和感染率
H3P%V33 6%
HPV31
1 4 % Other
9%
HPV45
15%
HPV18
ቤተ መጻሕፍቲ ባይዱ
最常见的低危型
(HPV6、11)
17
HPV感染途径及危险因素
随着筛查制度的建立,世界宫颈癌的发病率和死亡率已经大幅下降。我国由 70年代的10.28/10万下降到90年代的3.25/10万,但在高发病区,死亡率仍高居不 下。
地区 世界 中国 北京 上海 山西阳城
死亡率 (/10万) 8.00 3.25 2.54 3.8 36.00
4
患病年龄更趋于年轻化(发病年龄提前到45岁),发病史缩短。如吉林省在80年代统计宫颈癌 患者中小于35岁的妇女占4.8%,而2000年已经占到34.1%
分布:有些亚型和地区、宫颈癌的病理类型有关。
HPV45在非洲西部很常见,HPV39和59在美洲中部和南部常见,HPV52,58在中国常见。 在宫颈鳞状上皮细胞癌中以HPV16(占51%),在腺癌和腺鳞癌中HPV18分别占56%和39%。
10
表 HPV型别及宫颈病变
常见HPV型别 6,11 16 18 30,40,58,69 31,33,35,39 45,51,52,56 42,43,44 53 54 55 59 61,62,64,67 66 70
5
子宫颈癌的危险因素:
❖ 行为危险因素:如性生活过早、多个性伴侣、多孕多产、社会经济地位低下、 营养不良及性混乱等; ❖ 生物学因素:如细菌、病毒和衣原体等各种微生物的感染。 ❖ 目前仅有少量研究表明宫颈癌可能存在着家族聚集现象。
6
宫颈癌的生物学病因研究进展 : *早在十九世纪四十年代,一位意大利医生Regoni Stern最早提出结婚及
否与宫颈癌的发生可能有关; *60-70年代,人们的主要研究对象是HSV,HCMV等病原体; *1974年zur Hausen首次提出HPV感染与宫颈肿瘤有密切关系; *1977年Laverty在电镜中观察到宫颈癌活检组织中存在人乳头状瘤病毒 (Human papillomavirus,HPV)颗粒; *1995年IARC专题讨论会:高危型HPV持续感染是宫颈癌的主要病因。
