铁氰化钾溶液的循环伏安法研究
循环伏安法测定铁氰化钾实验讲义

[实验目的]1) 学习固体电极表面的处理方法。
2) 掌握循环伏安仪的使用技术。
3) 了解扫描速率和浓度对循环伏安图的影响。
[实验原理]铁氰化钾离子-亚铁氰化钾离子:])([])([6463CN Fe K CN Fe K ⇔氧化还原电对的标准电极电位:V 36.00=ϕ峰电流方程: 循环伏安法产生氧化电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol.L -1 NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s -1;电子转移速率大,为可逆体系(1.0 mol.L -1 NaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2 cm 〃s -1)。
[注意事项和问题]1.实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
3. 若实验中测得的条件电极电位和与文献值有差异,说明其原因。
53/21/21/2p 2.6910i n ACD v =⨯i—E 曲线[实验步骤]1. 指示电极的预处理铂电极用Al 2O 3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水超声清洗3min.。
2.配制溶液配制2⨯10-2、2⨯10-3 、8⨯10-4、2⨯10-4 mol 〃L -1的K 3[Fe(CN)6]溶液。
3. 不同扫描速率K 3[Fe(CN)6]溶液的循环伏安图先对10-3mol〃L -1K 3 [Fe(CN)6]溶液(含支持电解质KNO 3浓度为0.50 mol〃L -1, 通氮气除氧5min )以20mV/s 在+0.8至-0.2V 电位范围内扫描循环伏安图。
再对上述溶液以10、40、60、80、100、200mV/s ,在+0.8至-0.2V 电位范围内扫描,分别记录循环伏安图。
4. 不同浓度K 3[Fe(CN)6]溶液的循环伏安图在10-4、4⨯10-4、10-2 mol〃L -1 K 3[Fe(CN)6]溶液(均含支持电解质KNO 3浓度为0.50 mol〃L -1, 通氮气除氧5min )中,以20mV/s ,在-0.2至+0.8V 电位范围内扫描,分别记录循环伏安图。
循环伏安法测定铁氰化钾电化学性能概要

• 实际由于电极等实验状态的变化, 两者(尤其是ΔEp) 与理论值容易产生较大偏差。 • 非可逆电极的ΔEp和ipa/ ipa不具有上述理论关系,原 则上其差异大小与不可逆性是一致的。
图形解析
可逆体系
ipa ipc
1
△Ep = 2.3RT / nF = 56.5/n mV ( 25℃)
循环伏安法与单扫描极谱法的不同
b. 4mmol.L-1完成4种扫描速度的测量: 5mV/s 、(10
mV/s)、20mV/s、40 mV/s进行测量。
Technique
Cyclic Voltammetry
Init E= 0.5V
Parameters High E=0.5V Low E=-0.1V Scan Rate Initial Scan-----Negative
• 循环伏安法与单扫描极谱法相似之处,都是以快速线性 扫描的形式对工作电极施加电压,记下i-E曲线,同样 有峰电流 ip和峰电位Ep,ip、Ep的表达式也分别相同。
• 对于可逆电极反应 ip=2.69×105n3/2D1/2v1/2Ac 其中:ip为峰电流(A),n为电子转移数,A为电极面 积(cm2),D为扩散系数(cm2/s),v为扫描速度 (V/s),c为浓度(mol/L)。由此可见,ip与v1/2和c都 是直线关系。由于Da和Dc大致相同,对于可逆电极反应 ipa/ ipc ≈1。
• 扫描开始时,从起始电压扫描至某一电压后,再反 向回扫至起始电压,构成等腰三角形电压。
U
三角波
t
Ag/Agcl
Fe(CN)6 e Fe(CN)6 0 0.36V(vs.NHE)
3
铂盘电极
4
• 电位向负扫描时出现:O + e == R • 电位向正扫描时出现:R == O + e • 一次扫描过程中完成一个氧化和还原过程的循 环,故此法称为循环伏安法。
铁氰化钾循环伏安法有关性质的测定

实验五铁氰化钾循环伏安法有关性质的测定一. 实验目的掌握循环伏安法(CV)基本操作;了解可逆电化学过程及条件电极电位的测定;获得峰电流随电位扫描速度的变化曲线,获得峰电流随溶液浓度的变化函数关系;并学会电化学工作站仪器的使用。
二. 循环伏安法原理电化学中随着氧化还原反应的进行,会导致电流和电位的变化。
其中根据公式峰电流与电位扫描速度的1/2次方、溶液浓度成正比。
对于循环伏安法,扫描图像中前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
三. 实验仪器和药品铁氰化钾溶液、氯化钾溶液、铝粉、四个25ml容量瓶、电化学工作站,银电极,铂碳电极,银丝电极四. 实验步骤打开电脑并将仪器预热20分钟,打开电化学工作站操作界面。
将铁氰化钾标准溶液转移至电解池中 插入三支电极连接。
以标准的铁氰化钾溶液测试未磨电极的循环伏安曲线,看电位差的大小;超过100mv则用粗细的铝粉抛光铂碳电极,使得电位差在70--80以下;确定各参量:起始电位在0.5V左右,扫速为10、20、40、80、160mv/s,灵敏度为10-5--10-6,以标准铁氰化钾溶液测定不同扫速下的伏安曲线,测定并保存;配制4组不同浓度的铁氰化钾溶液:0.1、0.2、0.5、1.0ml 的铁氰化钾标准溶液于容量瓶中,在加入5ml氯化钾溶液,定容;控制参量:扫速为80,每个浓度6段三次扫描,依次对四组溶液测定伏安曲线,导出实验数据和曲线。
五.数据处理实验参数设定:打磨后电位差为81mv左右,比较合理。
亚铁氰化钾溶液的条件电极电位:从浓度和电位的表格中,可以根据浓度和电位做出曲线图,根据截距求出初始电位和条件电极电位。
测定峰电流和浓度关系时:Init E (V) = 0 High E (V) = 0.5 Low E (V) = 0 Init P/N = PScan Rate (V/s) = 0.08 Segment = 6 Sample Interval (V) = 0.001Quiet Time (sec) = 2 Sensitivity (A/V) = 1e-5测定峰电流和扫速关系时:Init E (V) = 0 High E (V) = 0.5 Low E (V) = 0 Init P/N = PScan Rate (V/s) = 0.02 Segment = 2 Sample Interval (V) = 0.001Quiet Time (sec) = 2 Sensitivity (A/V) = 1e-5数据表:峰电流和扫速数据表:0.1 0.2 0.5 10.226 0.226 0.231 0.24110mv20mv40mv80mv160mvSegment 1:Segment 1:Segment 1:Segment 1:Segment 1:Ep = 0.227V Ep = 0.226V Ep = 0.231V Ep = 0.239V Ep = 0.248Vip = -3.549e-6A ip = -5.605e-6A ip = -8.951e-6A ip = -1.245e-5A ip = -1.924e-5A Ah = -2.377e-5C Ah = -1.801e-5C Ah = -1.522e-5C Ah = -1.150e-5C Ah = -9.455e-6C Segment 2:Segment 2:Segment 2:Segment 2:Segment 2:Ep = 0.145V Ep = 0.140V Ep = 0.136V Ep = 0.126V Ep = 0.120Vip = 5.963e-6A ip = 8.119e-6A ip = 1.095e-5A ip = 1.437e-5A ip = 1.915e-5A Ah = 3.933e-5C Ah = 2.807e-5C Ah = 1.956e-5C Ah = 1.398e-5C Ah = 9.846e-6C曲线图:浓度和峰电流曲线图:所加体积ml0.10.20.51峰电流均值/10-6 2.6243 4.26310.65321.29峰电流和浓度的表格:0.1ml0.2ml0.5ml 1.0mlSegment 1:Segment 1:Segment 1:Segment 1:Ep = 0.226V Ep = 0.226V Ep = 0.231V Ep = 0.241Vip = -2.606e-6A ip = -3.670e-6A ip = -9.316e-6A ip = -1.788e-5A Ah = -2.189e-6C Ah = -2.997e-6C Ah = -8.084e-6C Ah = -1.722e-5C Segment 2:Segment 2:Segment 2:Segment 2:Ep = 0.144V Ep = 0.140V Ep = 0.132V Ep = 0.121Vip = 2.614e-6A ip = 4.106e-6A ip = 1.047e-5A ip = 2.132e-5A Ah = 2.090e-6C Ah = 3.476e-6C Ah = 9.477e-6C Ah = 2.124e-5C Segment 3:Segment 3:Segment 3:Segment 3:Ep = 0.226V Ep = 0.226V Ep = 0.232V Ep = 0.241Vip = -2.433e-6A ip = -3.807e-6A ip = -9.191e-6A ip = -1.705e-5A Ah = -2.025e-6C Ah = -3.105e-6C Ah = -8.032e-6C Ah = -1.634e-5C Segment 4:Segment 4:Segment 4:Segment 4:Ep = 0.144V Ep = 0.140V Ep = 0.131V Ep = 0.121Vip = 2.623e-6A ip = 4.292e-6A ip = 1.067e-5A ip = 2.133e-5A Ah = 2.092e-6C Ah = 3.622e-6C Ah = 9.763e-6C Ah = 2.123e-5C Segment 5:Segment 5:Segment 5:Segment 5:Ep = 0.226V Ep = 0.226V Ep = 0.232V Ep = 0.241Vip = -2.428e-6A ip = -3.940e-6A ip = -9.339e-6A ip = -1.708e-5A Ah = -2.015e-6C Ah = -3.221e-6C Ah = -8.149e-6C Ah = -1.640e-5C Segment 6:Segment 6:Segment 6:Segment 6:Ep = 0.145V Ep = 0.140V Ep = 0.131V Ep = 0.121Vip = 2.636e-6A ip = 4.391e-6A ip = 1.082e-5A ip = 2.132e-5A Ah = 2.069e-6C Ah = 3.690e-6C Ah = 9.877e-6C Ah = 2.117e-5C。
循环伏安法测定铁氰化钾的电极反应过程

实验三十四循环伏安法测定铁氰化钾的电极反应过程一、实验目的见《仪器分析实验》p123二、方法原理见《仪器分析实验》p123。
三、仪器和试剂1.JP—303型极谱分析仪2.铁氰化钾标准溶液:5.0×10-2mol/L3.氯化钾溶液:1.0mol/L四、实验步骤1.铁氰化钾试液的配置准确移取1.0mL5.0×10-2mol/L的铁氰化钾标准溶液于10mL的小烧杯中,加入1.0 mol/L 的氯化钾溶液5.0mL,再加蒸溜水4.0mL。
2.测量手续(1)打开303极谱仪的电源。
屏幕显示清晰后,输入当天的日期:××.××.××,按【INT】键。
(2)屏幕显示“运行方式”菜单后,选取“使用当前方法”项,按【YES】键。
屏幕将显示“线性循环伏安法”的方法参数菜单:导数(0~2)0量程(10e nA,e=1~4) 4扫描次数(1~8) 4扫描速率(50~1000mV/s)50起始电位(-4000~4000mV)-100终止电位(-4000~4000mV)600静止时间(0~999s)0如果显示的参数不符合,请按提示修改。
(3)测量铁氰化钾试液在教师指导下,置电极系统于10mL小烧杯的铁氰化钾试液里。
按【运行】键,运行自动完成后,“波高基准”项闪烁,用∧∨键确定“前谷”方法处理图谱,按【YES】键。
请记录波峰电位和波峰电流数据。
按两次【退回】键,再按【方法】键,选取“使用当前方法”项,按【YES】键,显示“线性循环伏安法”的方法参数菜单。
修改扫描速率为100mV,按【ENT】键。
再按【运行】键,照上述的过程一样进行测量。
直至完成扫描速率为50、100、150、200、250mV/s的测量。
上述的循环伏安图打印样本见附图。
五、结果处理见《仪器分析实验》p127五的1、3、5题。
六、问题讨论见《仪器分析实验》p128六的2题。
循环伏安法测定铁氰化钾实验讲义

[实验目的]1) 学习固体电极表面的处理方法。
2) 掌握循环伏安仪的使用技术。
3) 了解扫描速率和浓度对循环伏安图的影响。
[实验原理]铁氰化钾离子-亚铁氰化钾离子:])([])([6463CN Fe K CN Fe K ⇔氧化还原电对的标准电极电位:V 36.00=ϕ峰电流方程: 循环伏安法产生氧化电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol.L -1 NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s -1;电子转移速率大,为可逆体系(1.0 mol.L -1 NaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2 cm ·s -1)。
[注意事项和问题]1.实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
3. 若实验中测得的条件电极电位和与文献值有差异,说明其原因。
53/21/21/2p 2.6910i n ACD v =⨯i —E 曲线[实验步骤]1. 指示电极的预处理铂电极用Al 2O 3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水超声清洗3min.。
2.配制溶液配制2⨯10-2、2⨯10-3 、8⨯10-4、2⨯10-4 mol ·L -1的K 3[Fe(CN)6]溶液。
3. 不同扫描速率K 3[Fe(CN)6]溶液的循环伏安图先对10-3mol·L -1K 3 [Fe(CN)6]溶液(含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )以20mV/s 在+0.8至-0.2V 电位范围内扫描循环伏安图。
再对上述溶液以10、40、60、80、100、200mV/s ,在+0.8至-0.2V 电位范围内扫描,分别记录循环伏安图。
4. 不同浓度K 3[Fe(CN)6]溶液的循环伏安图在10-4、4⨯10-4、10-2 mol·L -1 K 3[Fe(CN)6]溶液(均含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )中,以20mV/s ,在-0.2至+0.8V 电位范围内扫描,分别记录循环伏安图。
铁氰化钾溶液的循环伏安法研究

铁氰化钾溶液的循环伏安法研究铁氰化钾溶液的循环伏安法研究1、实验⽬的(1)学习固体电极表⾯的处理⽅法。
(2)掌握循环伏安仪的使⽤技术。
(3)了解电位扫描速率和电活性物质浓度对循环伏安图的影响。
2、实验原理铁氰化钾离⼦[Fe(CN)6]3-/亚铁氰化钾离⼦[Fe(CN)6]4-氧化还原电对的电极反应为:电极电位与电极表⾯电活性物质浓度间的关系符合Nernst⽅程式。
在⼀定扫描速率下,从起始电位(+0.8 V)负向扫描到转折电位(-0.2 V)时,⼯作电极表⾯的[Fe(CN)6]3-被还原⽣成[Fe(CN)6]4-,产⽣还原电流;当反向扫描从转折电位(-0.2 V)变化到起始电位(+0.8 V)时,在⼯作电极表⾯⽣成的[Fe(CN)6]4-被氧化⽣成[Fe(CN)6]3-,产⽣氧化电流。
为了使溶液相传质过程只受扩散控制,应加⼊⽀持电解质并在溶液处于静⽌状态下进⾏电解。
25℃时,在0.10 mol/L KCl 溶液中K3[Fe(CN)6]的扩散系数约为6.3×10-6 cm2 s-1,标准电极反应速率常数约为5.2×10-2 cm s-1,电⼦转移速率⼤,为可逆体系。
3、仪器与试剂天津兰⼒科LK9805电化学分析仪;玻碳盘电极(Φ3 mm);铂辅助电极;饱和⽢汞电极;超声波清洗仪;电解池。
K3[Fe(CN)6]溶液:1.0 mmol/L(含0.10 mol/L KCl)。
KCl溶液:0.10 mol/L。
4、实验步骤1)玻碳盘⼯作电极的预处理:⽤Al2O3粉末(粒径0.05 µm)将电极表⾯抛光,然后在蒸馏⽔中超声波清洗,再⽤蒸馏⽔清洗,待⽤。
2)K3[Fe(CN)6]溶液的循环伏安图:(1)不同扫描速率下K3[Fe(CN)6]溶液的循环伏安图取1.0 mmol/L K3[Fe(CN)6]溶液20 mL置于电解池中,放⼊玻璃碳圆盘电极、饱和⽢汞电极及铂辅助电极(玻璃碳圆盘电极为⼯作电极,铂丝电极为辅助电极,饱和⽢汞电极为参⽐电极),设置起始电位为+0.8 V,终⽌电位为-0.2 V,扫描速率(v)分别为10、25、50、75、100、150、200、250、500 mV s-1,进⾏循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。
2_实验八铁氰化钾体系的循环伏安实验
实验八 铁氰化钾体系的循环伏安实验一、实验目的1.学习和掌握循环伏安法的原理和实验技术。
2. 了解可逆体系的循环伏安图的特性。
二、实验原理与技术循环伏安法(CV)是最重要的电分析化学研究方法之—。
在电化学、无机化学、有机化学、生物化学的研究领域中广泛应用。
由于它仪器简单、操作方便、图谱解析直观,常常是首先进行实验的方法。
CV 方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
这种方法也常称为三角波线性电位扫描方法。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以电流(纵坐标)对电位(横坐标)作图,所得的图形称为循环伏安图。
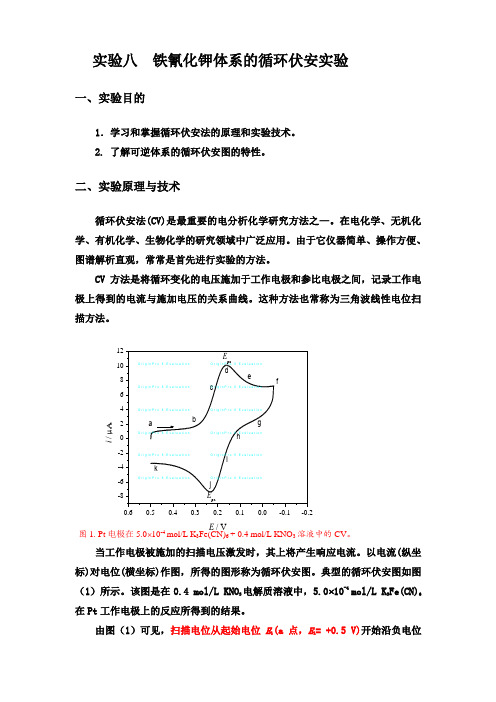
典型的循环伏安图如图(1)所示。
该图是在0.4 mol/L KNO 3电解质溶液中,5.0⨯10-4 mol/L K 3Fe(CN)6在Pt 工作电极上的反应所得到的结果。
由图(1)可见,扫描电位从起始电位E 1(a 点,E 1= +0.5 V)开始沿负电位i / μAE / V图1. Pt 电极在5.0⨯10-4 mol/L K 3Fe(CN)6 + 0.4 mol/L KNO 3溶液中的CV 。
的方向变化(如箭头所指方向),当电位至Fe(CN)63-可还原时,即析出电位,将产生阴极电流(b点)。
其电极反应为:Fe III(CN)63- + e-→ Fe II(CN)64-在析出电位后随着电位的变负,阴极电流迅速增加(b→d).直至电极表面的Fe(CN)63-浓度趋近零,电流在d点达到最高峰。
然后电流迅速衰减(d→g),这是因为电极表面附近溶液中的Fe(CN)63- 几乎全部电解转变为Fe(CN)64-而耗尽,即所谓的贫乏效应。
当电压扫描至-0.05V(f点)处,虽然已经转向开始阳极化扫描,但这时的电极电位仍相当的负,扩散至电极表面的Fe(CN)63-仍在不断还原,故仍呈现阴极电流,而不是阳极电流。
当电极电位继续正向变化至Fe(CN)64-的析出电位时,聚集在电极表面附近的还原产物Fe(CN)64-被氧化,其反应为:Fe II(CN)64- + e+ → Fe III(CN)63-这时产生阳极电流(i→k)。
循环伏安法测定铁氰化钾的电极反应过程

对实验结果进行了分析,探讨了铁氰化钾在电极上的氧化还原过程 和反应机理,为进一步研究铁氰化钾的电化学性质提供了基础。
展望
未来可以进一步优化实验条件,提高测定的灵敏度和准确性,为实际 应用提供更可靠的数据支持。
THANKS
感谢观看
电极材料选择
01
02
03
石墨电极
石墨电极具有高导电性和 化学稳定性,适用于多种 电化学反应。
铂电极
铂电极具有优良的导电性 和稳定性,适用于氧化还 原反应。
碳纤维电极
碳纤维电极具有高比表面 积和良好的电化学活性, 适用于电化学传感和催化 反应。
电极制备方法
物理涂布法
将活性物质涂布在电极基 底上,经过干燥和热处理 后得到电极。
循环伏安法
通过测量电极在多个扫描速率下的伏 安响应来分析电极的电化学行为,包 括氧化还原峰电位、峰电流等。
04
CATALOGUE
铁氰化钾的电极反应过程
铁氰化钾在电极上的氧化过程
铁氰化钾在电极上发生氧化反应,释放电子并生 成铁离子和氰根离子。
氧化峰电流随扫描速率的增加而增大,表明铁氰 化钾的氧化过程受扩散控制。
理信息。
02
CATALOGUE
铁氰化钾的性质
铁氰化钾的物理性质
外观
铁氰化钾是深红色晶体,易溶于水,在水溶液中呈现鲜艳的红色 。
密度
铁氰化钾的密度较大,大约为1.8g/cm³。
稳定性
铁氰化钾在常温下稳定,但在光照或加热条件下易分解。
铁氰化钾的化学性质
络合反应
铁氰化钾能与多种金属离子发生络合反应,形成稳定的配合 物。
氧化还原反应
铁氰化钾具有氧化还原性质,在不同的电位下可以发生氧化 或还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁氰化钾溶液的循环伏安法研究
1、实验目的
(1)学习固体电极表面的处理方法。
(2)掌握循环伏安仪的使用技术。
(3)了解电位扫描速率和电活性物质浓度对循环伏安图的影响。
2、实验原理
铁氰化钾离子[Fe(CN)6]3-/亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的电极反应为:
电极电位与电极表面电活性物质浓度间的关系符合Nernst方程式。
在一定扫描速率下,从起始电位(+0.8 V)负向扫描到转折电位(-0.2 V)时,工作电极表面的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流;当反向扫描从转折电位(-0.2 V)变化到起始电位(+0.8 V)时,在工作电极表面生成的[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流。
为了使溶液相传质过程只受扩散控制,应加入支持电解质并在溶液处于静止状态下进行电解。
25℃时,在0.10 mol/L KCl 溶液中K3[Fe(CN)6]的扩散系数约为6.3×10-6 cm2 s-1,标准电极反应速率常数约为5.2×10-2 cm s-1,电子转移速率大,为可逆体系。
3、仪器与试剂
天津兰力科LK9805电化学分析仪;玻碳盘电极(Φ3 mm);铂辅助电极;饱和甘汞电极;超声波清洗仪;电解池。
K3[Fe(CN)6]溶液:1.0 mmol/L(含0.10 mol/L KCl)。
KCl溶液:0.10 mol/L。
4、实验步骤
1)玻碳盘工作电极的预处理:
用Al2O3粉末(粒径0.05 μm)将电极表面抛光,然后在蒸馏水中超声波清洗,再用蒸馏水清洗,待用。
2)K3[Fe(CN)6]溶液的循环伏安图:
(1)不同扫描速率下K3[Fe(CN)6]溶液的循环伏安图
取1.0 mmol/L K3[Fe(CN)6]溶液20 mL置于电解池中,放入玻璃碳圆盘电极、饱和甘汞电极及铂辅助电极(玻璃碳圆盘电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极),设置起始电位为+0.8 V,终止电位为-0.2 V,扫描速率(v)分别为10、25、50、75、100、150、200、250、500 mV s-1,进行循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。
(2)不同浓度K3[Fe(CN)6]溶液的循环伏安图
将0.10 mol/L KCl溶液和1.0 mmol/L K3[Fe(CN)6]溶液按照一定体积比例配制成20 mL混合溶液,体积比分别为2:18;5:15,10:10;15:5;18:2。
放入玻璃碳圆盘电极、饱和甘汞电极及铂辅助电极(玻璃碳圆盘电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极),设置起始电位为+0.8 V,终止电位为-0.2 V,进行循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。
5、数据处理
(1)从K3[Fe(CN)6]溶液的循环伏安图,测量i pa、i pc、E Pa、E Pc值。
(2)分别以i pa和i pc对K3[Fe(CN)6]溶液浓度作图,说明峰电流与浓度的关系。
(3)分别以i pa和i pc对v1/2作图,说明峰电流与扫描速率间的关系。
(4)计算i pa/i pc值以及ΔE P,说明K3[Fe(CN)6]在KCl溶液中的电极过程的可逆性。
6、思考题
1. K3[Fe(CN)6与K4[Fe(CN)6溶液的循环伏安图是否相同?为什么?
2. 请简要阐述循环伏安法的原理和作用。
