氧化锌
氧化锌

检查
碱度 取本品1.0g,加新沸的热水10mL,振摇5分钟,放冷,滤过,滤液加酚酞指示液2滴,如显粉红色,加盐酸 滴定液(0.1mol/L)0.10mL,粉红色应消失。 硫酸盐 取本品1.0g,加稀盐酸适量使溶解,依法检查(通则0802),与标准硫酸钾溶液0.5mL制成的对照液比较, 不得更深(0.005%)。 碳酸盐与酸中不溶物 取本品2.0g,加水10mL混合后,加稀硫酸30mL,置水浴上加热,不得发生气泡,搅拌后,溶液应澄清。 炽灼失重 取本品约1.0g,精密称定,在800℃炽灼至恒重,减失重量不得过1.0%。 铁盐 取本品0.40g,加稀盐酸8mL、水15mL与硝酸2滴,煮沸5分钟使溶解,放冷,加水适量使成50mL,混匀后, 取出
应用领域
应用领域
1、在橡胶或电缆工业工业中用作天然橡胶、合成橡胶及乳胶的硫化活性剂、补强剂及着色剂,以使橡胶具 有良好的耐腐蚀性,抗撕裂性和弹性。白色胶的着色剂和填充剂,在氯丁橡胶中用作硫化剂,颗粒细小者(粒径 0.1μm左右)可用作聚烯烃或聚氯乙烯等塑料的光稳定剂。
2、有机合成催化剂、脱硫剂, 3、在化肥工业中对原料气作精脱硫用,用于合成氨、石油、天然气化工原料气的脱硫,甲醇和制氢等工业 原料气、油的深度脱硫净化过程, 4、用作分析试剂、基准试剂、荧光剂和光敏材料的基质 5、用于静电湿法复印、干法转印、激光传真通讯、电子计算机的静电记录及静电制版档 6、用于塑料行业、防晒化妆品系列产品、特殊陶瓷制品、特种功能涂料以及纺织卫生加工等 7、制药,用作收敛药,用于制软膏、锌糊、橡皮膏 8、用作白色颜料,着色力不及二氧化钛及立德粉。用于ABS树脂、聚苯乙烯、环氧树脂、酚醛树脂、氨基树 脂和聚氯乙烯及油漆和油墨的着色。用于颜料锌铬黄、醋酸锌、碳酸锌、氯化锌等的制造。
氧化锌制备

氧化锌制备
氧化锌可以通过不同的方法进行制备,常见的方法有以下几种:
1. 煅烧法:将锌粉或锌矿石在空气中进行高温煅烧,使其氧化生成氧化锌。
这种方法适合大规模工业生产。
2. 水热法:将锌离子与氢氧化钠或氢氧化铵等氢氧化物进行反应,生成氢氧化锌沉淀。
然后将氢氧化锌沉淀在高温和高压的条件下经过一定时间处理,得到氧化锌。
3. 溶胶-凝胶法:通过将适当的锌盐与氨水或其他碱性溶液反
应生成氢氧化锌溶胶,然后经过适当的处理得到氧化锌胶体。
最后将氧化锌胶体进行干燥和煅烧,得到氧化锌粉末。
4. 溶液法:将适当的锌盐溶解在水或其他溶剂中,加入适量的碱性溶液,使得pH值升高。
在适当的条件下,锌盐会与碱性
溶液中的氢氧化物反应生成氢氧化锌沉淀。
然后将氢氧化锌沉淀进行过滤、洗涤、干燥和煅烧,最终得到氧化锌粉末。
需要注意的是,不同的制备方法所得到的氧化锌粉末的颗粒大小、形貌以及性质可能会有所差异。
选取合适的制备方法可以根据具体的需求和应用。
氧化锌
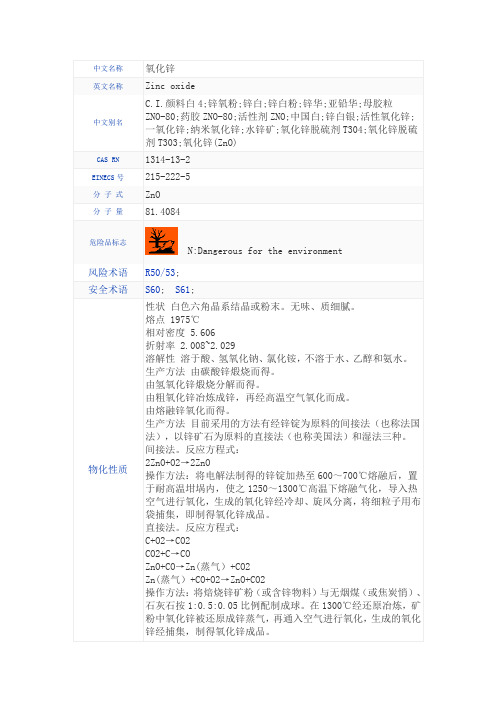
中文名称氧化锌英文名称Zinc oxide中文别名C.I.颜料白4;锌氧粉;锌白;锌白粉;锌华;亚铅华;母胶粒ZNO-80;药胶ZNO-80;活性剂ZNO;中国白;锌白银;活性氧化锌;一氧化锌;纳米氧化锌;水锌矿;氧化锌脱硫剂T304;氧化锌脱硫剂T303;氧化锌(ZnO)CAS RN 1314-13-2EINECS号215-222-5分子式ZnO分子量81.4084危险品标志N:Dangerous for the environment 风险术语R50/53;安全术语S60; S61;物化性质性状白色六角晶系结晶或粉末。
无味、质细腻。
熔点 1975℃相对密度 5.606折射率 2.008~2.029溶解性溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
生产方法由碳酸锌煅烧而得。
由氢氧化锌煅烧分解而得。
由粗氧化锌冶炼成锌,再经高温空气氧化而成。
由熔融锌氧化而得。
生产方法目前采用的方法有经锌锭为原料的间接法(也称法国法),以锌矿石为原料的直接法(也称美国法)和湿法三种。
间接法。
反应方程式:2ZnO+O2→2ZnO操作方法:将电解法制得的锌锭加热至600~700℃熔融后,置于耐高温坩埚内,使之1250~1300℃高温下熔融气化,导入热空气进行氧化,生成的氧化锌经冷却、旋风分离,将细粒子用布袋捕集,即制得氧化锌成品。
直接法。
反应方程式:C+O2→CO2CO2+C→COZnO+CO→Zn(蒸气)+CO2Zn(蒸气)+CO+O2→ZnO+CO2操作方法:将焙烧锌矿粉(或含锌物料)与无烟煤(或焦炭悄)、石灰石按1:0.5:0.05比例配制成球。
在1300℃经还原冶炼,矿粉中氧化锌被还原成锌蒸气,再通入空气进行氧化,生成的氧化锌经捕集,制得氧化锌成品。
湿法。
用锌灰与硫酸反应生成硫酸锌,再将其分别与碳酸钠和氨水反应,以制得的碳酸锌和氢氧化锌为原料制氧化锌。
反应方程式如下:Zn+H2SO4→ZnSO4+H2↑ZnSO4+Na2CO3→ZnCO3+Na2SO4ZnSO4+2NH3·H2O→Zn(OH)2+(NH4)2SO4以碳酸锌为原料,经水洗、干燥、煅烧、粉碎制得产品氧化锌。
氧化锌(Zinc oxide)基本资料

氧化锌(Zinc oxide)基本资料氧化锌(ZnO)是锌的一种氧化物,俗称锌白,英文名称是Zinc oxide。
中文别名有锌氧粉、锌白、锌白粉、锌华、亚铅华、锌白银、一氧化锌、水锌矿等等。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
氧化锌氧化锌生产厂家主要集中在辽宁(大连)、山东(潍坊)、河北(高邑、邢台)、江苏、浙江等地,生产的氧化锌以99.7%含量的为主,俗称997(99.7)氧化锌。
一、氧化锌物理化学性质1.1.基本信息密度:5.6沸点:2360ºC熔点:1975°C分子式:OZn分子量:81.408精确质量:79.924065PSA:17.07000外观性状:白色粉末折射率:2.008~2.0291.2.分子结构摩尔折射率:无可用的摩尔体积(cm3/mol):无可用的等张比容(90.2K):无可用的表面张力(dyne/cm):无可用的介电常数:无可用的极化率(10-24cm3):无可用的单一同位素质量:79.924061Da 标称质量:80Da平均质量:81.4084Da1.3.编号系统CAS号:1314-13-2MDL号:MFCD00011300 EINECS号:215-222-5 RTECS号:ZH4810000二、性质与稳定性2.1.如果遵照规格使用和储存则不会分解,未有已知危险反应,避免碱、碱金属2.2.受阳光照射发磷光,在阴极线和阳极线上,能发出绿色和紫色等光。
为两性氧化物,溶于稀酸、浓氢氧化碱溶液、氨水和铵盐溶液,不溶于水和醇。
2.3.工作人员应做好防护,应注意防尘通风。
空气中最高允许浓度0.5mg/m3。
溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
氧化锌和次氧化锌

氧化锌和次氧化锌一、氧化锌(ZnO)1. 物理性质外观:白色粉末或六角晶系结晶体。
熔点:1975℃。
密度:5.606g/cm³。
溶解性:难溶于水,可溶于酸和强碱。
例如,它能与盐酸反应生成氯化锌和水,化学方程式为:ZnO + 2HCl = ZnCl₂+ H₂O;与氢氧化钠反应生成偏锌酸钠和水,化学方程式为:ZnO+2NaOH = Na₂ZnO₂ + H₂O。
2. 化学性质氧化性:在高温下,氧化锌具有一定的氧化性。
例如,它可以与一氧化碳反应,将一氧化碳氧化为二氧化碳,自身被还原为锌,反应方程式为:ZnO+CO = Zn + CO₂(高温条件)。
酸碱性:氧化锌是一种两性氧化物,既能与酸反应表现出碱性,又能与碱反应表现出酸性。
3. 制备方法直接法:以锌精矿为原料,经高温氧化焙烧,使锌精矿中的硫化锌转变为氧化锌,反应方程式为:2ZnS+3O₂ = 2ZnO + 2SO₂(高温条件)。
间接法:将锌锭加热至1000℃以上,使其挥发形成锌蒸气,锌蒸气与空气中的氧气反应生成氧化锌,反应方程式为:2Zn+O₂ = 2ZnO。
湿法:用锌盐(如硫酸锌)溶液与碱(如氢氧化钠或氨水)反应生成氢氧化锌沉淀,然后将氢氧化锌加热分解得到氧化锌,以硫酸锌和氢氧化钠为例,反应方程式为:ZnSO₄+2NaOH = Zn(OH)₂↓+Na₂SO₄,Zn(OH)₂ = ZnO + H₂O(加热条件)。
4. 用途在橡胶工业中,氧化锌作为硫化活性剂使用,能提高橡胶的硫化效率,改善橡胶的物理性能,如硬度、耐磨性等。
在涂料工业中,可作为白色颜料,具有良好的遮盖力和着色力,同时还能提高涂料的耐候性和抗粉化性。
在电子工业中,氧化锌是一种重要的半导体材料,可用于制造压敏电阻、发光二极管(LED)等电子元件。
二、次氧化锌(ZnO·Zn(OH)₂)1. 物理性质外观:通常为淡黄色粉末。
密度:相对氧化锌有所不同,一般在4 5g/cm³左右。
氧化锌 表征-概述说明以及解释

氧化锌表征-概述说明以及解释1.引言1.1 概述概述氧化锌(Zinc Oxide,ZnO)是一种重要的无机化合物,由锌和氧两种元素构成。
它具有多种物理和化学性质,广泛用于各个领域。
本文将对氧化锌的表征进行详细介绍。
首先,我们将介绍氧化锌的物理性质。
氧化锌是一种白色粉末状固体,无味无臭。
其晶体结构属于六方晶系,具有高熔点和热稳定性。
此外,氧化锌具有优异的电学性能,是一种半导体材料,具有特殊的光学和电学性质。
其次,我们将探讨氧化锌的化学性质。
氧化锌在常温下相对稳定,不溶于水和酸,但可溶于碱性溶液。
它具有良好的催化活性,可以催化多种有机反应,例如光催化和氧化反应。
此外,氧化锌还具有抗菌、抗氧化、光敏和防紫外线等特性,因此在医药、化妆品和防晒等领域得到广泛应用。
最后,我们将介绍氧化锌的应用领域。
氧化锌作为一种重要的功能材料,广泛应用于多个领域。
例如,在橡胶工业中,氧化锌可用作活性剂,起到促进橡胶硫化反应的作用。
在电子行业中,氧化锌可以制备成透明导电膜,用于平板显示器和太阳能电池等器件。
此外,氧化锌还可用于催化剂、染料、润滑剂和防腐剂等方面。
综上所述,本文将全面介绍氧化锌的物理性质、化学性质和应用领域。
通过对氧化锌的表征,我们可以深入了解这种材料的特性和潜在的应用价值。
接下来的正文将对氧化锌的各个方面进行详细探讨,希望通过本文的阐述能够增加对氧化锌的全面理解,并为未来的研究和应用提供参考。
1.2 文章结构文章结构本文主要围绕氧化锌的表征展开,文章分为引言、正文和结论三部分。
引言部分(Chapter 1)为文章的开篇,主要包括概述、文章结构和目的。
在概述(1.1)中,将简要介绍氧化锌的基本情况,包括其化学式、晶体结构等相关信息,以及氧化锌在实际应用中的重要性。
这一部分旨在引起读者对本文的兴趣,并为后续内容做好铺垫。
接下来是文章的文章结构(1.2)部分,本部分将详细介绍整篇文章的组织结构。
首先,将会介绍本文的大纲,即引言、正文和结论三个主要部分。
氧化锌的物理化学性质及用途

氧化锌的物理化学性质及用途氧化锌(ZnO),俗称锌白,是锌的一种氧化物。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中。
氧化锌的能带隙和激子束缚能较大,透明度高,有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
中文名称:氧化锌英文名称:Zinc oxide中文别名:C.I.颜料白4;氧化锌; 锌氧粉; 锌白; 锌白粉; 锌华; 亚铅华; 预分散ZnO-80; 母胶粒ZnO-80; 药胶ZnO-80; 活性剂ZnO; 环氧乙酰蓖麻油酸甲酯;中国白; 锌白银; 活性氧化锌;一氧化锌; 氧化锌掺杂银; 锌白银(色料名);纳米氧化锌; 水锌矿; 氧化锌脱硫剂T304; 氧化锌脱硫剂T303; 金属氧化物; ZnO英文别名:C.I. 77947; C.I. Pigment White 4; Zinc oxide [USAN]; zincoxideheavy; flowers of zinc; zinc white; zinc oxide,edible; active zinc oxide; zinkoxyd aktiv; zinci oxidum; activox; activox b; actox14; zine oxide; zine white; zincoxide; actox16; actox216; ai3-00277; akro-zincbar85; akro-zincbar90; amalox; azo22; azo-33; azo-55; azo-55tt; azo-66; azo-66tt[1]CAS编号:1314-13-2物理性质白色六方晶系结晶或粉末。
无味、质细腻。
溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
氧化锌 9类

氧化锌9类摘要:I.氧化锌简介A.氧化锌的基本性质B.氧化锌的分类II.氧化锌的9类应用领域A.电子工业1.半导体材料2.光电子器件B.涂料工业1.防腐涂料2.防晒涂料C.医药领域1.药物载体2.药用辅料D.陶瓷工业1.陶瓷釉料2.电子陶瓷E.橡胶工业1.轮胎制造2.橡胶补强剂F.化学工业1.催化剂2.吸附剂G.食品工业1.食品添加剂2.营养强化剂H.环保领域1.废水处理2.空气净化I.其他领域1.光学材料2.磁性材料正文:氧化锌(ZnO)是一种常见的无机化合物,具有良好的物理和化学性质。
作为一种重要的工业原料,氧化锌在众多领域都有广泛的应用。
本文将对氧化锌的9类应用领域进行详细介绍。
首先,氧化锌在电子工业中有着广泛的应用。
作为一种半导体材料,氧化锌在光电子器件、光电传感器等方面具有重要应用。
此外,氧化锌具有良好的压敏性能,可用于制作压敏电阻。
其次,氧化锌在涂料工业中具有重要地位。
由于其优异的耐候性和防腐性能,氧化锌被广泛用作防腐涂料和防晒涂料的主要成分。
在医药领域,氧化锌具有良好的生物相容性和药物释放性能,可用作药物载体和药用辅料。
在陶瓷工业中,氧化锌作为陶瓷釉料的主要成分,可以提高陶瓷制品的硬度和耐磨性。
同时,氧化锌还在电子陶瓷等领域有广泛应用。
在橡胶工业中,氧化锌被用作轮胎制造中的补强剂,可以提高轮胎的耐磨性和抗老化性能。
此外,氧化锌在化学工业中可用作催化剂和吸附剂,具有良好的催化活性和吸附性能。
在食品工业中,氧化锌作为食品添加剂和营养强化剂,被广泛应用于食品生产中。
同时,氧化锌在环保领域也有重要应用,可用于废水处理和空气净化等方面。
在其他领域,氧化锌还可用作光学材料和磁性材料。
其高折射率和良好的透明性使其成为一种理想的光学材料;而磁性氧化锌在磁性材料领域具有巨大的应用潜力。
综上所述,氧化锌在众多领域具有广泛的应用,其多种功能和优异性能使其成为一种不可或缺的工业原料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ZrO2粉体合成与表征一前言ZrO2属于新型陶瓷,由于它具有十分优异的物理、化学性能,不仅在科研领域已经成为研究热点,而且在工业生产中也得到了广泛的应用,是耐火材料、高温结构材料和电子材料的重要原料。
在各种金属氧化物陶瓷材料中,ZrO2的高温热稳定性能,热性能最好,最适宜傲陶瓷涂层和高温耐火制品,以ZrO2为主要原料的锆英石基陶瓷颜料,高级釉料的重要成分;ZrO2的热导率在常见的陶瓷材料中最低,而热膨胀系数又与金属材料较为接近,成为重要的结构陶瓷材料;特殊的晶体结构,使之成为重要的电子材料;ZrO2的相变增韧等特性,成为塑性陶瓷材料的宠儿;良好的机械性能和热物理性能,使它能够成为金属基复合材料中性能优异的增强相。
目前在各种金属氧化物陶瓷中ZrO2的重要作用仅次于Al2O3由于氧化锆材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性等等优良的物化性能,氧化锆已经在陶瓷、耐火材料、机械、电子、光学、航空航天、生物、化学等等各种领域获得广泛的应用。
二结构性质氧化锆是白色固体,含有杂质时会显现灰色或淡黄色,添加显色剂还可显示各种其它颜色。
纯氧化锆的分子量为123.22,理论密度是5.89g/cm3,熔点为2715℃。
通常含有少量的氧化铪,难以分离,但是对氧化锆的性能没有明显的影响。
氧化锆有三种晶体形态:单斜、四方、立方晶相。
常温下氧化锆只以单斜相出现,加热到1100℃左右转变为四方相,加热到更高温度会转化为立方相。
由于在单斜相向四方相转变的时候会产生较大的体积变化,冷却的时候又会向相反的方向发生较大的体积变化,容易造成产品的开裂,限制了纯氧化锆在高温领域的应用。
但是添加稳定剂以后,四方相可以在常温下稳定,因此在加热以后不会发生体积的突变,大大拓展了氧化锆的应用范围。
氧化锆(化学式:ZrO2)是锆的主要氧化物,通常状况下为白色无臭无味晶体,难溶于水、盐酸和稀硫酸。
一般常含有少量的二氧化铪。
化学性质不活泼,但高熔点、高电阻率、高折射率和低热膨胀系数的性质,使它成为重要的耐高温材料、陶瓷绝缘材料和陶瓷遮光剂。
能带间隙大约为5-7eV。
二氧化锆的晶体结构自然界中以少见的斜锆石存在,为单斜晶系结构。
高熔点的立方氧化锆也是二氧化锆晶型之一,自然界以等轴钙锆钛矿((Zr,Ti,Ca)O2)少量存在,但多为人工合成,用作钻石的替代品。
二氧化锆还有另外一种四方晶系晶型。
这三者之间的转变温度受杂质影响很大,因此很难确定,大致在1100°C(单斜↔四方)和1900°C(四方↔立方)。
图1-1 ZrO2的三种晶形及相应的空间群如图1-1所示,ZrO2共有三种晶型,在高温段(>2370℃)为立方相,在中温段(1200—2370℃)为四方相,在低温段(<950℃)为单斜相。
ZrO2的四方晶型相当于萤石结构沿着C轴伸长而变形的晶体结构,而单斜晶则为四方晶沿着β角偏转一个角度而成。
三种晶形ZrO2的晶格常数见表1-1[6]。
纯二氧化锆的单斜相从室温到ll70℃是稳定的,超过这一温度转变为四方相,然后在2570℃转变为立方相,直到2680℃发生熔化。
二氧化锆的这三种晶型:单斜、四方和立方,其密度分别为5.65g·cm-3.6.10g·cm-3.6.27g·cm-3。
可见在同样质量下,温度越低,体积越大。
纳米二氧化锆的特性二氧化锆具有熔点和沸点高、硬度大、常温下为绝缘体、而高温下则具有导电性等优良性质二氧化锆有3种晶型.属多晶相转化的氧化物稳定的低温相为单斜晶结构(m—ZrO2)。
高于1 000 ℃时四方晶相(t—ZrO2 )逐渐形成,直至2 370 ℃只存在四方晶相,高于2 370 ℃至熔点温度则为立方晶相(c—ZrO2 )ZrO2在加热升温过程中伴随着体积收缩,而在冷却过程中则体积膨胀,因此在使用时为使其不发生体积变化,必须进行晶型稳定化处理。
常用的稳定剂有Y 0j、CaO、MgO、CeO:和其它稀土氧化物这些氧化物的阳离子半径与Zr“相近(相差在1 2 以内),它们在ZrO2中的溶解度很大.可以和ZrO2形成单斜、四方和立方等晶型的置换型固溶体。
这种固溶体可以通过快冷避免共析分解,以亚稳态保持到室温。
二氧化锆的化学性质很稳定,经煅烧后的二氧化锆性质尤其不活泼。
它可以被热浓盐酸、硫酸、氢氟酸和硝酸所侵蚀,高温下与氢氧化物、氧化物和碳酸盐共熔可生成锆酸盐,在酸中的溶解度与ZrO2的煅烧温度有关,煅烧温度愈高,溶解度则越低,见表1-2[7]。
高温煅烧过的ZrO2在浓硫酸中不易溶解,仅溶于氢氟酸。
ZrO2容易与碱和碳酸盐熔烧,形成锆酸盐。
也能与卤素化合,如在有碳存在下与氯作用生成ZrCl4。
表1-2 ZrO2的煅烧温度与酸溶解关系Table 1-2 The relationship on temperature of calcination and solubility in acid①表中的数字为50ml溶液溶解ZrO2的克数。
二氧化锆实质上是高分子的混合金属氧化物。
二氧化锆与碳和氯气高温反应,或者与四氯化碳反应,生成四氯化锆及二氯氧化锆,水解又得到二氧化锆。
它在电弧中与碳作用生成碳化锆。
三制备方法制备ZrO2纳米陶瓷粉体的方法有很多,大致分为固相法、气相法、液相法,也有的是这几种方法的综合,还有一种利用机械能的高能球磨法。
每一类方法又包括几种具体的方法。
在制备不同的陶瓷粉体时,同样的方法所需要的条件也可能不同。
由于液相法制备纳米粉体所需要的设备比较容易得到,因此在实验室中多采用液相法来制备纳米粉体。
在制备纳米粉体时,也多采用液相法。
长期以来,人们采用了许多方法来制备ZrO2纳米粉体。
3.1共沉淀法【1】共沉淀法是在羟基氯化锆等水溶性锆盐与稳定剂盐的混合水溶液中加入氨水等碱性物质,以获得两者的氢氧化物共沉淀的方法。
将沉淀物干燥后一般得到非晶态氢氧化物,经煅烧而制成ZrO2粉,其工艺流程如图1所示。
该方法工艺简单,所得粉体性能优良,但在洗涤后的沉淀物中,保留少量残余物(NH4Cl)对煅烧粉末的性能有不良影响。
另外,该法在反应过程中会产生团聚,所制备粉末分散性能较差,直接影响到陶瓷的性能。
为避免粉末的团聚,在粉末的制备过程中,可适当加入分散剂、表面活性剂或助表面活性剂,来分散和制粉末的分散性和粒径。
3.2水热法【2】水热法的实质是把前驱物置于高温高压的水热介质中进行化学反应,实现原子、分子级的微粒成核和晶体生长,最终形成具有一定粒度和结晶形态的晶粒的过程。
无论是从热力学与动力学观点或者是从工艺技术考虑,水热法都有着明显的优势。
例如:固体试样的大范围稳定性、动力学快速结晶;低温一步水热工艺、晶粒大小的可控制性、多功能性、环保技术等等。
国外水热法制备ZrO2已经实现工业生产,但由于该法需要特殊的高压釜设备,该设备易被腐蚀,且后处理设备复杂,目前在我国尚未实现工业化大生产。
3.3溶胶一凝胶法【3】溶胶一胶法是指金属的有机或无机化合物经过溶解、水解、沉淀、胶化、凝胶而固化成水合氧化锆,然后经脱水,干燥及煅烧来制得纳米ZrO2粉末。
这种无机胶化的溶胶—凝胶法的特点可概括为以下3点:①反应的速度很快,生成物几乎全为次粒子,团聚很少;②粒子的大小和形状均一;③化学纯度和相结构的单一性好。
四表征TEM是指简称透射电镜,是把经加速和聚集的电子束投射到非常薄的样品上,电子与样品中的原子碰撞而改变方向,从而产生立体角散射。
散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像。
通常,透射电子显微镜的分辨率为0.1~0.2nm,放大倍数为几万~百万倍,用于观察超微结构。
光学显微镜下无法看清的结构,又称“亚显微结构”。
XRD是X-ray diffraction 的缩写,X射线衍射,通过对材料进行X射线衍射,分析其衍射图谱,获得材料的成分、材料内部原子或分子的结构或形态等信息的研究手段。
显微镜ZrO2(3Y)粉体的XRD图谱见图1。
由图可见粉体基本为四方相,此外有少量的单斜相。
图2为粉体的TEM照片,由照片可见粉体颗粒为30纳米时,分散性最好。
五总结和展望对于ZrO2陶瓷粉体性能研究来说,今后研究的重点仍是寻求行之有效的适合工业化大生产的高质量ZrO2粉体制备方法,也就是说,特种粉体性能与其制备方法紧密相关,要制备出粒度更细、分布更窄、更均匀、分散性更好、表面性能更优越的粉体,就要首先研究新的制备原理,制备方法及制备设备,从而使粉体制造工艺流程短,生产能力大,能耗低,经济合理适于工业化。
随着人们对ZrO2的不断认识,以及对纳米材料的更深入的了解,纳米ZrO2的制备方法将得到更大的发展。
根据不同的用途而采用不同的制备方法,将成为现实,使纳米ZrO2的性质得到更大的发挥。
六实验方案6.1实验原料试剂与仪器磁力加热搅拌器,自制以阴离子交换膜隔膜的两室电解槽,梅特勒一托利多仪,马福炉,直流稳压电源红外线快速干燥器,离心机,两块网状扩张性钌钛电极,碘化钾淀粉试纸。
硝酸氧锆(ZrO(NO3)2)硝酸钠,氢氧化钠,无水乙醇均为分析纯,去离子水。
6.2实验方法(1)取0.1mol/L硝酸氧锆50mL加入0.5mo/L硝酸钠置于电解槽的阴极室,同时将一定量的05mol/L硝酸钠溶液置于阳极室(用浓氢氧化钠溶液始终控制阳极室pH>7)。
(2)在室温下,通入直流电,控制阴极电流密度为100A/m2,阳极室有氧气释放,阴极室强烈磁搅拌下,在在不断电解水消耗H释放OH一。
开始时阴极室电解液的pH值为2.1上升到4.0左右白色乳浊液生成,PH值不断上升时有大量的白色乳浊液析出,当pH值达到12.0左右,停止反应。
(3)先用去离子水反复洗涤白色乳浊液,同时使滤液酸化,碘化钾淀粉试纸检验无NO3-,NO2-为止.后用无水乙醇洗涤三次,沉淀物置于温度为9℃的红外线快速干燥器内干燥2h。
得到ZrO2·XH2O(前躯体)。
(4)按3℃/min升温速率加热到不同焙烧温度保温2h后随炉冷却,可得到粒径和晶型不同的ZrO2粉体。
7.实验方案依据共沉淀法该法在洗涤后的沉淀物中,保留少量残余物(NH4Cl)对煅烧粉末的性能有不良影响。
另外,在反应过程中会产生团聚,所制备粉末分散性能较差,直接影响到陶瓷的性能;机械研磨法在细磨过程中介质容易对原料污染;用湿化学方法制备ZrO2超细粉末,一般纯度不会太高,杂质主要来源于两个方面:反应原料和制备工艺。
为了获得高纯度的超细粉末,要在低浓度环境下为需使用高纯锆盐原料,用小剂量高效表面活性剂等。
电解法以其流程短、成本低、工艺简单、量高、纯度高产等优点在工业上广泛应用。
在以阴离子交换膜将电解槽分为两室中,进行电解,阴极表面形成类似均匀释放OH~的硬模板,成了均匀沉淀反应,制备出粒径均匀、分散性好的纳米粉体。
