氧化还原PPT课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应ppt课件

0
+5
+6
+4
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+
得1e-
第四步、用质量守恒法配平其他物质
H2O
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+ H2O2
第五步、检查质量,电荷,电子是否守恒
新/课/授/课
标变价 列得失 求总数 配系数 查守恒
标出有变价的元素的化合价 列出变价元素的得失电子情况 用最小公倍数配平使得得失电子数相等 用质量守恒法配平其他物质 检查质量,电荷,电子是否守恒
。
变式2
例/题/详/解
下列有关金属元素特征的叙述正确的是( ) A.金属元素的原子只有还原性,其阳离子只有氧化性 B.金属元素的单质在常温下都为固体 C.含金属元素的离子都是阳离子 D.金属阳离子被还原不一定得到金属单质
新/课/授/课
氧化性、还原性强弱的比较方法
氧化性强弱: 氧化剂 氧化产物 还原性强弱: 还原剂 还原产物
变式1
例/题/详/解
变式2
例/题/详/解
下 课见 中 学 次 BYE
下列微粒中,只有氧化性的是(
①S²- ②Fe2+ ③Fe3+ ④S
A.①②
B.②④
D.②④⑤⑥
) ⑤H+ ⑥Na+ ⑦Mg C.③⑤⑥
变式1
例/题/详/解
写出下列微粒在反应中表现出的性质。
S2-、Fe2+ 、H+、Cu、HCl、H2O
只能作氧化剂的是
。
只能做还原剂的是
。
既能作氧化剂又能做还原剂的是
氧化 还原 2
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
人教版化学必修一氧化还原反应ppt33张课件
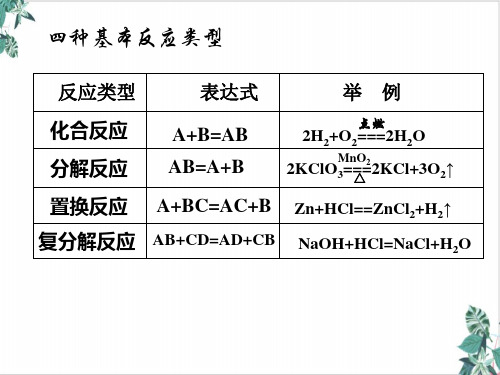
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

失2C氧u物O质+ CC高=u温O2C、u +Fe2COO32
Fe2O3 +还3 C原O反=高应温2Fe + 3 CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
2CuO + C 高==温= 2Cu + CO2↑ 失去氧,被还原,发生还原反应
CuO 还原反应 Cu O
Fe2O3 + 3CO ==高=温 2Fe + 3CO2
练习:以上面的双线桥表示形式为例,对下面的反应进
行双线桥分析: (1)Zn + 2HCl = ZnCl2 + H2↑
失去1x2e-,化合价升高,被氧化,发生氧化反应
0 +1
Zn + 2HCl
+2
0
= ZnCl2 + H2↑
得到2×1e-,化合价降低,被还原, 发生还原反应
典例 〔变式训练 2〕根据下列两个氧化还原反应回答问题: ①2KClO3=M=△n=O==2 2KCl+3O2↑ ②MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O
NaCl+H2SO4==Na2SO4+2HCl
人教版必修第一册
网第一章 物质及其变化
科
第三节 氧化还原反应 1.3.1 氧化还原反应
学
钢铁会生锈
食物会腐败
都因为发生了氧化还原反应
补充维生素为何能延缓皮肤老化?
1.从得失氧角度认识氧化还原反应
物质
反应物
发生的反应(氧化反应或还氧反应) 已学知识
(1得)氧请物根质据初中C学、过的CO氧化反应和还氧反应的知识氧,分化析反以应下反应,完成下表。
根据是否有 化合价变化
氧化还原反应 非氧化还原反应
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
氧化还原反应ppt课件

有单质参加或生成的反应不一定是氧化还原反应。
②有单质参加的化合反应一定是氧化还原反应。 √
③有单质生成的分解反应一定是氧化还原反应。
√
知能通练
3.实验室常利用下列反应制取少量N2: NaNO2+NH4Cl === NaCl+N2↑+2H2O。下列关于该反应的说
法不正确的是( B ) A.该反应是氧化还原反应 B.NaNO2发生氧化反应,NH4Cl发生还原反应 C.被还原的物质是NaNO2,被氧化的物质是NH4Cl D.被氧化和被还原的元素是同一种元素
知能通练
4. ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 === 2ClO2↑+K2SO4+2CO2↑+2H2O。下
列关于此反应的说法正确的是( A ) A.KClO3中部分元素的化合价降低,得到电子 B.H2SO4中部分元素的化合价降低 C.H2C2O4发生还原反应 D.H2C2O4既发生氧化反应又发生还原反应
否
Fe+2HCl === FeCl2 + H2↑
置换反应
是
Fe+CuSO4 === FeSO4 + Cu
置换反应
是
知识梳理 4.氧化还原反应与四大反应类型的关系
置换
复分解
知能通练 3.判断下列说法是否正确:
①有单质参加或生成的反应一定是氧化还原反应。 ×
放电
同素形体之间的转化不是氧化还原反应
3O2 === 2O3
知能通练
5. 下列反应既是置换反应又是氧化还原反应的是( A ) A.2F2+2H2O===4HF+O2 B.Cl2+H2O⥫⥬HCl+HClO C.3NO2+H2O===2HNO3+NO D.2Na2O2+2H2O===4NaOH +O2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2C2 lO C2 l2O 2 C2 lH2O HC H l ClO
1
2
3
达标排放
4
5
6
7
图 13-4 工 艺 流 程 图
1----硫 酸 铜 加 液 槽 ; 2----石 灰 乳 加 液 槽 ; 3----过 氧 化 氢 加 液 槽 ;
4----中 和 槽 ; 5----反 应 槽 ; 6----排 液 槽 ; 7----泵
11
空气氧化处理含硫废水氧化装置
12
第十三章 氧化还原
13.2.3二氧化氯氧化法
1.二氧化氯的主要物理化学性质 二氧化氯是一种黄绿色气体,具有与氯相似的刺激性气味,
沸点11℃,凝固点-59℃,极不稳定,在空气中浓度为10%时 就有可能爆炸。二氧化氯易溶于水,溶解度约为氯的5倍,在 室温4kPa分压下溶解度为2.9g/L。
C2 l O H 2O HC 3H lO Cl
4.臭氧氧化工艺的应用
臭氧可以用来对汽车制造厂综合废水(一级处理后的出水)进行
深度处理,且处理效果明显;臭氧对印染废水的CODCr值去除率 不高,而对色度的去除效果显著,与传统的氯气氧化、吸附、混
凝等脱色方法相比,用臭氧脱色有着脱色程度高、无二次污染等
优点。
8
第十三章 氧化还原
13.2.2过氧化氢氧化法
第ቤተ መጻሕፍቲ ባይዱ三章 氧化还原
13.1氧化剂 13.2高级氧化 13.3高锰酸钾及其复合盐的氧化 13.4其它氧化方法
1
第十三章 氧化还原
13.1氧化剂
氧化剂是一种能氧化其他物质而本身被还原的物质。 非金属单质氧化剂:如F2、O2、Cl2、Br2、I2、N2、S等; 金属的阳离子氧化剂:如Fe3+、Ag+、Cu2+等; 弱氧化性酸:如盐酸、稀硫酸等; 强氧化性酸:如浓H2SO4、浓HNO3、稀HNO3、HClO、 KMnO4、K2Cr2O7、KNO3、Na2O2、MnO2等。 既可做氧化剂又可做还原剂:例如,Na2O2、H2O2、S、SO2 等,但它们以一种性质为主,Na2O2、H2O2、S主要做氧化 剂;Fe2+、SO2主要做还原剂。
3M2n 2O33Mn2O
3M2n4O33Mn 4O
C N O 3 CN O 2
3CN O33CNO
5
臭氧消毒系统
6
第十三章 氧化还原
C N O O H H 2 O C3 2 O N3H
N3 H 3 O 3 2 N3 O 3 H 2O
C N 2 O H H 2 O C 2 O N 4 H
4
第十三章 氧化还原
2.臭氧的制备 生产臭氧的方法大致有:无声放电法、放射法、紫外线法,等离 子射流法和电解法等。 工业上最常见的是无声放电法。
3.臭氧氧化在水处理中的应用 1). 氧化无机物 臭氧能将水中的二价铁、锰氧化成三价铁及高价锰,使溶解性的 铁、锰变成固态物质,以便通过沉淀和过滤除去。
2 F2 eO 33 H 2O 2 F(O e)3H
1.过氧化氢的主要物理化学特性 纯过氧化氢是淡蓝色粘稠液体,熔点-0.43℃,沸点150.2℃。
在0℃时液体的密度是1.4649g/min,它的物理性质和水相似,它有 较高的介电常数。所以,不论纯过氧化氢或是它的水溶液都是一些 盐的离子化溶剂。过氧化氢可以任何比例与水混溶,过氧化氢也溶 解在包括醇、醚、酯等有机溶剂中。
3 N 4 H 5 O 3 3 N 3 O 6 H 2 O
2). 氧化有机物 臭氧能够氧化许多有机物,如蛋白质、氨基酸、有机胺、链型 不饱和化合物、芳香族、木质素、腐殖质等,目前在水处理中, 采用CODCr和BOD5作为测定这些有机物的指标,臭氧在氧化这 些有机物的过程中,将生成一系列中间产物,这些中间产物的 CODCr和BOD5值有的比原反应物更高。
2.过氧化氢的制备 从1945年起,利用有机物的自动氧化过程,使氧气还原成
过氧化氢。在工业生产上有两种方法:异丙醇法和蒽醌法。
C 3 2 C H O H 2 C 3 C H 3 O H 2 O C 2 H
9
第十三章 氧化还原
3.过氧化氢在水处理中的应用 1).Fenton试剂
Fenton试剂是亚铁离子和过氧化氢的组合,该试剂作为强氧 化剂的应用已具有一百多年的历史,在精细化工、医药化工、医 药卫生、环境污染治理等方面得到广泛的应用。
F2 e H 2 O 2 F3 e O H OH F2 eO H F3 e OH
F3 e H 2 O 2 F2 e H 2 O H
F3e OH F(O e )3 H (胶)体
2).过氧化氢单独氧化
①产品稳定,储存时每年活性氧的损失低于1%;
②安全,没有腐蚀性,能较容易地处理液体;
7
第十三章 氧化还原
3). 消毒 臭氧是非常有效的消毒剂。各种常用消毒剂的效果按以下顺序排 列:
O3>ClO2>HOCl>OCl->NHCl2>NH2Cl 臭氧杀菌效果好、速度快,而且对消灭病毒也很有效。臭氧消毒 的效果主要决定于接触设备出口处的剩余量和接触时间,其受pH 值、水温及水中氨量的影响较小。但也有一定的选择性,如绿霉 菌、青霉菌之类对臭氧具有抗药性,需较长时间才能杀死它们。
但一般臭氧化空气中臭氧浓度不超过10%,因此不会发生爆炸。臭氧
在水中的分解速度比在空气中快得多,所以臭氧不易储存,需边产边用。
3
第十三章 氧化还原
臭氧浓度/(mg/L)
2.8 2.4
2 1.6 1.2 0.8 0.4
0
0
20 40 60 80 100 时间/min
图13-2 臭氧在蒸馏水中的分解速率
③与水完全混溶,避免了溶解度的限制或排出泵产生气栓;
④无二次污染,能满足环保排放要求;
⑤氧化选择性高,特别是在适当条件下选择性更高。
10
第十三章 氧化还原
4.过氧化氢氧化工艺的工业应用 1).淀粉厂废水处理
F e n to n 试 剂
石灰
废水
氧化池
絮凝池
砂滤池
图 13-3 工 业 化 流 程 图
2).含氰废水的处理
2
第十三章 氧化还原
13.2高级氧化
13.2.1臭氧氧化法
1.臭氧的主要物理化学特性 臭氧的相对密度为氧的1.5倍,在水中的溶解度比氧气大10倍,比空 气大25倍。 臭氧在空气中会慢慢地连续自行分解成氧气,其反应式为
O3 23O2 14.45kJ
(13-1)
由于分解时放出大量热量,故当其浓度在25%以上时,很容易爆炸。
1
2
3
达标排放
4
5
6
7
图 13-4 工 艺 流 程 图
1----硫 酸 铜 加 液 槽 ; 2----石 灰 乳 加 液 槽 ; 3----过 氧 化 氢 加 液 槽 ;
4----中 和 槽 ; 5----反 应 槽 ; 6----排 液 槽 ; 7----泵
11
空气氧化处理含硫废水氧化装置
12
第十三章 氧化还原
13.2.3二氧化氯氧化法
1.二氧化氯的主要物理化学性质 二氧化氯是一种黄绿色气体,具有与氯相似的刺激性气味,
沸点11℃,凝固点-59℃,极不稳定,在空气中浓度为10%时 就有可能爆炸。二氧化氯易溶于水,溶解度约为氯的5倍,在 室温4kPa分压下溶解度为2.9g/L。
C2 l O H 2O HC 3H lO Cl
4.臭氧氧化工艺的应用
臭氧可以用来对汽车制造厂综合废水(一级处理后的出水)进行
深度处理,且处理效果明显;臭氧对印染废水的CODCr值去除率 不高,而对色度的去除效果显著,与传统的氯气氧化、吸附、混
凝等脱色方法相比,用臭氧脱色有着脱色程度高、无二次污染等
优点。
8
第十三章 氧化还原
13.2.2过氧化氢氧化法
第ቤተ መጻሕፍቲ ባይዱ三章 氧化还原
13.1氧化剂 13.2高级氧化 13.3高锰酸钾及其复合盐的氧化 13.4其它氧化方法
1
第十三章 氧化还原
13.1氧化剂
氧化剂是一种能氧化其他物质而本身被还原的物质。 非金属单质氧化剂:如F2、O2、Cl2、Br2、I2、N2、S等; 金属的阳离子氧化剂:如Fe3+、Ag+、Cu2+等; 弱氧化性酸:如盐酸、稀硫酸等; 强氧化性酸:如浓H2SO4、浓HNO3、稀HNO3、HClO、 KMnO4、K2Cr2O7、KNO3、Na2O2、MnO2等。 既可做氧化剂又可做还原剂:例如,Na2O2、H2O2、S、SO2 等,但它们以一种性质为主,Na2O2、H2O2、S主要做氧化 剂;Fe2+、SO2主要做还原剂。
3M2n 2O33Mn2O
3M2n4O33Mn 4O
C N O 3 CN O 2
3CN O33CNO
5
臭氧消毒系统
6
第十三章 氧化还原
C N O O H H 2 O C3 2 O N3H
N3 H 3 O 3 2 N3 O 3 H 2O
C N 2 O H H 2 O C 2 O N 4 H
4
第十三章 氧化还原
2.臭氧的制备 生产臭氧的方法大致有:无声放电法、放射法、紫外线法,等离 子射流法和电解法等。 工业上最常见的是无声放电法。
3.臭氧氧化在水处理中的应用 1). 氧化无机物 臭氧能将水中的二价铁、锰氧化成三价铁及高价锰,使溶解性的 铁、锰变成固态物质,以便通过沉淀和过滤除去。
2 F2 eO 33 H 2O 2 F(O e)3H
1.过氧化氢的主要物理化学特性 纯过氧化氢是淡蓝色粘稠液体,熔点-0.43℃,沸点150.2℃。
在0℃时液体的密度是1.4649g/min,它的物理性质和水相似,它有 较高的介电常数。所以,不论纯过氧化氢或是它的水溶液都是一些 盐的离子化溶剂。过氧化氢可以任何比例与水混溶,过氧化氢也溶 解在包括醇、醚、酯等有机溶剂中。
3 N 4 H 5 O 3 3 N 3 O 6 H 2 O
2). 氧化有机物 臭氧能够氧化许多有机物,如蛋白质、氨基酸、有机胺、链型 不饱和化合物、芳香族、木质素、腐殖质等,目前在水处理中, 采用CODCr和BOD5作为测定这些有机物的指标,臭氧在氧化这 些有机物的过程中,将生成一系列中间产物,这些中间产物的 CODCr和BOD5值有的比原反应物更高。
2.过氧化氢的制备 从1945年起,利用有机物的自动氧化过程,使氧气还原成
过氧化氢。在工业生产上有两种方法:异丙醇法和蒽醌法。
C 3 2 C H O H 2 C 3 C H 3 O H 2 O C 2 H
9
第十三章 氧化还原
3.过氧化氢在水处理中的应用 1).Fenton试剂
Fenton试剂是亚铁离子和过氧化氢的组合,该试剂作为强氧 化剂的应用已具有一百多年的历史,在精细化工、医药化工、医 药卫生、环境污染治理等方面得到广泛的应用。
F2 e H 2 O 2 F3 e O H OH F2 eO H F3 e OH
F3 e H 2 O 2 F2 e H 2 O H
F3e OH F(O e )3 H (胶)体
2).过氧化氢单独氧化
①产品稳定,储存时每年活性氧的损失低于1%;
②安全,没有腐蚀性,能较容易地处理液体;
7
第十三章 氧化还原
3). 消毒 臭氧是非常有效的消毒剂。各种常用消毒剂的效果按以下顺序排 列:
O3>ClO2>HOCl>OCl->NHCl2>NH2Cl 臭氧杀菌效果好、速度快,而且对消灭病毒也很有效。臭氧消毒 的效果主要决定于接触设备出口处的剩余量和接触时间,其受pH 值、水温及水中氨量的影响较小。但也有一定的选择性,如绿霉 菌、青霉菌之类对臭氧具有抗药性,需较长时间才能杀死它们。
但一般臭氧化空气中臭氧浓度不超过10%,因此不会发生爆炸。臭氧
在水中的分解速度比在空气中快得多,所以臭氧不易储存,需边产边用。
3
第十三章 氧化还原
臭氧浓度/(mg/L)
2.8 2.4
2 1.6 1.2 0.8 0.4
0
0
20 40 60 80 100 时间/min
图13-2 臭氧在蒸馏水中的分解速率
③与水完全混溶,避免了溶解度的限制或排出泵产生气栓;
④无二次污染,能满足环保排放要求;
⑤氧化选择性高,特别是在适当条件下选择性更高。
10
第十三章 氧化还原
4.过氧化氢氧化工艺的工业应用 1).淀粉厂废水处理
F e n to n 试 剂
石灰
废水
氧化池
絮凝池
砂滤池
图 13-3 工 业 化 流 程 图
2).含氰废水的处理
2
第十三章 氧化还原
13.2高级氧化
13.2.1臭氧氧化法
1.臭氧的主要物理化学特性 臭氧的相对密度为氧的1.5倍,在水中的溶解度比氧气大10倍,比空 气大25倍。 臭氧在空气中会慢慢地连续自行分解成氧气,其反应式为
O3 23O2 14.45kJ
(13-1)
由于分解时放出大量热量,故当其浓度在25%以上时,很容易爆炸。
