胃蛋白酶原I测定试剂盒(酶联免疫吸附法)产品技术要求meikang
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
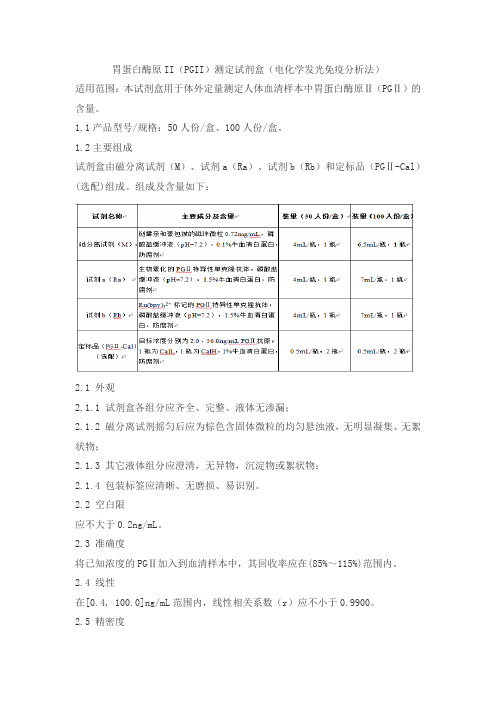
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中胃蛋白酶原Ⅱ(PGⅡ)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(PGⅡ-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.2ng/mL。
2.3 准确度
将已知浓度的PGⅡ加入到血清样本中,其回收率应在(85%~115%)范围内。
2.4 线性
在[0.4, 100.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高低两个水平的的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源至深圳新产业的PGⅡ定标液。
酶联免疫分析试剂盒说明书

人chemerin酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定人血清、血浆或其它相关液体中chemerin含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中chemerin水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入chemerin抗原、生物素化的抗人chemerin抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的chemerin呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为20,000pg/ml,做系列倍比稀释后,分别稀释10,000pg/ml,5,000pg/ml,2,500pg/ml,1,250pg/ml,625pg/ml,312.5pg/ml,156pg/ml,样品稀释液直接作为标准浓度0pg/ml,临用前15分钟内配制。
如配制10,000pg/ml标准品:取0.5ml20,000pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120ul/瓶(1:100)临用前以检测稀释液B1:100稀释。
骨源性碱性磷酸酶检测试剂盒(凝集素亲和法)产品技术要求北京中生金域诊断

骨源性碱性磷酸酶检测试剂盒(凝集素亲和法)适用范围:用于体外半定量检测人体全血或血清中骨源性碱性磷酸酶催化活性。
1.1 产品型号:JY–Color–BAP NB;JY–Color–BAP AB。
1.2 产品规格1.2.1 包装规格:20人份/盒、50人份/盒、100人份/盒。
1.2.2产品组成:产品主要组成成分见表1、表2。
表1 试剂盒配置表配 置 规 格 (装量)20人份/盒 50人份/盒 100人份/盒反应装置 1×20支 1×50支 5×20支显色液 JY–Color–BAP NB1ml ×1瓶3.5ml ×1瓶7ml ×1瓶 JY–Color–BAP AB洗涤液 JY–Color–BAP NB3ml ×1瓶 8ml ×1瓶 8ml ×2瓶 JY–Color–BAP AB终止液 JY–Color–BAP NB3ml ×1瓶4ml ×1瓶 8ml ×1瓶 JY–Color–BAP AB 7ml ×1瓶 7ml ×2瓶一次性定量取血管(含吸头)21支(含吸头1个)52支(含吸头1个)104支(含吸头1个)注:试剂盒中一次性定量取血管为外购有医疗器械证书的产品。
表2试剂配方和浓度配 置 组成 浓度显色液 氯化钠(NaCl) 700mmol/L氯化镁(MgCl2) 25mmol/L二甲基亚砜(DMSO)0.9%(体积比)洗涤液 氯化钠(NaCl) 13%氯化镁(MgCl2) 2.9% 聚乙二醇(PEG)13%氯化锌(ZnCl2) 7%氯化钙(CaCl2) 18%氯化锰(MnCl2) 32%迭氮钠(NaN3) 5%JY–Color–BAP NB终止液氯化钠(NaCl) 18%迭氮钠(NaN3) 25% JY–Color–BAP AB终止液 乙磺酸(MES) 9%氯化钠(NaCl) 13%迭氮钠(NaN3) 7%2.1 外观2.2.1 反应装置为白色塑料制品,结构应完整、表面光洁、无缺失、无折损、无脱落;2.2.2 测定用液体外观要求:a) 显色液为浅黄色液体,不得有任何沉淀及絮状悬浮物;b) 洗涤液为无色透明液体,不得有任何沉淀及絮状悬浮物;c) 终止液为无色透明液体,不得有任何沉淀及絮状悬浮物。
胃蛋白酶原II测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1 性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限
应不大于0.5 ng/mL。
2.5线性
试剂盒在0.5 ng/mL~100 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 5%。
2.7批间差
变异系数CV 应≤ 10%。
2.8稳定性
取失效期后的试剂盒进行检测,结果应符合 2.1~2.6 的要求。
人P21蛋白(P21)定量检测试剂盒(ELISA)使用说明书

本试剂盒只能用于科学研究,不得用于医学诊断。
人P21蛋白(P21)定量检测试剂盒(ELISA)使用说明书【试剂盒名称】人P21蛋白(P21)定量检测试剂盒(ELISA)【试剂盒用途】定量检测人血清、血浆及相关液体样本中P21蛋白(P21)的含量。
【检测原理】本试剂盒采用双抗体两步夹心酶联免疫吸附法(ELISA)。
将标准品、待测样本加入到预先包被人P21蛋白(P21)单克隆抗体透明酶标包被板中,温育足够时间后,洗涤除去未结合的成分,再加入酶标工作液,温育足够时间后,洗涤除去未结合的成分。
依次加入底物A、B,底物(TMB)在辣根过氧化物酶(HRP)催化下转化为蓝色产物,在酸的作用下变成黄色,颜色的深浅与样品中人P21蛋白(P21)浓度呈正相关,450nm波长下测定OD值,根据标准品和样品的OD值,计算样本中人P21蛋白(P21)含量。
【试剂盒组成】1酶标包被板12孔×8条7显色剂A液6mL2标准品0.3mL×6管8显色剂B液6mL320倍浓缩洗涤液25mL9终止液6mL4样本稀释液6mL10说明书1份5特殊稀释液6mL11封板膜2张6酶标试剂6mL12密封袋1个备注:标准品(1号→6号)浓度依次为:48、24、12、6、3、1.5ng/L【需要而未提供的试剂和器材】1、37℃恒温箱2、标准规格酶标仪3、精密移液器及一次性吸头4、蒸馏水5、一次性试管6、吸水纸【操作步骤】1、准备:从冰箱取出试剂盒,室温复温平衡30分钟。
2、配液:用蒸馏水将20倍浓缩洗涤液稀释成原倍的洗涤液。
3、加标准品和待测样本:取足够数量的酶标包被板,固定于框架上,分别设置标准品孔、待测样本孔和空白对照孔,记录各孔位置,在标准品孔中加入标准品50μL;待测样本孔中先加入待测样本10μL,再加样本稀释液40μL(即样本稀释5倍);空白对照孔不加。
4、温育:37℃水浴锅或恒温箱温育30min。
5、洗板:弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板4次(也可用洗板机按说明书操作洗板)。
胃蛋白酶原I(PGI)测定试剂盒(胶乳免疫比浊法)产品技术要求美康

胃蛋白酶原I(PGI)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中胃蛋白酶原I的含量。
1. 产品型号/规格及其划分说明包装规格为:规格1:试剂1:25ml,试剂2:5ml;规格2:试剂1:50ml,试剂2:10ml。
具体组成和含量见表1:表1:产品规格及装量2. 性能指标2.1外观:试剂盒各组份应齐全、完整,液体无渗漏;中文包装标签应清晰,无磨损;试剂1无色透明液体,试剂2 乳白色胶体溶液。
2.2 净含量:试剂的净含量不少于标示值。
2.3 试剂空白:用校准品稀释液作为空白样品进行测试,试剂空白吸光度值应小于0.02。
2.4分析灵敏度:以46ug/L的胃蛋白酶原I(PGI)为检测样本,吸光度变化率在0.00612-0.1603/min之间。
2.5线性:2.5.1试剂盒的线性范围为[2.5,245.0]ug/L,线性相关系数r不低于0.9900;2.5.2 [2.5,30.0]ug/L,绝对偏差不超过±3ug/L;(30.0,245.0]ug/L ,相对偏差在±10%范围内。
2.6 重复性:分别对浓度为50.0ug/L的低浓度控制血清和浓度为100.0ug/L高浓度的控制血清重复检测10次,变异系数(CV)应不大于10%。
2.7准确度:回收率在85%-115%;2.8分析特异性:检测浓度为107.8ug/L的胃蛋白酶原II中的胃蛋白酶原I的浓度,计算交叉反应率,应小于10%。
2.9批间差:相对偏差不大于10%。
2.10稳定性:2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
碧云天生物技术 Human Angiogenin ELISA Kit PA023说明书
碧云天生物技术/Beyotime Biotechnology订货热线:400-168-3301或800-8283301订货e-mail:******************技术咨询:*****************碧云天网站微信公众号网址:Human Angiogenin ELISA Kit产品编号产品名称包装PA023 Human Angiogenin ELISA Kit 96次产品简介:碧云天的Human Angiogenin ELISA Kit (Human Angiogenin Enzyme-Linked ImmunoSorbent Assay Kit),即人血管生成素酶联免疫吸附检测试剂盒,是一种用于特异性地高灵敏地定量检测人血清、血浆或细胞培养上清液中的Angiogenin的ELISA试剂盒。
本产品检测灵敏度高,特异性强,重复性好。
多次重复检测结果表明,最小检出量为4.75pg/ml,与EGF、GM-CSF、MIP-1α、MIP-1β、TGF-α、TGF-β1,小鼠 EGF、GM-CSF、MIP-1α等均没有交叉反应,板内、板间变异系数均小于10%。
人血管生成素(Angiogenin, ANG)是一种分子量为14kDa的单链非糖基化蛋白,属于核糖核酸酶中RISBASE家族。
该家族成员不仅具有核糖核酸酶活性,还具有一些特殊的生物学功能。
ANG氨基酸长度为123,包括3个链内二硫键。
人ANG与小鼠ANG具有75%的氨基酸同源性,且具有一定的种间交叉反应。
能够表达ANG的细胞主要有血管内皮细胞、平滑肌细胞、成纤维细胞、结肠柱状上皮细胞、淋巴细胞和部分肿瘤细胞。
ANG主要参与血管的形成过程。
基底膜的降解是血管新生过程中内皮细胞发生迁移的先决条件。
ANG首先与肌动蛋白结合,随后肌动蛋白-ANG复合物发生裂解,激活组织血纤维蛋白溶酶原。
这一过程产生的血纤维蛋白溶酶会降解基底膜中的层粘连蛋白和纤连蛋白。
血清胃蛋白酶原比值和CA724对胃癌的诊断价值及相关性分析

血清胃蛋白酶原比值和CA724对胃癌的诊断价值及相关性分析付明生;潘淑贤;朱金水【摘要】目的探讨血清胃蛋白酶原比值与CA724对胃癌的诊断价值及相关性分析.方法收集上海交通大学附属第六人民医院南院2011年7月-2012年6月经胃镜活检病理诊断非萎缩性胃炎的患者187例,萎缩性胃炎伴肠化108例,胃癌91例,空腹采静脉血,酶联免疫吸附(ELISA)定量测定血清胃蛋白酶原Ⅰ(PGⅠ)、PGⅡ,计算PG Ⅰ/PGⅡ(PGR)值,电化学发光免疫分析法(ECLIA)检测血清糖类抗原724(CA724).结果血清PGR=2.78时诊断胃癌敏感性为72.7%,特异性为77.2%,CA724=15.77u/ml时诊断胃癌敏感性为88.9%,特异性为97.2%;PGR联合CA724诊断胃癌阳性率为89%,与PGR(61.5%)、CA724 (73.6%)单独诊断胃癌的阳性率比较,差异有统计学意义(P<0.05);胃癌组中血清PGR与CA724无明显相关性(R=0.078,P=0.462).结论胃癌组血清PGR与CA724无相关性,但二者联合检测可提高胃癌诊断阳性率,可用于胃癌筛查.【期刊名称】《胃肠病学和肝病学杂志》【年(卷),期】2014(023)003【总页数】3页(P256-258)【关键词】胃蛋白酶原;糖类抗原724;胃癌【作者】付明生;潘淑贤;朱金水【作者单位】上海交通大学附属第六人民医院南院消化科,上海201400;上海交通大学附属第六人民医院南院消化科,上海201400;上海交通大学附属第六人民医院南院消化科,上海201400【正文语种】中文【中图分类】R735.2胃癌是我国最常见的恶性肿瘤之一,进展期胃癌死亡率高。
胃蛋白酶原(PG)是胃蛋白酶的前体,是胃黏膜的分泌产物,有PGⅠ和PGⅡ两种同工酶原。
血清胃蛋白酶原可反映胃黏膜状态和功能。
CA724 为糖蛋白,在消化道肿瘤患者血清中可升高。
通过测定血清PGⅠ、PGⅡ计算PGR 值,测定CA724 值,探讨血清PGR 与CA724 对胃癌的诊断价值及相关性分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃蛋白酶原I测定试剂盒(酶联免疫吸附法)适用范围:用于体外定量检测人血清中胃蛋白酶原I的含量。
1.1 包装规格
48人份/盒、96人份/盒、192人份/盒、480人份/盒。
1.2 主要组成成分
2.1外观
试剂盒各组份应齐全、完整,液体无渗漏,包装标签应清晰。
2.2 净含量
液体试剂的净含量不少于标示值。
2.3 线性
线性范围为[1.0,200]ug/L,线性相关系数r≥0.9900。
2.4 空白检测限
不高于1.0μg/L。
2.5重复性
检测高、低两个浓度的样本,变异系数(CV)应不大于15% 。
2.6准确度
回收率在85%~115%。
2.7特异性
测定PGII浓度为43ug/L校准品中PGI的浓度,计算交叉反应率,应小于10%。
2.8批间差
检测一个高浓度的样本,批间变异系数(CV)应不大于15%。
2.9稳定性
2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
2.10 校准品溯源性
试剂盒校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过芬兰biohit公司试剂盒比对赋值。
