1997年上海高考化学试题和参考答案
1997年全国高考化学试题及答案

1997年全国高考化学试题及答案本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至10页,共150分.考试时间120分钟.第Ⅰ卷 (选择题 共84分)注意事项:1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上.2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试题卷上.3.考试结束,监考人将本试卷和答题卡一并收回.可能用到的原子量:H 1 C 12 N 14 O 16 F 19 S 32CI 35.5 Fe 56 Cu 64 Br 80 I 127一.选择题(本题包括5小题,每小题3分,共15分.每小题只有一个选项符合题意.)1.19世纪中叶,门捷列夫的突出贡献是( )(A)提出原子学说 (B)发现元素周期律 (C)提出分子学说 (D)发现氧气2.下列各组微粒中,核外电子总数相等的是( )(A)K +和Na + (B)CO 2和NO 2 (C)CO 和CO 2 (D)N 2和CO3.将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )(A)2 mol ·L-1H 2SO 4溶液 (B)2 mol ·L -1NaOH 溶液(C)2 mol ·L -1MgSO 4溶液 (D)硅酸溶胶4.已知酸性大小:羧酸>碳酸>酚.下列含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代(均可称为水解反应),所得产物能跟NaHCO3溶液反应的是( )A .BC .D .5.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )(A)2H ++2e - =H 2 (B)Fe 2++2e - =Fe(C)2H 2O+O 2+4e -=4OH - (D)Fe 3++e -=Fe 2+二.选择题(本题包括15小题,每小题3分,共45分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分.)6.甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是: (CH 3)2C =O+HCN —→(CH 3)2C(OH)CN(CH 3)2C(OH)CN+CH 3OH+H 2SO 4—→CH 2=C(CH 3)COOCH 3+NH 4HSO 490年代新法的反应是:CH3C ≡CH+CO+CH3OH −→−Pb CH 2=C(CH 3)COOCH 3| NO 2 CH 2Br | NO 2 Br | CH 3 Br | NO 2 C —Br O与旧法比较,新法的优点是()(A)原料无爆炸危险(B)原料都是无毒物质(C)没有副产物,原料利用率高(D)对设备腐蚀性较小7.下列叙述中,正确的是()(A)含金属元素的离子不一定都是阳离子(B)在氧化还原反应中,非金属单质一定是氧化剂(C)某元素从化合态变为游离态时,该元素一定被还原(D)金属阳离子被还原不一定得到金属单质8.某溶液含有较多的Na2SO4和少量的Fe2(SO4)3.若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤.正确的操作步骤是()(A)②⑥③(B)④⑥①③(C)④⑥③⑤(D)②⑥①③⑤9.下列各组离子,在强碱性溶液中可以大量共存的是()10.已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是(A)铍的原子半径大于硼的原子半径(B)氯化铍分子中铍原子的最外层电子数是8(C)氢氧化铍的碱性比氢氧化钙的弱(D)单质铍跟冷水反应产生氢气11.分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水).下列关于甲、乙溶解度的叙述中肯定正确的是()(A)20℃时,乙的溶解度比甲的大(B)80℃时,甲的溶解度比乙的大(C)温度对乙的溶解度影响较大(D)温度对甲的溶解度影响较大12.下列反应的离子方程式正确的是()(A)氨气通入醋酸溶液中CH3COOH+NH3=CH3COONH4(B)澄清的石灰水跟盐酸反应H++OH-=H2O(C)碳酸钡溶于醋酸BaCO3+2H+=Ba2++H2O+CO2↑(D)金属钠跟水反应 2Na+2H2O=2Na++2OH-+H2↑13.向50mL 18 mol·L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量()(A)小于0.45 mol (B)等于0.45 mol(C)在0.45 mol和0.90 mol之间(D)大于0.90 mol14.0.1 mol·L-1NaOH和0.1 mol·L-1NH4Cl溶液等体积混合后,离子浓度大小正确的次序是()(A)c(Na+)> c(Cl-)> c(OH-)> c(H+) (B) c(Na+)= c(Cl-)> c(OH-)> c(H+)(C) c(Na+)= c(Cl-)> c(H+)> c(OH-) (D) c(Cl-)> c(Na+)> c(OH-)> c(H+)15.下列说法正确的是(NO表示阿伏加德罗常数的值) ()(A)在常温常压下,11.2 L N2含有的分子数为0.5NO(B)在常温常压下,1 mol Ne含有的原子数为NO(C)71 g Cl2所含原子数为2NO(D)在同温同压时,相同体积的任何气体单质所含的原子数相同16. (1997年全国高考题)CaC2和MgC2都是离子化合物.下列叙述中正确的是(AB )A.CaC2 和MgC2都能跟水反应生成乙炔[︰C C︰]2-C的电子B.-22C离形式存在C.CaC2 在水中以Ca2+和-22D.MgC2 的熔点低,可能在100℃以下17.将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是(A)KCl (B)Mg(OH)2(C)Na2CO3(D)MgSO418.在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是(A)pH=3的硝酸跟pH=11的氢氧化钾溶液(B)pH=3的盐酸跟pH=11的氨水(C)pH=3的硫酸跟pH=11的氢氧化钠溶液(D)pH=3的醋酸跟pH=11的氢氧化钡溶液19.反应2X(g)2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图所示。
上海高考化学及答案

2007年普通高等学校招生全国统一考试(上海卷)化学第|卷(共66 分)相对原子质量:H : 1 C : 12 N : 14 0: 16 Na : 23 Mg : 24 S: 32 K : 39 Fe : 56 Ba : 137、选择题(本题共 10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
4•下列有关物理量相应的单位表达错误的是 A 摩尔质量g/mol B 气体摩尔体积L/mol3C 溶解度g/100gD 密度g/cm5•请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是 A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒 C 一定条件下,金属钠可以成为绝缘体 D 一定条件下,水在 20 C 时能凝固成固体二、选择题(本题共 36分),每小题3分,只有一个正确选项,答案涂写在答题纸上。
6•下列过程或现象与盐类水解无关的是 A 纯碱溶液去油污B 铁在潮湿的环境下生锈C 加热氯化铁溶液颜色变深D 浓硫化钠溶液有臭味7.离子检验的常用方法有三种:下列离子检验的方法不合理的是 A NH 4+-气体法B 「—沉淀法C Fe 3+-显色法D Ca 2+-气体法&下列反应的离子方程式正确的是 A 氢氧化钠溶液中通入少量二氧化硫: SO 2 + OH -T HSO 3-— 2+—B 碳酸氢钠溶液与足量氢氧化钡溶液混合: HCO 3 +Ba +OH 宀BaCS J+ H 2OC 盐酸滴入氨水中:H ++ OH -f 出0D 碳酸钙溶解于稀硝酸中:CO 32 + 2H T CO 2T+ H 2O9•下列有关实验操作错误的是 A 用药匙取用粉末状或小颗粒状固体B 用胶头滴管滴加少量液体1. A C 近期我国冀东渤海湾发现储量达 石油属于可再生矿物能源石油的裂化是物理变化 駕U 是重要的核工业原料, 235 92 U说法正确的是2. 注。
上海高考化学真题附答案(ii卷解析)

2009年全国普通高等学校招生统一考试上海化学试卷本试卷分为第I卷(第1—4页)和第Ⅱ卷(第5—10页)两部分。
全卷共10页。
满分150分,考试时间120分钟。
第I卷(共66分)考生注意:1.答第I卷前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号、校验码,并用2B铅笔正确涂写准考证号和校验码。
2.第I卷(1—22小题),由机器阅卷,答案必须全部涂写在答题卡上。
考生应将代表正确答案的小方格用2B铅笔涂黑。
注意试题题号和答题纸编号一一对应,不能错位。
答案需要更改时,必须将原选项用橡皮擦去,重新选择。
答案不能涂写在试卷上,涂写在试卷上一律不给分。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 V-51 Cr-52Mn-55 Fe-56 Cu-64一、选择题(本题共10分,每小题2分,只有一正确选项,答案涂写在答题卡上。
)1.下列措施不能达到节能减排目的的是A.利用太阳能制氢燃料 B.用家用汽车代替公交车C.利用潮汐能发电 D.用节能灯代替白炽灯2.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是A.:He B. C.1s2 D.3.有机物的种类繁多,但其命中是有规则的。
下列有机物命名正确的是4.用浓氯化铵溶液处理过的舞台幕布不易着火。
其原因是①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度④氯化铵分解产生的气体隔绝了空气A.①② B.③④ C.③④ D.②④5.下列对化学反应的认识错误的是A.会引起化学键的变化 B.会产生新的物质C.必然引起物质状态的变化 D.必然伴随着能量的变化二、选择题(本题共36分,每小题3分,只有一个正确选项,答案涂写在答题卡上。
)6.下列实验装置不适用于物质分离的是7.在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是A .①②③B .②①③C .③②①D .③①②8.在通常条件下,下列各组物质的性质排列正确的是A .熔点:22CO KCl SiO >>B .水溶性:22HCl H S SO >>C .沸点:乙烷>戊烷>丁烷D .热稳定性:23HF H O NH >>9.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。
上海高三高中化学高考真卷带答案解析

上海高三高中化学高考真卷班级:___________ 姓名:___________ 分数:___________一、选择题1.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是 A .点燃,能燃烧的是矿物油B .测定沸点,有固定沸点的是矿物油C .加入水中,浮在水面上的是地沟油D .加入足量氢氧化钠溶液共热,不分层的是地沟油2.氰酸铵(NH 4OCN )与尿素[CO(NH 2)2] A .都是共价化合物 B .都是离子化合物 C .互为同分异构体D .互为同素异形体3.230Th 和232Th 是钍的两种同位素,232Th 可以转化成233U 。
下列有关Th 的说法正确的是 A .Th 元素的质量数是232 B .Th 元素的相对原子质量是231 C .232Th 转换成233U 是化学变化 D .230Th 和232Th 的化学性质相同4.下列变化需克服相同类型作用力的是 A .碘和干冰的升华B .硅和C 60的熔化 C .氯化氢和氯化钾的溶解D .溴和汞的气化5.374℃、22.1Mpa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的H +和OH -,由此可知超临界水 A .显中性,pH 等于7 B .表现出非极性溶剂的特性 C .显酸性,pH 小于7 D .表现出极性溶剂的特性6.与索尔维制碱法相比,侯德榜制碱法最突出的优点是 A .原料利用率高 B .设备少 C .循环利用的物质多D .原料易得7.将X 气体通入BaCl 2溶液,未见沉淀生成,然后通入Y 气体,有沉淀生成,X 、Y 不可能是8.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。
下列分析正确的是A .脱氧过程是吸热反应,可降低温度,延长糕点保质期B .脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe 3+C .脱氧过程中碳做原电池负极,电极反应为:2H 2O+O 2+4e→4OH -D .含有1.12g 铁粉的脱氧剂,理论上最多能吸收氧气336mL (标准状况)9.将盛有NH 4HCO 3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
历届高考中的化学平衡常数试题及其答案和详解

1.(1982年高考全国卷第8题)(12分)将9.2克N 2O 4晶体放入容积为2升的密闭容器中,升温到25℃时N 2O 4全部气化,由于N 2O 4发生如下分解反应:N 2O 42NO 2 △H=+56.848kJ/mol ,平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(g)尚未分解时压强的1.2倍,试回答下列问题: (1).平衡时容器内混和气体的压强P 是多少大气压? (2).平衡时容器内NO 2同N 2O 4的物质的量之比是多少? (3).平衡时该反应的平衡常数K 是多少?(4).如改变影响平衡的一个条件(如压力、温度或浓度)时,试将NO 2同N 2O 4的物质的量之比平衡常数K 的变化情况,选用增大、减小或不变等词句填下表:1.[答案] (1)1.47大气压;(2)21;(3)0.01; (4)[解析](1)。
先求混和气体的总物质的量n :设n 1、P 1分别是纯N 2O 4(g)的物质的量和压强,n 、P 分别是混和气体的总物质的量和压强;则PP 1=112.1P P ⨯=nn 1=n922.9 ;n=0.12 mol (2分);再利用PV=nRT 求混和气体的压强P=VnRT =2298082.012.0⨯⨯=1.47大气压(1分)。
(2)设0.1摩尔N 2O 4中有x 摩尔分解,则有如下的对应关系是:N 2O 42NO 2 △H=+56.848kJ/mol起始物质的量:0.1mol 0 变化物质的量: xmol 2xmol 平衡物质的量:0.1-x 2x平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(气)尚未分解时压强的1.2倍,混和气体的总物质的量:0.12mol ;则:0.1-x+2x=0.12;∴ x=0.02mol (2分);平衡时容器内NO 2同N 2O 4的物质的量之比:摩尔数摩尔数422O N NO =02.01.0202.0-⨯=21(1分)(3)k=][][4222O N NO =]21.0[]22[2LX L x -]04.0[]02.0[2=0.01(3分)(平衡常数表示式、平衡时物质的浓度和计算结果各给1分)(4)(每一空格给0.5分,共3分);k 是温度的函数,改变压强和改变浓度都不会改变平衡常数;N 2O 42NO 2△H=+56.848kJ/mol ,正反应是吸热反应,升高温度有利于平衡向正向移动,k 值增大;增大压强,平衡逆向移动,NO 2物质的量减小,N 2O 4物质的量增大,物质的量之比422O N NO 减小;升高温度,平衡正向移动,N 2O 4物质的量减小,NO 2物质的量增大,物质的量之比422O N NO 增大;增加N 2O 4的浓度平衡正向移动,平衡移动N 2O 4物质的量减小,N 2O 4物质的量净增加值大,平衡移动NO 2物质的量增大,物质的量之比422O N NO 减小。
高考化学复习普通高等学校招生全国统一考试(上海卷)化学答案解析(正式版)(解析版).docx

高中化学学习材料鼎尚图文收集整理相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Ca-40一、选择题(本题共10分,每小题2分,每题只有一个正确选项)1.中国科学技术名词审定委员会已确定第116号元素Lv 的名称为鉝。
关于Lv 293116的叙述错误的是( )A .原子序数116B .中子数177C .核外电子数116D .相对原子质量293 【答案】D考点:考查本题考查了元素原子的符号各个角标的含义及相互关系的知识。
2.下列物质见光不会分解的是( )A .HClOB .NH 4ClC .HNO 3D .AgNO 3【答案】B考点:考查物质的稳定性与反应条件的关系的知识。
3.某晶体中含有极性键,关于该晶体的说法错误的是()A.不可能有很高的熔沸点B.不可能是单质C.可能是有机物D.可能是离子晶体【答案】A考点:考查极性共价键存在的物质类别的判断的知识。
4.不能作为判断硫、氯两种元素非金属性强弱的依据是()A.单质氧化性的强弱B.单质沸点的高低C.单质与氢气化合的难易D.最高价氧化物对应的水化物酸性的强弱【答案】B考点:考查判断元素非金属性强弱的依据的知识。
5.二氧化硫能使溴水褪色,说明二氧化硫具有()A.还原性B.氧化性C.漂白性D.酸性【答案】A【解析】试题分析:二氧化硫中S元素的化合价是+4价,介于S元素的最高化合价和最低化合价之间,既有氧化性,又有还原性,二氧化硫能使溴水褪色的原因是发生反应:Br2+SO2+2H2O=H2SO4+2HBr。
在该反应在二氧化硫中的S元素的化合价升高,失去电子,被氧化,表现还原性。
故选项是A。
考点:考查二氧化硫的化学性质的知识。
二、选择题(本题共36分,每小题3分,每题只有一个正确选项)6.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有()A.2种B.3种C.4种D.5种【答案】C考点:考查物质的晶体类型与化学键的结合方式的关系的知识。
过渡元素高三化学复习教案 新课标 人教版
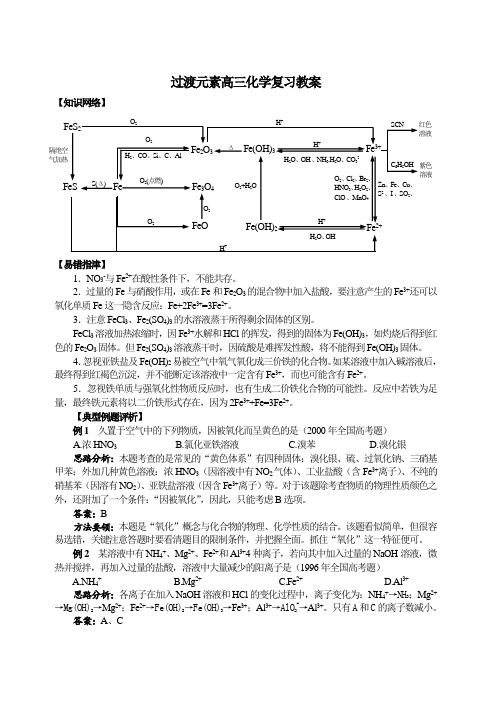
过渡元素高三化学复习教案【知识网络】1.NO3-与Fe2+在酸性条件下,不能共存。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。
但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。
如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。
反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
【典型例题评析】例1久置于空气中的下列物质,因被氧化而呈黄色的是(2000年全国高考题)A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银思路分析:本题考查的是常见的“黄色体系”有四种固体:溴化银、硫、过氧化钠、三硝基甲苯;外加几种黄色溶液:浓HNO3(因溶液中有NO2气体)、工业盐酸(含Fe3+离子)、不纯的硝基苯(因溶有NO2)、亚铁盐溶液(因含Fe3+离子)等。
对于该题除考查物质的物理性质颜色之外,还附加了一个条件:“因被氧化”,因此,只能考虑B选项。
答案:B方法要领:本题是“氧化”概念与化合物的物理、化学性质的结合。
该题看似简单,但很容易选错,关键注意答题时要看清题目的限制条件,并把握全面。
抓住“氧化”这一特征便可。
例2某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是(1996年全国高考题)A.NH4+B.Mg2+C.Fe2+D.Al3+思路分析:各离子在加入NaOH溶液和HCl的变化过程中,离子变化为:NH4+→NH3;Mg2+→Mg(OH)2→Mg2+;Fe2+→Fe(OH)2→Fe(OH)3→Fe3+;Al3+→AlO2-→Al3+。
全国高考(上海卷)化学试题及答案

全国⾼考(上海卷)化学试题及答案2012年全国普通⾼等学校招⽣统⼀考试上海化学试卷考⽣注意:1.本试卷满分l50分,考试时问120分钟·2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择题)或写(⾮选择题)在答题纸上;做在试卷上⼀律不得分。
3.答题前,考⽣务必在答题纸上⽤钢笔或圆珠笔清楚填写姓名、准考证号,并将核对后的条形码贴在指定位置上。
4.答题纸与试卷在试题编号上是⼀⼀对应的,答题时应特别注意,不能错位。
相对原⼦质量:H-1 C-12 N-14 O-16 Na-23 Si⼀28 Cl-35.5 K-39 Cu-64 Se-79⼀、选择题(本题共10分,每⼩题2分,每题只有⼀个正确选项)1.今年3⽉修订的《环境空⽓质量标准》中新纳⼊的强制监测指标是A.PM2.5 B.NOx C.SO2 D.可吸⼊颗粒物2.下列关于化⽯燃料的加⼯说法正确的是A.⽯油裂化主要得到⼄烯B.⽯油分馏是化学变化,可得到汽油、煤油C.煤⼲馏主要得到焦炭、煤焦油、粗氨⽔和焦炉⽓D.煤制煤⽓是物理变化,是⾼效、清洁地利⽤煤的重要途径3.氮氧化铝(AlON)属原⼦晶体,是⼀种超强透明材料,下列描述错误的是A.AlON和⽯英的化学键类型相同 B.AlON和⽯英晶体类型相同C.AlON和Al2O3的化学键类型不同D.AlON和Al2O3晶体类型相同4.PH3⼀种⽆⾊剧毒⽓体,其分⼦结构和NH3相似,但P-H键键能⽐N-H键键能低。
下列判断错误的是A.PH3分⼦呈三⾓锥形B.PH3分⼦是极性分⼦C.PH3沸点低于NH3沸点,因为P-H键键能低D.PH3分⼦稳定性低于NH3分⼦,因为N-H键键能⾼5.和氢硫酸反应不能产⽣沉淀的是A.Pb(NO3)2溶液 B.Na2S洛液 C.CuSO4溶液 D. H2SO4溶液⼆、选择题(本题共36分,每⼩题3分,每题只有⼀个正确选项)6.元素周期表中铋元素的数据见右图,下列说法正确的是A.Bi元素的质量数是209B.Bi元素的相对原⼦质量是209.0C.Bi原⼦6p亚层有⼀个未成对电⼦D.Bi原⼦最外层有5个能量相同的电⼦7.⽔中加⼊下列溶液对⽔的电离平衡不产⽣影响的是A.NaHSO4溶液 B.KF溶液 C.KAl(SO4)2溶液 D.NaI溶液8.过量的下列溶液与⽔杨酸()反应能得到化学式为C7H5O3Na的是A.NaHCO3溶液 B.Na2CO3溶液 C.NaOH溶液 D.NaCl溶液9.⼯业⽣产⽔煤⽓的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ下列判断正确的是A.反应物能量总和⼤于⽣成物能量总和B.CO(g)+H2(g)→C(s)+H2O(g)+131.4kJC.⽔煤⽓反应中⽣成1 mol H2(g)吸收131.4 KJ热量D.⽔煤⽓反应中⽣成1体积CO(g)吸收131.4 KJ热量10.⽤滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏⾼的是A.试样中加⼊酚酞作指⽰剂,⽤标准酸液进⾏滴定B.滴定管⽤蒸馏⽔洗涤后,直接注⼊标准酸液进⾏滴定C.锥形瓶⽤蒸馏⽔洗涤后,壹接加⼊待测溶液进⾏滴定D.滴定管⽤蒸馏⽔洗涤后,直接注⼊待测液,取20.00 mL进⾏滴定ll.⼯业上将氨⽓和空⽓的混合⽓体通过铂⼀铑合⾦⽹发⽣氨氧化反应,若有标准状况下VL氨⽓完全反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1997年上海高考化学试题和参考答案第Ⅰ卷(共70分)一、选择题(本题共24分),每小题2分,只有一个正确选项1、 下列物质中,受热后不易分解的是( )A 碳酸氢钠B 氯化铵C 硝酸铜D 硫酸钾2、 下列元素在化合物中,可变化合价最多的是( )A 铝B 氯C 镁D 氧3、 据最新报道,放射性同位素钬可有效地治疗肝癌。
该同位素原子核内的中子数与核外电子数之差是( )A 32B 67C 99 D1664、 下列电子式书写错误正确的是( ) A. B. C. D.5、 下列含有极性键的离子晶体是( )A .CH 3COOHB .NaOHC .Na 2O 2D .MgCl 26、 设阿佛加德罗常数的的值为N A ,下列叙述正确的是( )A . 1molD 2O 所含质子数为12 N AB .10g 氖气所含原子数为N AC .0.5 molAl 与足量盐酸反应转移电子数为1.5N AD .标准状况下,1L 水所含分子数为1/22.4 N A7、 只用水就能鉴别的一组物质是( )A .苯、乙酸、四氯化碳B .乙醇、乙醛、乙酸C .乙醛、乙二醇、硝基苯D .苯酚、乙醇、甘油8、 设C+CO1反应速度为v 1 N 23+Q 2 反应速度为v 2,对于上述反应,当温度升高时,v 1和v 2的变化情况为( )A 同时增大B 同时减小C 增大,减小D 减小,增大9、 实验室需用480mL0.1mol 的硫酸铜溶液,现选取500mL 容量瓶进行配制,以下操作正确的是( )A 称取7.68g 硫酸铜,加入500mL 水B 称取12.0g 胆矾配成500mL 溶液C 称取8.0g 硫酸铜,加入500mL 水D 称取12.5g 胆矾配成500mL 溶液10、某种胶体在电泳时,它的胶粒向阴极移动。
在这胶体中分别加入下列物质:①蔗糖溶液②硫酸镁溶液③硅酸胶体④氢氧化铁胶体,不会发生凝聚的是( )A ①③B ①④C ②③D ③④11、将100mL 升0.1mol/L 的BaCl 2溶液加入到100mL0.2mol/L 的H 2SO 4溶液中,则溶液中存在的离子浓度关系是( )A c(H +)>c(Cl -)>c(Ba 2+)>c(SO 42-)B c(Cl -)> c(H +)>c(SO 42-) >c(Ba 2+)C c(H +)> c(Cl -)>c(SO 42-) >c(Ba 2+)D c(Cl -)> c(H +)>c(Ba 2+)>c(SO 42-)12、你认为减少酸雨产生的途径可采取的措施是①少用煤作燃料②把工厂烟囱造高③燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源( )A ①②③B ②③④⑤C ①③⑤D ①③④⑤参考答案:Na + Na + ·×S ·×[ ]2- ····[H ︰N ︰H]+ H H [Cl]- H ︰N ︰ HH H + H + ·×O ·×[ ]2- ····1、D2、B3、A4、B5、B6、C7、A8、A9、D 10、B 11、C 12、C二、选择题(本题共30分),每小题3分,只有一个正确选项。
13、短周期元素M和N的离子M2+和N3-具有相同电子层结构,则下列说法正确的是()A M2+的离子半径比N3-小B M的原子序数比N小C M和N原子的电子层数相等D M和N原子最外层电子数相等14、将CO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是()A硫酸氢钾溶液 B 碳酸氢钙溶液 C 氯水 D 氢氧化钠溶液15、下列离子方程式中,正确的是()A在氯化铝溶液中加入过量氨水Al3++3OH- =Al(OH)3↓B 在硫酸铜溶液中加入过量氢氧化钡溶液Ba2++SO42- = BaSO4↓C 在澄清石灰水中通入过量二氧化碳OH- +CO2=HCO3-D 在碳酸投钙溶液中加入过量氢氧化钠溶液Ca2++HCO3- +OH- =CaCO3↓+H2O16、在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是①Cl- ②NO3- ③SO42-④S2-()A①② B ②③ C ③④ D ①③17、下列说法错误的是()A二氧化碳和漂白粉作用,生成具有氧化性的物质B 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱C 二氧化硅和烧碱反应,使溶液的碱性一定减弱D 二氧化氮可相互结合为四氧化二氮18、在下列各物质中加入过量盐酸后,最终不产生沉淀或浑浊的是()A偏铝酸钠溶液 B 苯酚钠溶液 C 硅酸钠溶液 D 硫代硫酸钠溶液19、(97上海)19、某有机物的结构式为,CH2CHOCH2COOHCH2OH它在一定条件下右能发生的反应有①加成②水解③酯化④氧化⑤中和⑥消去A ②③④B ①③⑤⑥C ①③④⑤D ②③④⑤⑥20、用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为()A 3B 4C 5D 621、在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器中内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色。
则m的n比值为()A3:2 B 2:3 C 8:3 D 3:822、在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为()A A>B B A=10-4 BC B=10-4 AD A=B参考答案:13、A14、D 15、C 16、D 17、B 18、A19、C 20、D 21、C 22、B三、选择题(本题16分)。
每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分。
23、下列各组溶液中,不用任何其他试剂就能鉴别的是()A Na2SO4H2SO4AlCl3BaCl2B HCl NaOH K2SO4NaHSO4C NaAlO2KHCO3NaCl NaHSO4D NaOH FeCl3MgCl2K2SO424、在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是()A将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多B 盐酸和醋酸都可用相应的钠盐与浓酸酸反应制取C 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大D 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等25、将可能混有下列物质的硫酸铵样品13.2g,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3L(标准状况),则该样品内不可能含有的物质是()A碳酸氢铵和硝酸铵B 碳酸铵和硝酸铵C 氯化铵和碳酸氢铵D 氯化铵和碳酸铵26、在由Fe、FeO和Fe2O3组成的混合物中加入100毫升2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子。
则下列判断正确的是()A混合物里三种物质反应时消耗盐酸的物质的量之比为1︰1︰3B 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1︰2C 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多D 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多参考答案:23、C、D 24、A、C 25、D 26、B、C第Ⅱ卷(共80分)四、(本题共24分)27、铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。
(1)配平制取铁酸钠的化学方程式:Fe(NO3)+NaOH+Cl2─Na2FeO4+NaNO3+NaCl+H2O 反应中元素被氧化,转移电子总数为(2)铁酸钠之所以能净水,除了能消毒外,另一个原因是28、W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。
W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1︰1,Y原子最外层s电子与p电子数之比为1:1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:(2)W、X元素的最高价氧化物对应水化物的碱性强弱为< (用分子式表示)。
(3)这四种元素原子半径的大小为> > > (填元素符号)29、哥伦亚号航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。
加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。
m摩尔高氯酸铵分解时除产生2m mol 水蒸气和m mol氧气外,其它组成元素均以单质形式放出,因而产生巨大的推动力。
试写出其中涉及的化学方程式:(1)(2)根据此反应原理,1摩尔高氯酸铵分解所产生的气体有摩尔。
考生注意:30题为分叉题,分(A)、(B)两题,考生可任选一题。
如两题都做,只以(A)题计分。
30、(A)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca 5(PO 4)3OH(s) 5Ca 2++3PO 43-+OH -进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是已知Ca 5(PO 4)3F (s )的溶解度比上面的矿化产物更小,质地更坚固。
主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:根据以上原理,请你提出一种其它促进矿化的方法:30、(B )抽烟对人体有害。
烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用表示)化合,发生下述反应:CO+Hb •O 22+Hb •CO 实验表明,Hb •CO 的浓度即使只有Hb •O 2浓度的2%,也足以使人的智力受损。
试回答:(1)上述反应的平衡常数表达式为:K= 。
(2)抽烟后,吸入肺部的空气中测得的CO 和O 2的浓度分别为10-6mol/L 和10-2mol/L 。
已知37℃时,平衡常数K=220,这时Hb •CO 的浓度 (填大于、等于或小于)Hb •O 2浓度的0.02倍。
(3)进入肺部的众多有害物质中,除CO 外还有一种称为尼古丁的剧毒的物质,它的结构简式为:式中以线示键,线的交点处代表有碳原子,并用原子数补足四价,但C 、H 原子都未标记出来。
试写出这它的分子式:参考答案:17、(1)2 16 3 2 6 6 8 ; Fe (或铁) 6e(2)还原产物Fe 3+发生水解生成Fe (OH )3胶体,能吸附杂质28、(1)2Mg+CO 2 点燃 2MgO+C(2)Mg(OH)2<NaOH(3)Na>Mg>C>O29、 4Al+3O 2=2Al 2O 3+Q2NH 4ClO 4(固)=N 2(气)+Cl 2(气)+2O 2(气)+4H 2O (气) 4摩尔30。
