Cu的显色与药物分析
天然药物化学显色反应总结
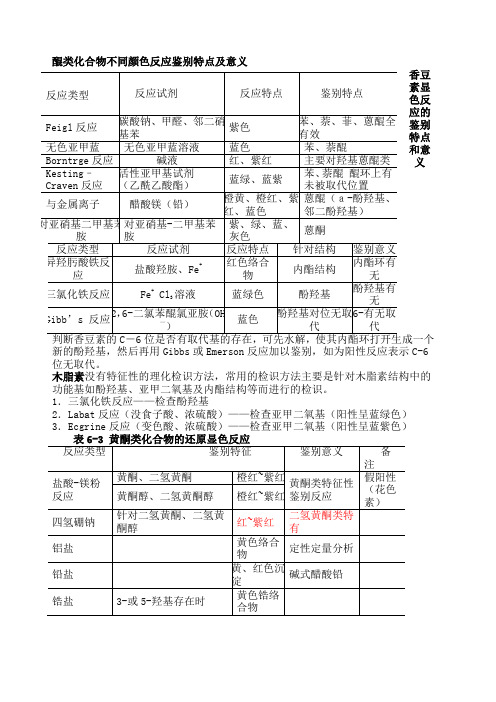
醌类化合物不同颜色反应鉴别特点及意义
香豆素显色反应的鉴别
特点
和意
义
新的酚羟基,然后再用Gibbs 或Emerson 反应加以鉴别,如为阳性反应表示C-6位无取代。
木脂素没有特征性的理化检识方法,常用的检识方法主要是针对木脂素结构中的功能基如酚羟基、亚甲二氧基及内酯结构等而进行的检识。
1.三氯化铁反应——检查酚羟基
2.Labat 反应(没食子酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝绿色)
3.Ecgrine 反应(变色酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝紫色)
3-OH、后黄色减褪,若有3-OH,则加枸橼酸后黄色不变,因此可用于区分黄酮和黄酮醇。
用的存在。
二酚羟基或兼有3-羟基、4-酮基或5-羟基、4-酮基结构。
而碱式醋酸铅的沉淀能力要大得多,一般酚类化合物均可与
②黄酮醇类在碱液中先呈黄色,通入空气后变为棕色。
③分子结构中有邻二酚羟基或3,4’-二羟基取代时,在碱液中不稳定,易被氧化,
按作用部位分:
作用于五元不饱和内酯
)、
C-1
7位
不
饱和内酯环的颜色反应
甲型强心苷的特征反应,因为五元不饱和内酯环上的双键位移产生C-22活性亚甲
基乙型强心苷为六元不饱和内酯环,故不能反应。
T(Girard T)或吉拉尔P(Girard P)两种试剂。
借此与不含羰基的皂苷元分离。
砷、锑、秘、汞、银化物的速测技术—铜片显色法和氰化物的速测技术

砷、锑、秘、汞、银化物的速测技术—铜片显色法和氰化物的速测技术1.速测原理在酸性条件下,某些无机化合物可与金属铜作用产生色彩变幻,由此推想可能存在的某些有害化合物。
本办法最低检出限砷为10ug,汞为100ug,按取样量5g计,最低检出量砷为2mg/kg,汞为20mg/kg。
2.速测范围本办法适用于食物中毒残留物中砷、锑、秘、汞、银、硫化物的迅速检测,以及保障性监测。
3.试验用器材电热板(也可用酒精灯等其他加热装置)、三角烧瓶、99.99%以上纯度的铜片、优级纯盐酸、氯化亚锡等。
4.速测步骤取样品5g于三角烧瓶中,加入25mL蒸馏水或纯净水,加入5mL盐酸,加入约0.5g混合试剂,将三角烧瓶放在加热装置上,使样液微沸约10min(目的是驱除可能存在的硫化物或亚硫化物),加入2片铜片,保持样液微沸约20min。
假如液体蒸发较快,注重补加一些热的蒸馏水或纯净水。
5.结果判定若加热30min后铜片表面变色,可按表5-5所示推想样品中可能存在的化合物,并保留样品,有条件时分离加以确证。
表5-5 铜片变色后预示可能存在的金属化合物 6.解释 (1)温控调到样液微沸即可,避开高温。
(2)加热过程中,注重观看铜片色彩变幻状况,如铜片已显然变黑时,应停止加热,否则当砷含量较高时会使沉积在铜片上的黑色物质脱落。
(3)溶液中浓度以2%~8%为宜,过低反应不能举行,过高会导致砷、汞的挥发损失。
(4)含蛋白质、油脂高的样品,会降低办法的敏捷度,应将样品消化处理后测定。
二、氰化物的速测技术氰化物属于烈性毒物,在食品中的来源有污染和人为投毒等。
有些植物本身含有氰昔,如木薯、苦杏仁、银杏、批把仁等。
氰苷经酶、酸或加热分解后产生剧毒的具挥发性的或氢氰酸。
氢氰酸的致死量约为60mg,或的致死量在200~300mg,苦杏仁的成人致死量平均50粒,儿童平均11粒。
1.速测原理氰化物遇酸产生氢氰酸,氢氰酸与加载在试纸上的苦味酸钠作用生成橘红色异氰紫酸钠。
药物分析各章药物的结构特点

本类药物具烃氨基侧链,显弱酸性,游离碱溶于有机溶剂,其盐可溶于水;分子中具有邻苯二酚(或苯酚)结构的药物可与重金属离子络合呈色,露置空气中或遇光易氧化,色渐变深,在碱性溶液中更易变色;多数药物分子中有手性碳原子,具有光学活性;苯环上的取代基也各具特性均可供分析用。
有紫外及红外吸收特性。
鉴别:三氯化铁反应。
肾上腺素:翠绿色,加氨试液,显紫色→紫红色。
重酒石酸去甲肾上腺素:翠绿色,加碳酸氢钠试液,显蓝色→红色。
盐酸去氧肾上腺素:紫色。
盐酸异丙肾上腺素:深绿色,滴加新制的5碳酸氢钠试液,显蓝色→红色。
氧化反应:盐酸异丙肾上腺素:在偏酸性条件下被碘迅速氧化,生成异丙基肾上腺素红,加硫代硫酸钠使碘的棕色消退,溶液显淡红色。
重酒石酸去甲肾上腺素:在上述条件下比较稳定,几乎不被碘氧化,需在酒石酸氢钾的饱和溶液(pH为3.56)中被碘氧化,溶液为五色或仅显微红色或淡紫色。
肾上腺素:在酸性条件下,被过氧化氢氧化后,溶液显血红色。
甲醛-硫酸反应:重酒石酸去甲肾上腺素:橙色→暗紫色。
异丙肾上腺素:污紫色。
去氧肾上腺素:污紫色。
紫外特征吸收与红外吸收光谱。
肾上腺素、重酒石酸去甲肾上腺素、盐酸去氧肾上腺素和盐酸异丙肾上腺素均需检查酮体。
紫外吸收分光光度法。
酮体在310nm处有最大吸收,而药物本身在此波长处几乎没有吸收。
规定:在310nm波长处测定吸收度不得大于0.05,即相当于含酮体的量低于0.06.含量测定:非水溶液滴定法。
冰醋酸为溶剂,加入醋酸汞试液消除氢卤酸的干扰,结晶紫为指示液。
溴量法:盐酸去氧肾上腺素及其注射液采用此方法测定含量。
利用药物中的苯酚结构,在酸性溶液中酚羟基邻、对位活泼氢能与过量的溴定量地发生溴代反应,再以碘量法测定剩余的溴,根据消耗的溴及硫代硫酸钠两种滴定液的量即可计算各供试品的含量。
操作要点:⑴游离溴及碘极易挥散,操作过程中必须防止逸失。
⑵不能加入太过量的溴,否则在溴代反应中会引起酚羟基的氧化或溴化,一般加入的溴液以过量2为宜。
怎么检验铜化学成份的方法

怎么检验铜化学成份的方法
有几种常用的方法可以检验铜的化学成份,包括:
1. 铜离子检测:通过添加某些特定试剂,如二硫化氢(H2S)或氨水(NH3),可以生成特征性的沉淀或溶液颜色变化,进而确认铜的存在。
2. 火焰测试:将铜样品置于烧嘴火焰中,观察火焰变色。
铜在焰色测试中会呈现特征性的蓝绿色。
3. X射线荧光光谱(XRF):这是一种非破坏性的测试方法,通过测量样品中的X射线荧光来分析其化学成分。
可以通过测量铜的特征性X射线发射来确定其含量。
4. 电化学测试:使用电化学方法,如电化学石墨炉原子吸收光谱法(EAGF-AAS),可以测定铜的含量。
该方法通常需要使用特定的仪器和实验条件。
5. 化学分析法:通过对铜样品进行溶解,并使用化学试剂进行反应,可以进一步分析铜的化学成分。
常用的化学分析方法有滴定法、石墨炉原子吸收光谱分析法(GFAAS)等。
根据具体需求和实验条件,可以选择适合的方法进行铜化学成分的检验。
pan滴定铜离子颜色变化

pan滴定铜离子颜色变化引言:铜离子是一种常见的金属离子,其在溶液中呈现出特殊的颜色。
本文将从理论和实验两个方面探讨铜离子在pan滴定过程中的颜色变化,旨在深入了解铜离子的性质和滴定分析的原理。
一、铜离子的特性铜离子是一种二价阳离子,化学符号为Cu2+。
它具有一种独特的蓝绿色,这是因为铜离子对可见光的吸收特性造成的。
铜离子的颜色与其电子结构和配位方式有关。
二、pan滴定的原理pan滴定是一种常用的分析化学方法,用于测定溶液中金属离子的浓度。
pan滴定的原理是基于配体与金属离子之间的络合反应。
在pan滴定中,常用的指示剂是1,10-苯菲啰啉(pan),它能够与铜离子形成稳定的配合物。
三、铜离子和pan的络合反应铜离子和pan之间的络合反应可以用下面的方程式表示:Cu2+ + pan → [Cu(pan)]2+在此反应中,铜离子和pan配体结合形成了稳定的铜-pan配合物。
这种配合物具有特殊的颜色,并且在滴定过程中发生颜色的变化。
四、pan滴定铜离子的实验步骤1. 准备铜离子溶液和pan指示剂溶液;2. 将铜离子溶液滴入滴定瓶中;3. 滴加pan指示剂溶液,观察颜色变化;4. 继续滴加指示剂溶液,直至颜色发生明显变化;5. 记录滴定过程中消耗的指示剂体积。
五、颜色变化的解释在pan滴定过程中,初始时的铜离子溶液呈现无色或淡黄色。
随着pan指示剂的滴加,铜离子与pan配体发生络合反应,形成蓝色或紫色的铜-pan配合物。
当铜离子与pan配体的摩尔比为1:1时,颜色变化最为明显。
六、颜色变化的机理铜离子和pan配体之间的颜色变化是由于电子跃迁引起的。
在铜离子的电子结构中,存在未占据的d轨道,而pan配体中的羰基(C=O)具有一对孤对电子。
当铜离子与pan配体结合时,d轨道与羰基的孤对电子之间发生电子跃迁,产生了特定的吸收峰,使得配合物呈现出蓝绿色。
七、pan滴定铜离子的应用pan滴定铜离子的方法广泛应用于环境监测、水质分析和食品检测等领域。
(完整版)黄酮类显色鉴别反应
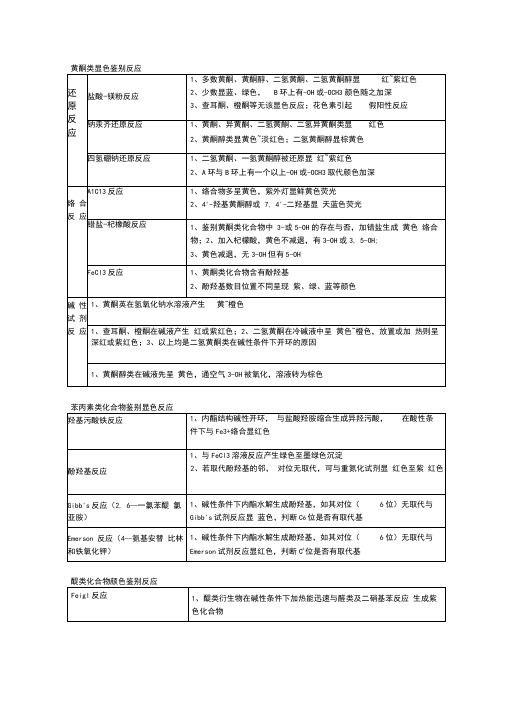
1、如有a--酚羟基或邻二酚羟基Z勾时,则可与Pb2+、Mg2+等
金属离子形成络合物,显 橙黄、橙红、紫红、蓝色
对亚硝基一甲聚胺反应
1、9或10位未取代的羟基蔗醍类化合物,尤箕是1,8--二羟基
衍生物,其羟基对位的亚甲基上的氢很活泼, 可与0.1%对亚硝基
二甲苯胺毗姥溶液缩合反应产生紫、绿、蓝、灰颜色
3、黄色减退,无3-OH但有5-OH
FeCl3反应
1、黄酮类化合物含有酚羟基
2、酚羟基数目位置不同呈现 紫、绿、蓝等颜色
碱 性 试 剂 反 应
1、黄酮英在氢氧化钠水溶液产生黄~橙色
1、查耳酮、橙酮在碱液产生 红或紫红色;2、二氢黄酮在冷碱液中呈 黄色~橙色,放置或加 热则呈深红或紫红色;3、以上均是二氢黄酮类在碱性条件下开环的原因
无沉淀
沉淀
糅质的化学性质
还原性
酚羟基多,易被氧化,能还原菲林试剂
与蛋白质沉淀
结合产生不溶于水的沉淀,作为提纯、鉴别的方法之一
与重金属沉淀
沉淀,在提取分高中此方法可除去糅质
与生物碱沉淀
沉淀,在提取分高中此方法可除去糅质
与三氯化铁作用
产生蓝黑色或绿黑色反应或沉淀。制造蓝色墨水
与铁氧化钾氨作用
反应呈深红色,很快变成棕色
Marquis试剂
吗啡--橙色至紫色;可待因--洋红色 至紫色
两类糅质的鉴别反应
试齐1」
可水解糅质
缩合鞋质
1、稀酸(共沸)
无沉淀
暗红色糅红沉淀
2、澳水
无沉淀
黄色或橙红色沉淀
3、三氯化铁
监色或监黑色(或沉淀)
绿或绿黑色(或沉淀)
4、石灰水
Cu的显色与药物分析

Cu的显色与药物分析引言铜是一种重要的金属元素,在许多领域具有广泛的应用。
其中,铜的显色反应在药物分析中起着重要的作用。
本文将介绍铜的显色特性以及在药物分析中的应用。
铜的显色特性水合离子与铜络合物铜离子(Cu2+)在水中可以形成多种水合离子和络合物。
其中,最常见的是四水合铜离子(Cu(H2O)42+)。
此外,铜离子还可以与其他配体形成各种络合物,如铜三胺络合物(Cu(NH3)32+)和铜二乙醇络合物(Cu(C2H5OH)2^2+)等。
铜的氧化还原性铜离子具有较强的氧化还原性。
在适当的条件下,它可以发生氧化反应或还原反应。
例如,Cu2+可以被还原为Cu+,进一步还原为Cu。
此外,它还可以参与其他氧化还原反应,如与硫化物反应生成硫化铜。
铜在药物分析中的应用铜作为指示剂铜的显色特性使其成为一种常用的指示剂。
在药物分析中,通过观察溶液的颜色变化来判断溶液中物质的存在与浓度。
例如,一些药物分析方法使用铜络合物的颜色作为定量分析的依据。
铜的显色反应铜离子可以与许多物质发生显色反应。
其中一种常见的反应是铜离子与酚类化合物发生络合反应,生成显色的络合物。
这种反应常用于测定药物中的酚类成分。
此外,铜离子还可以与其他有机物发生显色反应,如与某些草酸类物质发生还原反应生成蓝色络合物。
铜的定量分析铜离子的定量分析是药物分析中的一个重要研究方向。
常用的铜离子定量方法包括电化学方法、光度法、荧光法等。
其中,最常用的方法是光度法,通过测定铜络合物的吸收光谱来确定铜的浓度。
结论铜的显色特性在药物分析中具有重要的应用。
铜可以作为指示剂使用,并与许多物质发生显色反应。
其定量分析方法也得到了广泛研究和应用。
对铜的显色与药物分析的研究有助于提高药物分析的准确性和灵敏度。
参考文献1.Xiao L, et al. Copper complexes as dyes in clinical and analytical chemistry. Trends Anal Chem. 2020;124:115789.2.Gao Y, et al. Determination of copper in pharmaceutical products by spectrophotometry. Int J Anal Chem.2021;2021:6649465.。
(第三章)药物分析-色谱分析法

纸色谱
1)紫外光 :对未知化合物,展开后在用显色剂以前,应先在紫 外灯下进行察看。紫外光常用两种波长254 nm与365 nm。
2)碘:碘是一种非破坏性显色剂,价廉易得,显色迅速、灵敏。 与物质的反应往往是可逆的。
3)水:为非破坏性显色剂,用于硅胶薄层,纸色谱不常用。
纸色谱
④ 测量Rf值与鉴定:
必须注意:展开剂也须事先用缓冲液平衡后再使用。
斑点拖尾现象形成的几种原因:
① 点样量过多,超过了滤纸溶剂的溶解能力。
② 物质电离,导致Rf值差异。
③ 被分离的物质与滤纸上的Cu2+、Ca2+、Mg2+等杂质形 成络合物而形成拖尾,可改用纯滤纸展开。 ④ 某些物质在展开过程中分解,产物有不同的Rf值。
样点朝上,展开剂从上向下通过薄层或滤纸。展开 剂通过滤纸条或纱布条作为桥梁进行转移。展开剂 受吸附和重力的双重作用,展开较快。
特 殊 装 置
纸色谱的下行展开法
3. 双向展开
用于某些复杂成分或Rf值较小的成分的展开
B
d
C
c
b
a
d
c
b
a
A
混合样品
CB
A
**边缘效应: 消除边缘效应的方法: 1. 将展开槽、纸或薄层板用展开剂蒸气饱和; 2. 在层析缸内壁贴上用展开剂浸湿的滤纸条; 3. 点样位置距离边缘一定距离。
(1)氧化铝:有碱性、中性和酸性三类,粒度规格大多为100~150目。 碱性氧化铝(pH9~10):适用于碱性物质(如胺、生物碱)和对酸敏感的 样品(如缩醛、糖苷等),也适用于烃类、甾体化合物等中性物质的分离。 酸性氧化铝(pH3.5~4.5):适用于酸性物质如有机酸、氨基酸等以及色素 和醛类化合物的分离。 中性氧化铝(pH7~7.5):适用于醛、酮、醌、苷和硝基化合物以及在碱性 介质中不稳定的物质如酯、内酯等的分离,也用来分离弱的有机酸和碱等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•此法目前仍为各国药典收载作为磺胺药物的鉴别方法。 •4.麻黄碱类的定性分析
•
•鉴 •取麻黄碱溶液数滴,加硫酸铜试液1滴,20%的
别:
NaOH溶液2滴,即呈现紫色,用乙醚数ml萃取 ,乙醚层呈紫兰色,水相中显兰色,反应式为:
•
•5.吡啶类的定性分析
•吡啶环具有第三氮原子结构,呈碱性可与一些沉淀剂发生沉淀反应
•一.与O—O型配位基团或O—O型化合物反 应•1.生成稳定的有色螯合物沉淀
• N—亚硝基苯胲胺
•2.形成极性共价型化合物
•兰色
•
•双环已酮 草酰二醇
•深蓝色沉 淀
•二. 与O—N型配位基团反应
•1.与酮肟类作用产生有色沉淀
•绿色沉淀
•
•黄绿色沉淀
•2.与1,2—二氨基茵醌—磺酸作用产生深兰或绿色沉淀
•位原子
•
中未共有的电子对形成
•
•参考文献 •余仲建《有机化合物系统鉴定法》 •刘立群《有机理论与药物分析》 •陈耀祖《有机分析》 •中山大学等译《无机试剂中的有机试剂》 •南京药学院主编《药物分析》
•
•
—NRH
• 常见的配位基团有: >C═O, >C═S, —S—, ≡N—N, >NH,
•
—NH2, —N═O, —CHO
•
••必要条件:
•
有机试剂或铜⑾离子必须有一定的颜色
••原理:
•
a.反应生成物具有显色或深色作用
•
b.产生沉淀物
•
c. 沉淀的溶解度发生极大的变化,能被有机溶剂
•
萃取而呈现不同色泽
•深蓝或绿色沉 淀
•3.与茜素兰在酸性溶液中作用产生兰色结晶形沉淀
•
•蓝色结晶型沉淀
•三.与具有含S官能团的有机试剂反 应
•红氨酸
•黑色沉淀
•
•铜⑾离子在药物分析中的应用
•1.新配制氢氧化铜鉴别乙醇、乙酸、乙醛、甲 酸、甘油和葡萄糖等简单的有机化合物
•2.氨基酸、多肽和蛋白质的鉴别分析
•氨基酸的羧基可与一些金属成盐
•
• 双缩脲在氨性环境下极易与铜⑾离子生成红色或紫色螯合物 ,结构式为:
• 蛋白质分子中含有多个与双缩脲结构相同的肽键,因此蛋 白质也可以与铜⑾离子作用。
•
•注 • 一些含有一个肽键和一个—CH2NH2、—CRH—
! NH2、
CH2OH 、 —CH2—CH2以及NH2—C—
C—NH2等物质
•
︳︳
•茶碱
•
•结论
•综上所述,如果一个有机分子中含有一个成盐基团, 其中的活泼氢可被Cu2+取代,同时另外还含有一个配 位基团,该基团中有一个具有未共用电子对的原子, 当位置与性质合适时,就可以与Cu2+作用,分别以共 价键与配位键结合,形成内轨型配合物。
•常见的成盐基团有:—OH, —SH, —COOH, —SO3H, —NH2,
•异烟肼
•尼可刹米
•烟酸
•
•6.茶碱,嘌啶类的检测分析
• 有若干生物碱,碱性极弱,不能像一般强 碱性的氮原子上形 成带阳电荷的离子,如═NH2,═NH等。反之,氮原子上的氢 在一定的溶剂中加入一定的试剂能解离成H+和带阴电荷的氮 原子基团,与金属离子形成配合物。 • Cu2+在氨碱性溶液中与茶碱作用产生沉淀,可测得其含量 :
Cu的显色与药物分析
2020年5月25日星期一
•铜⑾离子的外层电子构型为3S23P63d9,它的3d,4S,4P 电子亚层有能级较低的空轨道,可以接受N、O、S等原 子所提供的孤电子对,形成共价型或配位型极性键的 化合物,具有特征颜色,从而可以利用铜离子鉴别和 测定某些有机物的种类和含量。
•
•铜⑾离子的化学性质
‖‖
•
NH2 NH2
OO
•也有类似的反应。因此,有类似反应的物质并
•3.磺胺•不类一药定物都的是鉴蛋白定质分和析多肽。
• 磺胺类药物很多,大部分用来抑菌消炎。磺胺药物与 Cu2+能生成盐类,在反应过程中产生不同颜色的沉淀物。根 据颜色反可以区别磺胺药物的种类。 • 磺胺药物在水溶液中的电离度很小,鉴定时先往磺胺药 物的水溶液中加0.1mol•L-1NaOH溶液数滴,使之成为钠盐, 然后再加入CuSO4试液,由于生成的磺胺铜盐的电离度和溶 度积小于其钠盐而析出:
