第五章 二元相图
第5章 相图

2.可逆与不可逆多晶转变
z 多晶转变相图 4个单相区
晶型II熔融曲线
晶型转变线 晶型I的升华曲线
熔体的蒸气压曲线
3相平衡点: 晶型II的升华曲线 晶型II、熔体和气相
3相平衡点: 晶型I、II和气相
z 多晶转变相图(介稳平衡态)
过热晶型I熔融曲线 过热晶型I的介稳单相区
过冷熔体的介稳单相区
硅钙石:不一致熔 各种高炉矿渣中
水泥熟料生产重要
9%体积效应
C2S:一致熔融化合物 具有复杂的多晶转变 C3S:不一致熔融化合物
2150℃ ~ 1250℃
IV. 三元系统相图
对于三元凝聚态系统, C=3,n=1(T)
相律:F = C-P + n = 4-P
Fmin = 0,Pmax = 4 Pmin = 1,Fmax = 3
z 自由度(F)
在温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内任意改变而不会引起旧相消失或新相产生的 独立变量数目.
z 组分及独立组分(C)
组分 系统中每个能独立分离出来,并能独立存在的化学纯物质. 独立组分 足以表示系统中各个相的组成所需的组分的最小数目.
C = 组分数-独立的化学反应数-独立的限制条件数
M’熔体的结晶路程
液相点
L M’
1
F=2
L→S F=1
3
L→S F=1
5
固相点
L→S 2
4 L→S
6S
M
⑦ 形成有限固溶体的二元相图
B在A中 形成的 固溶体
SA(B)的 溶解度 曲线
B在A中 的最大 固溶度
A在B中 的最大 固溶度
A在B中 形成的 固溶体
大学材料科学基础 第五章材料的相结构和相图(1)

弗兰克尔空位
肖脱基空位
2) 为了保持电中性,离子间数量不等的置换会 在晶体内部形成点缺陷。 如:2Ca2+→Zr4+ ,形成氧离子空缺。 3) 陶瓷化合物中存在变价离子,当其电价改变 时,也会在晶体中产生空位。 如:方铁矿中,部分Fe2+被氧化为Fe3+时, 2FeO+O → Fe2O3中,产生阳离子空缺。 同理,TiO2中,部分Ti4+被还原为Ti3+时,产 生阴离子空缺。 这种由于维持电中性而出现的空位,可以 当作电子空穴。欠缺或多出的电子具有一定的 自由活动性,因而降低了化合物的电阻。这种 现象在材料的电性能方面有重要意义。
3.陶瓷材料中的固溶方式
陶瓷材料——一般不具备金属特性,属无机非金属。 无机非金属化合物可以置换或间隙固溶的方式溶入其 它元素而形成固溶体,甚至无限固溶体,但是一般形 成有限固溶体。 如:Mg[CO3] → (Mg,Fe)[CO3] →(Fe,Mg)[CO3] →Fe[CO3] 菱镁矿 含铁菱镁矿 含镁菱铁矿 菱铁矿 不改变原来的晶格类型,晶格常数略有改变。
(3) 多为金属间或金属与类金属间的化合物, 以金属键为主,具有金属性,所以也称金属 间化合物。 (4) 晶体结构复杂。 (5) 在材料中是少数相,分布在固溶体基体 上,起到改善材料性能、强化基体的作用。 中间相可分为以下几类: 正常价化合物;电子化合物;间隙相;间隙 化合物;拓扑密堆相。
1. 正常价化合物 • 通常是由金属元素与周期表中第Ⅳ、Ⅴ、 Ⅵ族元素形成,它们具有严格的化合比, 成分固定不变,符合化合价规律,常具有 AB、AB2、A2B3分子式。 • 它的结构与相应分子式的离子化合物晶体 结构相同,如分子式具有AB型的正常价化 合物其晶体结构为NaCl型。正常价化合物 常见于陶瓷材料,多为离子化合物。如 Mg2Si、Mg2Pb、MgS、AuAl2等。 • 在合金材料中,起弥散强化的作用。
金属二元二元相图

100%
5.1.3. 相图的建立
5.1. 基本概念
5.1.3 相图的建立 可以从理论和实验两条途径获得相图 实验:测临界点 理论:热力学函数计算
测定临界点的方法:热分析、X射线、电阻法、 金相分析法、热膨胀、磁性方法等 原理:材料在到达临界点时,相关的性能或参数 有一个突变,通过测突变点来确定临界点。
5.3 共晶相图
2. 共晶成分( 61.9wt.% Sn) 在T=183oC时发生共晶转变 LE M + b N
合金中各相的相对百 分数:
% =
EN = 45.4% MN
b% =
ME = 54.6% MN
5.3.4 平衡凝固过程及组织
5.3 共晶相图
L
L
b
b
共晶组织中的II、bII,不容易在金相中被辨认
5.2
匀晶相图
5.2.3 非平衡匀晶转变
总的特点:成分不均匀 固相线偏离 易形成枝晶偏析
5.2 .3 非平衡转变
5.2
匀晶相图
1260
1240 1220 1205
固相线偏离
5.2 .3 非平衡转变
5.2
匀晶相图
先凝固的部分富Ni,不易侵蚀,呈现亮白色,成为枝干. 后凝固的部分富Cu,易被侵蚀,呈现暗黑色,分布于枝间.
第五章-I
二元相图
Binary Phase Diagram
T
米
水
基本概念- 相律、成分表示方法、相图测定、杠杆定理
匀晶
形成化合物的相图 共晶型
二 元 相 图
典型的 二元相图
共晶 包晶
包晶型
具有固态相变 两相平衡转变
材料科学基础 第5章 相 图剖析

由于 所以
dni dni
dG (i i )dni
在 相和 相处于平衡时,dG=0 ,故:
i i
即两相平衡的条件是两相中同一组元的化学 位相等。此时,在两相之间转移趋于平衡。 若多元系中有C个组元,P个相,则它们的相 平衡条件可以写成:
由热力学原理可知,当组元在不同相间转 移时,将引起体系自由能的变化。对于一个多 元系,这种自由能变化可用下式表示:
dG Vdp SdT
dn
i
i
在等温等压条件下,可简化为:
dG
dn
i
i
如果体系中只有 和 两相,当极少量(d n i)的 i 组元从 相转移到 相中,则B
Pb
10
20
30
40
50
60
70
80
90
500 400 tA 300 327.5℃ 231.9℃ M α +L 183℃ 19 α +β F Pb 10 20 30 40 50 60 70 80 90 G Sn E 61.9 L+β N β 97.5 L
200 α 100
tB
W W1 W2
2的质量 Wx W1 x1 体系中相 W21 x 体系中相 的质量 体系中物质的总质量 2
t1 t2 M R P Q
L1
L2 L E x x2 20 40 K S N B 100
由上两式可得:
体系中 相1 相 中 B2 组元的含量 B 中 组元的含量 B组元的含量
W1 (x x1 ) W2 (x 2 x)
1083
时间
Cu 0
30
实验五.二元液系相图
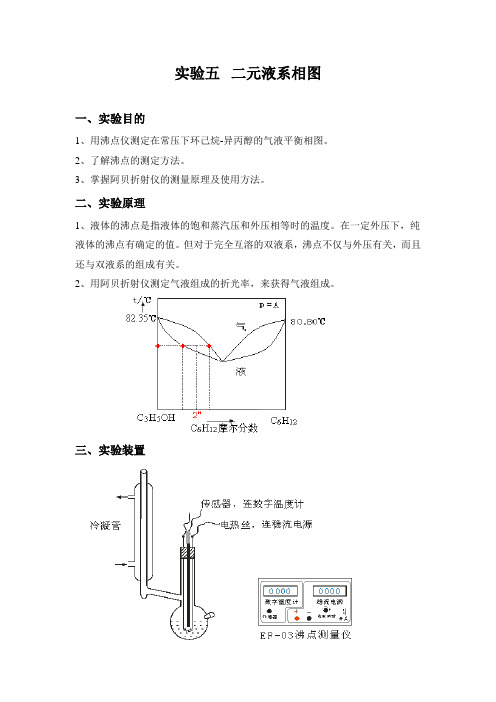
实验五二元液系相图一、实验目的1、用沸点仪测定在常压下环己烷-异丙醇的气液平衡相图。
2、了解沸点的测定方法。
3、掌握阿贝折射仪的测量原理及使用方法。
二、实验原理1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。
在一定外压下,纯液体的沸点有确定的值。
但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。
2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。
三、实验装置四、仪器及试剂仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管试剂:异丙醇、环己烷五、实验步骤1、配制含异丙醇约5%、10%、25%、35%、50%、75%、85%、90%、95%质量分数的环已烷溶液。
2、安装好干燥的沸点仪。
3、加入异丙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
4、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。
5、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。
6、用干燥的小滴管取液相液样,迅速用阿贝折射仪测其折光率。
7、每份样品需读数三次,取其平均值。
实验完毕,将蒸馏器中溶液倒回原瓶。
8、同法用含有异丙醇约为5%、10%、25%、35%、50%、75%、85%、90%、95%的环已烷溶液进行实验,各次实验后的溶液均倒回原瓶中。
实验过程应注意室内气压的读数。
9、根据环己烷-异丙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。
10、实验完毕后,关闭冷凝水,关闭电源,整理实验台。
六、阿贝折光仪的使用1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。
2、打开遮光板,合上反射镜。
3、轻轻旋转目镜,使视野最清晰。
4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
材料科学基础-第五章 材料的相结构及相图

相律在相图中的应用
C
2 二元系
P 1 2
3 1
f 2 1 0
3 2 1 0
含义
单相合金,成分和温度都可变 两相平衡,成分、相对量和温度 等因素中只有一个独立变量 三相平衡,三相的成分、相对 量及温度都确定 单相合金其中两个组元的含量 及温度三个因素均可变 两相平衡,两相的成分、数量 及温度中有两个独立变量 三相平衡,所有变量中只有 一个是独立变量 四相平衡所有因素都确定不变
结构简单的具有极高的硬度及熔点,是合金工具钢和硬 质合金的重要组成相。
I. 间隙化合物
间隙化合物和间隙固溶体的异同点
相同点: 非金属原子以间隙的方式进入晶格。
不同点: 间隙化合物:间隙化合物中的金属组元大多与自 身原来的结构类型不同 间隙固溶体:间隙固溶体中的金属组元仍保持自 身的晶格结构
I. 尺寸因素
II. 晶体结构因素 组元间晶体结构相同时,固溶度一般都较大,而且有可 能形成无限固溶体。若不同只能形成有限固溶体。
III. 电负性差因素
两元素间电负性差越小,越易形成固溶体,且形成的 固溶体的溶解度越大;随两元素间电负性差增大,固 溶度减小。
1)电负性差值ΔX<0.4~0.5时,有利于形成固溶体 2)ΔX>0.4~0.5,倾向于形成稳定的化合物
Mg2Si
Mg—Si相图
(2)电子化合物
由ⅠB族或过渡金属元素与ⅡB,ⅢB,ⅣB族元素 形成的金属化合物。 不遵守化合价规律,晶格类型随化合物电子浓度 而变化。 电子浓度为3/2时: 呈体心立方结构(b相); 电子浓度为21/13时:呈复杂立方结构(g相); 电子浓度为21/12时。呈密排六方结构(e相);
NaCl型 CaF2型 闪锌矿型 硫锌矿型 (面心立方) (面心立方) (立方ZnS) (六方ZnS)
材料科学基础 第五章 5.1-5.4相图

5.2.3 杠杆定律
设成份为 X的合金的总重量为1,液相的相对重量为 QL,其 成份为 X1,固相相对重量为Qα,其成份为X2,则 :
5.2.4 相图的类型和结构 根据组元的多少,可分为单元系、二元系、三元 系 …. 相图。
二元系相图的类型有:
① 液态无限溶解,固态无限溶解 -匀晶相图; ②液态无限溶解,固态有限溶解 -共晶相图和包晶
共晶组织:共晶转变产物。(是两相混合物)
共晶合金的特殊性质: ①比纯组元熔点低,简化了熔化和铸造的操作; ②共晶合金比纯金属有更好的流动性,其在凝固之 中防止了阻碍液体流动的枝晶形成,从而改善铸造 性能; ③恒温转变(无凝固温度范围)减少了铸造缺陷, 例如偏聚和缩孔; ④共晶凝固可获得多种形态的显微组织,尤其是规 则排列的层状或杆状共晶组织可能成为优异性能的 原位复合材料(in-situ composite )。
5.2.2 相律
相律(phase rule)是表示在平衡条件下,系统的自 由度数、组元数和相数之间的关系,是系统的平 衡条件的数学表达式。 相律数学表达式:f = C – P + 2 式中 P—平衡相数 C—体系的组元数 f—体系自由度(degrees of freedom) 数 2-温度和压力 自由度数 f:是指不影响体系平衡状态的独立可 变参数(温度、压力、浓度等)的数目。 在恒压下,相律表达式: f = C – P + 1
相律的应用
① 利用它可以确定系统中可能存在的最多平衡相数 单元系,因f ≥0,故 P≤1-0+1=2,平衡相最大为二个。 注意:这并不是说,单元系中能够出现的相数不能超过二 个,而是说,某一固定 T下,单元系中不同的相只能有两 个同时存在,而其它相则在别的条件下存在。
ch5-2 二元相图

24
共晶反应要点
• 共晶转变在恒温下进行。 • 转变结果是从一种液相中结晶出两个不同的固相。 • 存在一个确定的共晶点。在该点凝固温度最低。 • 成分在共晶线范围的合金都要经历共晶转变。
材料科学基础
第5章 相 图 5.3 二元相图
主讲:徐敏虹
1
二元相图的几何规律
1.两个单相区之间必定有一个由这两个相组成的两相区,而 不能以一条线接界。两个两相区必须以单相区或三相水平线 隔开。由此可以看出二元相图中相邻相区的相数差一个(点 接触除外)。这个规律被称为相区接触法则。
2
2.在二元相图中,若是三相平衡,则三相区必为一水平线,这条
T,C
183
L
L+
L+
c
d
e
+
Pb
Sn
25
将用适当方法(如侵蚀)处理后的金 属试样的磨面或其复型或用适当方法 制成的薄膜置于光学显微镜或电子显 微镜下观察到的组织
➢ 相组成物:组成合金显微组织的基本相。
由于形成条件不同,合金中各相构成的晶粒 将以不同的数量、形状、大小和分布等相组 合,并在显微镜下可区分的部分,称为组织
1.没有共晶反应过程,
T,C
而是经过匀晶反应形成 单相固相。
L
L+
L
+ Ⅱ
2.要经过脱溶转变, 固溶体中析出另一 种固相的过程,产 物称为次生相和二 次相, Ⅱ
冷却曲线 t Ⅱ
28
29
X2合金结晶过程分析
L
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5-2 二元匀晶相图
固溶体的凝固过程与纯金属一样,也包括形核与长大两个阶
段。但由于存在第二组元,使其凝固过程与纯金属的凝固过程有 所不同,主要表现在:
(1) 固溶体的凝固是在一个温度范围内完成的,而纯金属的
凝固是在恒温下完成的。 (2) 固溶体凝固时所形成的固相成分与液相不同,所以形核
时除需要结构起伏和能量起伏外,还需要一定的成分起伏(液相
ae线、be线—液相线 am线、bn线—固相线 mf线—Sn在Pb中的固溶度曲线 ng线—Pb在Sn中的固溶度曲线 men水平线—共晶转变线
wSn /%
在e点对应的温度下,会由
PbSn二元共晶相图
成分为e的液相中同时凝固出成分为m的 相和成分为n的 相
Te Le ( m n )
5-3 二元共晶相图
一、相图分析
两组元在液态无限互溶、在固态有限互溶或完全不互溶, 且在冷却过程中发生共晶转变的相图,称为共晶相图。 具有共晶相图的合金系 主要有Pb-Sn、Pb-Sb、Al-Si、
AgAu、PbBi等,一些硅酸
盐也具有共晶相图。
wSn /%
PbSn二元共晶相图
5-3 二元共晶相图
dG Vdp SdT i dni
式中S和V分别为体系的熵和体积,p为压力,T为温度,
i是 i 组元的化学位,它代表体系内组元在相间转移的驱
动力,dni为 i 组元在不同相之间的转移量。 在等温等压条件下,上式可简化为:
dG i dni
5-1 相图的基本知识
假设体系中只有 和 两相,当极少量(dni)的 i 组元从 相转移到 相中,则引起的体系自由能变 化为: 实际上 故
70Ni 50Ni 30Cu Ni 30Ni 50Cu 70Cu 1452 T / C L 1452 L+ 1083 1083
Cu 温度 / C
时间
Cu
wNi / %
Ni
5-1 相图的基本知识
思考题: 1. 何谓相律?
2. 请写出不含气相的凝聚态体系中相律的
具体表达式。
5-2 二元匀晶相图
第五章 二元相图
概述
相图:描述在热力学平衡状态下,材料的相和组 织与其成分和温度之间关系的图形。
从相图中可以确定不同成分的材料在不同温度下
所含相的种类和相对数量,通过相图可以预测材料的 性能,故相图是研究新材料和制定材料的生产工艺如 熔炼、铸造、塑性加工以及热处理规范的重要工具。
5-1 相图的基本知识
L Qo,在T 温度时液相的成分为 wB 、
L wB o wB
L L+
o
w B
B
A
wB
杠杆定律的推导
质量为QL,固相 的成分为 wB、质量为Q。 显然,T 温度时液、固两相的质量和应等于合金的总质 量,即:
Qo QL Q
5-2 二元匀晶相图
L L+
o
液相中B 组元的质量应为 QL wB,
L
L wB o wB
固相中B 组元的质量应为 Q wB,合金 中B 组元的质量应为 Qo wB 。
o
w B
B
A
wB
o
o L Q w Q w Q w 故有: o B L B B
o L (QL Q ) wB QL wB Q w B
后结晶的枝间的成分不同, 称为枝晶偏析。
CuNi 合金的铸态组织 枝干富Ni(白色),枝间富Cu(黑色)
5-2 二元匀晶相图
思考题: 1. 何谓匀晶转变?何谓成分过冷?何谓晶内偏析?
何谓枝晶偏析?
2. 指出单相固溶体合金的凝固过程与纯金属(或纯 组元)的凝固过程之间的主要区别。 3. 指出单相固溶体合金的平衡凝固过程与非平衡凝 固过程之间的主要区别。
中成分不均匀的现象即称为成分起伏)。 (3) 为了满足不同温度下两相平衡共存的成分要求,液、固
两相的成分必须随温度下降而不断地发生变化,这种成分的变化
必然依赖于两组元原子的扩散来完成。
5-2 二元匀晶相图
随着固溶体凝固过程的进行,液 相的量不断减少,而固相的量则不断 增加。在液、固两相平衡共存区,两 相的相对量与它们各自的成分有关。 o w 设合金的成分为 B、总质量为
称为非平衡凝固。
5-2 二元匀晶相图
固溶体在非平衡凝固时液、固两相成分变化及组织变化示意图
5-2 二元匀晶相图
对于固溶体合金的非平衡凝固过程: (1) 固相和液相的平均成分线分别偏离平衡相图中的固 相线和液相线。冷却速度越快,偏离固、液相线越严重; 反之,冷却速度越慢,越接近固、液相线。 (2) 先凝固部分总是富含高熔点组元,后凝固部分总是
这些变量并不都是彼此独立可变的。
5-1 相图的基本知识
由相平衡条件可知,有 C ( P 1) 个方程式表明各个
组元在不同相中的化学位之间的关系,而化学位是组元 浓度的函数,因此,用来确定体系状态的总变量中应有
C ( P 1) 个成分或浓度变量不能独立变化。
显然, P (C 1) 2 个总变量中应包括独立变量和 非独立变量两部分,其中的独立变量数即称为自由度, 用 f 表示。 f = 总变量数 非独立变量数
1 1 1
P 1
2 2 2 2P
P C C C C
5-1 相图的基本知识
(二)相律 相律:平衡条件下,多元多相体系中的组元数与相数之
间存在着一定的关系,这种关系称为相律。
[ P (C 1) 2] C ( P 1) C P 2
5-1 相图的基本知识
对于不含气相的凝聚态体系,压力在通常范围的变化
对平衡状态的影响极小。因此,相律可写成如下形式:
f C P 1
相律给出了平衡状态下多元多相体系中中存在的相数
与组元数及温度、压力之间的关系,对分析和研究相图具
k0 > 1
随溶质含量增大,k01时,合金凝固开始和终了温度降低,k01时,则相反
5-2 二元匀晶相图
液-固界面前沿液相中的溶质成分分布与其决定的凝固温度
1 k0 Rx w L wo (1 e D) k0
wo
1 k0 Rx TL TA mw e D) o (1 k0
o L Q wB wB ao 整理可得: o QL wB wB ob
QL
Q
杠杆定律的力学比喻
5-2 二元匀晶相图
杠杆定律:
Q ao w w % 100% Qo ab wB w
o B L B L B O QL ob w w B L% B 100% L Qo ab wB wB
相图)和具有极大点的相图(如PbTl相图)。 成分对应于极大点和极小点的合金,其液、固两相的成分相同,此时 确定合金状态的变量数应少一个,故自由度 f = 0,即发生恒温转变。
wB / %
a 具有极小点
wB / %
b 具有极大点
其他形式的二元匀晶相图
5-2 二元匀晶相图
二、固溶体的平衡凝固
平衡凝固:凝固过程中以极缓慢的速度冷却,使每个
临界线:acb线—液相线(凝固
温度 / C
b点—纯Ni的熔点
L c d 1083
1452
b
开始线)
adb线—固相线(凝固 终了线) 相区:液相线以上为液相区, 固相线以下为固相区,而液 相线与固相线所包围的区域 为液、固两相平衡共存区。
L+
a
Cu
wNi / %
Ni
5-2 二元匀晶相图
其它形式的二元匀晶相图包括具有极小点的相图(如AuCu、FeCo
L L+
o
L wB o wB
w B
B
A
wB
% — 相的相对量;L% — L相的相对量
杠杆定律只适用于处于平衡状态的两相区,且对相的类
型不作限制。
5-2 二元匀晶相图
平衡分配系数:平衡凝固时固相溶质含量与液相溶质含量之比 w k0 s wL
L T0 L T0
S
k0 < 1 wS wo wL S wL wo wS
有重要的意义。
5-1 相图的基本知识
二、相图的表示方法
材料的状态是由成分、温度和压力决定的,但是压力
对液固相之间或固相之间的变化影响不大,而且材料的状
态变化多数是在常压下进行的,因此,研究材料的相变时 往往不考虑压力的作用。这样,影响材料状态的因素就只 有成分和温度两个参数了,所以,相图就是以材料的成分 和温度为坐标所构成的图形。
5-3 二元共晶相图
单相区:液相L相区 固相 相区 固相 相区 两相区:L + 相区 L + 相区
5-2 二元匀晶相图
m wo T TA Gx k0
成分过冷
成分过冷:液固界面前沿液相的实际温度低于由溶质分布所 决定的凝固温度时所产生的过冷。
5-2 二元匀晶相图
三、固溶体的非平衡凝固
固溶体的凝固依赖于组元原子的扩散,要达到平衡凝 固,必须有足够的时间使扩散进行充分,但在实际生产条 件下,液态材料浇铸后的冷却速度较快,在每一温度下不 能保证足够的扩散时间,从而使凝固过程偏离平衡条件,
富含低熔点组元。
(3) 非平衡凝固总是导致凝固的终了温度低于平衡凝固
时的终了温度。
5-2 二元匀晶相图
非平衡凝固的固溶体内部富含高熔点组元,而后结晶的 外部则富含低熔点组元。这种在晶粒内部出现的成分不均匀 现象,称为晶内偏析。 由于固溶体通常以树枝 状生长方式生长,故非平衡
