苏教版高中化学必修二知识点总结(专题三、四)
高中化学苏教版必修二知识点总结(全面)

高中化学苏教版必修二知识点总结(全面)高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1. A X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横.行.。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期1 2种元素短周期第二周期2 8种元素周期第三周期3 8种元素元(7个横行)第四周期4 18种元素素(7个周期)第五周期5 18种元素周长周期第六周期6 32种元素期第七周期7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
高中化学苏教版必修二知识点总结(全面)

高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
苏教版高中化学必修二知识点总结(专题三、四)
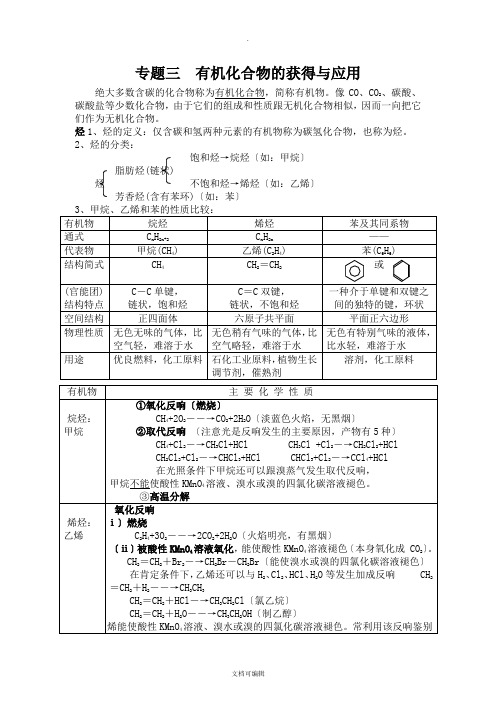
专题三 有机化合物的获得与应用绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO 、CO 2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:饱和烃→烷烃〔如:甲烷〕脂肪烃(链状)烃 不饱和烃→烯烃〔如:乙烯〕芳香烃(含有苯环)〔如:苯〕子的数目。
1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。
区别同分异构体,用“正〞,“异〞,“新〞。
二、食品中的有机化合物食物中的营养物质包含:糖类、油脂、蛋白质、维生素、无机盐和水。
人们肪 肪酸甘油酯 能发生水解反响蛋白质 C H O N S P 等 酶、肌肉、 毛发等氨基酸连接成的高分子能发生水解反响主 要 化 学 性 质 葡萄糖 结构简式:CH 2OH -CHOH -CHOH -CHOH -CHOH -CHO或CH 2OH(CHOH)4CHO 〔含有羟基和醛基〕醛基:①使新制的Cu(OH)2产生砖红色沉淀-测定糖尿病患者病情 ②与银氨溶液反响产生银镜-工业制镜和玻璃瓶瓶胆 羟基:与羧酸发生酯化反响生成酯蔗糖 水解反响:生成葡萄糖和果糖 淀粉 纤维素 淀粉、纤维素水解反响:生成葡萄糖 淀粉特性:淀粉遇碘单质变蓝 油脂 水解反响:生成高级脂肪酸〔或高级脂肪酸盐〕和甘油 蛋白质 水解反响:最终产物为氨基酸盐析 :蛋白质遇见〔饱和的硫酸钠、硫酸铵〕盐析,物理变化 变性 :蛋白质遇见强酸、强碱、重金属盐等变性,化学变化 颜色反响:蛋白质遇浓HNO 3变黄〔鉴别局部蛋白质〕 鉴别 :灼烧蛋白质有烧焦羽毛的味道〔鉴别蛋白质〕酶 特别的蛋白质,在适宜温度下:催化活性具有:高效性、专一性化学与可连续开展有关的化学方程式,单体、链节、聚合度、加聚反响、缩聚反响专题4化学科学与人类文明化学是翻开物质世界的钥匙 一、金属矿物的开发利用1、金属的存在:除了金、铂等少数金属外,绝大多数金属以化合态的形式存在于自然界。
苏教版高中化学必修二知识点总结专题三四

苏教版⾼中化学必修⼆知识点总结专题三四专题三有机化合物的获得与应⽤绝⼤多数含碳的化合物称为有机化合物,简称有机物。
像、2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟⽆机化合物相似,因⽽⼀向把它们作为⽆机化合物。
烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:饱和烃→烷烃(如:甲烷)脂肪烃(链状)烃不饱和烃→烯烃(如:⼄烯)芳⾹烃(含有苯环)(如:苯)3、甲烷、⼄烯和苯的性质⽐较:6、烷烃的命名:(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原⼦的数⽬。
1-10⽤甲,⼄,丙,丁,戊,已,庚,⾟,壬,癸;11起汉⽂数字表⽰。
区别同分异构体,⽤“正”,“异”,“新”。
⼆、⾷品中的有机化合物1、⼄醇和⼄酸的性质⽐较基本营养物质—糖类⾷物中的营养物质包括:糖类、油脂、蛋⽩质、维⽣素、⽆机盐和⽔。
⼈们习惯称糖类、油脂、蛋⽩质为动物性和植物性⾷物中的基本营养物质。
淀粉纤维素淀粉、纤维素⽔解反应:⽣成葡萄糖淀粉特性:淀粉遇碘单质变蓝油脂⽔解反应:⽣成⾼级脂肪酸(或⾼级脂肪酸盐)和⽢油蛋⽩质⽔解反应:最终产物为氨基酸盐析:蛋⽩质遇见(饱和的硫酸钠、硫酸铵)盐析,物理变化变性:蛋⽩质遇见强酸、强碱、重⾦属盐等变性,化学变化颜⾊反应:蛋⽩质遇浓3变黄(鉴别部分蛋⽩质)鉴别:灼烧蛋⽩质有烧焦⽻⽑的味道(鉴别蛋⽩质)酶特殊的蛋⽩质,在合适温度下:催化活性具有:⾼效性、专⼀性第三单元⼈⼯合成有机物化学与可持续发展有关的化学⽅程式,单体、链节、聚合度、加聚反应、缩聚反应专题4化学科学与⼈类⽂明化学是打开物质世界的钥匙⼀、⾦属矿物的开发利⽤1、⾦属的存在:除了⾦、铂等少数⾦属外,绝⼤多数⾦属以化合态的形式存在于⾃然界。
2、⾦属冶炼的涵义:简单地说,⾦属的冶炼就是把⾦属从矿⽯中提炼出来。
⾦属冶炼的实质是把⾦属元素从化合态还原为游离态,即M+n(化合态)M0(游离态)。
得电⼦、被还原3、⾦属冶炼的⼀般步骤:(1)矿⽯的富集:除去杂质,提⾼矿⽯中有⽤成分的含量。
苏教版化学必修二

苏教版化学必修二专题三 <有机化合物的获取与应用>重难点专题三课文目录第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物【重点】1、了解甲烷、乙烯、苯等的主要性质,认识乙烯、氯乙烯、苯的衍生物等在化工生产的重要作用。
2、知道乙醇、乙酸、糖类、油脂、蛋白质的组成和主要性质。
3、了解常见高分子材料的合成反应及乙酸乙酯最佳合成途径的选择。
4、了解取代反应、加成反应、酯化反应、皂化反应、水解反应、加聚反应的变化特征。
5、能根据元素的质量分数计算物质的化学式。
【难点】1、甲烷、乙烯、苯、乙醇、乙酸、糖类、油脂、蛋白质的组成结构和主要性质。
2、根据元素的质量分数计算物质的化学式。
3、乙酸乙酯最佳合成途径的选择。
4、取代反应、加成反应、酯化反应、皂化反应、水解反应、加聚反应的变化特征。
一、化石燃料与有机化合物天然气(甲烷)的利用(一)甲烷的结构(二)甲烷的性质1、物理性质:无色无味气体,密度比空气小,极难溶于水。
(天然气中按体积计,CH4占80%~97%)。
2、化学性质(1)氧化反应:由于甲烷的分子结构稳定,所以通常不与强酸、强碱、强氧化剂(如KMnO4)反应,但能燃烧(2)高温分解:(制取炭黑) (3)、取代反应:定义——有机物分子里的某些原子或原子团被其它原子或原子团所取代的反应叫取代反应。
CH 4光2Cl CH 3Cl 光2Cl CH 2Cl 2 光2Cl CHCl 3 光2ClCCl 4 生成的四种氯的取代物均不溶于水,甲烷中的4个氢原子逐步被氯原子取代,生成一系列甲烷的氯取代物和氯化氢。
取代反应与置换反应的区别(三)烷烃1概念:烃中碳原子跟碳原子之间都是以单键结合成链状,碳原子剩余的价键全部跟氢原子相连,使每个碳原子的化合价都得到充分利用,即都达到“饱和”。
这样的烃叫做饱和烃。
又叫烷烃。
通式为C n H 2n+2。
举例:乙烷 丙烷 丁烷 戊烷2、物理性质:烷烃的物性随着碳原子数和递增,呈现出规律性的变化:状态:气态 液态固态熔沸点:低高主要原因:随着碳原子数的递增,分子量增大,分子间作用力增大。
(完整)苏教版化学必修二知识点整理,推荐文档

第一章物质结构元素周期律1. 原子结构:如:的质子数与质量数,中子数,电子数之间的关系2. 元素周期表和周期律(1)元素周期表的结构A. 周期序数=电子层数B. 原子序数=质子数C. 主族序数=最外层电子数=元素的最高正价数D. 主族非金属元素的负化合价数=8-主族序数E. 周期表结构(2)元素周期律(重点)A. 元素的金属性和非金属性强弱的比较(难点)a. 单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性b. 最高价氧化物的水化物的碱性或酸性强弱c. 单质的还原性或氧化性的强弱(注意:单质与相应离子的性质的变化规律相反)B. 元素性质随周期和族的变化规律a. 同一周期,从左到右,元素的金属性逐渐变弱b. 同一周期,从左到右,元素的非金属性逐渐增强c. 同一主族,从上到下,元素的金属性逐渐增强d. 同一主族,从上到下,元素的非金属性逐渐减弱C. 第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)D. 微粒半径大小的比较规律:a. 原子与原子b. 原子与其离子c. 电子层结构相同的离子(3)元素周期律的应用(重难点)A. “位,构,性”三者之间的关系a. 原子结构决定元素在元素周期表中的位置b. 原子结构决定元素的化学性质c. 以位置推测原子结构和元素性质B. 预测新元素及其性质3. 化学键(重点)(1)离子键:A. 相关概念:B. 离子化合物:大多数盐、强碱、典型金属氧化物C. 离子化合物形成过程的电子式的表示(难点)(AB,A2B,AB2,NaOH,Na2O2,NH4Cl,O22-,NH4+)(2)共价键:A. 相关概念:B. 共价化合物:只有非金属的化合物(除了铵盐)C. 共价化合物形成过程的电子式的表示(难点)(NH3,CH4,CO2,HClO,H2O2)D 极性键与非极性键(3)化学键的概念和化学反应的本质:第二章化学反应与能量1. 化学能与热能(1)化学反应中能量变化的主要原因:化学键的断裂和形成(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小a. 吸热反应:反应物的总能量小于生成物的总能量b. 放热反应:反应物的总能量大于生成物的总能量(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化练习:氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO =O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。
(完整版)苏教版化学必修二知识点整理,推荐文档

第一章物质结构元素周期律1. 原子结构:如:的质子数与质量数,中子数,电子数之间的关系2. 元素周期表和周期律(1)元素周期表的结构A. 周期序数=电子层数B. 原子序数=质子数C. 主族序数=最外层电子数=元素的最高正价数D. 主族非金属元素的负化合价数=8-主族序数E. 周期表结构(2)元素周期律(重点)A. 元素的金属性和非金属性强弱的比较(难点)a. 单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性b. 最高价氧化物的水化物的碱性或酸性强弱c. 单质的还原性或氧化性的强弱(注意:单质与相应离子的性质的变化规律相反)B. 元素性质随周期和族的变化规律a. 同一周期,从左到右,元素的金属性逐渐变弱b. 同一周期,从左到右,元素的非金属性逐渐增强c. 同一主族,从上到下,元素的金属性逐渐增强d. 同一主族,从上到下,元素的非金属性逐渐减弱C. 第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)D. 微粒半径大小的比较规律:a. 原子与原子b. 原子与其离子c. 电子层结构相同的离子(3)元素周期律的应用(重难点)A. “位,构,性”三者之间的关系a. 原子结构决定元素在元素周期表中的位置b. 原子结构决定元素的化学性质c. 以位置推测原子结构和元素性质B. 预测新元素及其性质3. 化学键(重点)(1)离子键:A. 相关概念:B. 离子化合物:大多数盐、强碱、典型金属氧化物C. 离子化合物形成过程的电子式的表示(难点)(AB,A2B,AB2,NaOH,Na2O2,NH4Cl,O22-,NH4+)(2)共价键:A. 相关概念:B. 共价化合物:只有非金属的化合物(除了铵盐)C. 共价化合物形成过程的电子式的表示(难点)(NH3,CH4,CO2,HClO,H2O2)D 极性键与非极性键(3)化学键的概念和化学反应的本质:第二章化学反应与能量1. 化学能与热能(1)化学反应中能量变化的主要原因:化学键的断裂和形成(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小a. 吸热反应:反应物的总能量小于生成物的总能量b. 放热反应:反应物的总能量大于生成物的总能量(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化练习:氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO =O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。
最新苏教版高中化学必修二知识点总结

( 16 个族)
零族:稀有气体
三、元素周期律
1. 元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)
随着核电荷数的递增而呈周期性变化的规律。 元素性质的周期性变化实质是元素原子核外电
子排布的周期性变化的必然结果。
2. 同周期元素性质递变规律
第三周期元素
11Na
12Mg
13Al
氢化物稳定性: SiH 4< PH3< H2S< HCl
酸性 ( 含氧酸 ) : H2SiO3< H3PO4 <H2SO4< HClO4
(Ⅱ)同主族比较:
金属性: Li <Na< K<Rb< Cs(碱金属元素)
非金属性: F> Cl > Br > I( 卤族元素)
与酸或水反应:从难→易
单质与氢气反应:从易→难
( F 是非金属性最强的元素, 位于周期表右上方)
★判断元素金属性和非金属性强弱的方法:
( 1)金属性强 (弱) ——①单质与水或酸反应生成氢气容易 (难);②氢氧化物碱性强 (弱);
③相互置换反应(强制弱) Fe+ CuSO4= FeSO4+ Cu。
( 2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定)
;
③最高价氧化物的水化物(含氧酸)酸性强(弱) ;④相互置换反应(强制弱) 2NaBr+ Cl 2
= 2NaCl+Br 2。
(Ⅰ)同周期比较:
金属性: Na> Mg> Al
非金属性: Si < P< S<Cl
与酸或水反应:从易→难
单质与氢气反应:从难→易
碱性: NaOH> Mg(OH)2> Al(OH) 3
元素周期表的应用
1、元素周期表中共有个 7 周期, 3 是短周期, 3 是长周期。其中第 7 周
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1803 年,道尔顿提出原子学说;
1811 年,阿伏加德罗提出分子学说;
1825 年,法拉第发现苯;
1828 年,维勒首次从无机物合成有机物;
1857 年,凯库勒指出碳是四价;
1864 年,古德贝格和瓦格总结出质量作用定律;
1869 年,门捷列夫提出了他的第一张元素周期表;
1950 年,鲍林提出蛋白质的螺旋结构。
现代科学技术的发展离不开化学
1、20 世纪人类发明的技术: 信息技术;生物技术;核科学和核武器技术;航空航天和导弹技术;激光技术;纳米技术化 学合成和分离技术。
解决环境问题需要化学科学
1、消除汽车尾气的措施: (1)进行石油脱硫处理;
(2)发明汽车尾气处理装置;
(3)用无害汽油添加剂代替现有的四乙基铅抗震剂;
高温
Fe2 O3+ 2Al
2Fe+ Al 2 O3(铝热反应)
高温
Cr2O3 +2Al
2Cr + Al2O3(铝热反应)
(3) 热分解法:适用于一些不活泼的金属。
△
2HgO
2Hg+ O2↑
△
2Ag 2O
4Ag+ O2 ↑
金属的活动性顺序
K、 Ca、Na、 Zn、 Fe、Sn、
Hg、 Ag
Pt、 Au
(银氨溶液) CH3CHO + 2Cu(OH) 2――→ CH3COOH + Cu2 O↓+ 2H 2O
(砖红色) 醛基的检验:方法 1:加银氨溶液水浴加热有银镜生成。
方法 2:加新制的 Cu(OH) 2 碱性悬浊液加热至沸有砖红色沉淀
乙酸
①具有酸的通性:
CH
3COOH
≒
CH3
-
COO
+
H+
使紫色石蕊试液变红;
鉴别
:灼烧蛋白质有烧焦羽毛的味道(鉴别蛋白质)
特殊的蛋白质,在合适温度下:催化活性具有:高效性、专一性
第三单元 人工合成有机物 化学与可持续发展
有关的化学方程式,单体、链节、聚合度、加聚反应、缩聚反应
专题 4 化学科学与人类文明
化学是打开物质世界的钥匙 一、金属矿物的开发利用 1、金属的存在:除了金、铂等少数金属外,绝大多数金属以化合态的形式存在于自然界。 2、金属冶炼的涵义:简单地说,金属的冶炼就是把金属从矿石中提炼出来。金属冶炼的实
用途
C-C 单键, 链状,饱和烃
正四面体 无色无味的气体,比空 气轻,难溶于水
优良燃料,化工原料
C= C 双键, 链状,不饱和烃
六原子共平面 无色稍有气味的气体,比空 气略轻,难溶于水 石化工业原料,植物生长调 节剂,催熟剂
一种介于单键和双键之间的 独特的键,环状 平面正六边形
无色有特殊气味的液体,比 水轻,难溶于水
原子活泼。 ②氧化反应 (ⅰ)燃烧
CH3CH2OH+3O 2―→ 2CO2+3H2O
(ⅱ)在铜或银催化条件下:可以被
O2 氧化成乙醛( CH3 CHO )
2CH3 CH2 OH+O 2――→ 2CH3CHO+2H 2O
③消去反应
CH3 CH2 OH――→ CH2 = CH2 ↑+H 2O
氧化反应:醛基 (- CHO) 的性质 -与银氨溶液,新制 Cu(OH) 2 反应 CH3CHO + 2Ag(NH 3)2 OH――→ CH3COONH 4+ H2 O + 2Ag↓+ 3NH 3↑
CHCl3+Cl 2 ―→ CCl 4+HCl
在光照条件下甲烷还可以跟溴蒸气发生取代反应,
甲烷不能使酸性 KMnO 4 溶液、溴水或溴的四氯化碳溶液褪色。
③ 高温分解
烯烃: 应 (ⅰ)燃烧
乙烯
C2H4+3O2 ――→ 2CO2 +2H 2O(火焰明亮,有黑烟)
(ⅱ) 被酸性 KMnO 4 溶液氧化 ,能使酸性 KMnO 4 溶液褪色 (本身氧化成 CO 2)。
专题三 有机化合物的获得与应用
绝大多数含碳的化合物称为有机化合物,简称有机物。像
CO、 CO2、碳酸、碳酸盐等
少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:
饱和烃→烷烃(如:甲烷)
脂肪烃 ( 链状 )
电解
电解
电解
2NaCl(熔融)
2Na+Cl 2 ↑MgCl2(熔融)
Mg+ Cl 2 ↑ 2Al 2 O3(熔融)
4Al
+ 3O2 ↑ (2) 热还原法:适用于较活泼金属。
高温
高温
Fe2O3+ 3CO
2Fe+ 3CO 2↑ WO 3+ 3H 2
W+ 3H 2O
高温
ZnO +C
Zn + CO↑
常用的还原剂:焦炭、 CO、 H2 等。一些活泼的金属也可作还原剂,如 Al ,
烃和烯烃,如鉴别甲烷和乙烯。
(ⅲ)加聚反应 nCH2= CH2――→-〔 CH2- CH2〕- n(聚乙烯)
①氧化反应(燃烧)
苯
2C6H6+ 15O2―→ 12CO2+ 6H2O(火焰明亮,有浓烟)
②取代反应 苯环上的氢原子被溴原子、硝基取代。
+ Br2――→
Br + HBr
+ HNO 3――→ ③加成反应
Mg 、 Al
Pb、(H) 、Cu
金属原子失电子能
强
弱
力
金属离子得电子能
弱
强
力
主要冶炼方法
电解法
热还原法
ቤተ መጻሕፍቲ ባይዱ
热分解法
富集法
还原剂或
强大电流
H2、 CO、 C、
加热
物理方法或
特殊措施
提供电子
Al 等加热
化学方法
1、化学研究的对象是:
认识和研究物质组成、结构、性质及变化等
2、不活泼金属( Cu 和 Sn)可以单质形态存在于自然界;而相对较活泼的金属(
“异”,“新”。
二、食品中的有机化合物
1、乙醇和乙酸的性质比较
有机物
饱和一元 醇
通式 代表物
CnH2n+1 OH 乙醇
结构简式 官能团
CH3CH 2OH 或 C2H5OH 羟基:- OH
饱和一元 醛 —— 乙醛
CH3 CHO
醛基:- CHO
饱和一元 羧酸 CnH2n+1 COOH
乙酸 CH3COOH
相似 化合物
不同 化合物
同素异形体 由同种元素组成 的不同单质的互
称
元素符号表示相 同,分子式可不
同 不同 单质
同位素 质子数相同而中子 数不同的同一元素 的不同原子的互称
——
—— 原子
6、烷烃的命名:
( 1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。
1- 10 用甲,
乙,丙,丁,戊,已,庚,辛,壬,癸; 11 起汉文数字表示。区别同分异构体,用“正”,
食物中的营养物质包括: 糖类、 油脂、 蛋白质、 维生素、 无机盐和水。 人们习惯称糖类、
油脂、蛋白质为动物性和植物性食物中的基本营养物质。
种类
元素组成
代表物
代表物分子
糖类
单 CHO 糖 双 CHO
葡萄糖 果糖 蔗糖
C6 H12O 6 C12 H22O11
葡萄糖和果糖互为同分异构体 单糖不能发生水解反应 蔗糖和麦芽糖互为同分异构体
应
CH2=CH 2+ Br2-→ CH2 Br- CH2 Br(能使溴水或溴的四氯化碳溶液褪色)
在一定条件下,乙烯还可以与 H2、 Cl2、 HCl 、 H2O 等发生加成反应 CH2= CH 2+ H2 ――→ CH 3CH 3
CH2= CH 2+ HCl -→ CH3 CH2 Cl(氯乙烷)
1
CH2= CH 2+ H2 O――→ CH3CH2 OH (制乙醇) 应 乙烯能使酸性 KMnO 4 溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷
质是把金属元素从化合态还原为游离态,即
+n M(化合得态电)子、被还原 M
0 (游离态)。
3、金属冶炼的一般步骤: (1) 矿石的富集:除去杂质,提高矿石中有用成分的含量。
(2)
冶炼:利用氧化还原反应原理,在一定条件下,用还原剂把金属从其矿石中还原出来,得到
4
金属单质(粗) 。 (3) 精炼:采用一定的方法,提炼纯金属。 4、金属冶炼的方法 (1) 电解法:适用于一些非常活泼的金属。
与活泼金属,碱,弱酸盐反应,如 CaCO3、 Na2CO 3
酸性比较: CH3 COOH > H 2CO 3 2CH3COOH +CaCO3=2(CH 3COO) 2Ca+CO2↑+ H2O(强制弱)
②酯化反应
CH3 COOH + C2H5OH 酸脱羟基醇脱氢
CH3COOC2 H5+ H2O
基本营养物质—糖类
溶剂,化工原料
有机物
烷烃: 甲烷
主 要化学性质
①氧化反应(燃烧)
CH4 +2O2――→ CO2+2H 2 O(淡蓝色火焰,无黑烟) ②取代反应 (注意光是反应发生的主要原因,产物有 5 种)
CH4 +Cl2 ―→ CH 3Cl+HCl
CH3Cl +Cl 2 ―→ CH 2Cl 2 +HCl
CH2 Cl2+Cl 2―→ CHCl 3 +HCl
Fe 和 Al)
以化合太存在于自然界; 所以铜和锡很早被人类发现并使用, 铁和铝需要化学进行技术还原。
所以人类最先发现的是不活泼金属,活泼金属的冶炼需要大量的电能
鲍林提出了:氢键理论和蛋白质的螺旋结构模型,为后来的
