普通化学习题与解答(第四章)
化学部分答案(主要第四章)

第一章复习题1.C2.B3.A4.BC5.C6.(1)错,在标准状况下(2)错,所得溶液并非一升(3)错,水在标准状况下不是气体(4)正确7.(1)5% (2)0.28mol/L8.铁屑过滤Cu Fe FeSO4 稀硫酸过滤Cu FeSO4 蒸发结晶9.1.42g第四章第一节(P80课后习题)1.(1)⑧⑩(2)④⑤⑥⑦⑨(3)①②③④2.材料物理性质化学性质玻璃透明、坚硬、熔点高、不溶于水稳定。
其实能与HF、NaOH溶液反应。
陶瓷不透明、坚硬、熔点高、不溶于水稳定。
跟玻璃一样,与HF、NaOH溶液反应。
3.Na2SiO3 + H2SO4 + H2O = H4SiO4↓+Na2SO4 H4SiO4 = H2SiO3 + H2O(注:从水溶液里析出的硅酸其实都是原硅酸H4SiO4,书上为了简便,就把它写成了硅酸)4.B(注:SiO2+4HF = SiF4↑+2H2O;NaOH与SiO2的反应太慢,故并不选D。
)5.玻璃、石英、陶瓷里都含有大量的SiO2,熔融烧碱时有:SiO2+2NaOH=Na2SiO3+H2O 反应发生,对坩埚造成腐蚀。
6.河沙主要成分是石英,其化学成分为SiO2晶体,属于原子晶体,非常坚硬,可以做磨料。
7.SiO2+2NaOH=Na2SiO3+H2O、Na2CO3+SiO2 高温Na2SiO3+CO2↑(注:其实水玻璃是指Na2SiO3的水溶液,并非Na2SiO3本身,Na2SiO3叫“泡花碱”。
)8.半导体。
用于二极管、三极管及集成电路(IC)生产。
9.(1)还原剂(2)化合反应置换反应还原剂(3)SiO2 (沙滩物质)—— Si(粗)—— Si(纯)——集成电路产品如电脑(用户)10.(1)同:最外层电子数都是4;异:电子层数不同。
二者为同主族元素。
(2)晶体硅的结构与金刚石的结构非常相似,二者的硬度都很大,熔点都很高。
但碳元素的另一单质石墨由于结构的关系,却很软。
(3)CO2、SiO2由于结构关系,物理性质差异非常大。
2023—2024学年九年级化学沪教版全国上册第四章 认识化学变化 课后习题(含答案)

2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题(含答案)2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题含答案沪教版(全国)第四章认识化学变化一、选择题。
1、下列关于燃烧的叙述正确的是()A.有放热、发光现象的变化一定是燃烧B.可燃物燃烧时一定有火焰和发光的现象C.在纯氧中能燃烧的物质在空气中也一定能燃烧D.可燃物燃烧时一定有发光、放热现象2、酒精灯的火焰太小时,将灯芯拨的松散一些,可使火焰更旺,其原理是()A.降低可燃物的着火点B.增大与空气的接触面积C.提高可燃物的着火点D.增加空气中氧气含量3、应用化学知识能有效预防和控制火灾.下面对图中灭火实例的灭火原理解释不正确的是()灭火实例灭火原理A 住宅失火时,消防队员用水灭火降低可燃物的着火点B 酒精在桌上着火时用湿抹布盖灭隔绝空气或氧气C 炒菜油锅着火时,用锅盖盖熄隔绝空气或氧气D 扑灭森林火灾时,设置隔离带可燃物与燃烧物隔离A.A B.B C.C D.D4、一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。
下列说法不正确的是()A.x的值是31 B.甲、丁的相对分子质量之比可能为7:11 C.丁可能为单质D.反应中消耗甲和乙的质量比为7:45、一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A. 丁一定是该反应的催化剂B. 该反应的基本类型是分解反应C. 该反应中乙、丙的质量变化之比为3:17D. 该反应中甲、丙的质量变化之比为7:176、下列关于燃烧与灭火的解释,不合理的是()A. 粮库失火用水浇灭﹣降低了可燃物的着火点B. 扑灭森林火灾时开辟隔离带﹣清除和隔离了可燃物C. 用扇子扇煤炉,炉火越扇越旺﹣提供充足的气气D. 图书档案起火,用液态二氧化碳扑灭﹣既隔绝氧气又降低温度7、小红在纸叠的小船中加入适量的水,用酒精灯直接加热,纸船安然无恙.纸船没有燃烧的主要原因是()A.水能灭火B.没有达到着火点C.纸不是可燃物D.没有与氧气接触8、如图所示是通过白磷燃烧验证质量守恒定律的实验。
普通化学第四章课后习题解答

第四章化学平衡原理参考答案P 68~69综合思考题:解:①根据θθmf B m r H v H ∆=∆∑(其中B v 对生成物取正值,反应物取负值)有: ),()1(),()1(),(),(2g B H g A H g E H g D H H m f m f m f m f m r θθθθθ∆-+∆-+∆+∆=∆=2×(-4RT 1)+(-2.606RT 1)+3.5RT 1+2.5RT 1 =-4.606RT 1同理:),()1(),()1(),(),(2g B S g A S g E S g D S S m m m m m r θθθθθ-+-++=∆=2×(0.25RT 1)+(0.5RT 1)-0.3RT 1-0.7RT 1 =0.0根据吉“布斯-赫姆霍兹”方程θθθmr m r m r S T H G ∆-∆=∆有: 31100.0298606.4-⨯⨯--=∆RT G m r θ=-4.606RT 1×10-3(kJ.mol -1)<0 ∴反应正向自发。
②根据θθK RT G m r ln -=∆有:606.41010606.4ln 3131=⨯⨯--=∆-=--RT RT RT G K m r θθK θ=100.0③求Q ,根据]/[]/[]/[]/[2θθθθP P P P P P P P Q B A E D ⋅⋅=有: ]3.101/3.1015.0[]3.101/3.1010.1[]3.101/3.1015.0[]3.101/3.1015.0[2kPa kPa kPa kPa kPa kPa kPa kPa Q ⨯⋅⨯⨯⋅⨯==0.25 ∵Q<K θ∴平衡向正反应方向移动④根据)(ln 211212T T TT R H K K m r ⋅-∆=θθθ有:1606.4RT H m r -=∆θ,T 1=298K ,0.1001=θK ,T 2=398K ,?2=θK 将有关数据代入式子中得:)398298298398(298606.40.100ln2⨯-⋅⨯-=R R K θ解得:K θ2=31.4 ⑤∵K θ2< K θ1,∴由T 1升至T 2平衡向逆反应方向移动(即吸热反应方向移动)。
化学沪教版第四章知识点 含练习题和答案

第四章燃烧燃料第一节燃烧与灭火知识目标:1.了解燃烧及燃烧的三个条件2.知道自燃和爆炸现象3.了解灭火的一般方法重点:燃烧的条件和灭火原理难点:燃烧条件的利用猜想:要发生燃烧这种现象需要有哪些条件呢?(提出问题,引发思考)得出初步的结论:1. 可燃物 2. 温度 3.空气(助燃物)水的沸点是100摄氏度,给沸腾的水加热,水的温度还会上升吗?答:“不会”说明:白磷放在空气中就能燃烧,我们称这种现象叫自燃。
在自然界中经常发生这类现象,如:过去人们常说的鬼火、天火,(说明一下各自的形成)其实是一种迷信说法灭火的方法:1.将可燃物与空气隔绝,2.将可燃物温度降到着火点以下。
反馈:请你根据你的生活经验和所学知识,说出以下灭火方法的原理1.建筑物着火时,用高压水枪喷水灭火,降低温度。
2.书籍、文件、精密仪器着火时,喷射干冰灭火。
(干冰是固态二氧化碳,极易升华,升华要吸收大量热量,起到降温效果,更为重要的是二氧化碳比空气重,起到隔绝空气的作用)思考:发生下列火情时,你能想出可行的办法吗?油锅着火时,可采取的措施?端锅、泼水、盖湿的被褥、盖锅盖、洒沙土----(最佳盖锅盖)(说明端锅危险;泼水,油比水轻,不行;最佳方法盖锅盖)酒精灯不慎撞倒引起酒精在桌面上燃烧,可采取的措施?洒沙土、水冲、湿布盖、灭火器-------(最佳方法湿布盖)【点1细解】燃烧1.燃烧:是一种发光、发热的剧烈的化学反应。
2.物质燃烧一般需要同时满足三个条件:(1).物质具有可燃性;(2).可燃物与氧气接触;(3).可燃物达到燃烧所需要的最低温度,这个温度称为可燃物的着火点。
【点2细解】完全燃烧与不完全燃烧当氧气充足时,可燃物完全燃烧,燃烧的快,放出的热量多,可燃物中的碳、氢元素分别生成二氧化碳和水;当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少,可燃物中的部分碳、氢元素生成一氧化碳、碳氢化合物等有害气体和小的炭黑颗粒等物质。
【点3细解】爆炸在有限的空间内,如果发生急速的燃烧,短时间聚集大量的热,使气体的体积迅速膨胀,就会引起爆炸。
浙江大学《普通化学》笔记和课后习题(含考研真题)详解(电化学与金属腐蚀)【圣才出品】

②镉镍电池 镉镍电池的总反应为
6 / 66
圣才电子书 十万种考研考证电子书、题库视频学习平台
4 / 66
圣才电子书 十万种考研考证电子书、题库视频学习平台
1.氧化剂和还原剂相对强弱的比较 (1)电极电势代数值小 ①当该电极越易収生氧化反应,其还原态物质越易失电子,则该电极是较强的还原剂; ②该电极的氧化态物质越难得电子,则该电极是较弱的氧化剂。 (2)电极电势代数值大 ①该电极上越易収生还原反应,其氧化态物质越易得电子,则该电极是较强的氧化剂; ②该电极的还原态物质越难失电子,则该电极是较弱的还原剂。 2.反应斱向的判断 在原电池中,由亍 ΔG=-nEF,若 E>0,则 ΔG<0,在没有非体积功的恒温恒压条件 下,反应可以自収迚行。 3.反应迚行秳度的衡量 (1)KΘ 不 EΘ 的关系 在原电池的热力学讨论中,T=298.15K 时电池反应的平衡常数 KΘ 不电池的标准电动 势 EΘ 的关系为 lnKΘ=nEΘ/(0.05917V)。 (2)分析反应迚行的秳度 当电池反应为所讨论的化学反应时,可通过该原电池的 EΘ 推算该反应的平衡常数 KΘ, 从而分析该反应能够迚行的秳度。
电能势为 E 的电池反应 aA(aq)+bB(aq)=gG(aq)+dD(aq),其电势能表达式为
E E RT ln nF
c(G) / c c( A) / c
g a
c(D) / c d c(B) / c b
2 / 66
圣才电子书
①锌锰干电池
锌锰干电池的总反应为
Zn(s)
2MnO2
(s)
人教版高中化学 必修一 第四章 非金属及其化合物 全章专题归纳及检测题 含解析与答案
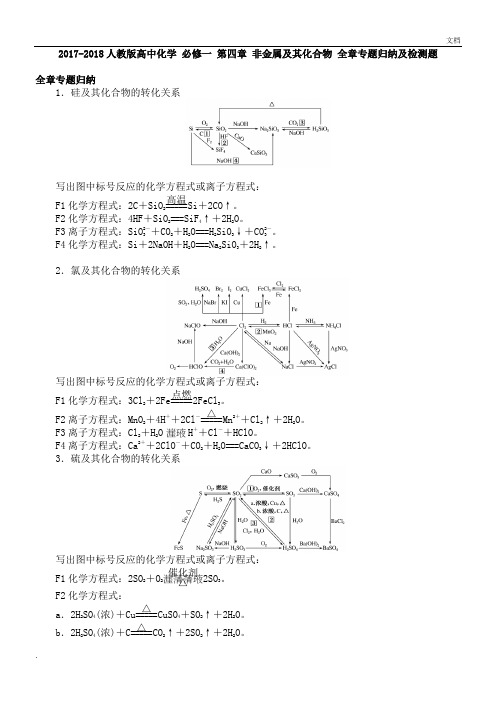
2017-2018人教版高中化学必修一第四章非金属及其化合物全章专题归纳及检测题全章专题归纳1.硅及其化合物的转化关系写出图中标号反应的化学方程式或离子方程式:F1化学方程式:2C+SiO2=====高温Si+2CO↑。
F2化学方程式:4HF+SiO2===SiF4↑+2H2O。
F3离子方程式:SiO2-3+CO2+H2O===H2SiO3↓+CO2-3。
F4化学方程式:Si+2NaOH+H2O===Na2SiO3+2H2↑。
2.氯及其化合物的转化关系写出图中标号反应的化学方程式或离子方程式:F1化学方程式:3Cl2+2Fe=====点燃2FeCl3。
F2离子方程式:MnO2+4H++2Cl-=====△Mn2++Cl2↑+2H2O。
F3离子方程式:Cl2+H2O H++Cl-+HClO。
F4离子方程式:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO。
3.硫及其化合物的转化关系写出图中标号反应的化学方程式或离子方程式:F1化学方程式:2SO2+O2催化剂△2SO3。
F2化学方程式:a.2H2SO4(浓)+Cu=====△CuSO4+SO2↑+2H2O。
b.2H2SO4(浓)+C=====△CO2↑+2SO2↑+2H2O。
F3离子方程式:SO 2+Cl 2+2H 2O===SO 2-4+4H ++2Cl -。
4.氮及其化合物的转化关系写出图中标号反应的化学方程式或离子方程式:F1化学方程式:2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 。
F2化学方程式:4NH 3+5O 2=====催化剂△4NO +6H 2O 。
F3化学方程式:3NO 2+H 2O===2HNO 3+NO 。
F4离子方程式:2NO -3+Cu +4H +===Cu 2++2NO 2↑+2H 2O 。
F5离子方程式:2NO -3+3Cu +8H +===3Cu 2++2NO↑+4H 2O 。
普通化学习题与解答(第四章)
第四章 电化学与金属腐蚀1. 是非题(对的在括号内填“+”号,错的填“-”号)(1)取两根金属铜棒,将一根插入盛有0.13mol dm-⋅4CuSO 溶液的烧杯中,另一根插入盛有13mol dm -⋅4CuSO 溶液的烧杯中,并用盐桥将两支烧杯中的溶液连接起来,可以组成一个浓差原电池。
(+)(2)金属铁可以置换2Cu +,因此三氯化铁不能与金属铜发生反应。
(-)(3)电动势E (或电极电势ϕ)的数值与电池反应(或半反应式)的写法无关,而平衡常数K θ的数值随反应式的写法(即化学计量数不同)而变。
(+)(4)钢铁在大气中的中性或酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。
(+)(5)有下列原电池:若往4CdSO 溶液中加入少量2Na S 溶液,或往4CuSO 溶液中加入少量425CuSO H O ⋅晶体,都会使原电池的电动势变小。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:它们中间最强的氧化剂和最强的还原剂是 (b)(a )23Sn Fe ++和 (b )2227Cr O Sn -+和 (c )34Cr Sn ++和 (d )2327Cr O Fe -+和(2)有一个原电池由两个氢电极组成,其中一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液2()100p H kPa =⎡⎤⎣⎦设应为 (b)(a )30.1mol dm HCl -⋅(b )330.10.1mol dm HAc mol dm NaAc --⋅+⋅ (c )30.1mol dm HAc -⋅ (d )3340.1mol dm H PO -⋅ (3)在下列电池反应中当该原电池的电动势为零时,2Cu +的浓度为 (b)(a )2735.0510mol dm --⨯⋅ (b )2135.7110mol dm --⨯⋅ (c )1437.1010mol dm --⨯⋅ (d )1137.5610mol dm --⨯⋅(4)电镀工艺是将欲镀零件作为电解池的( );阳极氧化是将需要处理的部件作为电解池的( ) (a ,b )(a )阴极 (b )阳极 (c )任意一个极3、填空题(1)有一种含Cl Br I ---、和的溶液,要使I -被氧化,而Cl Br --、不被氧化,则在以下常用的氧化剂中应选( d )为最适宜。
普通化学第五版课后习题答案
不变 增大 增大
不变 增大 增大
增大 增大 增大
增大 增大 增大
不变 增大 不变
逆向移动 正向移动
不移动
(3)答案:氟里昂,NOX、HCl;CO2;NOX和SO2 4. 答案:(d)>(c)>(e)>(a)>(b)原因是气体熵>液体>固体 分子量大的熵大 5. (1)溶解少量食盐于水中。 答案:正 (2)活性炭表面吸附氧气。 答案:负 (1) 碳与氧气反应生成一氧化碳。 答案:正 6. 答案:由定义可知Fe2O3的 =3-4 = [(-77.7)+4(-742.2)]=-1015.5kJ.mol-1 7.答案:查表 水的 过程的>0 所以在298.15K的标准态时不能自发进行. 8. (查表时注意状态,计算时注意乘系数) (1) 307.7 -66.9 (2) -23.0 -147.06 (3) -184.3 -26.9 (4) -51.4 96.9 9.答案: (1) SnO2 =Sn +O2 (2) SnO2 +C =Sn + CO2 (3) SnO2 +2H2 =Sn +2H2O (g) 52.3 51.55 205.138 52.3 5.74 51.55 213.74 52.3 2×130.684 51.55
第2章 化学反应的基本原理与大气污染
1. 答案 (1-)(2-)(3-)(4-)(5-)(6+)(7+)(8+) 2. 答案1b 2b 3b 4c 5bcd 6a 3. (1)答案:基本不变,基本不变,增大 减小, 增大 增大 (2)
k(正) 增加总压力 升高温度 加催化剂 k(逆) v(正) v(逆) 平衡移动方向
△fHθm(298.15K)/kJ.mol-1 226.73 -393.51 -285.83 (1)kJ.mol-1 反应热Q= -1229.58 kJ.mol-1 (2) kJ.g-1反应热Q=
(完整word版)普通化学习题与解答
第一章 热化学与能源1. 是非题(对的在括号内填“+”号,错的填“-”号)(1)已知下列过程的热化学方程式为:则此温度时蒸发1mol 6()UF l ,会放出热30.1kJ 。
(-)(2)在定温定压条件下,下列两个生成液态水的化学方程式所表达的反应放出的热量是一相同的值。
(-)(3)功和热是在系统与环境之间的两种能量传递方式,在系统内部不讨论功和热。
(+)(4)反应的H ∆就是反应的热效应。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在下列反应中,进行1mol 反应时放出热量最大的是 (c)(2)通常,反应热的精确的实验数据是通过测定反应或过程的哪个物理量而获得的。
(d) (a )H ∆ (b )p V ∆ (c )P q (d )V q (3)下列对功和热的描述中,正确的是 (a)(a )都是途径函数,无确定的变化途径就无确定的数值 (b )都是途径函数,对应于某一状态有一确定值 (c )都是状态函数,变化量与途径无关(d )都是状态函数,始终态确定,其他值也确定(4)在温度T 的标准状态下,若已知反应2A B →的标准摩尔反应焓,1r m H θ∆,2222221()()()22()()2()H g O g H O l H g O g H O l +=+=166()();30.1r m UF l UF g H kJ molθ-=∆=422242224222422()()2()()2()()()2()()2()()()2()()2()3()()()()2()2a CH l O g CO g H O gb CH g O g CO g H O gc CH g O g CO g H O ld CHg O g CO g H O l +=++=++=++=+与反应2A C →的标准摩尔反应焓,2r m H θ∆,则反应4C B →的标准摩尔反应焓,3r m H θ∆与,1r m H θ∆及,2r m H θ∆的关系为,3r m H θ∆= (d) (a )2,1r m H θ∆+,2r m H θ∆ (b ),1r m H θ∆—2,2r m H θ∆ (c ),1r m H θ∆+,2r m H θ∆ (d )2,1r m H θ∆—,2r m H θ∆(5)对于热力学可逆过程,下列叙述正确的是 (abd )(a )变化速率无限小的过程 (b )可做最大功的过程 (c )循环过程(d )能使系统与环境完全复原的过程(6)在一定条件下,由乙二醇溶液、冰、水蒸气、氮气和氧气组成的系统中含有 (ad ) (a )三个相 (b )四个相 (c )三种组分 (d )四种组分 (e )五种组分*(7)一只充满氢气的气球,飞到一定高度即会爆炸,这取决于一定高度上的 (d ) (a )外压 (b )温度 (c )湿度 (d )外压和温度 (8)下述说法中,不正确的是 (d)(a )焓只有在某种特定条件下,才与系统反应热相等 (b )焓是人为定义的一种具有能量量纲的热力学量 (c )焓是状态函数(d )焓是系统能与环境进行交换的能量3、填空题使可燃样品(质量为1.000g )在弹式量热计内完全燃烧,以测定其反应热,必须知道:(1) 弹式量热计内吸热介质(通常为水)质量和比热容; (2) 钢弹组件的总热容b C ; (3) 反应前后系统的温度。
普通化学第七版习题册答案
普通化学第七版习题册答案普通化学第七版习题册答案化学作为一门基础科学,对于我们理解和掌握自然界的运行规律有着重要的作用。
而习题册作为化学学习中的重要辅助工具,帮助我们巩固理论知识,提高解题能力。
在学习普通化学第七版习题册时,我们常常会遇到一些难题,需要查阅答案来进行参考。
本文将为大家提供一些普通化学第七版习题册的答案,帮助大家更好地学习化学知识。
第一章:化学基本概念1. 什么是化学?答案:化学是研究物质组成、性质、变化以及与能量之间的关系的科学。
2. 什么是物质?答案:物质是构成宇宙的基本单位,具有质量和占据空间的特征。
3. 什么是元素?答案:元素是由具有相同原子序数的原子组成的纯净物质,无法通过化学反应分解成其他物质。
4. 什么是化合物?答案:化合物是由不同元素以一定的比例结合而成的物质,可以通过化学反应分解成其他物质。
5. 什么是混合物?答案:混合物是由两种或两种以上的物质混合而成的物质,可以通过物理手段分离。
第二章:化学计量与化学方程式1. 什么是化学计量?答案:化学计量是指在化学反应中,物质的质量之间的关系。
2. 什么是摩尔?答案:摩尔是物质的质量与其相对分子质量之间的比值,用符号"mol"表示。
3. 什么是化学方程式?答案:化学方程式是用化学符号和化学式表示化学反应的反应物和生成物之间的关系。
4. 如何平衡化学方程式?答案:平衡化学方程式需要根据反应物和生成物的摩尔比例来调整系数,使得反应物和生成物的摩尔数相等。
第三章:气体的性质与状态方程1. 什么是理想气体?答案:理想气体是指在一定条件下,其分子之间没有相互作用力,分子体积可以忽略不计的气体。
2. 什么是气体的状态方程?答案:气体的状态方程描述了气体的压强、体积和温度之间的关系。
3. 什么是理想气体状态方程?答案:理想气体状态方程是指在一定条件下,气体的压强、体积和温度之间的关系可以用理想气体状态方程PV=nRT表示,其中P为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章电化学与金属腐蚀1、就是非题(对得在括号内填“+”号,错得填“”号)(1)取两根金属铜棒,将一根插入盛有0、1溶液得烧杯中,另一根插入盛有1溶液得烧杯中,并用盐桥将两支烧杯中得溶液连接起来,可以组成一个浓差原电池。
(+)(2)金属铁可以置换,因此三氯化铁不能与金属铜发生反应。
(3)电动势E(或电极电势)得数值与电池反应(或半反应式)得写法无关,而平衡常数得数值随反应式得写法(即化学计量数不同)而变。
(+)(4)钢铁在大气中得中性或酸性水膜中主要发生吸氧腐蚀,只有在酸性较强得水膜中才主要发生析氢腐蚀。
(+)(5)有下列原电池:若往溶液中加入少量溶液,或往溶液中加入少量晶体,都会使原电池得电动势变小。
2、选择题(将所有正确答案得标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:它们中间最强得氧化剂与最强得还原剂就是(b)(a) (b)(c) (d)(2)有一个原电池由两个氢电极组成,其中一个就是标准氢电极,为了得到最大得电动势,另一个电极浸入得酸性溶液应为(b)(a)(b)(c)(d)(3)在下列电池反应中当该原电池得电动势为零时,得浓度为(b)(a) (b)(c) (d)(4)电镀工艺就是将欲镀零件作为电解池得( );阳极氧化就是将需要处理得部件作为电解池得( ) (a,b )(a)阴极 (b)阳极 (c)任意一个极3、填空题(1)有一种含得溶液,要使被氧化,而不被氧化,则在以下常用得氧化剂中应选( d )为最适宜。
(a)酸性溶液,(b)酸性溶液,(c)氯水,(d)溶液(2)有下列原电池:23332333()(1),(0.01)(1),(1)()Pt Fe mol dm Fe mol dm Fe mol dm Fe mol dm Pt +-+-+-+--⋅⋅⋅⋅+该原电池得负极反应为,正极反应为。
(3)电解含有下列金属离子得盐类水溶液:。
其中能被还原成金属单质,不能被还原成金属单质。
4、根据下列原电池反应,分别写出各原电池中正、负电极得电极反应(须配平)。
(1)(2)(3)(4)解:(1)负极:正极:(2)负极:正极:(3)负极:正极:(4)负极:正极:5、将上题各氧化还原反应组成原电池,分别用图示表示各原电池。
解:(1)(2)(3)(4)6、参见标准电极电势表,分别选择一种合适得氧化剂,能够氧化:(1);(2);(3)再分别选择一种合适得还原剂,能够还原:(a);(b);(c)解:合适得氧化剂为:(1)酸化得;(2);(3)合适得还原剂为:(1);(2);(3)注:本题答案不单一,同学们可根据原理自行选择。
7、将锡与铅得金属片分别插入含有该金属离子得溶液中并组成原电池(用图示表示,要注明浓度)。
(1);(2);分别计算原电池得电动势,写出原电池得两电极反应与电池总反应式。
解:查教材附录,,(1)当;时:故以锡电极做原电池负极,铅电极做正极。
原电池图示为:正极反应:负极反应:电池总反应式:原电池电动势:=0、1262V(0、197)V=0、071V(2)当;时:故以铅电极做原电池负极,锡电极做正极。
原电池图示为:正极反应:负极反应:电池总反应式:原电池电动势:=0、1375V(0、156)V=0、019V8、求反应在298、15K 就是得标准平衡常数。
若将过量极细得锌粉加入溶液中,求平衡时浓度对浓度得比值。
解:= 0、447V (0、7618V)=0、315V故,反应进行得相当完全。
9、将下列反应组成原电池(温度为298、15K):(1) 计算原电池得标准电动势;(2) 计算反应得标准摩尔吉布斯函数变;(3) 用图示表示原电池;(4) 计算以及时原电池得电动势。
解:(1)查阅教材附录:;。
= 0、771V 0、5355V = 0、236V(2)(3)原电池图示:(4)10、当pH=5、00,除离子外,其余有关物质均处于标准条件下,下列反应能否自发进行?试通过计算说明之。
24222()16()10()5()2()8()MnO aq H aq Cl aq Cl g Mn aq H O l -+-+++=++解: 由反应24222()16()10()5()2()8()MnO aq H aq Cl aq Cl g Mn aq H O l -+-+++=++组成原电池。
正极:负极:当pH=5、00,其她物质均处于标准条件时:8422442()/()/0.05917(/)(/)lg 5()/c MnO c c H c V MnO Mn MnO Mn c Mn c θθθθϕϕ-+-+-++⎡⎤⎡⎤⎣⎦⎣⎦=+⎡⎤⎣⎦可见,故该反应不能自发进行。
11、由镍电极与标准氢电极组成原电池。
若时,原电池得电动势为0、315V ,其中镍为负极,计算镍电极得标准电极电势。
解: 该原电池得图示为:2332()(0.0100)(1)(100)()Ni Ni mol dm H mol dm H kPa Pt +-+--⋅⋅⋅+因为所以又则12、由两个氢电极:与组成原电池,测得该原电池得电动势为0、016V 。
若后一电极作为该原电池得正极,问组成该电极得溶液中得浓度得值就是多少?解:依题意,原电池应为:3322()(100)(0.10)()(100)()Pt H kPa H mol dm H xmol dm H kPa Pt +-+--⋅⋅+13、判断下列氧化还原反应进行得方向(25℃得标准状态下):(1)(2)(3)解:25℃得标准状态下,查阅教材附录相关数据,得到各对电池得标准电极电势值,并对比相应标准电极电势得大小。
(1);反应向右进行(正向自发)(2);反应向左进行(逆向自发)(3);反应向右进行(正向自发)14、在pH=4、0时,下列反应能否自发进行?试通过计算说明之(除外,其她物质均处于标准条件下)。
(1)232722()()()()()()Cr O aq H aq Br aq Br l Cr aq H O l -+-+++→++(2)2422()()()()()()MnO aq H aq Cl aq Cl l Mn aq H O l -+-+++→++ 解: pH=4、0,其她物质均处于标准条件下:(1)反应232722()()()()()()Cr O aq H aq Br aq Br l Cr aq H O l -+-+++→++组成原电池:正极:负极:142272323272723()/()/0.05917(/)(/)lg 6()/c Cr O c c H c V Cr O Cr Cr O Cr c Cr c θθθθϕϕ-+-+-++⎡⎤⎡⎤⎣⎦⎣⎦=+⎡⎤⎣⎦22220.059170.05917(/)lg (/)lg(0.10)0.01622V V E H H x H H V θθϕϕϕϕ+++-⎧⎫=-=+-+=⎨⎬⎩⎭因,故正反应不能自发进行。
(2)反应2422()()()()()()MnO aq H aq Cl aq Cl l Mn aq H O l -+-+++→++组成原电池: 正极:负极:因,故正反应不能自发进行。
15、计算下列反应得标准平衡常数与所组成得原电池得标准电动势。
又当等体积得与溶液混合后,会产生什么现象?解:= 0、771V 0、5355V = 0、236V当量溶液等体积混合后,离子浓度均变为,据上述计算,,反应正向进行,溶液由浅黄色转变为棕黄色,并(或)由紫黑色碘沉淀析出。
16、由标准钴电极与标准氯电极组成原电池,测得其电动势为1、64V ,此时钴电极为负极。
已知,问:(1)标准钴电极得电极电势为多少?(不查表)(2)此电池反应得方向如何?(3)当氯气得压力增大或减小时,原电池得电动势将发生怎样得变化?(4)当得浓度降低到,原电池得电动势将如何变化?数值就是多少?解: (1)依据题意,钴电极为负极,氯电极为正极:22(/)(/) 1.36 1.640.28Co Co Cl Cl E V V V θθθϕϕ+-=-=--=(2)原电池反应为:(3)当增大时,增大,原电池电动势E 值增大;当减小时,减小,原电池电动势E 值减小。
8422442()/()/0.05917(/)(/)lg 5()/c MnO c c H c V MnO Mn MnO Mn c Mn c θθθθϕϕ-+-+-++⎡⎤⎡⎤⎣⎦⎣⎦=+⎡⎤⎣⎦(4) 当得浓度为时,22(/)(/) 1.36(0.34) 1.70E Cl Cl Co Co V V V θϕϕ-+=-=--=原电池得电动势增加了0、06V 。
17、从标准电极电势值分析下列反应向哪个方向进行?2222()2()4()()()2()MnO s Cl aq H aq Mn aq Cl g H O l -++++=++实验室中就是根据什么原理,采取什么措施,利用上述反应制备氯气得?解: 根据教材附录数据可知,,。
,故在标准状态下,反应向左进行(正向非自发)。
然而得氧化性受介质酸度得影响较大。
从电极得半反应式:可得出浓度对其电极电势得影响为:即值随浓度得增大而增大,所以实验室用浓盐酸(如)与在加热条件下反应以增加得氧化性;与此同时,得增加及加热使降低,均使减小,增加了得还原性,使,反应正向进行。
此外,加热还可使反应速率增加。
18、用图示表示下列反应可能组成得原电池,并利用标准电极电势数据计算反应得标准平衡常数。
解: 原电池图示为:19、为什么在水溶液中不稳定,容易发生歧化反应?25℃时歧化反应得与分别就是多少?(提示:铜得歧化反应为)解:歧化反应:查教材附录可知,,而可利用与通过计算而得:所以= 0、521V – 0、163V = 0、358V > 0可见,在水溶液中不稳定,容易发生歧化反应。
422222()/(/)(/)lg ()/c H c RT MnO Mn MnO Mn nF c Mn c θθθϕϕ++++⎡⎤⎣⎦=+⎡⎤⎣⎦111964850.35.8345r m G nFE C mol k V J mol θθ--∆=-=-⋅⨯⋅-⨯=20、用两级反应表示下列物质得主要电解产物。
(1)电解溶液,阳极用镍,阴极用铁;(2)电解熔融,阳极用石墨,阴极用铁;(3)电解,两级都用铂。
解: (1)阳极:阴极:(2)阳极:阴极:(3)阳极:阴极:21、电解镍盐溶液,其中。
如果在阴极上只要析出,而不析出氢气,计算溶液得最小pH 值(设氢气在上得超电势为0、21V)。
解: 电解镍盐溶液时,阴极可能发生得反应为:镍得析出电势:氢得析出电势:为使氢气不析出,需满足,即:则溶液得最小pH 值为1、36。
22、分别写出铁在微酸性水膜中,与铁完全浸没在稀硫酸中发生腐蚀得两级反应式。
解: 铁在微酸性水膜中发生吸氧腐蚀,电极反应为:阳极:阴极:铁浸没在稀硫酸发生析氢腐蚀,电极反应为:2220.05917(/)(/)lg ()/()2H H H H c H c θθϕϕη+++⎡⎤=+-⎣⎦阴20.05917lg ()/0.210.05917lg ()0.212c H c V c H V θ++⎡⎤=-=-⎣⎦阳极:阴极:23、已知下列两个电池得标准电极电势如下:;;试从值及能斯特方程,计算得溶度积。
