2016河南职高对口升学化工类专业化工基础实验教案:铝盐中铝含量的测定
铝含量测定实验报告

通过查阅资料可知明矾中铝含量的测定方法有四种:第一种方案:直接滴定法。
DCTA(环己烷二胺四已酸)在室温下能与Al3+迅速定量络合。
用DCTA测定Al3+可使操作简化,不过DCTA较贵[1]。
第二种方案:置换滴定法。
此法用于测定像合金,硅酸盐,水泥和炉渣等复杂试样中铝的含量,以此提高选择性[1]。
在pH=3-4时,加入定过量的EDTA溶液煮沸使Al3+与EDTA充分配合,冷却后调PH至5-6,以二甲酚橙为指示剂,用Zn标准溶液滴定过量的EDTA(不记体积)至微红色,然后加入过量的NH4F,加热至沸,使AlY-与F-之间发生置换反应,并释放出与Al3+配合的EDTA,再用Zn2+标准溶液滴定至紫红色,即为终点[2]。
AlY-+6F-+2H+ = AlF63-+H2Y2-第三种方案:返滴定法。
此法用于简单试样如明矾,氢氧化铝,复方氢氧化铝片,氢氧化铝凝胶等药物中铝含量的测定[1]。
由于Al3+易形成一系列多核羟基络合物,这些多核羟基络合物与EDTA络合缓慢,且Al3+ 对二甲酚橙指示剂有封闭作用,故通常采用返滴定法测定铝。
加入定量且过量的EDTA标准溶液,先调节溶液pH至3-4,煮沸几分钟,使A13+ 与EDTA 络合反应完全。
冷却后,再调节溶液PH至5-6,以二甲酚橙为指示剂,用Zn2+标准溶液滴定至溶液由黄色变为紫红色,即为终点[3]。
第四种方案:重量分析法。
精确称取三份明矾试样(2g左右)与250mL的烧杯中,按如下方法处理:加热溶解烧杯中的明矾试样,直至溶液澄清。
调节pH=3~9。
往烧杯中滴加0.2mol/L的8-羟基喹啉至过量,此时溶液产生沉淀。
Al3+ + 3C9H7ON=Al(C9H6ON)3↓+ 3H+抽滤分离沉淀,将沉淀定量转入瓷坩埚中,高温灼烧1小时后,置于干燥器中冷却,分析天平生恒重至相邻两次质量差为2mg。
称得的质量即为Al2O3的质量[4]。
在本实验将采用第三种方案来测定明矾中铝的含量。
河南职高对口升学化工类专业化工基础实验教案:氯化钡中钡的测定
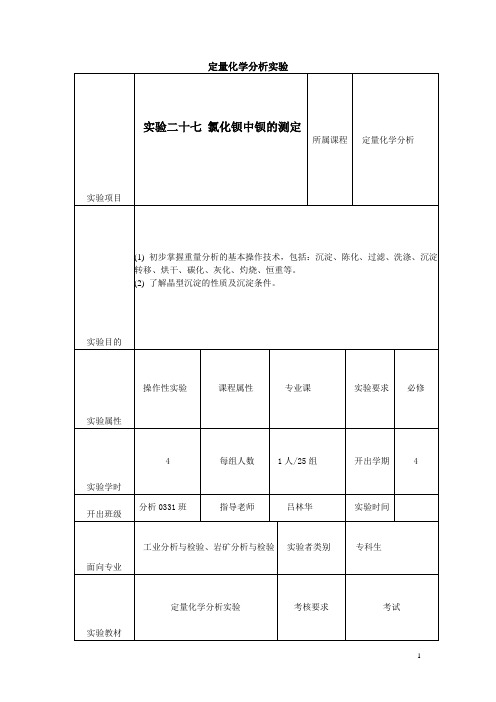
1实验目的(1) 初步掌握重量分析的基本操作技术,包括:沉淀、陈化、过滤、洗涤、沉淀转移、烘干、碳化、灰化、灼烧、恒重等。
(2) 了解晶型沉淀的性质及沉淀条件。
2 实验原理重量法测定氯化钡中钡的含量是利用沉淀反应:Ba2+ + SO42- = BaSO4测定过程概括如下:试样的称重和溶解-沉淀-陈化-过滤-洗涤-灼烧-称重。
因BaSO4属晶型沉淀,初生成时常为细晶型,过滤时易透过滤纸,为得到较粗大而纯净的BaSO4沉淀,应特别注意掌握有利于晶型沉淀的条件,即所谓的“稀”、“热”、“搅”、“慢”、“陈”。
选稀H2SO4为沉淀剂,为使BaSO4沉淀完全,H2SO4必须过量(一般过量50~100% )。
沉淀带下来的H2SO4,在灼烧时可挥发除去,不影响测定。
沉淀从溶液析出时,由于共沉淀现象会使沉淀沾污,如NO3-、Cl-、CO32-常以钡盐形式共沉淀,而阳离子如碱金属、Ca2+、Fe3+等常以硫酸盐或硫酸氢盐形式共沉淀。
至于在实验中哪些离子共沉淀及影响如何取决于杂质离子的浓度和沉淀的性质。
加入稀HCl一则可防止BaSO3等共沉淀,二则可适当增加BaSO4溶解度减少其过饱和程度,有利于获得较大颗粒沉淀。
3 试剂(l) HCl:2 mol/L(2) H2SO4:l mol/L(3) AgNO3:0.1 mol/L(4) 慢速定量滤纸4 分析步骤本实验做两份平行测定(同时操作)。
(1) 试样的称取,溶解和沉淀取一干燥洁净的称量瓶,置于小表面皿上,在指导老师处领取BaCl2·2 H2O 试样。
减量法准确称取0.5~0.6 g ,于250 mL 烧杯中,加蒸馏水约70 mL ,再加2~3 mL 2 mol/L HCl 。
盖上表面皿,加热近沸,但勿煮沸以防溅失。
另取3 mL H2SO4于100 mL 烧杯中,加水稀释约至30 mL ,加热近沸。
将此热的稀H2SO4用滴管慢慢滴加至热的试样溶液中。
边滴加边搅拌。
铝盐中铝含量的测定(置换滴定)

加水及35.00ml EDTA标准溶液 百里酚蓝、氨水
EDTA溶液滴定 加六亚 甲基四胺 由黄色变成紫红色
五、注意事项
• 分析天平的正确使用; • 溶液酸度的调节; • 滴定速度的控制 • 终点颜色的观察与正确读数。
六、数据处理
• Zn2+标准溶液、EDTA标准溶液的浓度
C ( Zn 2 ) 25 C ( EDTA) V1 V0
杯中,加入300 ml去离子,稀释至500ml.,
转入试剂瓶中,摇匀,贴标签,待标定。 EDTA二钠 300 ml去离子
四、实验步骤
• 2、用ZnO基准物质配制C(Zn2+)=0.02mol/L的Zn2+标准
溶液
准确称取已烘干至恒重的ZnO基准物质0.4g,于小烧 杯中,加2~3滴水湿润,滴加HCl溶液(1+1)使之完 全溶解后,25ml蒸馏水,混匀,定量转入250ml容量 瓶中,加蒸馏水稀释,定容,摇匀,待用。 水 HCl溶液
四、实验步骤 • 3、铝含量的测定 • 准确称取铝盐试样1.3g【准确称取Al2(SO4)3固 体1.0g;Fe2(SO4)3固体0.3g】,于小烧杯中, 加少量HCl溶液(1+1)及50ml水使之完全溶 解后,混匀,定量转入250ml容量瓶中,加蒸 馏水稀释,定容,摇匀,待用。
水 HCl溶液
铝盐试样
实验步骤
准确移取上述试液25.00ml于250ml锥形瓶中,加 20ml水及35.00ml EDTA标准溶液,加8~10滴百里 酚蓝指示剂,用氨水中和恰好呈黄色(PH=3~3.5), 煮沸后,加六亚甲基四胺溶液20 ml,使PH=5~6, 用力振荡,冷却。加3滴二甲酚橙指示剂,用Zn2+标准 溶液滴定至溶液由黄色变为紫红色(不计体积)。加 NH4F固体2g,加热煮沸2min,冷却,用Zn2+标准溶液 滴定至溶液由黄色变为紫红色即为终点,记录消耗的 标准Zn2+溶液的体积。平行测定四次。
实验三 铝合金中铝含量的测定(铜滴定法)

铝合金中铝含量的测定方法:EDTA 置换滴定法一、方法原理铝离子(Al 3+)与EDTA 络和反应的速度较慢,不能用直接法来滴定,因此采用置换滴定法。
首先加入过量的EDTA 溶液(不必定量),调节pH = 3.5左右(用甲基橙指示剂指示),煮沸2~3min ,使Al 3+与EDTA 完全络合。
同时其他干扰离子也与EDTA 反应,用六次甲基四胺调节pH 为5~6,用PAN 指示剂(1-(2-吡啶偶氮)-2-萘酚)指示,趁热用铜标准溶液除去过剩的EDTA 。
此时,加入适量的NH 4F ,利用F -与Al 3+生成更稳定络合物这一性质,置换出与Al 3+等物质的量的EDTA 。
经加热煮沸后,再用铜标准溶液滴定至终点,由此可计算出试样中铝的含量。
反应如下:AlY - + 6F - = AlF 63- + Y 4- , Y 4- + Cu 2+ = CuY 2-煮沸后趁热滴定是为了防止PAN 指示剂僵化。
二、实验试剂(1) HCl-HNO 3混合酸:在500mL 水中加400mLHCl 、100mLHNO 3,混匀。
(2) 20% 六次甲基四胺溶液(3) 0.02 mol/L EDTA 溶液(4) 1% NaOH 溶液(5) 甲基橙指示剂(6) 0.1% PAN 指示剂(7) 0.01mol/L CuSO 4标准溶液:称2.500 g CuSO 4·5H 2O ,于1000mL 大烧杯中,加入1:1 H 2SO 42~3滴,蒸馏水溶解并稀释为1L 。
三、分析步骤准确称取试样0.10g (准确到0.0002g )于小烧杯中,加入5mL HCl-HNO 3混合酸和5mL 水,于电热板上小心加热溶解。
取下冷却后,慢慢转入100mL 容量瓶中,加水定容,摇匀。
吸取25.00mL 试液于250mL 锥形瓶中,加水20 mL ,0.02 mol/L EDTA 15.00mL 。
用甲基橙作指示剂,慢慢滴加1% NaOH 溶液,使溶液变为橙色。
铝盐中铝含量测定

• 加20mL六次甲基四胺,此时应为黄色,如果呈红 色,还需滴加(1+3) HCl ,使其变黄。 • 把Zn2+滴入锥形瓶中,用来与多余的EDTA络合, 当溶液恰好由黄色变为紫红色时停止滴定。 • 于上述溶液中加入10mL NH4F ,加热至微沸,流 水冷却,再补加2滴二甲酚橙,此时溶液为黄色。 再用Zn2+标液滴液所消耗的体积v,计 算铝的质量。
结果计算
ω ( Al2 SO3 ) =
CZnVZn × M 1 Al2 SO3
2
m
×100%
0.02mol/LZn标准滴定溶液制备方案 0.02mol/LZn标准滴定溶液制备方案
• 0.02mol/L锌离子标准溶液的制备 称取0.42g于800℃灼烧至恒重的基准氧化锌于 小烧杯中,称准至0.01g。用少量水湿润,加1+4 盐酸溶液10mL,盖上表面皿,使样品溶解(必要时 略加热),吹洗表面皿,冷却后定量转移至250mL 容量瓶中定容。
(cV ) Zn Al % = ×100% 25.00 m× 250
试剂与仪器
• • • • • • • • NaOH(200g/L); HCl(1+1),(1+3); EDTA溶液(0.02mol/L); 二甲酚橙(2g/L) ; 氨水(1+1); 六次甲基四胺(200g/L); Zn标准溶液 (0.02mol/L); NH4F(200g/L);
• (3)铝是热的良导体,它的导热能力比铁大3倍, 工业上可用铝制造各种热交换器、散热材料和炊 具等。 • (4)铝有较好的延展性(它的延展性仅次于金和银), 在100 ℃~150 ℃时可制成薄于0.01 mm的铝箔。 这些铝箔广泛用于包装香烟、糖果等,还可制成 铝丝、铝条,并能轧制各种铝制品。 • (5)铝的表面因有致密的氧化物保护膜,不易受到 腐蚀,常被用来制造化学反应器、医疗器械、冷 冻装置、石油精炼装置、石油和天然气管道等。
实验59铝盐中铝的测定(置换滴定法)

实验59 铝盐中铝的测定(置换滴定法)1.实验目的(1)掌握置换滴定法测定铝的原理。
(2)了解控制溶液的酸度、温度和滴定速度在配合滴定中的重要性。
(3)了解置换滴定法测定铝的终点颜色的变化情况。
2.实验原理A13+离子与EDTA配合速度很慢,并对指示剂有封闭作用,故不能用直接滴定法测定铝。
本实验采用置换滴定法,即在试样溶液中先加入过量的EDTA溶液(酸性溶液),调溶液的pH值为3.5,煮沸溶液,使A13+与EDTA配合完全,再调溶液的pH=5-6,加入PAN指示剂,用铜盐标准溶液返滴定过量的EDTA(也可用二甲酚橙作指示剂,用锌盐返滴定)。
再加入NH 4F,利用F -能与Al 3+生成更稳定的配合物这一性质,使AlY -转变为更稳定的配合物AIF 63-,释放出与A13+等物质量的EDTA,再用铜盐标准溶液滴定。
反应式如下:−−−−+=+4366Y AlF F AlY−+−=+224CuY Cu Y 根据滴定释放出的EDTA 所用去铜盐标准溶液的体积,求算铝的百分含量。
3. 仪器与试剂试剂:硫酸铝钾(固)试样C·P,1:1 HC1溶液,0.1%甲基橙水溶液,1:1 NH 3·H 2O溶液,20%六次甲基四胺缓冲溶液(pH=5.5) ,0.1%PAN乙醇溶液, NH 4F(固)A·R,0. 02mo1·L -1 EDTA溶液, 0. 02mo1·L -1CuSO 4标准溶液(称取5g CuSO 4·5H 2O,加入3~4滴1:1 H 2SO 4,加水溶解并稀释至1L,吸取EDTA标准溶液25.00ml于锥形瓶中,加水稀释至100m1,加入10m120%六次甲基四胺缓冲溶液,加热至80--90℃取下,加3--4滴PAN指示剂,用硫酸铜标准溶液滴至稳定的紫红色为终点。
)。
仪器:分析天平(电子天平),台平,50mL 酸式滴定管,250mL 锥形瓶,100mL 容量瓶,10mL 移液管(吸量管),10mL 量杯,100mL 量筒,150mL 烧杯,电炉。
铝合金中铝含量的测定实验报告

铝合金中铝含量的测定实验报告
本实验旨在通过一系列实验步骤,找到合适的测量铝合金中铝含量的方法,并通过实验结果来验证该方法的可行性。
实验原理:
铝合金中铝含量的测定通常采用滴定法或分光光度法。
本实验采用滴定法测定。
实验步骤:
1.将0.3g的样品加入到250mL锥形瓶中,加入20mL的盐酸和20mL的硝酸, 放置于热水槽中加热30分钟使其完全溶解。
2.冷却至室温后加入50mL的蒸馏水。
3.加入15mL的氨水,用盐酸将溶液中的氨滴到中性为止。
4.加入10mL的氧化钠,并用甲醛钠标准溶液滴定至染色消失。
5.根据计算公式计算出铝的含量。
实验数据及计算:
1.取铝样品0.3g,加入20mL的盐酸和20mL的硝酸溶解,得到溶液体积
V1=40mL。
2.加入50mL的蒸馏水以稀释,得到溶液总体积V2=90mL。
3.加入15mL的氨水,用盐酸将溶液中的氨滴到中性为止。
4.加入10mL的氧化钠,用甲醛钠标准溶液滴定至染色消失,耗用甲醛钠标准溶液30.8mL。
则由计算公式:
n(Al)= N(甲醛钠标准溶液)×V(甲醛钠标准溶液)/ V(铝样品)×F (甲醛钠标准溶液浓度)/ M(铝样品)
可得铝的含量为:
n(Al)= 0.1mol/L ×30.8mL/0.3g ×0.1mol/L/26.98g/mol = 3.60%
实验结论:
本实验采用滴定法测定铝合金样品中铝含量,结果表明该方法具有较高的准确性和稳定性,适用于铝合金的含铝量测定。
在本实验中,铝合金中铝的含量为3.60%。
铝盐中铝含量的测定

铝盐中铝含量的测定
铝盐中铝含量测定
实验试剂配制
1、EDTA---0.02mol/L:称取1.86g乙二胺四乙酸二钠溶解定容250升容量瓶中
2、铜标准溶液-----0.02mol/L用分析天平称取0.75~0.85g无水CuSO4于250ml烧杯中加一滴(1+1)H2SO4溶解定容250ml容量瓶(自配)
3、乙酸一乙酸钠缓冲溶液(PH=4.3)将2.43g无水乙酸钠溶解于水加入80ml冰乙酸稀释至一升摇匀(PH试纸或精密PH试纸检验)
4、PAN指示剂(2g/L)将0.2gPAN〔名称1-(2-吡啶偶氮)-2-萘酚〕溶于100ml乙醇中
5、(1+1)H2SO4:一体积浓硫酸用于一体积水中(自配)
试验台摆放仪器
仪器:
托盘天平
烧杯:25ml两个、100ml一个
量筒:50ml一个、5ml一个
胶头滴管一个
25ml酸式滴定管
25ml移液管
锥形瓶三个、洗瓶、吸耳球、玻璃棒
试剂:0.02mol/LEDTA、乙酸乙酸钠(PH=4.3)、PAN指示剂、无水硫酸铜、浓硫酸
你先看看顺便再问问赵老师、曹老师环工和环科实验技术要求不同;环工大不部分药品是自己动手配置、环科往年都是把所有的药品配置好进实验室就开始做;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016河南职高对口升学化工类专业化工基础实验教案:铝
盐中铝含量的测定
定量化学分析实验
实验三十一铝盐中铝含量的测所属课程定量化学分析定
实验项目
1(掌握置换滴定法测定铝盐的原理和方法。
2(掌握二甲酚橙指示剂的应用条件和终点颜色判断。
实验目的
操作性实验课程属性专业课实验要求必修
实验属性
4 每组人数 1人/25组开出学期 4
实验学时
分析0331班指导老师吕林华实验时间
开出班级
工业分析与检验、岩矿分析与检验实验者类别专科生面向专业
定量化学分析实验考核要求考试实验教材
1
一、实训目的
1(掌握置换滴定法测定铝盐的原理和方法。
2(掌握二甲酚橙指示剂的应用条件和终点颜色判断。
二、实训原理
3+Al与EDTA配合反应进行缓慢,可利用返滴定法或置换滴定法测定铝的含量。
置换滴定法的基本原理是:
3+在pH=3,4的条件下,于铝盐试液中加入过量的EDTA溶液,加热煮沸使Al
配合完全。
调节溶液
pH=5,6,以二甲酚橙为指示剂,用锌盐标准滴定溶液滴定剩余的EDTA。
然后
3+加入过量的NHF,加热煮沸,置换出与Al配合的EDTA,再用锌盐标准滴定4 溶液滴定至紫红色为终点。
有关反应如下:
2–3+–+HY + Al = AlY + 2H 22–2+2–+HY+ Zn =ZnY + 2H 2
(剩余) ––+2–3–AlY+ 6F + 2H = AlF + HY 622–2+2–+ +2H HY+ Zn = ZnY2
(置换生成)
三、试剂
1(EDTA溶液c(EDTA)= 0.02mol/L。
2+2+2(锌盐标准溶液c(Zn) = 0.02 mol/L:可用标定EDTA所配制的Zn溶液,标定方法同实验八。
3(百里酚蓝指示液(1g/L):0.10g百里酚蓝溶于20%乙醇,用20%乙醇稀释至
100mL。
4(二甲酚橙指示液(2g/L):0.20g二甲酚橙溶于水,稀释至100mL。
5(HCl(1+1):盐酸于水按1+1体积比混合。
6(氨水(1+1)。
7(六次甲基四胺(200 g/L):20g六次甲基四胺溶于少量水,稀释至100mL。
8(固体NHF。
4
9(硫酸铝试样。
2
四、实训内容
准确称取硫酸铝试样0.5g,加3mL(1+1)HCl,50mL水溶解,定量移入100mL容量瓶中,稀释至刻度,摇匀。
用移液管移取上述试液10.00mL,放入锥形瓶中,加20mL水和30.00mL的
c(EDTA)= 0.02mol/LEDTA溶液,再加4,5滴百里酚蓝指示液,以氨水(1+1)中和至黄色(pH=3,3.5),煮沸2min,取下,加入20%六次甲基四胺溶液20mL(或固体六次甲基四胺4g)使试液(pH=5,6),用力振荡,以流水冷却。
然后加入2 2+滴二甲酚橙指示液,用c(Zn)=0.02 mol/L锌盐标准滴定溶液滴定至溶
液由黄色变成紫红色(不记体积,为什么?)。
在溶液中加入2g固体NHF,加热4煮沸2min,冷却,用锌盐标准滴定溶液滴定至溶液由黄色变紫红色为终点,平行测定三次。
五、计算公式
式中ω(Al)——Al的质量分数,,; 2+2+ c(Zn)——Zn标准滴定溶液的浓度,mol/L;
2+2+ V(Zn)——滴定时消耗Zn标准滴定溶液的体积,mL;
m(样品)——铝盐试样的质量,g ;
M(Al)——Al的摩尔质量,g/mol。
六、数据记录
1
2
3
称量瓶+ 样品(倾样前)/g
称量瓶+样品(倾样后)/g
m(试样)/g
取试液体积/mL
2+V(Zn)/ mL
2+C(Zn)/mol/L
ω(Al)/%
3
Al的平均质量分数/%
Al相对平均偏差
七、思考题
1(测定步骤中加入氨水和六次甲基四胺的目的是什么,可否用其中一种调节酸度,
2(滴定过程中,为什么要两次加热,
3(第一次用锌盐标准滴定溶液滴定EDTA,为什么不记体积,若此时锌盐溶液过量,对分析结果有何影响,
(列出铝含量的计算公式。
若以Al4(SO).18HO计,其计算公式如何(按置换2432
滴定法计算)?
5(置换滴定法中所用EDTA溶液是否必须是标准滴定溶液,
4。
