环己醇制备环己酮
实验六环己酮的制备

振摇时烧瓶中通过温度计套管插入温度计测温,氧化反应 开始后,混合液迅速变热,且橙红色的重铬酸盐变为墨绿 色的低价铬盐。当烧瓶内温度达到55℃时,可用冷水浴适 当冷却,控制温度不超过60℃。待前一批重铬酸盐的橙色 消失之后,再加入下一批。
实验六环己酮的制备
单击此处添加副标题内容
环己酮的制备
环已酮的制备
一、实验目的 二、实验原理 三、主要仪器及试剂 四、实验步骤 五、实验关键及注意事项 六、思考题
一 实验目的
学习由醇氧化制备酮的基本原理。 掌握由环已醇氧化制备环己酮的
实验操作。
二 实验原理
N a 2 C r 2 O 7H 2S O 4H 2 O
六 思考题
1、为什么要将重铬酸钠溶液分批加入反应瓶中? 2、当氧化反应结束时,为何要加入甲醇? 3 、本实验的氧化剂能否改用硝酸或高锰酸钾, 为什么?
谢谢聆听
共同学习相互提高
1)甲醇沸点64.7℃,前馏分中含甲醇,弃去。
2)31℃时,环己酮在水中的溶解度为2.4g/100ml,即使用盐析, 仍不可避免有少量环己酮损失,故水的馏出量不宜过多。
3)判断全部蒸出的方法:第一,馏出液澄清;第二,将馏分与水 混溶,若无油珠说明蒸馏完毕。
(二)粗品的精制
4. 萃取、干燥
将馏出液用2g精盐饱和。分液漏斗分出有机层后,分 别用6ml乙醚萃取水层两次,合并有机层和萃取液,然 后加入0.5-1g无水MgSO4干燥至澄清。
注意事项:
一定注意分液后不要倒掉水。 由于乙醚易燃易挥发,因此实验中严禁出现明火。
五 实验成败的关键
铬酸氧化醇是一个放热反应,实验中必须严格 控制反应温度以防反应过于剧烈。温度过低反应 困难,过高副反应增多。
实验四_环己酮的制备
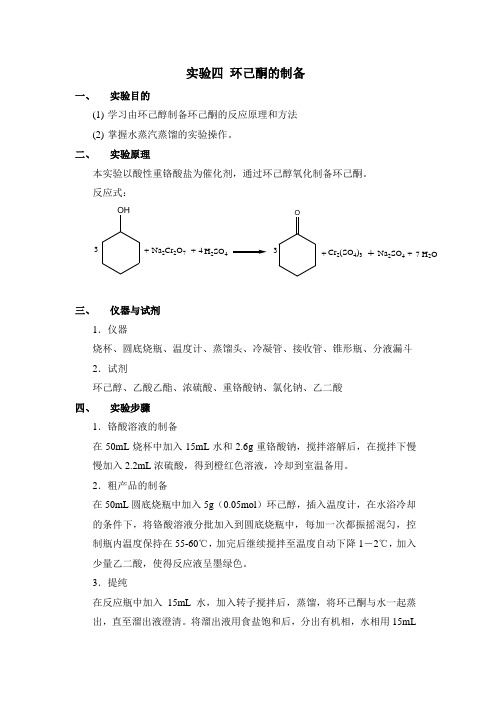
实验四 环己酮的制备一、 实验目的(1) 学习由环己醇制备环己酮的反应原理和方法(2) 掌握水蒸汽蒸馏的实验操作。
二、 实验原理本实验以酸性重铬酸盐为催化剂,通过环己醇氧化制备环己酮。
反应式: OH 3+Na 2Cr 2O 7+H 2SO 44O++Cr 2(SO 4)3Na 2SO 4+H 2O 73三、 仪器与试剂1.仪器烧杯、圆底烧瓶、温度计、蒸馏头、冷凝管、接收管、锥形瓶、分液漏斗2.试剂环己醇、乙酸乙酯、浓硫酸、重铬酸钠、氯化钠、乙二酸四、 实验步骤1.铬酸溶液的制备在50mL 烧杯中加入15mL 水和2.6g 重铬酸钠,搅拌溶解后,在搅拌下慢慢加入2.2mL 浓硫酸,得到橙红色溶液,冷却到室温备用。
2.粗产品的制备在50mL 圆底烧瓶中加入5g (0.05mol )环己醇,插入温度计,在水浴冷却的条件下,将铬酸溶液分批加入到圆底烧瓶中,每加一次都振摇混匀,控制瓶内温度保持在55-60℃,加完后继续搅拌至温度自动下降1-2℃,加入少量乙二酸,使得反应液呈墨绿色。
3.提纯在反应瓶中加入15mL 水,加入转子搅拌后,蒸馏,将环己酮与水一起蒸出,直至溜出液澄清。
将溜出液用食盐饱和后,分出有机相,水相用15mL乙酸乙酯萃取两次,萃取液并入有机相。
将产物放入圆底烧瓶中,加入转子,蒸馏除去乙酸乙酯,收集151-155℃馏分。
五、注意事项1、加入铬酸溶液时,温度必须控制在55-60℃,温度过低不易反应,温度过高副反应增多。
2、反应完全后,加入少量乙二酸除去未反应的重铬酸钠。
3、31℃时环己酮在水中的溶解度为2.4g,故水的溜出量不宜过多,否则造成损失。
4、酸液不要接触皮肤,也不可随意丢弃,以防污染环境。
六、问题与讨论1、本实验用重铬酸盐为氧化剂,如果用高锰酸钾氧化,产物是什么?2、为什么将铬酸溶液分批加入烧瓶中?3、反应结束后为什么加入乙二酸?如果不加入乙二酸有什么不好?4、该实验有哪些改进方法?。
环己酮合成实验报告

环己酮合成实验报告环己酮合成实验报告引言:环己酮是一种重要的有机化合物,广泛应用于化工、医药和农药等领域。
本实验旨在通过酸催化的氧化还原反应,合成环己酮,并通过对反应条件的调节,探讨其对产率和纯度的影响。
实验部分:1. 实验原理环己酮的合成反应是通过环己醇的氧化还原反应实现的。
在酸性条件下,环己醇经过氧化反应生成环己酮。
本实验中,我们采用酸性催化剂作为氧化剂,如硫酸、磷酸或硫酸铜等。
2. 实验步骤(1)制备反应体系:将一定量的环己醇和催化剂溶解在适量的溶剂中,如乙醇或二甲基甲酰胺。
(2)反应条件调节:探究不同催化剂、溶剂、反应温度和反应时间对产率和纯度的影响。
(3)反应操作:将反应体系加热至设定温度,在搅拌条件下进行反应。
(4)产物分离:将反应混合物进行冷却,然后用水洗涤、干燥和蒸馏等操作,分离出目标产物。
结果与讨论:1. 催化剂的选择我们尝试了不同的催化剂,包括硫酸、磷酸和硫酸铜。
结果显示,硫酸铜催化剂具有较高的催化活性和选择性,能够有效地催化环己醇的氧化反应。
2. 溶剂的影响我们比较了乙醇和二甲基甲酰胺作为溶剂的效果。
结果表明,乙醇作为溶剂时,反应速率较快,产率较高,但纯度稍低。
而二甲基甲酰胺作为溶剂时,反应速率较慢,产率较低,但纯度较高。
因此,在实际应用中,需根据具体需求选择合适的溶剂。
3. 反应温度和反应时间的影响我们分别调节了反应温度和反应时间,观察其对产率和纯度的影响。
结果显示,随着反应温度的升高,反应速率增加,但同时伴随着产物分解和副反应的增加。
而反应时间的延长有助于提高产率和纯度,但过长的反应时间也会导致产物分解和副反应的增加。
结论:通过本实验,我们成功合成了环己酮,并探究了不同条件对产率和纯度的影响。
在实际应用中,可根据需求选择合适的催化剂、溶剂、反应温度和反应时间,以提高产率和纯度。
此外,本实验还为进一步研究环己酮的合成和应用提供了基础。
参考文献:[1] Smith, J. M., & Johnson, R. R. (2010). Organic Chemistry: Principles and Mechanisms. John Wiley & Sons.[2] Li, G., & Wang, Z. (2014). Catalytic oxidation of cyclohexanol to cyclohexanone over copper catalysts. Journal of Molecular Catalysis A: Chemical, 393, 71-78.。
有环己醇多步合成环己酮肟

有环己醇多步合成环己酮肟
(1)环己醇制备环己酮
醛和酮可用相应的伯醇和仲醇氧化得到,实验室中通常用重铬酸钾做氧化剂。
由于醛和酮是醇类氧化的中间产物,因此需要控制氧化条件以防止过度氧化。
国内外实验教材一般选择重铬酸钾/硫酸体系对环己醇氧化制备环己酮,收率约60%。
该方法环境污染严重,反应时间长,后处理工作麻烦困难。
OH 3+Na 2Cr 2O 7+H 2SO 44O
++Cr 2(SO 4)3Na 2SO 4+H 2O 73 为了改进上述不足,实验室可在路易酸催化作用下用双氧水氧化环己醇制备环己酮[ 7 ] 。
在装有回流冷凝管、滴液漏斗、温度计的三口烧瓶中加入环己醇和氯化铁,从滴液漏斗中滴加30%双氧水,水浴控温在55 ~60℃,振摇,反应时间70分钟。
反应混合物蒸馏,馏出液加入饱和食盐水,分出有机层,水层用乙醚萃取。
合并有机相,无水硫酸钠干燥,水浴蒸除乙醚后,蒸馏,收集152~156℃馏分,收率约75%。
采用价廉无毒害的FeCl3 做催化剂,用H2O2 氧化环己醇制备环己酮,反应条件温和,反应时间短,克服了传统有机化学实验教材中HCrO4、Na 2Cr 2O 7 /H 2 SO 4、KMnO 4 氧化法污染大、时间长的缺点,是一条合成环己酮的绿色工艺路线。
环己酮经Meerwein - Ponndorf还原反应也可得到环己醇。
(2)环己酮制备环己酮肟
脂肪酮和芳香酮都可以和羟胺作用生成肟。
环己酮在碳酸钠或乙酸钠等弱酸盐存在下,与羟胺盐酸盐很容易进行缩合脱水反应得到环己酮肟。
环己酮

b.混合物中含有焦油状物质,采用通常的蒸馏、萃取等 方法都不适用。
c.在常压下蒸馏会发生分解的高沸点有机物质。 ③ 答:(1)不溶或难溶于水;(2)共沸腾下与水不发生 化学反应;(3)在100℃左右时,必须具有一定的蒸汽压 [至少666.5-1333Pa(5-10mmHg)]
安全管的作用是什么?
T形管的作用是什么?
环己酮的制备
实验学时:4学时 实验类别:基础有机合成实验
一、实验目的
1. 学习用重铬酸盐氧化法由环己醇制备环己酮
的原理和方法;
2.了解盐析效应在分离有机化合物中的应用。
二、基本原理
OH
O
3
+
NaCr2O7
+ 5 H2SO4
3
+
Cr2(SO4)3 + 2 NaHSO4 + 7 H2O
以铬酸为氧化剂氧化仲醇是制备脂肪酮常用的方 法。铬酸氧化是一个放热反应,必须严格控制反 应温度以免反应过于剧烈。 问题:用铬酸氧化制备醛和酮有什么不同?
4、实验完毕,关好水电。
5、称重、计算产率。
问题:在馏出ห้องสมุดไป่ตู้加入精盐饱和有什么作用?
五、操作重点及注意事项
1、浓H2SO4的滴加要缓慢,分批滴加。 2、铬酸氧化醇是一个放热反应,实验中必须严格控制反应温度以防 反应过于剧烈。反应中控制好温度,温度过低反应困难,过高到 副反应增多。
3、回收乙醚用水浴蒸馏,无明火。在精制环已酮时,用空气冷凝管。
①当有机物与水一起共热时,整个系统的蒸汽压为各组分蒸 汽压之和,当总蒸汽压(p)与大气压力相等时,液体沸腾。 混合物的沸点低于任何一个组分的沸点,有机物可在比其沸 点低得多的温度,而且在低于100℃的温度下随蒸汽一起蒸馏 出来。这样的操作叫水蒸气蒸馏。
环己醇制备环己酮

环己醇制备环己酮一、实验目的1.学习铬酸氧化法制备环己酮的原理和方法。
2.通过第二醇转变为酮的实验,进一步了解醇和酮之间的区别和联系。
二、实验原理反应式:OH O副反应:OHOOC—(CH2)4—COOH三、仪器设备圆底烧瓶,温度计,分液漏斗,冷凝管。
四、相关知识点醇的氧化反应,酮的氧化反应。
五、实验步骤1. 投料反应在500ml圆底烧瓶内,放置120ml冰水,在搅拌下慢慢加入20ml 浓硫酸,充分混匀,小心加入20g环己醇(21ml,0.2mo1/l)。
在上述混合液内插入一支温度计,将溶液冷至30℃以下。
在烧杯中将21g 重铬酸钠(Na2Cr2O7·2H2O,0.07mo1/l)溶解于12ml水中。
取此溶液lml加入圆底烧瓶中,充分振摇,这时可观察到反应温度上升和反应液由橙红色变为墨绿色,表明氧化反应已经发生。
继续向圆底烧瓶中滴加剩余的重铬酸钠溶液,同时不断振摇烧瓶,控制滴加速度,保持烧瓶内反应液温度在55—60℃之间。
若超过此温度时立即在冰水浴中冷却。
滴加完毕,继续振摇反应瓶直至观察到温度自动下降1—2℃以上。
然后再加入少量的草酸(约需1g),使反应液完全变成墨绿色,以破坏过量的重铬酸盐。
(二)分离粗产物和收集产物1. 分离粗产物在反应瓶内加入100ml水,再加几粒沸石,装成蒸馏装置,将环己酮与水一并蒸馏出来,环己酮与水能形成沸点为95℃的共沸混合物。
直到馏出液不再混浊后再多蒸15—20ml(约收集馏液80—100ml),用食盐(15—20g)饱和馏液,在分液漏斗中静置后分出有机层。
2. 收集产物有机层用无水碳酸钾干燥,蒸馏,收集150—156℃的馏分,环己酮产量12—13 g(产率62%—67%)。
六、实验报告要求写好标题,目的,原理,操作步骤,记录实验结果, 对实验现象进行解释及讨论。
七、思考题1、制备环己酮时,当反应结束后,为什么要加入草酸,如果不加入草酸有什么不好?用反应式说明之。
环己醇生成环己酮反应机理

环己醇生成环己酮反应机理嘿,朋友!咱来聊聊环己醇生成环己酮这事儿。
你可以把环己醇想象成一个有点内向的小团子,它安安静静地待在那儿。
这个反应就像是一场神奇的变身秀。
首先呢,需要一个氧化剂,这个氧化剂就像是一个超级爱管闲事的魔法精灵,比如说重铬酸钾(K₂Cr₂O₇)。
当这个魔法精灵靠近环己醇这个小团子的时候,就开始搞事情啦。
环己醇的羟基( - OH)就像是小团子头上的一个小辫子,这个魔法精灵一把抓住这个小辫子,就想把它改造改造。
这个过程就像是一场激烈的拔河比赛。
环己醇的小辫子(羟基)不想被轻易改变,但是魔法精灵力量很强大。
在这个拉扯的过程中,羟基上的氢原子就像一个胆小的小跟班,被魔法精灵硬生生地拽走了。
然后呢,原本羟基的位置就空出来了,就像一个原本插着小旗的小坑突然空了。
这个时候,旁边的碳原子就感觉有点孤单啦,它就想调整一下自己的状态。
就像一个人原本有个小伙伴在身边,突然小伙伴走了,它就想换个姿势一样。
这个碳原子就和旁边的碳原子重新组合了一下化学键,就像两个人重新挽起了手。
这时候,原本的环己醇小团子就慢慢变成了环己酮这个新的小团子。
环己酮呢,就像是环己醇经过精心打扮后的新模样,有点帅气又有点小神秘。
如果把整个反应看成是一场舞台剧的话,环己醇是开场的小主角,有点懵懂。
而氧化剂就是那个突然闯入的大反派,强行改变了主角的命运。
但是呢,这个改变也不是那么容易的,中间经历了各种原子之间的推推搡搡,就像一群调皮的小朋友在打闹。
最后,环己酮闪亮登场,它像是从一个青涩的小角色变成了一个成熟的小明星,在化学的舞台上有了自己新的地位。
这个反应虽然看起来复杂,但就像一场有趣的化学魔术,充满了惊喜和奇妙的变化。
从微观的角度看,那些原子就像一个个小小的积木块,被重新组合拼接,构建出了一个全新的结构。
这环己醇生成环己酮的反应啊,就像是化学世界里一个独特的魔法故事,让人忍不住想要探究更多的化学魔法呢。
制环己酮实验报告

一、实验目的1. 了解环己酮的化学性质和制备方法。
2. 掌握实验室制备环己酮的基本操作技能。
3. 通过实验,验证环己酮的制备反应原理和实验步骤。
二、实验原理环己酮是一种重要的有机化合物,广泛应用于医药、农药、香料、染料等领域。
环己酮的制备方法主要有环己烷氧化法、环己醇脱氢法和环己烯酯化加氢法等。
本实验采用环己醇脱氢法制备环己酮,其反应原理如下:C6H12 + O2 → C6H10O + H2OC6H10O → C6H10O + H2C6H10O + H2 → C6H10O2三、实验仪器与试剂1. 仪器:圆底烧瓶、冷凝管、滴液漏斗、酒精灯、温度计、分液漏斗、蒸馏装置、锥形瓶、磁力搅拌器等。
2. 试剂:环己醇、浓硫酸、氢氧化钠、蒸馏水、活性炭等。
四、实验步骤1. 将50ml环己醇加入圆底烧瓶中,加入适量的活性炭,搅拌溶解。
2. 在搅拌的同时,向圆底烧瓶中缓慢加入浓硫酸,控制反应温度在180-200℃之间。
3. 反应进行约30分钟,观察到溶液由无色变为浅黄色。
4. 将反应溶液冷却至室温,用分液漏斗分离出环己酮。
5. 将环己酮溶液加入锥形瓶中,加入适量的氢氧化钠溶液,调节pH值至中性。
6. 用蒸馏装置对环己酮进行蒸馏,收集沸点在156-158℃的馏分。
7. 将蒸馏得到的环己酮溶液加入适量的蒸馏水,搅拌均匀。
8. 将溶液过滤,得到环己酮固体。
五、实验结果与分析1. 实验制备的环己酮固体为白色晶体,具有良好的结晶性。
2. 通过对环己酮的物理性质进行测定,结果表明实验制备的环己酮纯度较高,符合实验要求。
六、实验讨论1. 实验过程中,环己醇的加入量和硫酸的加入量对反应的影响较大。
适量的环己醇和硫酸有利于提高环己酮的产率和纯度。
2. 在反应过程中,控制反应温度对提高环己酮的产率和纯度具有重要意义。
3. 实验制备的环己酮纯度较高,为后续的实验研究提供了良好的基础。
七、实验总结通过本次实验,我们了解了环己酮的制备方法、原理和实验步骤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环己醇制备环己酮
一、实验目的
1.学习铬酸氧化法制备环己酮的原理和方法。
2.通过第二醇转变为酮的实验,进一步了解醇和酮之间的区别和联系。
二、实验原理
反应式:
OH O
副反应:
O
HOOC—(CH2)4—COOH
三、仪器设备
圆底烧瓶,温度计,分液漏斗,冷凝管。
四、相关知识点
醇的氧化反应,酮的氧化反应。
五、实验步骤
1. 投料反应
在500ml圆底烧瓶内,放置120ml冰水,在搅拌下慢慢加入20ml 浓硫酸,充分混匀,小心加入20g环己醇(21ml,0.2mo1/l)。
在上
述混合液内插入一支温度计,将溶液冷至30℃以下。
在烧杯中将21g 重铬酸钠(Na2Cr2O7·2H2O,0.07mo1/l)溶解于12ml水中。
取此溶液lml加入圆底烧瓶中,充分振摇,这时可观察到反应温度上升和反应液由橙红色变为墨绿色,表明氧化反应已经发生。
继续向圆底烧瓶中滴加剩余的重铬酸钠溶液,同时不断振摇烧瓶,控制滴加速度,保持烧瓶内反应液温度在55—60℃之间。
若超过此温度时立即在冰水浴中冷却。
滴加完毕,继续振摇反应瓶直至观察到温度自动下降1—2℃以上。
然后再加入少量的草酸(约需1g),使反应液完全变成墨绿色,以破坏过量的重铬酸盐。
(二)分离粗产物和收集产物
1. 分离粗产物
在反应瓶内加入100ml水,再加几粒沸石,装成蒸馏装置,将环己酮与水一并蒸馏出来,环己酮与水能形成沸点为95℃的共沸混合物。
直到馏出液不再混浊后再多蒸15—20ml(约收集馏液80—100ml),用食盐(15—20g)饱和馏液,在分液漏斗中静置后分出有机层。
2. 收集产物
有机层用无水碳酸钾干燥,蒸馏,收集150—156℃的馏分,环己酮产量12—13 g(产率62%—67%)。
六、实验报告要求
写好标题,目的,原理,操作步骤,记录实验结果, 对实验现象进行解释及讨论。
七、思考题
1、制备环己酮时,当反应结束后,为什么要加入草酸,如果不加入草酸有什么不好?用反应式说明之。
2、用高锰酸钾的水溶液氧化环己酮,应得到什么产物?
3、如欲将乙醇氧化成乙醛,应采用哪些措施以避免其进一步氧化成乙酸?。
