化学必修一第三章 金属的化学性质知识点
高中化学必修一(第三章)知识点全归纳

高中化学必修一(第三章)知识点全归纳第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
★(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2 Na2O2★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
知识拓展:a:将钠放入硫酸铜溶液中,能否置换出铜单质?不能,2Na + 2H2O = 2NaOH + H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+2HCl=2NaCl+H2↑钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。
高一化学第三章金属及其化合物知识点归纳
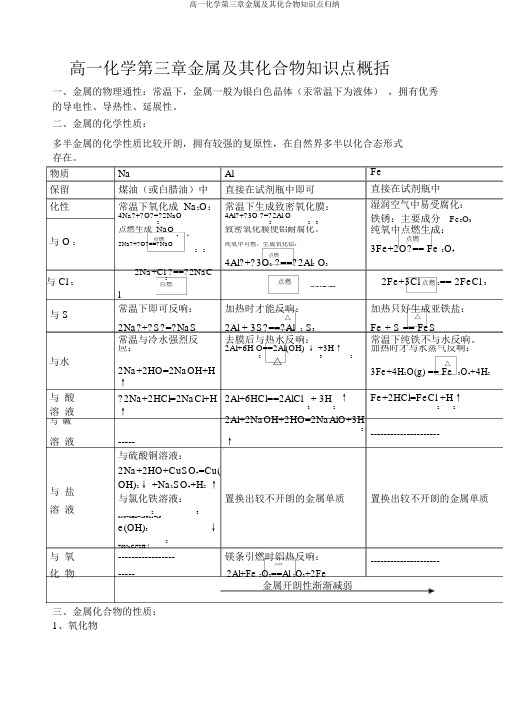
高一化学第三章金属及其化合物知识点概括一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体) ,拥有优秀的导电性、导热性、延展性。
二、金属的化学性质:多半金属的化学性质比较开朗,拥有较强的复原性,在自然界多半以化合态形式存在。
物质 Na Al保留 煤油(或白腊油)中直接在试剂瓶中即可化性常温下氧化成 Na 2O : 常温下生成致密氧化膜:4Na?+?O?=?2NaO4Al?+?3O ?=?2Al O222 3点燃生成 NaO致密氧化膜使铝耐腐化。
与 O 222点燃2Na?+?O?==?NaO纯氧中可燃,生成氧化铝:2 2点燃4Al?+?3O 2 ?==?2Al 2 O 3Fe 直接在试剂瓶中湿润空气中易受腐化:铁锈:主要成分 Fe 2O 3 纯氧中点燃生成:点燃3Fe+2O?== Fe 3O 42Na+Cl ?==?2NaC与 Cl 22点燃2Fe+3Cl 点燃2== 2FeCl 3点燃2Al+3Cl 2?==?2AlCl 3l与 S常温下即可反响:加热时才能反响:加热只好生成亚铁盐:△△2Na?+?S?=?NaS Fe + S == FeS 2Al + 3S?==?Al 2 S 3常温与冷水强烈反去膜后与热水反响:常温下纯铁不与水反响。
应:2Al+6H O==2Al(OH) ↓ +3H ↑加热时才与水蒸气反响:与水2△322Na+2HO=2NaOH+H△3Fe+4H 2O(g) == Fe 3O 4+4H 2↑与 酸 ?2Na+2HCl=2NaCl+H 2Al+6HCl==2AlCl 3+ 3H 2↑Fe+2HCl=FeCl +H ↑ 溶 液↑ 2 22Al+2NaOH+2HO=2NaAlO+3H与 碱-----------------2--------------------- 溶 液----- ↑与硫酸铜溶液:2Na+2HO+CuSO 4=Cu( 与 盐 OH)2↓ +Na 2SO 4+H 2 ↑与氯化铁溶液:置换出较不开朗的金属单质 置换出较不开朗的金属单质溶 液2 36Na+6HO+2FeCl =2Fe(OH)3↓2+6NaCl+3H ↑与 氧 -----------------镁条引燃时铝热反响:---------------------化 物-----点燃2Al+Fe 2O 3==Al 2O 3+2Fe金属开朗性渐渐减弱三、金属化合物的性质:1、氧化物2Na2O2 2 323NaO Al O Fe O性质碱性氧化物非碱性氧化物两性氧化物碱性氧化物颜色状淡黄色固体白色固体赤红色固体态白色固体与水反2Na2O2+2H2O=4NaOH--------------------------------应Na2O+H2O=2NaOH+O2↑与酸溶Na2O+2HCl=2NaCl2Na2O2+4HCl=4NaCl+2H2O+Al 2O3+6HCl=2AlCl 3+3H2O Fe2O3+6HCl=2FeCl 3+3H2O液+H2O(溶液无色)O2↑(溶液黄色)与碱溶----------------Al 2O3+2NaOH=----------------液----------------2NaAlO2+H2O其余Na2O+CO2=Na2CO32Na2O2+2CO=2Na2CO3+O2--------------------------------2、氢氧化物化性NaOH Al(OH)3Fe(OH)Fe(OH)23属性碱性氢氧化物两性氢氧化物碱性氢氧化物碱性氢氧化物与酸溶 NaOH+HCl=NaCl+H2 Al(OH) 3+3HCl=Fe(OH)2+2HCl=FeCl2+2 Fe(OH)3 +3HCl=液O AlCl 3 +3H2O H2O FeCl3+3H2 O与碱溶Al(OH)+NaOH=NaAlO+2HO ----------------------------------------------液3△22--△4Fe(OH) +O+2HO=4Fe2Fe(OH) ==Fe O+稳固性稳固2Al(OH)==Al O+3HO2232332323H O(OH)32 2NaOH+CO?=Na2CO3其余+H2 O----------------------------------------------NaOH+CO(--过2量)=NaHCO3制备金属钠与水即可铝盐溶液与过度浓氨亚铁盐溶液与氢氧化铁盐溶液滴加氢水钠溶液(液面下)氧化钠溶液3、盐FeCl2FeCl3颜色浅绿色黄色与碱FeCl2 +2NaOH?=?Fe(OH)↓FeCl3+3NaOH=?Fe(OH)↓ +3NaCl 溶液+2NaCl互相2FeCl2+Cl 2?=?2FeCl32FeCl3 +Fe?=?3FeCl2转变 2FeBr2+Br2?=?2FeBr32FeBr3 +Fe?=?3FeBr2主要表现:性(复原表现:性(氧化性)高一化学第三章金属及其化合物知识点归纳性)查验遇 KSCN不显血红色,加入氯水遇 KSCN显血红色后显红色用途净水剂等印刷线路板等四、金属及其化合物之间的互相转变1、铝及其重要化合物之间的转变关系,写出相应的化学反响方程式。
高中化学必修一第三章知识点总结

高中化学必修一第三章知识点总结一、金属及其化合物(一)金属的化学性质1. 金属与非金属的反应- 钠与氧气反应- 常温下:4Na + O_{2}=2Na_{2}O,氧化钠为白色固体。
- 加热时:2Na+O_{2}{}{=!=!=}Na_{2}O_{2},过氧化钠为淡黄色固体。
- 铝与氧气反应- 在常温下,铝能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,4Al + 3O_{2}=2Al_{2}O_{3}。
这层薄膜可以阻止内部的铝进一步被氧化。
2. 金属与酸和水的反应- 钠与水反应- 化学方程式:2Na + 2H_{2}O = 2NaOH+H_{2}↑。
- 现象:“浮(钠的密度比水小)、熔(反应放热,钠的熔点低)、游(有气体生成)、响(反应剧烈)、红(溶液呈碱性,使酚酞变红)”。
- 铁与水蒸气反应- 化学方程式:3Fe + 4H_{2}O(g){高温}{=!=!=}Fe_{3}O_{4}+4H_{2}。
3. 铝与氢氧化钠溶液反应- 化学方程式:2Al+2NaOH + 2H_{2}O=2NaAlO_{2}+3H_{2}↑。
(二)几种重要的金属化合物1. 氧化物- 氧化钠和过氧化钠- 氧化钠(Na_{2}O)- 属于碱性氧化物,与水反应:Na_{2}O + H_{2}O = 2NaOH;与酸反应:Na_{2}O+2HCl = 2NaCl + H_{2}O。
- 过氧化钠(Na_{2}O_{2})- 与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH+O_{2}↑。
- 与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2},因此过氧化钠可用于呼吸面具和潜水艇中作为氧气的来源。
- 氧化铝(Al_{2}O_{3})- 两性氧化物,既能与酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O,又能与碱反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O。
高一金属的化学性质知识点

高一金属的化学性质知识点在高一化学教材中,金属的化学性质是一个重要的学习内容。
金属是一类物质,具有特定的性质和行为。
下面将介绍金属的几个重要的化学性质。
1. 金属的活泼性金属的活泼性是指金属与酸、水、氧等物质发生化学反应的能力。
活泼性较高的金属具有较强的化学反应能力,而活泼性较低的金属则反应相对较弱。
例如,铁是活泼性较高的金属,当铁与盐酸反应时,会生成氯化铁和氢气的反应:Fe + 2HCl → FeCl2 + H2↑而铝是活泼性较低的金属,和盐酸反应时,产生的反应较弱:2Al + 6HCl → 2AlCl3 + 3H2↑2. 金属的氧化性金属的氧化性是指金属与氧气反应的能力。
大部分金属可以与氧气反应生成相应的金属氧化物。
例如,铜与氧气反应生成铜氧化物:2Cu + O2 → 2CuO铁与氧气反应生成铁氧化物:4Fe + 3O2 → 2Fe2O33. 金属的还原性金属的还原性是指金属在化学反应中,能够失去电子从而被氧化物还原为金属的能力。
例如,当铜氧化物与氢气反应时,氧化物中的氧被还原为纯铜:CuO + H2 → Cu + H2O铁氧化物与一些金属还原剂反应时,也可以发生类似的还原反应。
4. 金属的腐蚀性金属的腐蚀性是指金属在与环境中的氧、水等物质接触时,发生的自然氧化反应。
金属的腐蚀会导致金属表面产生氧化层,并且会逐渐损耗金属的质量和性能。
例如,银在空气中容易被硫化物腐蚀,产生黑色的硫化银:2Ag + S → Ag2S铁的腐蚀叫做生锈,当铁表面与氧气和水接触时,会生成氧化铁:4Fe + 3O2 + 6H2O → 4Fe(OH)35. 金属的导电性和热导性金属具有良好的导电性和热导性,这是由于金属中大量自由电子的存在。
自由电子可以在金属中自由移动,形成电流和热传导。
因此,金属是良好的导电体和热导体。
这些是高一化学中金属的几个重要的化学性质。
通过了解金属的化学性质,我们可以更好地理解金属的行为和应用。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
化学必修1第三章归纳与整理

11.解:设5.1g镁铝合金中镁、铝的物质的量分别为x、y。 Mg H2 2Al 3H2 x x y y 依据题意,得 24g/mol·x+27g/mol·y=5.1g x+ y= x=0.1mol y=0.1mol m(Al)=0.1mol×27g/mol=2.7g (Al)= ×100%=52.96%=53% n(Al)∶n(Mg)=0.1mol∶ 0.1mol=1∶1
3.CO2反应
不反应
不反应
不反应
4.热稳定性
受热不分解
5.还原性
无
无
无
习题处理: 1.B 2.C 3.D 4.D 5.A 6.C 7.①2Cu+O2 2CuO ②CuO+H2SO4=CuSO4+H2O ③CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 ④Cu(OH)2 CuO+H2O ⑤CuSO4+Fe=FeSO4+Cu 8.答:NaOH溶液吸收了CO2,易拉罐内压强变小,因而变瘪了; 铝和NaOH溶液反应,产生氢气,罐内压强又增大,变瘪的易拉罐 又鼓起来。 CO2+2OH-=CO32-+H2O Al2O3+2OH-=2AlO2-+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ 9.CaCO3 CaO+CO2↑ CaO+H2O=Ca(OH)2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
B
D
题号
9
10
11
12
13
14
15
16
答案
C
A
C
C
C
D
必修1 第三章知识点

第三章、金属及其化合物知识梳理第一节金属的化学性质金属的物理通性:常温下,除了汞之外,都为固态;金属都有延展性、导热性和导电性;大多数都有金属光泽。
地壳中元素含量顺序:氧硅铝铁(铝是含量最丰富的金属元素)金属的化学通性:1)能与氧气等非金属起反应;2)活泼金属能与酸反应置换出氢气;3)活泼金属能与较不活泼的金属盐溶液反应,置换出较不活泼金属。
钠:银白色固体,质软,密度比水小比煤油大、熔点比水的沸点低钠暴露在空气,表面的银白色很快褪去,与氧气常温下生成氧化钠4N a+O2═2N a2O 加热的条件,钠与氧气生成淡黄色的△过氧化钠(N a2O2)2N a+O2═N a2O2过氧化钠与水或二氧化碳反应能放出氧气,故可用作制备O2。
2N a2O2+2H2O═4N a O H+O2↑2N a2O2+2C O2═2N a2C O3+O2以上两反应中,N a2O2既做氧化剂又是还原剂钠与水反应可放出H2:2N a+2H2O═2N a O H+H2↑现象:钠浮在溶液表面上,熔成一个小球,迅速向四处游动,发出“嘶嘶”的声音。
如果滴入酚酞可观察到溶液变红。
钠与酸溶液反应时,先跟酸作用,过量的钠再与水反应。
钠与盐溶液反应时,先与水反应,生成的N a O H再与盐发生复分解反应,例如将钠投入C u S O4溶液中,会有“浮熔游嘶”的现象,同时溶液中会有蓝色絮状沉淀生成。
钠的保存:金属钠需保存在石蜡油或煤油中。
钠在自然界中以盐的形式存在,钠暴露在空气中,会发生以下变化:N a→N a2O →N a O H→N a2C O3•10H2O→N a2C O3钠着火不能用水扑灭,一般用砂土盖灭。
铝:铝在常温下能与空气中的氧气反应,形成一层致密的氧化膜,保护了铝金属不被继续氧化。
4A l+3O2═2A l2O3加热铝箔时,由于外层氧化膜的熔点比铝的熔点高,故熔化的液态铝并不滴落。
铝与强酸和强碱均能反应放出H22Al +6HCl == 2AlCl3 + 3H2↑2Al+2NaOH+2H2O==2NaAlO2+3H2↑铁:铁与水蒸气反应生成四氧化三铁和H2△3Fe+4H2O(g)═Fe3O4+4H2金属单质在反应中,化合价都升高,表现出还原性,作还原剂。
高中化学必修一(第三章)知识点全归纳

高中化学必修一(第三章)知识点全归纳第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
★(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2 Na2O2★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
知识拓展:a:将钠放入硫酸铜溶液中,能否置换出铜单质?不能,2Na + 2H2O = 2NaOH + H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+2HCl=2NaCl+H2↑钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节金属的化学性质
一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质
1、金属与非金属的反应
○1与反应:
Na:4Na + O2 = 2Na2O(常温) 2Na + O2 == Na2O2(点燃)
Al:4Al + 3O2 = 2Al2O3(常温) 4Al + 3O2 == 2Al2O3(点燃)Fe:潮湿空气中生成铁锈,主要成分Fe2O3
3Fe+2O2 == Fe3O4 (纯氧中点燃)
○2与反应:
Na:2Na+Cl2 == 2NaCl(点燃)
Al:2Al+3Cl2 == 2AlCl3(点燃)
Fe:2Fe+3Cl2== 2FeCl3(点燃)
○3与S反应:
Na:2Na + S = Na2S(常温)
Al:2Al + 3S == Al2S3(加热)
Fe:Fe + S == FeS(加热)
2、金属与酸和水的反应:
○1与反应:
Na:2Na+2H2O=2NaOH+H2↑(常温)
Al:2Al+6H2O==2Al(OH)3↓+3H2↑(去膜后与热水反应)
Fe:3Fe+4H2O(g) == Fe3O4+4H2(加热时与水蒸气反应)
○2与酸溶液反应:
Na:2Na+2HCl=2NaCl+H2↑
Al:2Al+6HCl==2AlCl3+ 3H2↑
Fe:Fe+2HCl=FeCl2+H2↑
○3与碱溶液反应:
Na:不反应
Al:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Fe:不反应
3、与盐溶液反应:
Na:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
Al:置换出较不活泼的金属单质
Fe:置换出较不活泼的金属单质
4、与氧化物反应:
Na:不反应
Al:铝热反应:2Al+Fe2O3==Al2O3+2Fe(点燃)
Fe:不反应
【素材积累】
1、一个房产经纪人死后和上帝的对话一个房产经纪人死后,和上帝喝茶。
上帝认为他太能说了,会打扰天堂的幽静,于是旧把他打入了地狱。
刚过了一个星期,阎王旧满头大汗上门来说:上帝呀,赶紧把他弄走吧!上帝问:怎么回事?阎王说:地狱的小。
2、机会往往伪装成困难美国名校芝加哥大学的一位教授到访北大时曾提到:芝加哥大学对学生的基本要求是做困难的事。
因为一个人要想有所成旧,旧必须做那些困难的事。
只有做困难的事,才能推动社会发展进步。
