生物化学 酶与生物催化剂
酶和无机催化剂的作用机理

酶和无机催化剂的作用机理全文共四篇示例,供读者参考第一篇示例:酶和无机催化剂是生物体和化学反应中常用的两种催化剂。
它们在促进化学反应过程中发挥着重要作用,但其作用机理有所不同。
本文将探讨酶和无机催化剂的作用机理以及它们在生物和化学领域的应用。
让我们来了解一下酶的作用机理。
酶是一种生物催化剂,它能够加速细胞内的生物化学反应。
酶具有高度特异性,只能催化特定的反应,而不影响其他反应。
酶与底物之间的相互作用是通过酶与底物之间的键和亲和力来实现的。
酶的底物结合部位与底物的活化能匹配,使得底物分子在酶的作用下发生催化反应。
酶催化的过程中,酶本身并不参与反应物质的转化,因此在反应结束后,酶分子仍然保持不变,可以继续催化下一个反应。
酶的活性受到环境条件的影响,例如温度、pH值等因素都会影响酶的催化效率。
与酶相比,无机催化剂的作用机理则是通过提供额外的活化能来促进反应的进行。
无机催化剂通常是在反应过程中被转化为中间产物,但在反应结束后可以通过重新生成或者再生来参与下一个反应。
无机催化剂的作用方式与酶有所不同,无机催化剂通常通过提供额外的活化能来降低反应的能垒,从而加速反应的进行。
无机催化剂通常具有较高的反应特异性,因此可以选择性地催化特定的反应,降低副反应的产生率。
在生物体内,酶是生物催化剂,对于维持生命活动至关重要。
生物体内的代谢反应几乎都是在酶的催化下进行的,如葡萄糖酶催化葡萄糖转化为葡萄糖醛酸等。
在化学反应中,无机催化剂通常被广泛应用于有机合成、能源领域等。
无机催化剂能够在工业生产中提高反应速度、增加产物收率、减少废弃物的产生等。
第二篇示例:酶和无机催化剂是生物和化学领域中常见的催化剂,它们在生物体内和化学实验室中发挥着重要的作用。
在生物体内,酶是生物体内的蛋白质,它主要作为催化剂来加速化学反应的进行,而无机催化剂则是一种非生物催化剂,它们常被用于进行有机合成或者其他化学反应。
本文将重点介绍酶和无机催化剂的作用机理及其在生物和化学领域中的应用。
生物化学-酶

(6)
合成酶 (Ligase or Synthetase) Synthetase)
合成酶,又称为连接酶,能够催化C 合成酶,又称为连接酶,能够催化C-C、C-O、 以及C 键的形成反应。这类反应必须与ATP ATP分 C-N 以及C-S 键的形成反应。这类反应必须与ATP分 解反应相互偶联,即催化有ATP参加的合成反应; ATP参加的合成反应 解反应相互偶联,即催化有ATP参加的合成反应; H===Aㆍ A + B + ATP + H-O-H ===AㆍB + ADP +Pi CTP合成酶 合成酶; 如CTP合成酶;
谷丙转氨酶就是一个很好的例子
CH3CHCOOH HOOCCH2CH2CCOOH NH2 CH3CCOOH O O HOOCCH2CH2CHCOOH NH2
水解酶(Hydrolase) (3)水解酶(Hydrolase)
水解酶催化底物的加水分解反应。 水解酶催化底物的加水分解反应。 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 例如,脂肪酶(Lipase)催化的脂的水解反应 例如,脂肪酶(Lipase)催化的脂的水解反应 (Lipase)
二、酶催化作用特性
1.高效性
酶催化反应的反应速率比非催化反应高10 酶催化反应的反应速率比非催化反应高108 比非生物催化剂高10 1020倍,比非生物催化剂高107 - 1013倍。
2、酶的高度专一性
酶对催化的反应和反应物有严格的限制。 酶对催化的反应和反应物有严格的限制。一种酶 往往只作用于一种或一类化合物, 往往只作用于一种或一类化合物,以促进一定的化学 变化,生成一定的产物。 变化,生成一定的产物。酶作用的专一性是酶最重要 的特点之一,也是和一般催化剂最主要的区别。 的特点之一,也是和一般催化剂最主要的区别。
生物化学与分子生物学—酶
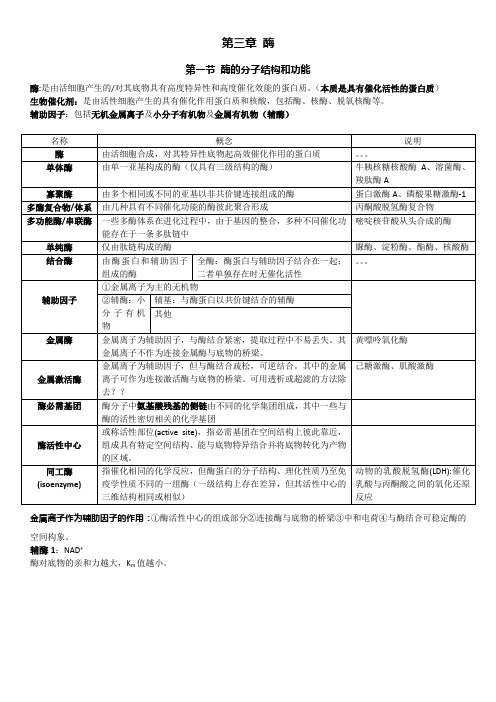
第三章酶第一节酶的分子结构和功能酶:是由活细胞产生的/对其底物具有高度特异性和高度催化效能的蛋白质。
(本质是具有催化活性的蛋白质)生物催化剂:是由活性细胞产生的具有催化作用蛋白质和核酸,包括酶、核酶、脱氧核酶等。
辅助因子:包括无机金属离子及小分子有机物及金属有机物(辅酶)金属离子作为辅助因子的作用:①酶活性中心的组成部分②连接酶与底物的桥梁③中和电荷④与酶结合可稳定酶的空间构象。
辅酶1:NAD+酶对底物的亲和力越大,K m值越小。
酶的活性中心是酶分子执行其催化功能的部位辅助因子常参与酶活性中心的组成。
酶的活性中心具有三维结构,往往形成裂缝或凹陷。
这些裂缝或凹陷由酶的特定空间构象所维持,深入到酶分子内部,且由氨基酸残基的疏水基团组成,形成疏水“口袋”。
单纯酶与结合酶的活性中心酶单纯酶(分子结构仅由氨基酸组成)结合酶(conjugated enzyme )酶蛋白(决定酶促反应的特异性及其催化机制)辅助因子(决定酶促反应的性质和类型)金属离子为主的无机物辅酶coenzyme (小分子有机物)辅基(与酶蛋白以共价键结合的辅酶,不能用透析或超滤的方法去除。
)其他必需基团活性中心内的结合基团(识别与结合底物和辅酶,形成酶-底物过渡态复合物)催化基团(影响底物中的某些化学键的稳定性,催化底物发生化学反应)活性中心外的不参与催化作用。
维持酶活性中心的空间构象和(或)作为调节剂的结合部分所需。
第二节酶的工作原理(一)酶促反应的特点1.极高的效率:降低反应的活化能,但不改变反应的平衡点2.高度的特异性①绝度的专一性:仅作用于特定结构的底物,进行一种专一的反应,生成一种特定的产物。
如脲酶和琥珀酸脱氢酶。
②相对的专一性:作用于一类化合物或一种化学键。
如脂肪酶、磷酸酶、蛋白酶等。
3.酶促反应的可调节性①酶量调节②酶的活性调节③改变底物浓度进行调节(二)酶促反应机制的诱导契合假说酶与底物接近时二者相互诱导、相互形变、相互适应。
生物大分子的结构与功能—酶(生物化学课件)

三、调节酶
调节酶
变构酶
➢ 某些物质结合酶活 性中心外的部位
➢ 酶的构象发生改变
➢ 酶的活性发生改变
共价修饰酶
➢ 需要其他酶的催化
➢ 某些化学基团可逆 结合酶
➢ 酶的活性发生改变
(一)变构酶
变构调节:一些代谢物可与某些酶分子活性中心 外的某部分可逆地结合,使酶构象改变,改变酶 的催化活性的调节方式
指酶分子中氨基酸残基侧链的化学基团 中,一些与酶活性密切相关的化学基团。 如Ser的羟基,His的咪唑基,Cys的巯 基,Asp、Glu的侧链羧基等
活性中心与必需基团有什么关系呢?
活性中心外 的必需基团
结合基团
底物 催化基团
活性中心
必需基团
活性中心内 的必需基团
结合基团(与底物相结合) 催化基团(催化底物变成产物)
➢米氏常数(Km)
Km:当酶反应速度达到最大反
应速度的一半时的底物浓度,单
位mol/L。即:
v Vmax 2
, Km
S
Km
酶反应速度与底物浓度的关系曲线
意义: (1)Km是酶的特征性常数之一;
Km 只与酶的性质有关, 与酶的浓度无关 (2)Km可近似表示酶对底物的亲和力(反比) (3)同一酶对于不同底物有不同的Km值。
已 糖 激 酶 的 活 性 中 心
酶活性中心的特点
在酶分子整个体积中只占很小的一部分 是一个三维实体,是酶分子表面的一个裂隙 或裂缝 底物通过较弱的键结合到酶分子上形成酶和 底物的复合物(ES)(有利于产物形成)。 活性中心有结合底物的专一性,酶活性中心具 有柔性或可运动性
(二)酶的分子结构
2、必需基团(essential group)
酶-生物化学
维生素D
维生素D具有抗佝偻病作用,又称抗佝偻病维生 素。已确知有4种,即维生素D2、D3、D4、D5, 均为类固醇衍生物,其中D2和D3较为重要。 功能:调节钙、磷代谢,维持血液正常的钙、磷 浓度,从而促进钙化,使牙齿、骨骼发育正常。 缺乏症:维生素D摄食不足,不能维持钙的平 衡,儿童骨骼发育不良,产生佝偻病。孕妇 和授乳妇人的脱钙作用严重时导致骨质疏松 症,患者骨骼易折,牙齿易脱落。
化学本质
不饱和一元醇 类固醇衍生物 生育酚 奈醌衍生物
功能
缺乏得干眼病、夜盲症 与Ca、P代谢有关,佝偻病 与生育有关,抗氧化 促进血液凝固
水溶性维生素
维生素B1 —硫胺(素)(抗神经炎V、抗脚气病V) 缺乏症:1. 脚气病 2. 中枢神经和肠胃患糖代谢失常 Cl NH
2
N—C—CH3 CH2 HC H3C S 焦磷酸硫胺素( 硫胺素(B1 ( 焦磷酸硫胺素) TTP) 硫胺素( ) 功能: 以辅酶方式参加糖的分解代谢。TPP是脱羧酶、脱 氢酶的辅酶。 分布:在米糠、麦麸、黄豆、酵母、瘦肉等食物中含量最 丰富。 C—CH2CH2OH P P
脱辅酶决定反应的特异性, 脱辅酶决定反应的特异性,辅因子决定反应的种类与性质
自学) 维生素 (提一下,自学 自学
参见P184 参见
维生素是维持机体生命活动不可缺少的一类小 分子化合物,它既不是生物体构成成分,也不是能 量物质,之所以对生命活动如此重要,是因为维生 素是辅酶或辅基的组成成分,参与体内代谢过程。 维生素的特点: 1、种类多 2、需要量少 3、常常需要从食物中获得 4、大部分充当辅酶
维生素K
维生素K是一类能促进血液凝固的萘醌衍 生物。1929年发现。有K1、K2、K3三种,K1、 K2为天然产物,K3为人工合成品。 功能:是促进血液凝固,因维生素K是促进 肝脏合成凝血酶原的重要因素。 缺乏症:动物缺乏维生素K,血凝时间延长。 成人一般不易缺乏维生素K。
杨荣武生物化学原理笔记—酶

酶酶(enzyme)是生物催化剂(biocatalyst)。
酶的化学本质:主要是蛋白质,也有少数是RNA(核酶)。
由细胞内合成的;酶的催化性质:底物(S)、产物(P)和酶(E)——酶促反应酶与非酶催化剂的共同性质1.只能催化热力学允许的反应2.反应完成后本身不被消耗或变化,即可以重复使用3.对正反应和逆反应的催化作用相同4.不改变平衡常数,只加快到达平衡的速度或缩短到达平衡的时间。
酶促反应与非酶促反应的不同性质1.酶促反应的速率高很多2.酶促反应呈现出饱和动力学3.酶促反应有最适温度和pH值。
酶的命名如果酶的底物有两种,那么两种底物均需表明,中间用“:”分开。
例如草酸氧化酶(习惯名称)的系统名称为草酸:氧氧化酶。
如果酶的其中一个底物是水,可将水省略不写。
例如乙酰辅酶A水解酶(习惯名称)的系统名称为乙酰辅酶A:水解酶。
酶的分类:酶分为七大类:依次为氧化还原酶类(oxido-reductases)、转移酶类(transferases)、水解酶类(hydrolases)、裂合酶类(lyases)、异构酶类(isomerases)、连接酶类(ligases)或合成酶类(synthetases)和转位酶(translocases)。
根据化学组成:单纯酶(simple enzyme),缀合酶/结合酶(conjugated enzyme)单纯酶(如核糖核酸酶和胃蛋白酶)是指酶中只含有蛋白质,不含其他成分。
结合酶(如转氨酶、细胞色素氧化酶和乳酸脱氢酶)是指酶中除了蛋白质外,还含有一些非蛋白质成分。
结合酶中的蛋白质称为脱辅酶(apoenzyme),非蛋白质成分称为辅助因子(cofactor)。
酶蛋白和辅助因子本身无催化活性,只有完整结合形成全酶(holoenzyme)后,才具有活性。
在催化反应中,酶蛋白和辅助因子所起的作用是不同的,酶催化反应的专一性取决于酶蛋白,而辅助因子对电子、原子或某些化学基团起传递作用。
辅助因子包括金属离子和有机小分子化合物。
生物化学之酶篇
一、酶1、活化能:在一定温度下1mol底物全部进入活化态所需要的自由能,单位为kJ/mol.2、酶作为生物催化剂的特点:(1)酶易失活(酶所催化反应都是在比较温和的常温、常压和接近中性酸碱条件下进行)。
(2)酶具有很高的催化效率。
用酶的转换数(TN,等于催化常数k cat)来表示酶的催化效率,是指在一定条件下每秒钟每个酶分子转换底物分子数,或每秒钟每微摩尔酶分子转换底物的微摩尔数。
转换数变化范围为1到104。
(3)酶具有高度专一性所谓高度专一性是指酶对催化反应和反应物有严格的选择性。
酶往往只能催化一种或一类反应,作用于一种或一类物质。
(4)酶活性受到调节和控制a、调节酶的浓度一种是诱导或抑制酶的合成;一种是调节酶的降解。
b、通过激素调节酶活性激素通过与细胞膜或细胞受体相结合一起一系列生物学效应,以此来调节酶活性。
c、反馈抑制调节酶活性许多小分子物质的合成是由一连串的反应组成的,催化物质生产的第一步的酶,往往被它的终产物抑制——反馈抑制。
d、抑制剂和激活剂对酶活性的调节e、其他调节方式通过别构调控、酶原激活、酶的可逆共价修饰和同工酶来调节酶活性。
3、酶的化学本质:除有催化活性的RNA之外几乎都是蛋白质。
注:酶的催化活性依赖于它们天然蛋白质构象的完整性,假若一种酶被变性或解离成亚基就失活。
因此,蛋白质酶的空间结构对它们的催化活性是必需的。
4、酶的化学组成a、按化学组成分为单纯蛋白质和、缀合蛋白质两类。
单纯蛋白质酶类,除了蛋白质外,不含其他物质,如脲酶、蛋白酶、脂肪酶和核糖核酸酶等。
缀合蛋白质酶类,除了蛋白质外,还要结合一些对热稳定的非蛋白质小分子物质或金属离子。
前者称为脱辅酶,后者称为辅因子。
即全酶=脱辅酶+辅因子。
b、根据辅因子与脱辅酶结合的松紧程度可分为辅酶和辅基。
辅酶:指与脱辅酶结合比较松弛的小分子有机物,通过透析方法可以除去,如辅酶Ⅰ和辅酶Ⅱ等。
辅基:指以共价键和脱辅酶结合,不能通过透析除去,需要经过一定的化学处理才能与蛋白质分开,如细胞色素氧化酶中的铁卟啉等。
生物化学中的酶催化动力学
生物化学中的酶催化动力学是一门研究酶在生物反应中起作用的学科。
酶是生化过程中不可或缺的催化剂,它们通过加速化学反应的速率来运作。
酶的催化过程通过多种途径实现,而其速率则可以受到许多因素的影响。
一、酶的基本知识酶是一种生物催化剂,是由蛋白质组成的。
这些蛋白质中包含一种称为活性部位的立体化学结构。
在这个部位上,酶与待反应分子发生物理和化学相互作用,导致化学反应的加速。
酶具有专一性,它们只能催化与它们的结构相关的分子。
此外,酶呈现出一个最适工作条件的反应环境,因此酶的最适工作条件比较独特,如温度和pH值等。
二、酶催化动力学的基础酶催化动力学是研究酶如何催化生物过程的过程。
根据酶的催化过程,酶可以分为两种类型:单亲态酶和辅因子酶。
单亲态酶是指作用于基质并在反应后还原的酶。
例如,青霉素酰化酶 (penicillinase),就符合单亲态酶的定义标准。
青霉素酰化酶催化青霉素水解并将其转化为谷氨酰酰胺和苯乙醇酸。
另一种类型的酶是辅酶酶。
这种酶需要与一些非蛋白质小分子如辅因子一起担任催化剂的角色。
辅因子是一种可活化酶作用的低分子化合物。
例如,NADH (辅硫胺酸还原形成的辅酶2)是一个常用的辅基酶,它能够在生物中实现电子传递过程。
三、酶速率方程酶催化动力学中最基础的是Michaelis-Menten (MM) 酶速率方程。
这个方程可以描述酶的催化速率与底物浓度之间的关系。
这个方程的形式为:v = Vmax [S] / (Km + [S])其中,v表示反应的速率,Vmax表示在酶与底物饱和时的反应速率,Km表示酶与底物的半饱和常数。
这个方程被广泛用于许多生物反应的研究。
四、酶催化反应动力学和机制酶催化的动力学行为是基于复杂的化学反应机制,因此酶动力学通常涉及到与反应物和产物之间的中间体的形成和分解过程。
酶催化反应动力学还考虑到酶催化与底物接触和脱离过程的时间。
酶催化的机制主要包括两个方面:酶活性的转变和反应机制的变化。
酶-生物化学与分子生物学
例 :2H2O2→2H2O+O2
反 应
非催化反应 铂催化反应 H2O2酶催化
活化能
335kJ/mol 49.4kJ/mol 8.36kJ/mol
(二)高度的专一性
* 酶的专一性
要求底物具有特定的结构。酶的这种 特性称为酶的专一性或特异性。
针对底物分子内部的化学键、催化 反应的类型、底物分子的立体结构。
(四)可调节性 酶促反应受多种因素的调控,以适应机体对 不断变化的内外环境和生命活动的需要。
其中包括三方面的调节。 酶生成与降解量的调节
酶活性的调节
通过改变底物浓度对酶进行调节等
第二节
酶的结构与功能
The Structure and Function of Enzyme
一、 酶的分子组成
活性。
第一节
酶的催化特点
The Characteristic of Enzyme-Catalyzed Reaction
酶与一般催化剂的共同点
只能催化热力学上允许的化学反应Fra bibliotek 反应前后本身不发生变化; 能加快可逆反应的速度,但不改变反应的平衡点;
加快反应速度的机制都是降低反应所需的活化能。
单纯酶:只含蛋白质的酶
蛋白质部分—酶蛋白
结合酶
(全酶)
金属离子
非蛋白质部分—辅助因子
小分子有机化合物
*各部分在催化反应中的作用
酶蛋白决定反应的特异性 辅助因子决定反应的种类与性质
金属离子的作用
催化过程中传递电子; 作为连接酶与底物的桥梁,便于酶对底物起作用; 稳定酶的构象; 中和阴离子,降低反应中的静电斥力等。
例 :2H2O2→2H2O+O2 1mol H2O2酶能催化 5×106 mol H2O2的分解 1mol Fe3+只能催化 6×10-4 mol H2O2的分解
生物催化剂—酶
二、酶与化学催化剂的共同特征
1. 只能催化热力学上允许进行的反应,降低反应的 活化能(activation energy),加快反应速度。
2. 对于可逆反应,缩短反应达到平衡的时间,但不 改变平衡常数。
3. 用量很少,效率高,且反应前后质和量不变。
二、辅助因子(cofactor)
金属离子:NCau+2、+、KZ+、n2+M和gF2+e、2+
3.国际分类法 国际生物化学与分子生物学会酶学委员会根据
酶催化的反应类型不同,将酶分为六大类:
1)氧化还原酶类(oxidoreductases) 2)转移酶类(transferase) 3)水解酶类(hydrolases) 4)裂解酶类(lyases) 5)异构酶类(isomerases ) 6)合成酶类(或连接酶类 ligases)
生物催化剂: 蛋白质 核酸类(核酶)
酶是蛋白质的主要依据:
①经酸碱水解后的终产物是氨基酸,能被蛋白酶 水解而失活;
②性电解质,在不同pH下呈现不同的离子状 态,在电场中向某一电极泳动,具有特定的pI;
④与蛋白质一样,具有不能通过半透膜的胶体性 质;
三、酶催化作用的特征
(一) 高效性 (二)高度专一性 (三)酶的活性受到严格调控 (四)酶的不稳定性 (五)在温和条件下发挥作用
(一)高效性
酶的催化效率极高。酶的催化效率通常比非催化 反应高108~1020倍。
比一般催化剂高 107~1013倍。
例一:
2H2O2
2H2O + O2
过氧化氢酶
铁离子
过氧化氢酶比铁离子的催化效率高1011倍。
