初中化学酸碱盐知识归纳
初中化学酸碱盐知识点总结.doc

初中化学酸碱盐知识点总结初中化学酸碱盐知识点总结一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
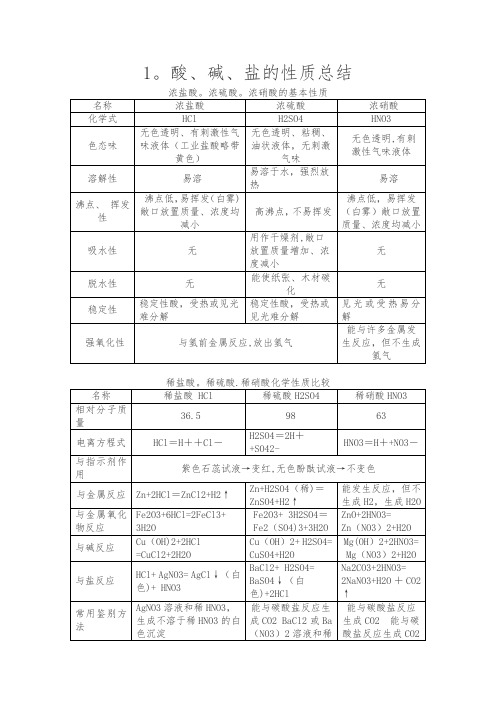
1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸HCl浓硫酸H2SO4颜色、状态“纯净”:无色液体工业用盐酸:黄色(含Fe3+)无色粘稠、油状液体气味有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾)吸水性脱水性腐蚀性用途①金属除锈②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油2.酸的通性:盐酸HCl 硫酸H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3 BaCl2+H2SO4=BaSO4↓ +2HCl 注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
初中化学酸碱盐知识点总结

初中化学酸碱盐知识点总结酸碱盐是化学中的一大重要概念,它在日常生活中扮演着重要的角色。
以下是初中化学中酸碱盐的相关知识点的总结。
1.酸的性质和特征-酸有酸味,可腐蚀金属。
-酸在水溶液中导电。
-酸会变红蓝石蕊试纸红。
-酸和碱反应可以产生盐和水。
2.碱的性质和特征-碱有苦味,滑腻。
-碱在水溶液中导电。
-碱会变红纸蓝。
-碱和酸反应可以产生盐和水。
3.盐的性质和特征-盐是由阳离子和阴离子组成的晶体。
-盐在水中溶解时会导电。
-盐的溶液味道咸。
-盐可以通过酸碱中和反应制备。
4.酸的酸度和碱的碱度-酸的酸度可以用pH值来表示,pH值越小,酸度越大。
-碱的碱度可以用pH值来表示,pH值越大,碱度越大。
5.酸碱中和反应-酸和碱反应,生成盐和水的反应称为酸碱中和反应。
-酸碱中和反应中,酸和碱的摩尔比是1:1-酸碱中和反应是放热反应。
6.酸碱指示剂-酸碱指示剂可以用来检测溶液是酸性、中性还是碱性。
-酸碱指示剂可根据其颜色的变化来判断溶液的酸碱性。
-常用的酸碱指示剂有酚酞、甲基橙、溴蓝等。
7.盐的命名规则-盐的命名通常以阴离子的名称来作为盐的名称。
-如果阴离子是单质元素,就用元素名来命名。
-如果阴离子是由多个原子组成的复杂离子,则用化学式来命名。
8.酸和碱的常见名称和化学式-酸常见的名称有盐酸、硫酸、硝酸等。
-碱常见的名称有氢氧化钠、氢氧化铜等。
-酸和碱的化学式的记法规则如下:-酸的化学式通常以H开头,如HCl、H2SO4-碱的化学式以氢氧化物的形式出现,如NaOH、Ca(OH)29.中和反应的计算-在酸碱中和反应中,可以根据所用的物质的量关系来计算,使用化学方程式的配平。
-配平方程式可以通过将反应式两边的化学式前添加系数来实现。
初中化学酸碱盐复习PPT

碱的个性
俗名:烧碱、火碱和苛性钠
易潮解,
可作某些气体的干燥剂。(H2,O2 )
氢氧化钠:
氢氧化钙:
易溶。
俗名:熟石灰、消石灰、(加水)石灰浆、石灰乳 微溶。
强碱具腐蚀性 溶解时放热
碱的共性:
练习
A、NaOH与HCl B、NaOH与CuSO4 C、HCl与AgNO3 D、FeCl3与NaOH
02
Fe Fe2O3 Fe3O4 Fe2+溶液 Fe3+溶液 Fe(OH)3
04
规律可寻
有关沉淀的记忆 在初三阶段,接触最多的沉淀可以总结为“六白”“一蓝”“一红褐” “六白”CaCO3 Ag2 CO3 BaCO3 BaSO4 AgCl Mg(OH)2 可溶于稀硝酸,且产生气体 不溶于稀硝酸 可溶于稀硝酸,不产生气体 “一蓝” Cu(OH)2 “一红褐” Fe(OH)3 钾、钠、硝酸溶;铵盐也相同; 钾、钠、钙、钡、氨;溶碱有五种; 硫酸除铅、钡;氯除银、亚汞; 碳酸和磷酸;钾、钠、铵才溶。
6
NaOH+BaCl2= Ba(OH)2+NaCl
7
2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2
8
下列物质能发生化学反应吗?为什么?
判断下列物质能否反应,能反应的写出化学方程式: HCl 和 Fe ② H2SO4和Cu AgNO3和Cu ④AgCl和 Fe ZnSO4和 Fe ⑥ NaOH和KCl H2SO4和NaOH ⑧ Fe(OH)3和HCl Cu(OH)2和 NaCl
复合肥
微量元素肥
NH 4HCO3 ( NH 4)2SO 4 NH 3NO 3 NH 3 H 2O CO(NH2)2
初中化学知识点酸碱盐总结

初中化学知识点酸碱盐总结初中化学是学生接触化学学科的初级阶段,其中酸碱盐是化学基础知识中的重要部分。
本文将对初中化学中的酸碱盐知识点进行总结,以帮助学生更好地理解和掌握这些基本概念。
# 酸的概念及性质酸是指在电离时会产生氢离子(H+)的化合物。
酸的主要性质包括:1. 味道酸涩:酸味是酸的一个显著特征,如柠檬汁、醋等都含有酸性物质。
2. 能使指示剂变色:不同的指示剂在酸性环境下会呈现不同的颜色。
例如,酸会使蓝色的石蕊试纸变红。
3. 与碱反应产生盐和水:酸和碱的中和反应是化学中常见的反应类型,产物通常是盐和水。
4. 能与某些金属反应:酸可以与活泼金属反应生成氢气和相应的金属盐。
5. 具有腐蚀性:强酸如硫酸、盐酸等具有较强的腐蚀性,需谨慎处理。
# 碱的概念及性质碱是指在电离时会产生氢氧根离子(OH-)的化合物。
碱的性质包括:1. 味道苦涩:碱味通常给人的感受是苦涩的。
2. 能使指示剂变色:与酸类似,碱也能使某些指示剂发生颜色变化。
例如,碱会使红色的石蕊试纸变蓝。
3. 与酸反应产生盐和水:碱与酸的中和反应产生盐和水,这是中和反应的另一种表述。
4. 能与某些非金属反应:碱可以与某些非金属元素如二氧化碳反应生成相应的盐。
5. 具有腐蚀性:强碱如氢氧化钠、氢氧化钾等也具有腐蚀性。
# 盐的概念及性质盐是由阳离子(通常是金属离子)和阴离子(通常是酸根离子)组成的化合物。
盐的性质包括:1. 溶解性:盐在水中的溶解性不一,有的盐易溶于水,如食盐(氯化钠),有的则难溶,如碳酸钙。
2. 电导性:盐在水中溶解后,其溶液能导电,因为盐解离出的离子可以自由移动并传递电荷。
3. 与酸或碱反应:某些盐可以与酸或碱反应,产生新的盐和酸或碱。
4. 热稳定性:不同的盐具有不同的热稳定性,有的盐在加热时会分解,如碳酸氢钠加热会分解为碳酸钠、水和二氧化碳。
# 酸碱盐的分类1. 酸的分类:- 无机酸:如硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)等。
初中化学中酸碱盐知识解读

初中酸碱盐知识一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+ 酸→ 盐+ 氢气(3)碱性氧化物+ 酸→ 盐+ 水(4)碱+ 酸→ 盐+ 水(5)盐+ 酸→ 另一种盐+ 另一种酸(产物符合复分解条件)三、碱2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→ 盐+水(3)酸+碱→ 盐+水(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 ΔCuO +H2O2Fe(OH)3 ΔFe2O3+3H2O②常见沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
四、酸性氧化物与碱性氧化物五、中和反应 溶液酸碱度的表示法--pH 1、定义:酸与碱作用生成盐和水的反应 2、应用:(1)改变土壤的酸碱性 (2)处理工厂的废水 (3)用于医药3、溶液酸碱度的表示法--pH (1)(2)pH 的测定:最简单的方法是使用pH 试纸 用玻璃棒(或滴管)蘸取待测试液少许,滴在pH 试纸上,显色后与标准比色卡对照,读出溶液的pH (读数为整数) (3)酸雨:正常雨水的pH 约为5.6(因为溶有CO2) pH<5.6的雨水为酸雨六、酸碱盐性质之酸的通性 酸的组成——氢离子+酸根离子 (1)跟指示剂反应紫色石蕊试液遇酸变红色 无色酚酞试液遇酸不变色 (2)酸的PH<7(3)跟(H )前的活泼金属起置换反应 酸 + 金属==盐 + 氢气 例:2HCl +Fe=FeCl2+H2↑(4) 跟碱性氧化物和某些金属氧化物反应 酸 + 碱性(金属)氧化物—→盐+水 例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O (5)跟某些盐反应 酸+碳酸盐==盐+水 酸+盐—→新酸+新盐例:H2SO4+BaCl2=2HCl +BaSO4↓ (6)跟碱起中和反应 酸+碱—→盐+水例:2HCl +Cu(OH)2=CuCl2+2H2O七、初中化学酸碱盐的复习及重点题型解析在各省市中考试卷的命题中,无不将酸碱盐的化学性质的考察作为重中之重。
(完整版)初中化学酸碱盐总结

1、酸(1)使酸碱指示剂变色(非氧化性酸),紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色,无色酚SU式液遇酸溶液不变色(2)酸呈酸性(PH值〈7)(3)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应(非氧化性酸)酸+金属一-盐+氢气【置换反应】例:2HCl+Fe=FeC12+H2 t(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物一-盐+水例:3H2S04+Fe203=Fe2(S04)3+3H20(5)跟碱起中和反应酸+碱盐+水例:2HC1+Cu (OH) 2=CuC12+2H20(6)与某些盐反应生成酸和新盐。
盐+酸二新盐+新酸,要依照复分解的条件来判断是否会发生反应例:BaC12+H2S04=BaS04 I +2HC1{常见的酸:盐酸:物理性质:有刺鼻性气味和酸味的液体,易挥发,遇水蒸气形成口雾。
化学性质:有酸的通性用途:除锈,制药,胃液里的盐酸帮助消化。
硫酸:物理性质:纯硫酸是无色粘稠油状液体,不挥发。
硫酸特性:吸水性.脱水性.强氧化性。
稀硫酸有酸的通性。
2、碱非可溶性碱的性质:1、能与酸反应可溶性碱的通性:2、碱呈碱性碱能使紫色石蕊试液变蓝碱能使无色的酚駄试剂变红。
pH>73、与酸性氧化物反应注:碱+酸性氧化物=盐+水【不是复分解反应】例:φCa (OH) 2+C02=CaC03 I ÷H20②2NaOH+CO2=Xa2CO3+H2O注:酸性氧化物不等于非金属氧化物4碱+酸=盐+水5碱+盐=碱+盐【反应物均可溶】{常见的碱:NaOH俗称:烧碱。
火碱。
苛性钠。
物理性质:白色固体,易溶于水,溶解时放热明显,易潮解。
化学性质;有碱的通性。
用途:除油污。
用于肥皂造纸纺织印染。
Ca(OH)2俗称:消石灰。
熟石灰。
物理性质:白色粉末,微溶于水。
化学性质:有碱的通性。
用途:水溶液用于检验二氧化碳,制烧碱。
改良酸性土壤。
砌砖抹墙。
3、盐1.能和酸反应生成新酸和新盐2.能和酸性氧化物生成盐和水3.能和盐反应生成新碱和新盐酸与碱中和的产物(中和反应),由金属离子(包括钱根离子)与酸根离子构成。
初中酸碱盐化学方程式(全)

初中酸碱盐化学方程式(全)酸的通性酸的定义是,电离时生成的阳离子全部都是H+。
我们以常见的硫酸和盐酸为例来说明酸的通性。
酸使紫色石蕊试液变红,使无色酚酞试液不变色。
盐酸和硫酸都能使紫色石蕊试液变红,但无色酚酞试液不变色。
金属与酸反应会生成盐和氢气。
但要注意,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
金属活动顺序表可以通过金属跟酸的反应情况导出,金属活动性由强逐渐减弱。
碱的通性与酸雷同,我们可以将碱定义为:电离时生成的阴离子全部是OH-离子。
我们以常见的氢氧化钠和氢氧化钙为例来说明碱的通性。
碱使紫色石蕊试液变蓝,使无色酚酞试液变红。
氢氧化钠和氢氧化钙都能使紫色石蕊试液变蓝,无色酚酞试液变红。
酸性氧化物和碱反应会生成盐和水。
2NaOH和CO2反应生成Na2CO3和H2O,Ca(OH)2和CO2反应生成CaCO3和H2O。
酸和碱反应生成盐和水,例如NaOH和HCl反应生成NaCl和H2O,Ca(OH)2和H2SO4反应生成CaSO4和2H2O。
盐和碱反应时,必须两者都是可溶的,且生成物之一是沉淀,反应才能进行。
只有可溶性碱才能跟一些非金属氧化物发生反应,这些非金属氧化物是酸性氧化物。
酸性氧化物多数能溶于水,跟水化合生成酸。
如果对于碱跟某些金属氧化物反应的化学方程式感到困难,可以先写出非金属氧化物跟水反应生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分写出生成物,最后合并成一个化学方程式。
盐的概念可以认为是酸碱电离后离子交换生成了盐和水。
例如,我们可以把NaCl看作是HCl和NaOH电离后的产物。
常见的盐及其化学性质包括:盐溶液和金属反应生成盐和金属,盐和酸反应生成盐和酸,盐溶液和碱溶液反应生成盐和碱,盐溶液和盐溶液反应生成盐和盐。
单质、氧化物、酸、碱和盐之间的相互关系,例如金属单质和酸反应生成盐和氢气,金属单质和盐溶液反应生成另一种金属和另一种盐。
具体反应包括锌和稀硫酸反应生成ZnSO4和H2,铁和稀硫酸反应生成FeSO4和H2,镁和稀硫酸反应生成MgSO4和H2,铝和稀硫酸反应生成Al2(SO4)3和H2,锌和稀盐酸反应生成ZnCl2和H2,铁和稀盐酸反应生成FeCl2和H2,镁和稀盐酸反应生成MgCl2和H2,铝和稀盐酸反应生成AlCl3和H2.34.当铁和硫酸铜溶液反应时,产生的产物为亚硫酸铁和铜。
初中化学酸碱盐性质总结
③硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。
打开浓硝酸的瓶盖在瓶口会产生白色酸雾.浓硝酸通常带黄色,而且硝酸越浓,颜色越深.这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。
所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。
硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞.除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。
硝酸能溶解除金和铂以外的所有金属。
金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。
但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。
较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。
硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
硝酸与Cu、C发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8 HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓) CO2↑+4NO2↑+2H2O④磷酸是一种中等强度的三元酸,可以形成一种正盐和两种酸式盐.如:磷酸氢二钠(Na2HPO4),磷酸二氢钠(NaH2 PO4),磷酸二氢铵[NH4H2PO4 ],磷酸氢二铵[(NH4)2HPO4 ],磷酸二氢钙[Ca(H2PO4)2](溶于水).2.常见物质的溶解性常见酸中除硅酸(H2SiO3)外均可溶;常见碱中除NaOH、KOH、Ca(OH)2 、NH3•H2O可溶,微溶外其余均为难溶碱。
其中Cu(OH)2 为蓝色沉淀,Fe(OH)3 为红褐色沉淀,其余均为白色沉淀;常见的盐的溶解性规律是:钾、钠、铵、硝溶;盐酸银不溶;硫酸钡不溶硫酸钙、硫酸银微溶;碳酸钾、钠、铵能溶;碳酸镁微溶.3.金属活动顺序表的应用金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au----——————————--———————-———-——-→金属活动性由强到弱金属活动顺序表的应用主要是在置换反应中的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学酸碱盐知识归纳 一、概念: 1、 酸的组成——氢离子+酸根离子 2、 碱的组成——金属离子+氢氧根离子 3、 盐的组成——金属离子+酸根离子 4、 复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。AB+CD=AD+CB 5、 稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。 6、 中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。 二、熟记常见元素和原子团的化合价口诀: (正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。 (负价)负一价:氟、氯、溴、碘; 负二价:氧和硫。 (可变正价):一二铜汞,二三铁,二四碳,四六硫。 (原子团的化合价 负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4); 负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4); 负三价:磷酸根(PO4); 正一价:铵根(NH4)。 三、熟记下列反应方程式: (一)酸的性质(1)与指示剂反应 紫色石蕊试液变红色,无色酚酞试液不变色。 (2)酸 + 碱 = 盐 + 水。 (3)酸 + 某些金属氧化物 = 盐 + 水。 (4)酸 + 活泼金属 = 盐 + 氢气。 (5)酸 + 盐 = 新盐 + 新酸。 1、 锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑ 有气泡产生,锌粒逐渐减少。 2、 锌跟稀硫酸反应: Zn + H2SO4 = ZnSO4 + H2 ↑ 3、 铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑ 有气泡产生,铁逐渐减少, 4、 铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2 ↑ 溶液变成浅绿色。 5、 铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失, 6、 铁锈跟稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色 7、 氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失, 8、 氧化铜跟稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 溶液变 成蓝色。 (二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。 (2)碱 + 多数非金属氧化物 = 盐 + 水 (3)碱 + 酸 = 盐 + 水 (4)碱+某些盐 = 另一种盐 + 另一种碱 1、 氢氧化钠跟二氧化碳反应:2NaOH + CO2 = Na2CO3 + H2O 2、 氢氧化钠跟二氧化硫反应:2NaOH + SO2 = Na2SO3 + H2O 3、 氢氧化钠跟三氧化硫反应:2NaOH + SO3 = Na2SO4 + H2O 4、 氢氧化钙跟二氧化碳反应:Ca(OH)2 + CO2 = CaCO3↓ + H2O 使澄清石灰水变浑浊 5、 氢氧化钠跟稀硫酸反应:2NaOH + H2SO4 = Na2SO4 + 2H2O 6、 氢氧化钠跟稀盐酸反应:NaOH + HCl = NaCl + H2O 7、 生石灰跟水反应:CaO + H2O =Ca(OH)2 (三)盐的性质:(1)盐 + 某些金属=另一种盐 + 另一种金属。 (2)盐 + 某些酸 = 另一种盐 + 另一种酸。 (3)盐 + 某些碱 = 另一种盐 + 另一种碱 (4)盐 + 某些盐 = 另一种盐 + 另一种盐 1、 硫酸铜溶液跟铁反应:CuSO4 + Fe = ZnSO4 +Fe 铁表面覆盖红色物质,溶液由蓝色变浅绿色 2、 碳酸钠跟盐酸反应:Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑有气泡产生固体逐渐减少 3、 碳酸氢钠跟盐酸反应:NaHCO3 + HCl = NaCl +H2O + CO2↑有气泡产生固体逐渐减少 4、 石灰石跟稀盐酸反应:CaCO3 + 2HCl = CaCl2 +H2O +CO2↑有气泡产生固体逐渐减少 5、 硝酸银跟稀盐酸反应:AgNO3 + HCl = AgCl↓ +HNO3 有白色沉淀产生 6、 氯化钡跟稀硫酸反应:BaCl2 + H2SO4 = BaSO4↓ + 2HCl 有白色沉淀产生 7、 氢氧化钙根碳酸钠溶液反应:Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 有白色沉淀产生 8、 硝酸银溶液跟氢氧化钠溶液反应:AgNO3 + NaCl = AgCl↓ + NaNO3有白色沉淀产生 9、 氯化钡溶液跟硫酸钠溶液反应:BaCl2 + Na2SO4 = 2NaCl + BaSO4↓有白色沉淀产生 四、金属活动性顺序表: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 五、溶解性表: (1) 大多数酸可溶(HCl、HNO3、H2CO3有挥发性、浓H2SO4有吸水性。) (2) 碱的溶解性:钾、钠、钡、铵溶、钙微溶,其余碱 全不溶。 (3) 盐的溶解性: 钾、钠、铵、硝四盐溶。 氯化物除AgCl不溶外,其余全溶。 硫酸盐除BaSO4不溶,Ag2SO4、CaSO4微溶外,其余全溶。 碳酸盐除钾、钠、铵盐全溶、MgCO3微外,其余全不溶。 六、反应条件: 1、 复分解反应的条件——生成物中有沉淀析出,或有气体放出,或有水生成 2、 金属跟酸反应的条件—— (1) 在金属活动性顺序表中,金属要排在氢前。 (2) 浓硫酸、硝酸跟金属反应不能生成氢气。 (3) 铁发生置换反应时,生成+2价的铁的化合物。 3、 金属跟盐反应的条件—— (1)在金属活动性顺序表中,单质的金属要比盐中金属活泼。 (2)反应物中的盐要可溶。 (3)K、Ca、Na、Ba等金属跟盐反应不能生成另一种盐和另一种金属。 4、 盐跟盐反应的条件——反应物都要可溶,生成物要有沉淀。 5、 盐跟碱反应的条件——反应物都要可溶,生成物要有沉淀或气体。 七、熟记常见物质的俗称和化学式: 生石灰—— CaO 熟石灰——Ca(OH)2 石灰石、大理石—— CaCO3 食盐——NaCl 火碱、烧碱、苛性钠—— NaOH 纯碱、苏打——Na2CO3 小苏打—— NaHCO3 铁锈、赤铁矿——Fe2O3 赤铁矿—— Fe3O4 金刚石、石墨—— C 干冰——CO2 冰—— H2O 天然气(甲烷)——CH4 酒精(乙醇)—— C2H5OH 醋酸(乙酸)——CH3COOH 八、熟记常见物质的颜色: 红色的固体——Cu、Fe2O3 、P(红磷) 黑色的固体——C、CuO、Fe3O4、FeO、MnO2 白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等 暗紫色的固体——KMnO4 黄色的固体—— S 蓝色的固体——CuSO4?5H2O 蓝色絮状沉淀——Cu(OH)2 红褐色絮状沉淀——Fe(OH)3 常见不溶于酸的白色沉淀——BaSO4、AgCl 溶于酸并放出使澄清石灰水变浑浊的气体的白色沉淀——BaCO3、CaCO3等不溶性碳酸盐的沉淀 溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀 蓝色的溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液 浅绿色的溶液——FeSO4、FeCl2等含Fe2+溶液 黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液 九、物质的检验和鉴别: 1、 检验稀盐酸(或Cl-)——取少量待检液体于洁净的试管中,滴入几滴AgNO3溶液和稀HNO3,有白色沉淀产生。 2、 检验稀硫酸(或SO42-)——取少量待检液体于洁净的试管中,滴入几滴BaCl2溶液和稀HNO3,有白色沉淀产生。 3、 检验CO32-——取少量待检液体于洁净的试管中,滴入几滴稀HCl,有使澄清石灰水变浑浊的气体产生。 4、 检验NH4+——取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。 5、 鉴别稀盐酸和稀硫酸——分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。 6、 鉴别Ca(OH)2和NaOH溶液——分别取少量待检液体于两支洁净的试管中,分别通入CO2气体(或各滴入几滴Na2CO3溶液),有白色沉淀产生的原溶液是Ca(OH)2,无现象产生的原溶液是NaOH。 ◎补充下列反应方程式: 1、 氢氧化铜跟稀盐酸反应: Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失 2、 氢氧化铜跟稀硫酸反应: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液 3、 氢氧化钠跟硫酸铜溶液反应:2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓ 有蓝色沉淀产生 4、 氢氧化钠跟氯化铁溶液反应:3NaOH + FeCl3 = Fe(OH)3↓
