2017届高中化学一轮复习课时跟踪检测(一)钠及其化合物鲁教版
高优指导2017版高三化学一轮复习滚动测试卷一(第1_2单元)鲁科版

滚动测试卷一(第一~二单元)(时间:90分钟满分:100分)一、选择题(本题共18小题,每小题3分,共54分,每小题只有一个选项符合题目要求)1.(2015重庆检测)下列说法正确的是( )①煤和石油都是混合物②豆浆和雾都是胶体③水、过氧化氢、水玻璃都是纯净物④不锈钢和目前流通的硬币都是合金⑤SO2、NO2和CO2都属于酸性氧化物A.①②④B.②③④C.①④⑤D.①②③④⑤答案:A解析:①煤是有机物和无机物形成的复杂的混合物,石油是烷烃、环烷烃、芳香烃形成的混合物;②豆浆是胶体,雾是气溶胶,也是胶体;③水玻璃是硅酸钠的水溶液,是混合物,错误;④不锈钢是铁合金,硬币也是合金;⑤NO2不是酸性氧化物,错误。
2.(2015北京西城区期末)下列应用不涉及氧化还原反应的是( )A.铝热法冶炼难熔金属B.工业上电解熔融状态Al2O3制备AlC.Na2O2用作呼吸面具的供氧剂D.实验室用NH4Cl和Ca(OH)2制备NH3答案:D解析:A、B、C项中都有单质生成,存在元素化合价的变化,属于氧化还原反应,D项无元素化合价变化,为非氧化还原反应。
3.下列说法不正确的是( )A.分散系中分散质粒子直径大小,胶体介于溶液与浊液之间B.制备Fe(OH)3胶体时,溶液呈红褐色停止加热C.明矾、漂白粉、臭氧的净水原理相同D.利用丁达尔效应可检验雾霾是否为胶体答案:C解析:明矾净水是利用胶体的吸附作用,是把浑水变为清水,漂白粉、臭氧的净水是利用其强氧化性。
4.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等答案:C解析:由于12C18O和14N2的相对分子质量不等,故体积相等的两种气体的质量不等,因此密度不等,A项错误;1个12C18O分子中有16个中子,1个14N2分子中有14个中子,二者均为双原子分子,原子数相等,即分子数相等,但中子数不等,B项错误;12C18O和14N2均为14电子分子,同温同压下,体积相等则分子数相等,所具有的电子数相等,C项正确;每个12C18O和14N2分子内均有14个质子,由于二者的相对分子质量不等,故等质量的两种分子所具有的质子数不等,D项错误。
2017_2018学年高中化学课时跟踪检测(一)认识有机化学 鲁科版选修5

1.以下有关说法正确的是( )A.有机化学是19世纪的新兴学科,其发展与其他学科无关B.日常生活中广泛使用的有机合成材料塑料、合成橡胶、合成纤维等均是有机化学的贡献C.环境保护与有机化学无关D.凡是含碳元素的化合物都称为有机物解析:选B 有机化学自19世纪初由贝采里乌斯提出形成独立学科,其发展与物理、生物等其他学科联系密切,现在,有机化学已经与其他学科融合形成了分子生物学、材料科学以及环境科学等多个新型学科,A项错误;有机合成材料广泛应用于生活的方方面面,B项正确;很多有机物如甲醛、DDT等的使用对环境造成污染,但环境保护是可以通过有机化学的研究和发展来实现的,C项错误;Na2CO3、CO2等均含有碳元素,但属于无机物,D项错误。
2.有机化合物是一种代替有机氯农药DDT的新型杀虫剂,其含有的官能团共有( ) A.5种B.4种C.3种 D.2种解析:选C 观察题给有机化合物的结构简式,含有(—OH)(羟基)、(—CHO)(醛基)、CC(碳碳双键)3种官能团。
3.按碳骨架分类,下列说法不正确的是( )解析:选D A项中的有机物为烷烃,属于脂肪烃;B项中的有机物中含有碳环,属于脂环烃;C项中的有机物中含有苯环,属于芳香烃;D项中的有机物中含有氧,不属于烃。
4.下面的原子或原子团不属于官能团的是( )A.OH- B.—BrC.—NO2 D.解析:选A 官能团是决定化合物特殊性质的原子或原子团,一定是电中性的。
5.下列有机化合物的分类不正确的是( )解析:选A 分子结构中无苯环,不属于苯的同系物。
6.下列物质属于同系物的是( )D.CH2===CH—CH===CH2和CH3—CH2—CH2—CCH解析:选A 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
B项中两种物质分别是酚和醇,C项中两种物质结构不相似,D项中两种物质结构不相似。
7.下列烷烃的命名正确的是( )解析:选C A不正确,在原命名中1号碳原子上的甲基应包含在主链上,正确的命名应为戊烷。
适用于新教材2025版高考化学一轮总复习第一章课时规范练1钠及其重要化合物碱金属鲁科版

课时规范练1一、选择题:每小题只有1个选项符合题意。
1.下列关于钠及其化合物的叙述正确的是( )A.金属钠是银白色金属,硬度很大B.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应C.等质量的NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多D.向酚酞溶液中加入Na2O2粉末,溶液先变红后褪色,并有气泡生成,可用小刀切割,A错误;钠投入盐酸中,钠先与盐酸反应生成NaCl和H2,若有钠剩余再与水反应,B错误;1molNaHCO3的质量为84g,完全反应消耗1molHCl,1molNa2CO3的质量为106g,完全反应消耗2molHCl,故等质量时,Na2CO3消耗盐酸比NaHCO3多,C错误;向酚酞溶液中加入Na2O2粉末,先与水反应生成NaOH和H2O2,溶液呈碱性而变红色,由于H2O2具有强氧化性,可使酚酞漂白褪色,且H2O2分解产生O2,D正确。
2.如表所示,对陈述1和陈述2的正确性及二者之间是否具有因果关系的推断都正确的是( )具有较强的腐蚀性,不能用于治疗胃酸过多,陈述1错误,A错误;向滴有酚酞的水中加入过量Na2O2,溶液先变红后褪色,陈述1错误,B错误;碳酸氢钠可用于烘焙糕点,是利用了其受热分解产生CO2的性质,与其溶解度无关,D错误。
3.下列叙述正确的是( )A.Na与足量盐酸反应消耗的HCl与等质量的Na在空气中久置后再与足量盐酸反应消耗的HCl相等B.在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水C.Na2O2有氧化性,可用于食品的漂白消毒D.Na2O2与Na2O都能与水反应生成碱,它们都是碱性氧化物与HCl反应生成NaCl,Na在空气中久置后再与足量盐酸反应也生成NaCl,质量相等的钠消耗HCl一样多,A正确;在Na2O2与水的反应中,Na2O2中O元素由-1价变为-2价和0价,则Na2O2既是氧化剂也是还原剂,水既不是氧化剂也不是还原剂,B错误;Na2O2能够与水反应生成NaOH,具有强腐蚀性,不能用于食品的漂白消毒,C错误;Na2O2与水反应生成碱,同时还生成了氧气,不是碱性氧化物,D错误。
高考化学一轮复习钠及其化合物学案

1.物理性质:银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。
2.化学性质:(具有还原性) (1).与非金属单质(如O 2、Cl 2)的反应 Na+O 2===Na 2O(常温下) Na+O 2=====△Na 2O 2(点燃或加热) Na +Cl 2=====点燃2NaCl(2).与酸、水(滴有酚酞)、醇 反应1).与酸反应离子方程式:2Na +2H===2Na +H 2↑(快) 2).与水反应:①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑ ②与滴加酚酞的水反应的现象及解释3).与醇反应:2Na+2CH 3CH 2OH →2CH 3CH 2ONa+H 2↑(沉、慢)3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
4.钠的用途(1)钠钾合金(液态)可用于原子反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na +TiCl 4=====熔融4NaCl +Ti 。
现象:浮——钠的密度比水小熔——反应放热,钠的熔点低 游——产生气体推动钠球游动 响——反应剧烈红——产生了强碱NaOH1.钠与水、酸反应的实质都是与H +的反应。
2.钠与乙醇反应的特点——慢、沉钠与乙醇反应,钠块先沉在液面下,后上下浮动、能看到表面冒出气泡,并不能熔化成小球。
(1)在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2( √)(2)金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( ×)(3)钠表面自然形成的氧化层能够保护内层金属不被空气氧化(×)(4)金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti( ×)(5)根据反应Na+KCl熔融NaCl+K↑,知Na的金属性强于K(×)(6)实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶( √) 1.氧化钠与过氧化钠的比较-2-122223.氢氧化钠(1)物理性质:NaOH 的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有吸水性;吸收空气中的水分而潮解;有很强的腐蚀性。
新高考化学一轮总复习讲解资料-钠及其化合物
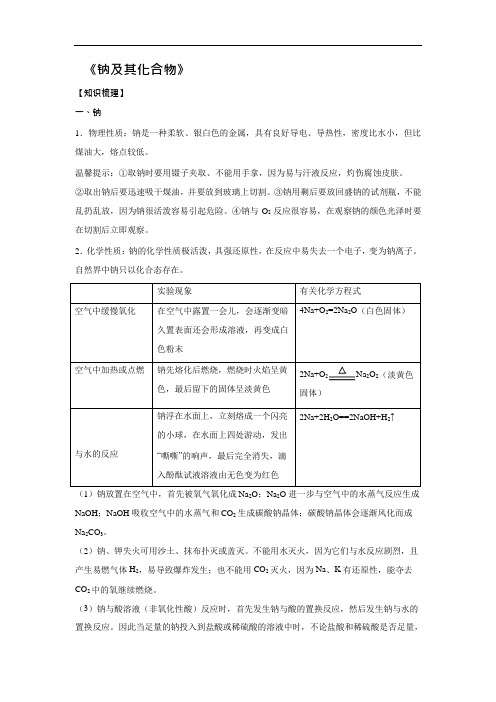
《钠及其化合物》【知识梳理】一、钠1.物理性质:钠是一种柔软、银白色的金属,具有良好导电、导热性,密度比水小,但比煤油大,熔点较低。
温馨提示:①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤。
②取出钠后要迅速吸干煤油,并要放到玻璃上切割。
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险。
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察。
2.化学性质:钠的化学性质极活泼,具强还原性,在反应中易失去一个电子,变为钠离子。
自然界中钠只以化合态存在。
2Na+O2Na2O2(淡黄色固体)(1)钠放置在空气中,首先被氧气氧化成Na2O;Na2O 进一步与空气中的水蒸气反应生成NaOH;NaOH 吸收空气中的水蒸气和CO2 生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成Na2CO3。
(2)钠、钾失火可用沙土、抹布扑灭或盖灭。
不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K 有还原性,能夺去CO2 中的氧继续燃烧。
(3)钠与酸溶液(非氧化性酸)反应时,首先发生钠与酸的置换反应,然后发生钠与水的置换反应。
因此当足量的钠投入到盐酸或稀硫酸的溶液中时,不论盐酸和稀硫酸是否足量,金属钠均能完全反应,产生氢气的多少由金属钠决定。
(4)钠与盐溶液反应时,首先发生钠与水的反应,生成NaOH 和H2;然后发生NaOH 溶液与盐溶液的反应。
如钠与硫酸铜溶液的反应,现象为:钠浮在水面上,迅速地熔化为小球,在水面上四处游动,并发出嘶嘶响声,同时溶液中生成蓝色沉淀。
反应过程为:2Na+2H2O =2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;总反应为:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑。
3.保存:钠很容易跟空气中的氧气和水起反应,因此在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。
2017-2018学年高中化学课时跟踪检测(一)走进化学科学鲁科版必修1

课时跟踪检测(一)走进化学科学1.发现元素周期律的化学家是( )A.波义耳B.道尔顿C.李时珍 D.门捷列夫解析:选D 俄国科学家门捷列夫于1869年发现元素周期律。
2.下列变化不属于化学变化的是( )A.溶洞的形成过程 B.物质的燃烧C.矿石的粉碎 D.合成高分子解析:选C 有新物质生成的变化是化学变化,矿石粉碎无新物质生成,不属于化学变化。
3.化学变化过程中,可能发生变化的是( )A.质量 B.元素种类C.原子数目 D.分子种类解析:选D 化学变化前后原子数目、元素种类均不发生变化,符合质量守恒定律,因有新物质生成,故分子种类可能发生变化。
4.下列做法不能体现低碳生活的是( )A.骑自行车上下班 B.减少食品加工过程C.发展氢能和太阳能 D.大量使用化石燃料解析:选D 大量使用化石燃料(天然气、煤、石油)能产生大量CO2,不符合低碳生活的要求。
5.人类使用材料的增多和变化,标志着人类文明的进步,下列材料与化学制备无关的是 ( )A.青铜器 B.铁器C.石器 D.高分子材料解析:选C 冶金(青铜器、铁器制备)、高分子材料合成均涉及化学反应,石器加工只需物理处理。
6.为防止污染环境,下列燃料最理想的是( )A.煤 B.氢气C.石油 D.植物秸秆解析:选B 煤、石油、植物秸秆的主要成分均为有机物,大量燃烧产生温室气体CO2,同时还产生SO2等有毒气体。
氢气燃烧产物为H2O,对空气无污染。
7.宣传科学知识,介绍高新科技,推广高新技术,揭露伪科学,是科学工作者和当代中学生的义务。
下列说法中不属于伪科学的是( )A .没有水就没有生命B .这种饮料中不含任何化学物质C .这种口服液中含丰富的氮、磷、镁等微量元素D .这种环保汽车不消耗任何能源解析:选A 任何物质都由化学元素组成,均属于化学物质;口服液中的微量元素含量不可能丰富;根据能量守恒定律可知,任何汽车都会消耗能源。
8.下列事实中,不能说明化学是具有实用性的科学的是( )A .制造化学肥料,提高粮食产量B .研制药物,治疗疾病C .合成食品添加剂D .提出更完善的化学理论解析:选D 制造化学肥料、研制药物、合成食品添加剂均体现出化学的实用性,A 项、B 项、C 项均不符合题意;提出更完善的化学理论不足以说明化学的实用性,D 项符合题意。
高考化学总复习 课时跟踪检测六 钠及其重要化合物

课时跟踪检测六钠及其重要化合物(时间:45分钟满分:100分)一、选择题(每小题5分,共60分)1.(2017届保定市高阳中学月考)钠及其化合物与人们的生活密切相关,某同学对其认识不正确的是( )A.碳酸氢钠常用于治疗胃酸过多症B.Na2O2用作呼吸面具的供氧剂C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔D.金属钠着火时,使用泡沫灭火器来灭火解析:Na燃烧生成的Na2O2能与CO2反应生成O2,因此钠着火时不能用泡沫灭火器灭火,可用沙土掩埋法灭火,D项错误。
答案:D2.取Na2O、Na2O2、Na2CO3的固体混合物做了以下实验,以下记录不符合事实的是( )A.加入水中,产生无色气体B.加入酚酞溶液中,溶液先变红后褪色C.在干空气中加热到400 ℃,质量减少D.与硫酸反应后,检测到有Na2SO4生成解析:A项Na2O2与水反应有O2生成,正确;B项Na2O、Na2O2与水反应均生成NaOH,且Na2CO3溶于水也显碱性,故能使酚酞溶液变红,但Na2O2具有漂白性,所以红色消失,正确;C项Na2O与空气中O2反应生成Na2O2,使固体质量增加,Na2O、Na2O2均可与CO2反应,使固体质量增加,错误;D项硫酸与Na2O、Na2O2、Na2CO3均反应,有Na2SO4生成,正确。
答案:C3.(2017届衡水中学二调)下列关于碱金属元素(以M表示)及其单质的说法中,不正确的是( ) A.均可在空气中燃烧,主要产物均为过氧化物M2O2B.均可与水剧烈反应,产物均为MOH和H2C.自然界不存在任何碱金属元素的单质D.碱金属元素在所有的化合物中均为+1价解析:锂在空气中燃烧生成Li2O,A项错误;碱金属单质均可与水剧烈反应,产物均为MOH和H2,B 项正确;碱金属非常活泼,在自然界中以化合态形式存在,自然界不存在碱金属单质,C项正确;碱金属原子最外层均有1个电子,在形成的化合物中表现+1价,D项正确。
高三一轮复习钠及其化合物ppt课件

△ 2NaHCO3
Na2CO3+CO2↑+H2O
七、碱金属元素的原子结构和碱金属的性质的比较
K例外
元元核 素素电 名符荷 称号数
相似性
颜 色 最外 和 层电
状 子数
化学 性质
态
递变性
熔 点
沸 点
密 度
原 子 半 径
电 子
层 数
还 原 性
锂 Li 3 银
单质都是 降 降 增 增 增 增
钠 Na 11 白
一、钠的物理性质
金属钠:色 银白色 密度 小 导电、传热性
态 固体
熔沸点
良好
硬度 软
低
二、钠的化学性质
(一)与非金属反应
1、钠与氧气反应:
失4e-
4Na + O2
2Na2O (白色)
得4e-
失去2e-
2Na + O2 点燃 Na2O2(淡黄色) 得到2e-
2、与其它非金属反应:
在氯气中燃烧: (剧烈、产生白色的烟) 2Na + Cl2 点燃 2NaCl
解析 ①为了滤去黄光;②、③除去铂丝上的杂质; ④本身颜色越微弱的火焰在实验时干扰越小,被检 验物质的火焰颜色越明显;焰色反应除用铂丝外, 还可以用光洁无锈的铁丝、镍丝、铬丝等。 答案 D
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
碳酸氢钠 四种:Na.C.H.O
俗名
纯碱、苏打
小苏打
晶体颜色 白色粉末
细小的白色晶体
溶解性
易溶
可溶
与酸反应 现象明显
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 课时跟踪检测(一)钠及其化合物 1.(2016·唐山模拟)下列说法不正确的是( ) A.Na2O2用作呼吸面具的供氧剂 B.金属钠燃烧时生成淡黄色Na2O C.乙醇可与金属钠反应放出氢气 D.金属钠着火时,用细沙覆盖灭火 解析:选B 钠在空气中燃烧生成淡黄色的Na2O2。 2.(2016·杭州模拟)等质量的钠进行下列实验,其中生成氢气最多的是( ) A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再放入足量的水中 C.将钠放入足量稀硫酸中 D.将钠放入足量稀盐酸中 解析:选B 将等质量的钠投入到水、稀硫酸或稀盐酸中,放出的氢气的量相等;将钠用铝箔包好并刺一些小孔,再放入足量的水中,首先是钠与水反应生成NaOH和氢气,铝与NaOH溶液反应生成氢气,则B项生成氢气最多。 3.利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是( ) A.非金属单质燃烧时火焰均为无色 B.NaCl与Na2CO3灼烧时火焰颜色相同 C.焰色反应均应透过蓝色的钴玻璃观察 D.只有金属单质灼烧时火焰才有颜色 解析:选B A项,某些非金属单质燃烧时火焰也有颜色,例如H2燃烧产生淡蓝色火焰,S在空气中燃烧产生淡蓝色火焰,在纯氧中燃烧产生蓝紫色火焰,错误;B项,焰色反应为金属元素的性质,与元素的存在形式(化合态或游离态)无关,同种金属元素的焰色反应相同,正确;C项,只有观察钾元素的焰色反应时须透过蓝色钴玻璃,错误;D项,焰色反应是元素的性质,而不是单质的性质,错误。 4.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( ) A.过氧化钠 B.氧化钠 C.钠 D.钾 解析:选B Na2O2、Na、K与水反应均会有气体生成,均会使U形管内液面左边低于右边,A、C、D错误;Na2O与水反应放热但没有气体生成,则U形管内液体慢慢右移,但恢复到原温度后又使U形管内两液面相平。
5.(2016·黑河模拟)将0.05 mol Na分别投入到盛有100 mL 水、100 mL 盐酸、100 mL 硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( ) A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O===2Na++2OH-+H2↑ B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 D.三个烧杯中置换生成气体的物质的量一定相同 解析:选A 钠投入溶液中,发生的反应实质是钠与酸或者水电离产生的氢离子的反应,钠与盐酸反应的实质为2Na+2H+===2Na++H2↑,故A错误;盐酸为酸、硫酸铜为强酸弱碱盐 2
水解显酸性,所以X、Y、Z三种溶液中,氢离子浓度由大到小的顺序为Y、Z、X,氢离子浓度越大,反应越剧烈,水中氢离子浓度最小,所以反应最缓和,故B正确;钠与硫酸铜溶液反应,方程式为2Na+2H2O===2NaOH+H2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,故C正确;依据得失电子守恒,可知相同量的钠失去电子数相同,生成氢气的量相同,故D正确。 6.用如图所示实验装置进行相关实验探究,其中装置不合理的是( )
A.鉴别纯碱与小苏打 B.证明Na2O2与水反应放热 C.证明Cl2能与烧碱溶液反应 D.探究钠与Cl2反应 解析:选A 加热固体时,试管口不能向上倾斜,A项设计错误;B项中脱脂棉燃烧,能表明Na2O2与水反应放热;C项中气球变大,Cl2能被NaOH溶液吸收;D项能进行Na与Cl2反应。 7.下列有关钠及其化合物的叙述正确的是( ) A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1∶1 B.9.2 g金属钠投入到足量的重水中,则产生的气体中含有0.4 mol电子 C.钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 D.钠、钾是低熔点的轻金属,所以钠钾合金在常温时柔软似蜡 解析:选B 过氧化钠中阴、阳离子分别是O2-2和Na+,所以过氧化钠晶体中的阴离子与阳离子的物质的量之比为1∶2,A项错误;9.2 g钠的物质的量为0.4 mol,0.4 mol钠和足量重水反应生成0.2 mol重氢,每个重氢分子中含有2个电子,所以产生的气体中含有0.2 mol×2=0.4 mol电子,B项正确;在化学反应中钠常常失去电子被氧化,作还原剂,Na+具有弱氧化性,C项错误;钠钾合金在常温时呈液态,可用作原子反应堆的导热剂,D项错误。 8.(2016·河南十校联考)X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
A B C D X HCl Na2O2 Na2CO3 SO2 Y FeCl2 NaOH CO2 Na2SO3 Z Cl2 Na2CO3 CaCO3 H2SO4 W FeCl3 NaHCO3 Ca(HCO3)2 NaHSO3
解析:选B 由题图分析可知,X能转化为Y和Z,Y和Z能发生反应生成W,B项中NaOH和Na2CO3不反应,不符合题意。 9.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( ) 选项 陈述Ⅰ 陈述Ⅱ 判断
A 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,生成Na2O2 Na2O2中阴阳离子个数比为1∶1 Ⅰ对,Ⅱ错,无 B 向Na2O2的水溶液中滴入酚酞变Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ 3
红色 错,无 C 金属钠保存在煤油中,以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用于航天员的供氧剂 Na2O2能和CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有 解析:选D A项错误,金属Na在空气中逐渐变暗,因生成Na2O,Na2O2中阴阳离子个数比为1∶2。B项错误,Na2O2与水反应生成NaOH,使酚酞变红,但又迅速将其氧化漂白而退色。C项错误,钠在空气中生成的氧化物为氧化钠,金属钠保存在煤油中,是为了隔绝氧气和水蒸气。D项正确,过氧化钠可以消耗CO2、H2O,产生O2,因此可用作航天员的供氧剂。 10.(2016·东城模拟)某同学对Na2O2与CO2反应后所得固体进行研究,下列实验方案中,不能测得固体中Na2CO3的质量分数的是( ) A.取a g混合物与足量稀盐酸充分反应,将反应后溶液加热蒸干、灼烧,得到b g固体 B.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g C.取a g混合物与足量BaCl2溶液充分反应,过滤、洗涤、烘干,得到b g固体 D.取a g混合物与足量水反应,加热,使气体完全逸出,冷却至室温后测得气体体积为V L(已换算为标准状况) 解析:选B A项,Na2CO3、Na2O2都可与盐酸反应生成NaCl,根据混合物和生成的NaCl的质量可求得Na2CO3的质量分数;B项,混合物与硫酸充分反应后逸出的气体中除了有CO2外,还有H2O(g)(还可能有O2,但O2不能被碱石灰吸收,不影响实验结果),二者都能被碱石灰吸收,碱石灰增加的质量并不完全是CO2的质量;C项,Na2CO3能与BaCl2溶液反应生成BaCO3
沉淀,根据BaCO3的质量可求得Na2CO3的质量,进而求得Na2CO3的质量分数;D项,Na2O2与
水反应产生O2,根据O2的体积可求得Na2O2的质量,进而得出Na2CO3的质量分数。 11.某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题: (1)写出下列物质的化学式:C________,D________,E________。 (2)写出下列反应的化学方程式: ①A→B:___________________________________________________________。 ②B→C:__________________________________________________________。 (3)写出下列反应的离子方程式: ①A+H2O→E:_______________________________________________________。 ②Cl2+E溶液:________________________________________________________。 (4)标准状况下,11.2 L Cl2与足量E溶液充分反应,转移电子数为________。 解析:据题意可知A为Na,B为Na2O2,C为Na2CO3,D为CO2,E为NaOH。Cl2+2NaOH===NaCl+NaClO+H2O,可知0.5 mol Cl2参加反应时,转移0.5NA个电子。 答案:(1)Na2CO3 CO2 NaOH
(2)①2Na+O2=====△Na2O2 ②2Na2O2+2CO2===2Na2CO3+O2 (3)①2Na+2H2O===2Na++2OH-+H2↑ ②Cl2+2OH-===Cl-+ClO-+H2O (4)0.5NA或3.01×1023 12.现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
