羟基在苯酚亲电取代反应中的定位作用

羟基在苯酚亲电取代反应中的定位作用*
邝代治1 张志坚1,2 冯泳兰1 张复兴1 王剑秋1
(1衡阳师范学院化学与材料科学系,2衡阳师范学院生命科学系,衡阳 421008)
摘要 苯酚的羟基在空间的位置影响苯酚的能量和原子电荷密度,从而影响苯酚的亲电取代反应。苯酚的O —C 键旋转形成不同构象之间的最大与最小体系能量值之差ΔE 仅ΔE =0.002508a.u .(1.5738kcal?mol -1)。当O —H 与苯环共平面时体系能量[E (0)=E (180)= -305.4412692a.u ]最低,为较稳定的优势构象。苯酚中羟基虽然表现为吸电基,但它的作用使苯环的邻、对位碳原子的负电荷比苯环碳原子高,成为亲电取代反应中心,在邻、对位碳原子上较容易被亲电试剂进攻。亲电试剂Me +与苯酚反应形成邻、对位的碳正离子中间体比间位碳正离子中间体稳定,有利于生成邻、对位取代产物,因此,羟基为邻、对位定位基。 关键词 苯酚电子结构,羟基的定位效应
苯酚是常见且重要的有机中间体,苯酚的亲电取代反应是一类重要有机反应,苯酚的羟基在苯酚的亲电取代反应中起着重要作用。有机化学教材和教学中用定位法则解释苯酚在亲
电取代反应时羟基的定位效应[1-3]。认为羟基向苯环供电,即活化苯环,又由于羟基的供电
子使苯环的邻、对位电荷密度相对较大,亲电取代反应新引入基团主要进入羟基的邻、对位,所以羟基为邻、对位定位基。
其实芳烃的亲电取代反应较复杂,主要与电子效应和空间效应有关,教材和教学中涉及到基团的空间效应主要是基团的空间位阻,很少注意基团本身的空间效应和空间效应影响电子效应的关系。我们认为,苯酚通过它的C —O 键可自由旋转,形成各种构象,最终以主要的稳定构象存在。一旦C —O 键旋转,空间效应影响电子效应,从而羟基的定位作用(能力)受到影响。因此,对定位效应作用的认识还须考虑空间效应与电子效应相互影响。所以,教学中主要从三个方面理解羟基在苯酚亲电取代反应中的定位作用。低能稳定构象是参与化学反应的主要物种;原子电荷分布,尤其是苯环碳原子所带电荷是发生亲电取代反应和反应位置的重要条件;亲电取代反应中间体的稳定性是影响反应途径或反应位置的重要因素。
1 分子构象与体系能量E
为了阐明这个问题,我们进行了分子建模,以C2-C1-O7-H13的二面角为零时的构象为初始构象(Scheme 1,原子符号略),记作α(0),羟基绕O —C 键逆时针方向旋转(设分子随O —C
键旋转时其它键参数不变),寻找旋转角度与分子体系能量的关系,每
旋转10度选取一构象计算单点能量和原子电荷。
苯酚的-OH 基绕O —C 键空间旋转,分子体系能量变化如图1所示,发现体系能量E 与旋转角α有关。当C1、O7和H13三个原子构
成的平面与苯环垂直时的构象,体系能量[E (90)=E (270)= -305.4387612a.u .]最高,与苯环共平面时体系能量[E (0)=E (180)= -305.4412692a.u ]最低,为较稳定的优势构象。但它们之间的能量差[ΔE =0.002508a.u ]很小,O7—
C1单键可自由旋转。
Scheme 1
2 分子构象与原子电荷分布
苯酚分子中O 、H 和C 三种元素的电负性不同而原子带电荷不同。苯酚-OH 基绕O —C 键旋转,形成不同的构象中O 、H 和C 三种原子所带电荷应有变化,将影响亲电取代反应。
* 湖南省高校教改研究资助项目(湘教通[2008]263号148) 12346713812
11109
2.1 苯酚构象与-OH基的原子电荷分布
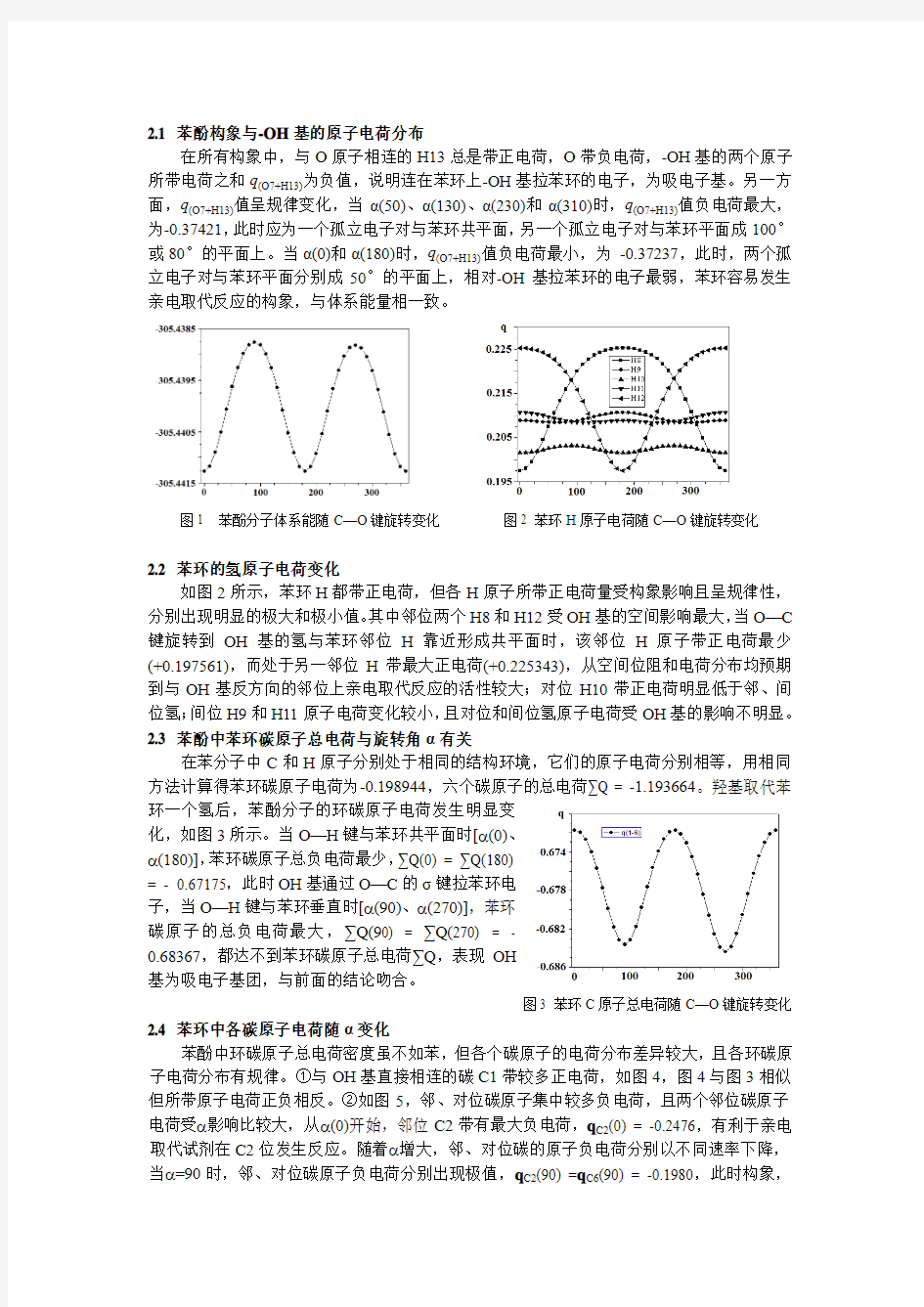
在所有构象中,与O原子相连的H13总是带正电荷,O带负电荷,-OH基的两个原子所带电荷之和q(O7+H13)为负值,说明连在苯环上-OH基拉苯环的电子,为吸电子基。另一方面,q(O7+H13)值呈规律变化,当α(50)、α(130)、α(230)和α(310)时,q(O7+H13)值负电荷最大,为-0.37421,此时应为一个孤立电子对与苯环共平面,另一个孤立电子对与苯环平面成100°或80°的平面上。当α(0)和α(180)时,q(O7+H13)值负电荷最小,为-0.37237,此时,两个孤立电子对与苯环平面分别成50°的平面上,相对-OH基拉苯环的电子最弱,苯环容易发生亲电取代反应的构象,与体系能量相一致。
图1 苯酚分子体系能随C—O键旋转变化图2 苯环H原子电荷随C—O键旋转变化
2.2 苯环的氢原子电荷变化
如图2所示,苯环H都带正电荷,但各H原子所带正电荷量受构象影响且呈规律性,分别出现明显的极大和极小值。其中邻位两个H8和H12受OH基的空间影响最大,当O—C 键旋转到OH基的氢与苯环邻位H靠近形成共平面时,该邻位H原子带正电荷最少(+0.197561),而处于另一邻位H带最大正电荷(+0.225343),从空间位阻和电荷分布均预期到与OH基反方向的邻位上亲电取代反应的活性较大;对位H10带正电荷明显低于邻、间位氢;间位H9和H11原子电荷变化较小,且对位和间位氢原子电荷受OH基的影响不明显。
2.3 苯酚中苯环碳原子总电荷与旋转角α有关
在苯分子中C和H原子分别处于相同的结构环境,它们的原子电荷分别相等,用相同方法计算得苯环碳原子电荷为-0.198944,六个碳原子的总电荷∑Q = -1.193664。羟基取代苯环一个氢后,苯酚分子的环碳原子电荷发生明显变
化,如图3所示。当O—H键与苯环共平面时[α(0)、
α(180)],苯环碳原子总负电荷最少,∑Q(0) = ∑Q(180)
= - 0.67175,此时OH基通过O—C的σ键拉苯环电
子,当O—H键与苯环垂直时[α(90)、α(270)],苯环
碳原子的总负电荷最大,∑Q(90) = ∑Q(270) = -
0.68367,都达不到苯环碳原子总电荷∑Q,表现OH
基为吸电子基团,与前面的结论吻合。
图3 苯环C原子总电荷随C—O键旋转变化2.4 苯环中各碳原子电荷随α变化
苯酚中环碳原子总电荷密度虽不如苯,但各个碳原子的电荷分布差异较大,且各环碳原子电荷分布有规律。①与OH基直接相连的碳C1带较多正电荷,如图4,图4与图3相似但所带原子电荷正负相反。②如图5,邻、对位碳原子集中较多负电荷,且两个邻位碳原子电荷受α影响比较大,从α(0)开始,邻位C2带有最大负电荷,q C2(0) = -0.2476,有利于亲电取代试剂在C2位发生反应。随着α增大,邻、对位碳的原子负电荷分别以不同速率下降,当α=90时,邻、对位碳原子负电荷分别出现极值,q C2(90) =q C6(90) = -0.1980,此时构象,
邻位比苯环碳的原子负电荷少,不利于亲电取代反应,对位q C4(90) = -0.2180,稍有利于亲电取代反应。随着α的增大,邻、对位碳原子带的负电荷分别以不同速率递增,当α达180时,邻、对位三个碳原子负电荷分别达最大值:q C2(180) = -0.2067,q C6(180) =-0.2477,q C4(180) = -0.2180,尤其是C6碳原子明显高于苯环碳原子负电荷,最有利于亲电取代反应的构象。
③间位碳原子均带负电荷,但两个间位碳原子带负电荷随α变化不大,变化规律与邻、对位相反,且均低于苯环碳的原子所带负电荷,特别是在稳定构象时所带负电荷最小,不利于亲电取代反应。因此,苯酚的羟基表现为邻、对位定位基。
图4 C1原子电荷随C—O键旋转变化图5 邻、间和对位碳原子电荷随C—O键旋转变化
3 亲电反应中间体的稳定性与反应途径
当α为0或180时分子体系能量最低,为最稳定构象,此时OH基的邻、对位电荷密度最大,尤其是与O—H共平面且与苯环的二面角为0时的邻位碳最可能优先发生亲电取代反应。以此结构与亲电试剂(R+)反应,理论上将在邻、间和对位发生取代反应,产生(Ⅱ)~(Ⅵ)五种中间体(M+),如Scheme 2所示,现以R=Me为例,它们的中间体M+和产物P的能量(a.u.)分别为:
II III IV V VI
M+ -344.7509562 -344.7389407 -344.7507651 -344.7375737 -344.7571365
P -344.4450042 -344.4508108 -344.4494633 -344.4510245 -344.4504317
结果发现它们的中间体的能量关系:E(Ⅵ) Scheme 2 参考文 [1] 曾昭琼主篇,有机化学[M].北京:高等教育出版社,第四版(上册),2004.166-172. [2] 夏淑真,罗一鸣主篇,Organic Chemistry[M].武汉:华中科技大学出版社,2006.90-92. [3] R.T.Morrison and R.N. Boyd,Organic Chemistry,fourth edition.,Allyn and Bacon,Inc.1983.598-601 Orientation Effect of the hydroxy group on the Reaction of Electrophilic Aromatic Substitution KUANG Dai-Zhi1Zhang Zhijian1,2FENG Yong-Lan1ZHANG Fu-Xing1WANG Jian-Qiu1 (1Department of Chemistry and Materials Science, Hengyang Normal University, Hengyang421008;2 Department of Life Sciences, Hengyang Normal University, Hengyang 421008, Hunan;China) The atomic charge of phenol is effected by the space location of the hydroxy, so that the orientation effect of the hydroxy on the reaction of electrophilic aromatic substitution will also be effected.The molecular conformation is formed by the O—C bond rotation , the 0.002508a.u (1.5738kcal?mol-1) barrier is not a very high one.even at room temperature with sufficient energy is large enough that a rapid interconversion between conformations, that the potential energy of the molecule is at a minimum E(0)=E(180)= -305.4412692a.u for the eclipsed is stabilized. The hydroxy is a drawing electronic group by σ and p-π bond. The hydroxy group is a ortho-para director,thereby increasing the negative electric charges of the ortho-para of benzene and activating the benzene reaction. The carbocations was formed via the reaction of phenol with Me+, the carbocation dehydrogenation gave substituted products that of ortho-para is to be more stable than that of meta position. keywords: electronic structure of the phenol, orientation effect of the hydroxyl 教学目标:掌握各种因素对亲核取代反应机理的影响。 教学重点:烷基结构、亲核试剂、溶剂等因素对S N1 和S N2 反应的影响 教学安排:H 1,H3 —>H4;40min 基本概念:溶剂解:溶剂作为亲核试剂的亲核取代反应,称为溶剂解或溶剂解反应。溶剂解反应可根据所用的溶剂是水、乙醇还是乙酸,分别称为水解、乙醇解,乙酸解等。 卤代烷的亲核取代反应,既可按S N2 亦可按S N1 机理进行,但究竟按何种机理进行呢?这与卤代烷结构,离去基团亲核试剂和溶剂的性质等诸因素有关,下面分别讨论。 一、烷基结构的影响 1.烷基的结构对S N2 反应的影响 在卤代烷的S N2 反应中,如果中心碳原子上连接的取代烷基(支链)越多,它们对亲核试剂从碳卤键背后进攻中心碳原子的空间位阻就越大,使得发生有效碰撞的概率大为下降;而在过渡态时众多的支链与中心碳原子要保持在同一个平面内,其张力是很大的,这就使形 成过渡态需要有非常高的活化能,这些都将导致卤代烷进行S N2 反应的活性下降,反应速率减小。例如,I-与下面各溴代烷的丙酮溶液中于25℃发生S N2 反应时的相对反应速率为: 如果在卤代烷的β- 碳原子上连有支链烷基时,对S N2 反应的速率也有明显的影响,即卤代烷中心碳( α- 碳)原子上连接的烷基体积越大,其空间位阻越大,不利于亲核试剂的攻 击。例如,在C 2H5 OH 溶剂中C2H5ONa 与下面各溴代烷于55℃发生S N2 反应的相对反应速率为: 反应物CH3CH2B r CH3CH2CH2B r (CH3)2CHCH2B r (CH3)3CCH2B r 相对速 率 100 28 3.0 4.2×10-4 综上所述,卤代烷进行S N2 反应时,在其它条件相同时,不同结构卤代烷的反应活性次序为: 取代基定位效应 开放分类:化学、效应、芳香烃 目录 ? 定义 ? 单取代的苯衍生物的定位效应 ? 苯环上有两个取代基的定位效应 ? 取代基定位效应解析 取代基定位效应 英文名称:Substituent??positioning??effects定义 ? ?? ?含有取代基的苯衍生物,在进行芳香族亲电取代反应时,原有的取代基,对新进入的取代基主要进入位置,存有一定指向性的效应。这种效应称为取代基定位效应。 单取代的苯衍生物的定位效应 ? ? ①如苯环上的取代基为-NH2(-NHR、-NR2,R为烷基)、-OH、 -OCH3(-OC2H5等)、-NHCOCH3、-C6H5、-CH3(-C2H5等)等(按定位效应由强到弱次序排列)时,其亲电取代的反应性较苯高。在取代反应中,此类取代基导致得到大部分为邻位和对位取代的异构体。此类取代基称为有活化作用的邻、对位取代基。 取代基的定位效应是个反应速率问题。上邻、对位反应快而上间位慢,就显示邻、对位定位效应;上间位反应快而上邻、对位慢,就显示间位定位效应。 ? ?? ? 稳定的活性中间体的能量低,与之相应的过渡状态的能量也就低,活化能低,反应速率就快;过渡状态能量高,活化能高,反应速率就慢。因此,不同的反应速率实质上反映了活性中间体的稳定性,而活性中间体的稳定性,可以用共振论的方法加以分析。例如用甲苯进行亲电取代反应时,亲电试剂E+可以进攻邻、对位和间位。当亲电试剂进攻邻、对位时,有比较稳定的极限式(a,b)参与共振,CH3与带正电荷的碳相连,CH3有给电子效应,可以中和部分正电荷,使正碳离子稳定,杂化产生的活性中间体也比较稳定。亲电试剂进攻间位时,没有比较稳定的极限式,没有CH3与带正电荷的碳相连的极限式参与杂化。因此,甲基是邻、对位定位基。 ②如苯环上的取代基为 -F、-Cl、-Br、-I、-CH2Cl、-CH匉CHNO2等时,则具有这些取代基的苯的亲电取代反应性较苯低,即这些基使苯环钝化。邻位和对位钝化程度较间位小,有利于形成邻位和对位的 亲电反应和亲核反应 一、目的和要求 通过本节课的学习,达到: 1. 掌握共价键的断裂方式 2. 掌握有机化学反应类型的分类 3. 掌握亲电试剂和亲核试剂的概念 4. 掌握亲电和亲核概念 5. 掌握亲电和亲核反应的历程 要求能够辨别亲电反应和亲核反应。 引言(提出问题) 我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下: C H CH Br 2CCl 4C H CH Br Br Br 2 CCl 4 C H CH Br Br Br Br 同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下:C H CH CH 3 OH KOH C H 2 C H OCH 3 在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。 二、共价键的断裂方式 有机化学反应的实质是旧键的断裂和新键的形成过程。组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种: 1 均裂 均裂:A:B →A·+B· 即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。 2 异裂 异裂:A:B →A-+B+(或A++B-) 即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。 三、有机反应类型分类 根据共价键断裂方式分类 根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应: 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对正原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 反应类型分类如下表所示: 在本节课中,主要对离子型反应中的亲电反应和亲核反应相关知识进行介绍。要清楚亲核反应和亲电反应,首先要明确什么是反应物,什么是试剂。 四、反应物和试剂及试剂的分类 1.反应物和试剂 反应物(或作用物)和试剂之间并没有十分严格的界限,是个相对的概念、习惯用语。本来相互作用的两种物质,即可互为反应物,也可互为试剂。但为了讨论和研究问题时方便,从经验中人为的规定反应中的一种有机物为反应物,无机物或另一种有机物为试剂。例如乙烯与溴的加成反应,乙烯为反应物,溴为试剂。苯肼与醛、酮的反应,醛、酮为反应物,苯肼为试剂。 C H 2CH 2Br 2H 2 2 Br Br CCl 自由基取代——烷烃卤代、芳烃侧链卤代、烯烃α—H 卤代 自由基反应 自由基加成——烯烃的过氧化效应,部分聚合反应 亲电加成——烯、炔、二烯烃的加成,脂环烃小环的开环加成 反应类型 亲电取代——芳环上的取代反应 离子型反应 亲核加成——醛、酮的亲核加成、羟醛缩合反应 亲核取代——卤代烃、醇的S N 1反应,芳环上卤素被取代反应 消除反应——卤代烃和醇的E 1反应 亲核加成—消除反应——羧酸衍生物的代表反应 协同反应(反应连续进行,一步完成)——双烯合成、S N 2、 E 2反应 苯环上亲电取代反应的定位规律 基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。原有取代基称做定位基。 一、两类定位基 在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。实际上只有一种或二种主要产物。例如各种一元取代苯进行硝化反应,得到下表所示的结果: 排在苯前面的取代硝化产物主要是邻位和对位取代物,除卤苯外,其它取代苯硝化速率都比苯快;排在苯后面取代硝化产物主要是间位取代物,硝化速率比苯慢得多。归纳大量实验结果,根据苯环上的取代基(定位基)在亲电取代反应中的定位作用,一般分为两类:第一类定位基又称邻对位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等。 第二类定位基又称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等。 两类定位基的结构特征:第一类定位基与苯环直接相连的原子上只有单键,且多数有孤对电子或是负离子;第二类定位基与苯环直接相连的原子上有重键,且重键的另一端是电负性 大的元素或带正电荷。两类定位基中每个取代基的定位能力不同,其强度次序近似如上列顺 序。 苯环上亲电取代反应的定位规律 二、定位规律的电子理论解释 在一取代苯中,由于取代基的电子效应沿着苯环共轭链传递,在环上出现了电子云密度较 大和较小的交替分布现象,因而环上各位置进行亲电取代反应的难易程度不同,出现两种定 位作用。也可以从一取代苯进行亲电取代反 应生成的中间体σ络合物的相对稳定性的角度进行考察,当亲电试剂E +进攻一取代 时,生成三苯 σ络合物: Z 不同,生成的三种σ 络合物碳正离子的稳定性不同,出现了两种定位作用。 1.第一类定位基对苯环的影响及其定位效应 以甲基、氨基和卤素原子为例说明。 甲基在甲苯中,甲基的碳为sp3杂化,苯环碳为sp2杂化,sp2杂化碳的电负性比sp3杂 化碳的大,因此,甲基表现出供电子的诱导效应(A)。另外,甲基C—H σ 键的轨道与苯 环的π 轨道形成σ—π 超共轭体系(B)。供电诱导效应和超共轭效应的结果,苯环上电 子密度增加,尤其邻、对位增加得更多。因此,甲苯进行亲电取代反应比苯容易,而且主要 发生在邻、对位上。 亲电试剂E+进攻甲基的邻、间、对位置,形成三种σ 络合物中间体,三种σ 络合物 碳正离子的稳定性可用共振杂化体表示: 进攻邻位: 苯环上的取代定位规则 大量实验事实表明,当一些基团处于苯环上时,苯环的亲电取代反应会变得容易进行,同时指使再进入的基团将连接在它的邻位或对位。例如,当苯环上已存在一个甲基时(即甲苯),它的卤化、硝化和磺化等反应,反应温度均远低于苯,且新基团的导入均进入苯环上甲基的邻或对位: Cl Gil, CH) NO, 甲基的这种作用称为定位效应。在这里甲基是一个邻、对位指向基,具有活 化苯环的作用,称为活化基。类似的活化基团还有许多,它们也被称为第一类取代基,并按活化能力由大到小的顺序排列如下: O -NH2,-NHR -N艮,-OH>-NHCO,R-OR,亠°匸? >-R,-Ph>-X 处于这一顺序最末的卤素是个特例。它一方面是邻、对位指向基,另一方面 又是使苯环致钝的基团,这是由于卤素的电负性远大于碳,因此其吸电子效应已超过了本身的供电子能力,这就使环上的电子云密度比卤素进入前有所降低,因而使亲电试剂的进攻显得不力。此称为钝化作用。 还有许多比卤素致钝力更强,而且使再进基团进入间位的取代基,它们被称为间位指示基或第二类取代基,按其致钝能力由大到小的顺序排列如下:-NR3,-NQ, -CF a,-CCl3>-CN, -SQH, -CH= O, -COR -COOH -COOR 常见的取代基的定位作用见表 -NR2(-H)-CN -NHR-CHCI-SQH -NH2-CHCI -OH-F-CHO -OCH3-Cl-COCH -NHCOR-Br-COOH -CH3-I-COOR -C2H5-CONH -CH(CH3)2 -C(CH3)2 -Ar (-H) 由于取代基的指向和活化或钝化作用,在合成一个指定化合物时,采取哪种路线就必须事先作全面考虑。如:欲合成下列化合物时,显然b-路线是合理的。 如果以苯为原料,欲合成对-硝基苯甲酸(此物质在后面章节将学到)时,则 应该先对苯进行甲基化后再进行硝化,最后将甲基氧化: 苯环上原有的取代基对新导入取代基有影响,这种影响包括反应活性和进入位置两个方面。通常,苯环上原有的第一取代基称为定位基,从大量实验事实的分析总结中发现,定位基的定位作用遵循一定的规律,这一规律称为苯环上亲电取代反应定位规律(又称定位规则)。下面分别讨论定位基的类型;定位规则的理论解释;二元取代苯的定位规律;定位规律的应用。 (一)定位基的类型 1.邻、对位定位基。这类定位基的结构特征是定位基中与苯环直接相连的原子不含不饱和键(芳烃基例外),不带正电荷,且多数具有未共用电子对。常见的邻、对位定位基及其反应活性(相对苯而言)如下: 强致活基团:―NH2(―NHR,―NR2),―OH 中致活基团:―OCH3(―OR),―NHCOCH3(-NHCOR) 弱致活基团:―ph(―Ar),―CH3(-R) 弱致钝基团:―F,―Cl,―Br,―I 这类定位基多数使亲电取代反应较苯容易进行,但卤素例外。 2.间位定位基。这类定位基的结构特征是定位基中与苯环直接相连的原子一般都含有不饱和键(-CX3例外)或带正电荷。常见的间位定位基及其定位效应从强到弱顺序如下:―N+H3,―N+R3,―NO2,―CF3,―CCl3,―CN,―SO3H,―COH,―COR,―COOH,―COOR,―CONH2等。 这类定位基属致钝基团,通常使苯环上亲电取代反应较苯难进行,且排在越前面的定位基,定位效应越强,反应也越难进行。 (二)定位规则的理论解释 苯环上的取代反应是亲电取代反应。因此,从反应活性的角度分析,凡有助于提高苯环上电子云密度的基团,就能使苯环活化,反应活性提高;反之,凡是使环上电子云密度降低的基团,就能使苯环钝化,反应活性降低。从反应位置的角度分析,当苯环上没有取代基时,环上六个碳原子的电子云密度是均等的;但当苯环上有取代基时,由于取代基的电子效应沿着苯环共轭体系传递。在环上出现了出现了电子云密度的疏密交替分布现象。第二个取代基总是进入苯环上电子云密度相对较大的部位,从而使这些碳原子上的取代物占了多数。现以―CH3,―OH,―Cl,―NO2为代表加以说明。 1.甲基(―CH3)。甲基具有正的诱导效应(+I),是供电子基;此外,甲基的 C-H键的σ电子可与苯环的п电子发生σ,п-超共轭效应。其结果均可使苯环上的电子云密度增大,特别是甲基的邻、对位增加的更多。 因此,甲苯比苯易发生亲电取代反应,而且主要发生在邻、对位上。 2.酚羟基(-OH)。从诱导效应看,氧的电负性大于碳,存在负的诱导效应(-I),但氧上的未共用电子对可与苯环上的п电子产生给电子的p,п-共轭效应(+C)。在反应时,动态的共轭效应占主导地位,总的结果是使苯环上电子云密度提高,而不是降低,而且邻、对位增加的较多。 所以,苯酚的亲电取代反应比苯容易进行,且第二个取代基主要进入酚羟基的邻、对位。 3.氯原子(―Cl)。氯原子的电负性较大,是吸电子基,存在负的诱导效应(-I)。但同时,氯原子的未共用电子对,同样可以与苯环上的п电子产生给电子的p,п-共轭效应(+C)。但与酚羟基不同的是氯原子的+C不足以抵消-I,总的结果是使苯环上电子云密度降低,且间位降低较多,邻、对位降低的较少,量子化学的计算也表明同样的结果。 (+)表示电子云密度比苯小 亲核取代反应及其影响因素 航03班 林三春 2010011556 摘要: 本文分为四部分。第一部分论述了亲核取代反应的组成部分:亲核试剂、离去基团、反应底物,特地列出了常见的亲核试剂、常见的离去基团。第二部分论述了亲核取代反应机理,主要论述了四种:SN1、SN2、离子对机理和邻近基团参与机理,其中还包括各种机理的实验现象验证,以及对反应产物的影响,如对构型的影响。第三部分论述了亲核反应的影响因素,主要有烃基、离去基团、溶剂和亲核试剂四种,详细地说明了这四种因素如何影响反应。给出了判断离去基团的好坏,以及比较亲核试剂的亲核性的方法。最后一部分论述了亲和取代反应与消除反应的竞争关系,其中包括SN1与E1竞争,SN2与E2竞争。主要以卤代烃为例阐述的。 在论述的同时,还附有适当的图示,以及实验数据,通过比较等手段,使得论述更加有说服力。 全文通过这四个部分,详细、全面地介绍了亲核取代反应。 正文: 亲核取代反应,简称SN 亲核取代反应,通常发生在带有正电或部分正电荷的碳上,碳原子被带有负电或部分负电的亲核试剂(Nu:-)进攻而取代。 一、亲核取代反应的重要组成成分: 亲核取代反应中涉及到的三个重要组成成分为:亲核试剂、离去基团、反应底物。 称为反应底物。进攻反应底物的试剂CH30Na (或 CH3O —)是带着电子对与碳原子结合成键的,它本身具有亲核性,称为亲核试剂,一般用Nu 表示。这类反应之所以称为亲核取代也正是因为它是由亲核试剂进攻反应底物而引起的取代反应。反应底物上的溴原子带着电子对从碳原子上离去,所以Br-;称为离去基团,一般用L 表示。该取代反应是在与溴相连的那个碳原子上进行的,常称该碳原子为中心原子,或反应中心。 .一般的亲核取代反应可以用如下的通式表示: 。其中R —L 为反应底物,L —为离去基团,Nu —为亲核试剂,弯箭头表示电子转移的方向。 1、亲核试剂: 亲核性是指:带负电荷或孤对电子的试剂即亲核试剂对亲电子原子的进攻的能力。 具有亲核性的物质叫做亲核试剂。凡是带有未共享电子对的物质(如Lewis 碱)都具有一定的亲核性,它们都可能作为亲核试剂。亲核试剂可以是中性分子,也可以是带负电的阴离子。下表列出的是亲核取代反应中常见的一些亲核试剂: 第七章芳环上的亲电和亲核取代反应7.1芳环的亲电取代反应 7.1.1芳环上的亲电取代历程 1、亲电试剂的产生 亲电试剂 2、π-络合物的形成 芳环上电子云密度R 3、σ-络合物的形成 硝基所在碳为sp3杂化 4、消去-H+ σ-络合物的证据 已分离出C+ 通过红外和核磁等可鉴定中间体的结构。 7.1.2苯环上亲电取代反应的定位规律 从反应速度和取代基进入的位置进行考虑 1、第一类定位基(邻,对位定位基) 2、第二类定位基(间位定位基) 均为致钝基 7.1.3定位规律在有机合成中的应用 7.1.4典型的芳香亲电取代反应 1.硝化反应 硝化试剂有HNO3-H2SO4 真正的硝化试剂为硝酰正离子。混酸体系有强氧化性 如用混酸将得氧化产物 同时还有部分氧化产物HNO3/CCl4低温时的硝化速度较快 温和的硝化试剂HNO2/C(NO2)4 可避免间位硝化与氧化 2.磺化反应 亲电试剂为SO3或(共轭酸) 特点:(1)可逆反应,可用于芳环的定向取代(占位)。(2)置换反应,合成一些难于合成的物质。 发生间接硝化 3.卤化反应 (1)卤素作卤化剂 (2)N-卤代酰胺或N-卤代磺酰胺作卤化剂 等 其卤化性能较差,只与活泼芳烃反应,可避免氧化反应发生(芳胺和酚)。 而在非极性CCl4等溶剂中是自由基引发剂 自由基取代反应。 1. Fridel-Crafts反应 (1) 烃基化 亲电试剂产生 催化剂活性 AlCl3>FeCl3>SbCl5>SnCl4>BF3>TiCl4>ZnCl2 特点 A. 易发生重排反应 亲电试剂发生重排 B. 易发生多烷基化 C. 可逆反应 动力学条件下,遵守定位规律,热力学控制条件下得稳定的间位产物。 D. 钝化的芳烃不发生烷基化 E.-OH,-NH2和-OR等与路易斯酸配位,使催化剂难于发生烷基化,可改用烯作烷基化剂,以酚铝或苯胺铝作催化剂 (2)酰基化反应 1 用酰氯时,ACl3的量要大于1mol,用酸酐时ACl3要大于2mol。 2 酚的酰化是Fries重排 3 不会发生重排 5.重氮盐的偶联反应 亲电反应和亲核反应详解 一、目的和要求 通过本节课的学习,达到: 1. 掌握共价键的断裂方式 2. 掌握有机化学反应类型的分类 3. 掌握亲电试剂和亲核试剂的概念 4. 掌握亲电和亲核概念 5. 掌握亲电和亲核反应的历程 要求能够辨别亲电反应和亲核反应。 引言(提出问题) 我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下: C H CH Br 2CCl 4C H CH Br Br Br 2 CCl 4 C H CH Br Br Br Br + 乙炔1,2-二溴乙烯1,1,2,2-四溴乙烷 (亲电加成) 同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下: C H CH CH 3OH KOH C H 2 C H OCH 3 + 加热、加压 乙炔甲基乙烯基醚 (亲核加成) 在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。 二、共价键的断裂方式 有机化学反应的实质是旧键的断裂和新键的形成过程。组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种: 1 均裂 均裂:A:B →A·+B· 即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。 2 异裂 异裂:A:B →A-+B+(或A++B-) 即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。 三、有机反应类型分类 根据共价键断裂方式分类 根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应: 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 亲电取代反应是亲电试剂进攻化合物负电部分,取代其它基团的化学反应。一般发生于芳香族化合物,是一种向芳香环系引入官能团的重要方法,是芳香族化合物的特性之一。被取代的基团通常是氢原子,但其他基团被取代的情形也是存在的。一般来说,亲电取代特指芳香亲电取代。另一种比较少见的亲电取代反应是脂肪族的亲电取代。 芳香系亲电取代机理一致,下图给出了苯环的一般历程,亲电基团首先与芳香环电子结合形成n络合物,之后再过渡到一个中间体(T 络合物。最后当新基团亲电能力强于氢离子时,就会从芳香环上脱去 氢离子完成反应 亲核取代反应是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。 亲核取代反应,或称亲核性取代反应,通常发生在带有正电或部份正电荷的碳上,碳原子被带有负电或部分负电的亲核试剂(Nu:-)进攻,与该碳原子相连的某原子或基团被取代。 常分为两种反应机构: 单分子亲核取代反应(SN1第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。由于速控步为第一步,只涉及一种分子,故称SN1反应。 双分子亲核取代反应(SN2较强亲核剂直接由背面进攻碳原子,并形成不 稳定的一碳五键的过渡态,随后离去基团离去,完成取代反应。 这类反应是有机化学中非常重要的一类反应,不论在理论研究中 还是在有机合成实际中都是极其有用的一类反应。 影响因素 1.底物的烃基结构:反应底物的分子烃基中C上的支链越多,SN2 的反应越慢。通常,伯碳上最容易发生SN2仲碳其次,叔碳最难。 的碱性愈弱、愈稳定,就愈容易离去。-C公用的一对电子离去的。 通常,L: 2.离去基团(L):一般来说,离去基团越容易离去,SN2越快。反应时,L是带着原来与 3.亲核试剂(Nu:):亲核试剂的亲核性愈强,浓度愈高,反应速度愈快。 4.溶剂的种类:极性溶剂中,snl反应容易发生。对sn2反应不利。非极性溶剂则相反。碳正离子在极性溶剂中比在非极性溶剂中稳定。sn2的中间体电荷分散,在非极性溶剂中更稳定。 亲核加成,如果进攻试剂本身已不具有获取电子倾向,反而有提供电子能力,如醇、-SH (巯)、胺基与炔反应时,是有提供电子能 力的RO (不是离子,未达到电离程度)先进攻炔键,称亲核加成。 此反应是由亲核试剂与底物发生的加成反应。反应发生在碳氧双 一、定位基定位效应 苯环上已有的取代基叫做定位取代基。 1、邻对位定位取代基 ①概念:当苯环上已带有这类定位取代基时,再引入的其它基团主要进入它的邻位或对位,而且第二个取代基的进入一般比没有这个取代基(即苯)时容易,或者说这个取代基使苯环活化。 ②特征:这类取代基中直接连于苯环上的原子多数具有未共用电子对,并不含有双键或三键。 ③定位取代效应按下列次序而渐减: -N(CH3)2 , -NH2 , -OH , -OCH3 , -NHCOCH3 , -R , (Cl,Br,I) 二甲氨基氨基羟基甲氧基乙酰氨基烷基卤素 2、间位定位取代基 ①定义:当苯环上己有在这类定位取代基时,再引入的其它基团主要进入它的间位,而且第二个取代基的进入比苯要难,或者说这个取代基使苯环钝化。 ②特征:取代基中直接与苯环相连的原子,有的带有正电荷,有的含有双键或三键。 ③定位效应按下列次序而渐减: -N+(CH3)3 , -NO2 , -CN , -SO3H , -CHO , -COOH 三甲铵基硝基氰基磺酸基醛基羧基 3、取代定位规律并不是绝对的。实际上在生成邻位及对位产物的同时,也有少量间位产物生成。在生成间位产物的同时,也有少量的邻位和对位产物生成。 4、苯环的取代定位规律的解释 当苯环上连有定位取代基时,苯环上电子云密度的分布就发生变化。这种影响可沿着苯环的共轭链传递。因此共轭链上就出现电子云密度较大和电子云密度较小的交替现象,从而使它表现出定位效应。 ①邻对位定位取代基的定位效应: 邻对位定位取代基除卤素外,其它的多是斥电子的基团,能使定位取代基的邻对位的碳原子的电子云密度增高,所以亲电试剂容易进攻这两个位置的碳原子。 卤素和苯环相连时,与苯酚羟基相似,也有方向相反的吸电子诱导和共轭两种效应。但在此情况下,诱导效应占优势,使苯环上电子云密度降低,苯环钝化,故亲电取代反应比苯难。但共轭使间位电子云密度降低的程度比邻对位更明显,所以取代反应主要在邻对位进行。 ②间位定位基的定位效应: 这类定位取代基是吸电子的基团,使苯环上的电子云移向这些基团,因此苯环上的电子云密度降低。这样,对苯环起了钝化作用,所以较苯难于进行亲电取代反应。 ③共振理论对定位效应的解释 邻对位中间体均有一种稳定的共振式(邻对位定位基的影响)。 在间位定位基的影响下,在三个可能的碳正离子中间体中,邻对位共振式中正电荷是在连有吸电子基的碳上,它使碳正离子中间体更不稳定。所以间位碳正离子中间体是最有利的。 二、二取代苯的定位规律 如果苯环上已经有了两个取代基,当引入第三个取代基时,影响第三个取代基进入的位置的因素较多。定性地说,两个取代基对反应活性的影响有加和性。 1.苯环上已有两个邻对位定位取代基或两个间位定位取代基,当这两个定位取代基的定位方向有矛盾时,第三个取代基进入的位置,主要由定位作用较强的一个来决定。 2.苯环上己有一个邻对位定位取代基和一个间位定位取代基,且二者的定位方向相反,这时主要由邻对位定位取代基来决定第三个取代基进入的位置。 3.两个定位取代基在苯环的1位和3位时,由于空间位阻的关系,第三个取代基在2位发生取代反应的比例较小。 参考资料:有机化学高等教育出版社 苯环上亲电取代反应的定位规律 苯环上亲电取代反应的定位规律 基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。原有取代基称做定位基。 一、两类定位基 在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。实际上只有一种或二种主要产物。例如各种一元取代苯进行硝化反应,得到下表所示的结果: 1.第一类定位基对苯环的影响及其定位效应以甲基、氨基和卤素原子为例说明。 甲基在甲苯中,甲基的碳为sp3杂化,苯环碳为sp2杂化,sp2杂化碳的电负性比sp3杂化碳的大,因此,甲基表现出供电子的诱导效应(A)。另外,甲基C—H σ 键的轨道与苯环的π 轨道形成σ—π 超共轭体系(B)。供电诱导效应和超共轭效应的结果,苯环上电子密度增加,尤其邻、对位增加得更多。因此,甲苯进行亲电取代反应比苯容易,而且主要发生在邻、对位上。 亲电试剂E+进攻甲基的邻、间、对位置,形成三种σ 络合物中间体,三种σ 络合物碳正离子的稳定性可用共振杂化体表示: 进攻 邻位: 进攻 对位: 进攻 间位: 亲电试剂进攻苯生成的σ 络合物的碳正离子也可以用共振杂化体表示: 苯环上亲电取代反应的定位规律 显然,共振杂化体Ⅰ和Ⅱ比Ⅲ稳定,因为Ⅰc和Ⅱb的正电荷在有供电基的叔碳上,较分散。而在Ⅲ中,正电荷都分布在仲碳上,不稳定。所以甲基是邻对位定位基。共振杂化体Ⅲ比Ⅳ稳定,虽然在Ⅲ和Ⅳ中的共振极限结构式都是正电荷 分布在仲碳上,但甲基有供电性,使Ⅲ的正电荷可以分散在环和甲基上,因此,甲基活化了苯环。从共轭效应和共振论两种观点分析、考察甲苯的亲电取代反应,都得出甲基是第一类定位基、 亲核取代反应 亲核取代反应是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。 中文名 亲核取代反应 外文名 nucleophilic substitution reaction 别称 亲核性取代反应 举例 单分子亲核取代反应 应用学科 有机化学 目录 .1基本性质 .2反应类型 .? SN1 反应 .? SN2反应 .3影响因素 .4举例 基本性质 以卤代烃为例: 卤素连在饱和碳原子上,碳带有部分正电荷,卤素带有部分负电荷,富电子试剂—亲核试剂(nucleophile,简写Nu)进攻带部分正电荷的碳子,亲核试剂与碳原子形成共价键,卤原子则带着一对电子以负离子的形式离去,即卤素被亲核试剂取代,这种有机分子中的原子或基团被亲核试剂取代的反应称为亲核取代反应,用S N表示。 卤代烷R—X为底物(substrate),常用“S”表示,Nu-为亲核试剂,X-为离去基团,常用“L”表示。与离去基团相连的碳原子称为中心碳原子。亲核试剂属于Lewis碱,可以是带负电荷的离子(如OH-、RO-、RCOO-、NO3-、NH2-、RS-、HS-、N3-、CN-、RMgX、 X-等),也可以是拥有孤对电子的中性分子(如H2O、ROH、RNH2、R2NH、R3N、PPh3等)。 如果反应中所用的溶剂同时又作为亲核试剂,这样的亲核取代反应也称为溶剂解,如水解、醇解等,亲核取代反应又分为单分子亲核取代反应(S N1)与双分子亲核取代反应(S N2)。 反应类型 SN1 反应 第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。由于速控步为第一步,只涉及一种分子,故称S N1 反应。 常发生于:碳上取代基较多,如:(CH3)3CX,使得相应碳正离子的能量更低,更加稳定。同时位阻效应也限制SN2 机理中亲核试剂的进攻。 对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻发生化学反应而形成内能更低的分子。 反应特点:反应速率决定步骤在于离解一步(第一步),所以根据动力学理论推断该反应为一级速率反应,反应物。从立体化学观点来看,该反应的反应物若为光学异构物之一,则产物反转机率略大于50%。在碳阳离子形成时,整个分子略呈现平面三角形,亲核体可以由平面三角形上下两侧进行攻击,形成新分子。故理论上反转机率为50%,但因原先脱离的阴离子影响碳阳离子,故亲核剂倾向由反侧攻击形成反转的产物。 该反应适合在高极性稍有质子性溶剂中进行,高极性有助于利用本身极性带有的部份负电稳定碳阳离子,稍有质子性溶剂提供质子与较强亲核剂(通常是被脱离的)化合有助于反应平衡往产物移动。 SN2反应 较强亲核剂直接由背面进攻碳原子,并形成不稳定的一碳五键的过渡态,随后离去基团离去,完成取代反应。 常发生于:碳原子取代较少(如:CH3X),可较容易使SN2反应发生。原因是碳原子上有烷基取代时会有供电效应使被进攻的碳正电性减弱,且烷基取代会产生空间位阻,阻碍进攻。 对碳正离子生成有不利条件的环境下:有许多拉电子基或较少推电子基(1级碳>2级碳>3级碳)。 苯环上取代反应的定 位规则 苯环上原有的取代基对新导入取代基有影响,这种影响包括反应活性和进入位置两个方面。通常,苯环上原有的第一取代基称为定位基,从大量实验事实的分析总结中发现,定位基的定位作用遵循一定的规律,这一规律称为苯环上亲电取代反应定位规律(又称定位规则)。下面分别讨论定位基的类型;定位规则的理论解释;二元取代苯的定位规律;定位规律的应用。 (一)定位基的类型 1.邻、对位定位基。这类定位基的结构特征是定位基中与苯环直接相连的原子不含不饱和键(芳烃基例外),不带正电荷,且多数具有未共用电子对。常见的邻、对位定位基及其反应活性(相对苯而言)如下: 强致活基团:―NH2(―NHR,―NR2),―OH 中致活基团:―OCH3(―OR),―NHCOCH3(-NHCOR) 弱致活基团:―ph(―Ar),―CH3(-R) 弱致钝基团:―F,―Cl,―Br,―I 这类定位基多数使亲电取代反应较苯容易进行,但卤素例外。 2.间位定位基。这类定位基的结构特征是定位基中与苯环直接相连的原子一般都含有不饱和键(-CX3例外)或带正电荷。常见的间位定位基及其定位效应从强到弱顺序如下: ―N+H3,―N+R3,―NO2,―CF3,―CCl3,―CN,―SO3H,―COH,―COR ,―COOH, ―COOR,―CONH2等。 这类定位基属致钝基团,通常使苯环上亲电取代反应较苯难进行,且排在越前面的定位基,定位效应越强,反应也越难进行。 (二)定位规则的理论解释 苯环上的取代反应是亲电取代反应。因此,从反应活性的角度分析,凡有助于提高苯环上电子云密度的基团,就能使苯环活化,反应活性提高;反之,凡是使环上电子云密度降低的基团,就能使苯环钝化,反应活性降低。从反应位置的角度分析,当苯环上没有取代基时,环上六个碳原子的电子云密度是均等的;但当苯环上有取代基时,由于取代基的电子效应沿着苯环共轭体系传递。在环上出现了出现了电子云密度的疏密交替分布现象。第二个取代基总是进入苯环上电子云密度相对较大的部位,从而使这些碳原子上的取代物占了多数。现以―CH3,―OH,―Cl,―NO2为代表加以说明。 1.甲基(―CH3)。甲基具有正的诱导效应(+I),是供电子基;此外,甲基的 C-H键的σ电子可与苯环的п电子发生σ,п-超共轭效应。其结果均可使苯环上的电子云密度增大,特别是甲基的邻、对位增加的更多。 因此,甲苯比苯易发生亲电取代反应,而且主要发生在邻、对位上。 2.酚羟基(-OH)。从诱导效应看,氧的电负性大于碳,存在负的诱导效应(-I),但氧上的未共用电子对可与苯环上的п电子产生给电子的p,п-共轭效应(+C)。在反应时,动态的共轭效应占主导地位,总的结果是使苯环上电子云密度提高,而不是降低,而且邻、对位增加的较多。 所以,苯酚的亲电取代反应比苯容易进行,且第二个取代基主要进入酚羟基的邻、对位。 3.氯原子(―Cl)。氯原子的电负性较大,是吸电子基,存在负的诱导效应(-I)。但同时,氯原子的未共用电子对,同样可以与苯环上的п电子产 亲电反应和亲核反应讲稿 林桂汕 一、目的和要求 通过本节课的学习,达到: 1. 掌握共价键的断裂方式 2. 掌握有机化学反应类型的分类 3. 掌握亲电试剂和亲核试剂的概念 4. 掌握亲电和亲核概念 5. 掌握亲电和亲核反应的历程 要求能够辨别亲电反应和亲核反应。 引言(提出问题) 我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下: C H CH Br 2CCl 4 H Br Br Br 2 4 C H CH Br Br Br Br 同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下:C H CH CH 3 OH KOH C H 2 C H OCH 3 在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。 二、共价键的断裂方式 有机化学反应的实质是旧键的断裂和新键的形成过程。组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种: 1 均裂 均裂:A:B →A·+B· 即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。 2 异裂 异裂:A:B →A-+B+(或A++B-) 即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。 三、有机反应类型分类 根据共价键断裂方式分类 根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应: 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对正原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 反应类型分类如下表所示: 自由基取代——烷烃卤代、芳烃侧链卤代、烯烃α—H卤代 自由基反应 自由基加成——烯烃的过氧化效应,部分聚合反应 亲电加成——烯、炔、二烯烃的加成,脂环烃小环的开环加成反应类型亲电取代——芳环上的取代反应 离子型反应亲核加成——醛、酮的亲核加成、羟醛缩合反应 亲核取代——卤代烃、醇的S N1反应,芳环上卤素被取代反应 消除反应——卤代烃和醇的E1反应 亲核加成—消除反应——羧酸衍生物的代表反应 协同反应(反应连续进行,一步完成)——双烯合成、S N2、E2反应 在本节课中,主要对离子型反应中的亲电反应和亲核反应相关知识进行介绍。要清楚亲核反应和亲电反应,首先要明确什么是反应物,什么是试剂。 四、反应物和试剂及试剂的分类 1.反应物和试剂 反应物(或作用物)和试剂之间并没有十分严格的界限,是个相对的概念、习惯用语。本来相互作用的两种物质,即可互为反应物,也可互为试剂。但为了讨论和研究问题时方便,从经验中人为的规定反应中的一种有机物为反应物,无机物或另一种有机物为试剂。例如乙烯与溴的加成反应,乙烯为反应物,溴为试剂。苯肼与醛、酮的反应,醛、酮为反应物,苯肼为试剂。 苯环的定位规则 学习目标 掌握亲电取代反应的定位规则 了解定位规则的应用 一、苯环的定位规则 一元取代苯再进行取代反应时,新引进的基团在理论上讲应该进入原有基团的邻位、间位和对位,应该有3种不同的异构体。但实际情况并不是这样。例如硝化反应: CH 3 HNO 3 (浓) ? +NO 2 CH 3 + 浓H 2SO 4 20℃~30℃ CH 3 NO 2 + CH 3 NO 2 62% 33% 5% NO 2 HNO 3(发烟) +NO 2 NO 2 + 浓H 2SO 4 NO 2 2 NO 2 NO 2 + 6% 1% 93% 可以看出,甲苯的硝化主要生成邻对位产物,而且反应比较容易进行;硝基苯硝化主要生成间位产物,而且反应比较难以进行。由此可见,第二个取代基进入的位置是受苯环上原有基团的影响,这种现象称为定位效应。苯环上原有基团称为定位基。人们根据大量实验事实,总结归纳出下面的定位规律。 1、第二个取代基在苯环上取代的位置由苯环上原有基团的性质决定,与第二个取代基的性质无关。 2、定位基分为两类: 邻对位定位基,这一类基团大部分使苯环活化,致使苯环取代反应容易进行, HNO 3 (浓) ?+ 浓H SO 55℃~60℃ NO 2 + H 2O 硝基苯 故又称致活基团;能支配第二个取代基在苯环上主要取代在它的邻位和对位。常见的邻对位定位基按定位效应强弱次序排列如下: 一NR 2、一NHR 、一NH 2、一OH 、一OR 、一NHCOR 、一R 、一X 间位定位基,这一类基团大部分使苯环钝化,致使苯环取代反应较难进行,故又称致钝基团;能支配第二个取代基在苯环上主要取代在它的间位。常见的间位定位基按定位效应强弱次序排列如下: 3、在苯环上有两个取代基,欲引入第三个取代基时,第三个取代基所进入的位置,取决于苯环上原有两个基团的综合效应。 当苯环上原有两个定位基的定位作用一致时,第三个取代基进入的位置由原有两个取代基共同决定。例如: 3 H 2 3 2 当苯环上原有两个定位基的定位作用不一致时,有两种情况:一是两个定位基为同一类时,则第三个取代基进入的位置由定位效应强的取代基决定。例如: 二是苯环上有两个不同类定位基时,第三个取代基进入的位置则由原取代基中是邻对位定位基所决定。例如: 二、定位效应的解释 苯环是一个电子云分布均匀的闭合体系,当苯环上有一个取代基时,取代基能使苯环上的电子云分布发生改变。定位基对苯环的影响是通过电子效应(包括诱导效应和共轭效应)及立体效应来实现的。现以几个典型的定位基为例做具体的 一NR 3、一NO 2、一CN 、一SO 3H 、一CHO 、一 COR 、一COOH(R) + 2 3 3 2亲核取代反应的机理及影响因素.
苯环上取代基的定位效应
有机化学反应之亲电反应与亲核反应
苯环上亲电取代反应的定位规律
苯环上的取代定位规则
苯环上取代反应的定位规则
亲核取代反应及其影响因素
第七章芳环上的亲电和亲核取代反应[1]
有机化学反应之亲电反应与亲核反应详解
亲核亲电反应
苯环上的定位基
苯环上亲电取代反应的定位规律
亲核取代反应
苯环上取代反应的定位规则讲课稿
亲电反应和亲核反应讲稿林桂汕一、目的和要求通过本节课的
苯环的定位规则概要
