无菌过滤器清洗验证方案

无菌过滤器清洗验证方案
一、验证目的:
本验证从目检及微生物角度试验并再次证明,无菌过滤器按清洗规程(QG/HW WS-47-1997)进行清洗后,使用该设备进行无菌过滤生产时没有来自上批产品及清洗过程所带来污染的风险,以考证该SOP的可行性和可靠性。
三、清洗规程:执行SOP QG/HW WS-47-1997
清洗流程图
溶液(加NaOH溶液调PH值至 50℃,0.9%生理盐水 300PPMNaClO
3
10左右)
无菌过滤器冲洗15min
80℃注射用水 121℃、蒸汽灭菌30min
循环30min 冲洗30min 无菌状态
装入灭菌盒
四、验证方法:
1、取样方法:
1.1 取样点:无菌过滤器滤液出口。
1.2 取样液:最终冲洗水(洗出液)——按《中国药典》2000年版二部相关项
下检验合格的新鲜注射用水冲洗的最终洗出液;
1.3 取样方法:于上述取样点接取最终冲洗水作为被验样品。
Ⅰ、用经注射用水清洗的具塞三角烧瓶,接取最终冲洗水约500ml,供理化检验用。
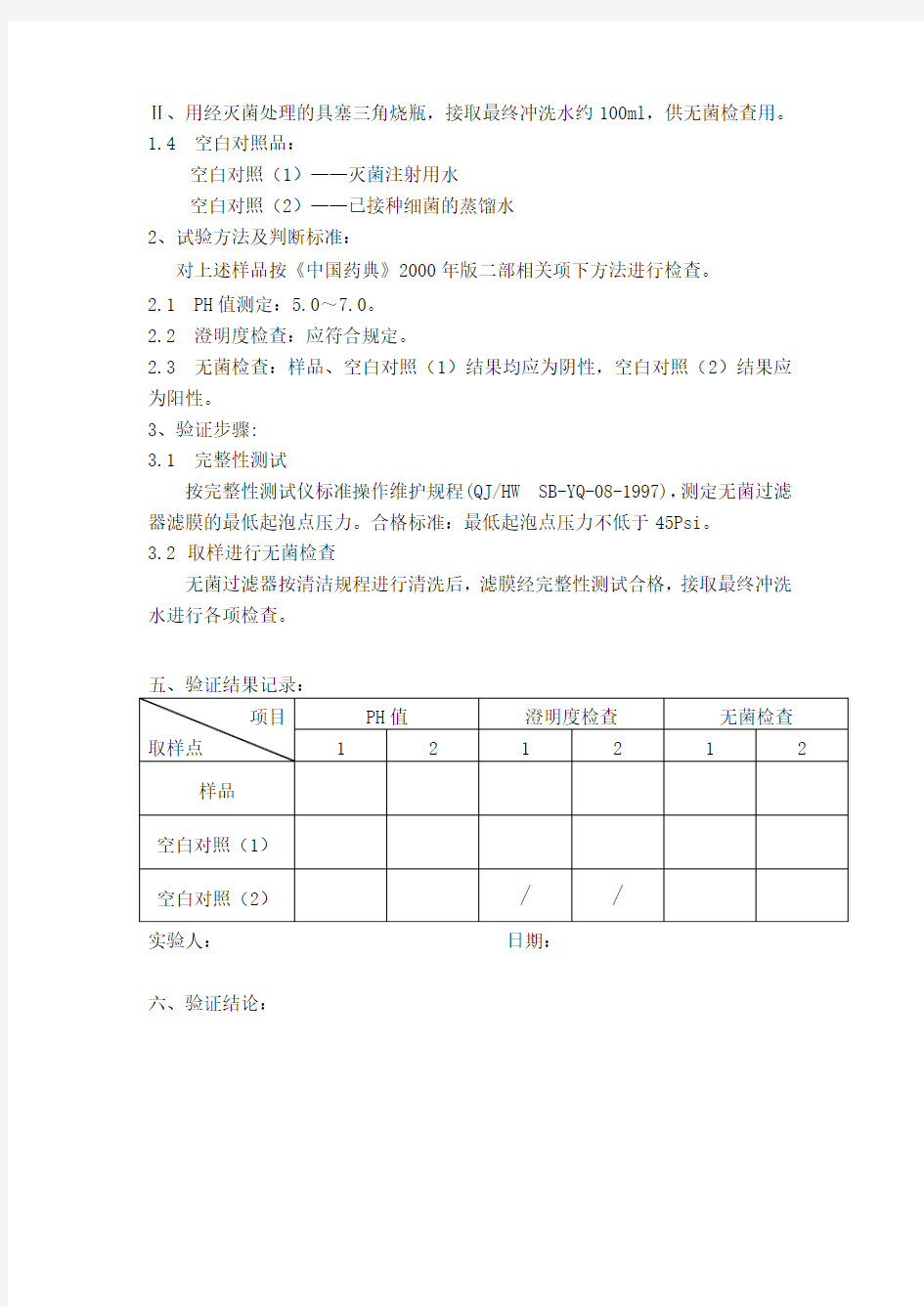
Ⅱ、用经灭菌处理的具塞三角烧瓶,接取最终冲洗水约100ml,供无菌检查用。
1.4 空白对照品:
空白对照(1)——灭菌注射用水
空白对照(2)——已接种细菌的蒸馏水
2、试验方法及判断标准:
对上述样品按《中国药典》2000年版二部相关项下方法进行检查。
2.1 PH值测定:5.0~7.0。
2.2 澄明度检查:应符合规定。
2.3 无菌检查:样品、空白对照(1)结果均应为阴性,空白对照(2)结果应为阳性。
3、验证步骤:
3.1 完整性测试
按完整性测试仪标准操作维护规程(QJ/HW SB-YQ-08-1997),测定无菌过滤器滤膜的最低起泡点压力。合格标准:最低起泡点压力不低于45Psi。
3.2取样进行无菌检查
无菌过滤器按清洁规程进行清洗后,滤膜经完整性测试合格,接取最终冲洗水进行各项检查。
实验人:日期:
六、验证结论:
无菌过滤器清洗验证方案
无菌过滤器清洗验证方案 一、验证目的: 本验证从目检及微生物角度试验并再次证明,无菌过滤器按清洗规程(QG/HW WS-47-1997)进行清洗后,使用该设备进行无菌过滤生产时没有来自上批产品及清洗过程所带来污染的风险,以考证该SOP的可行性和可靠性。 三、清洗规程:执行SOP QG/HW WS-47-1997 清洗流程图 溶液(加NaOH溶液调PH值至 50℃,0.9%生理盐水 300PPMNaClO 3 10左右) 无菌过滤器冲洗15min 80℃注射用水 121℃、蒸汽灭菌30min 循环30min 冲洗30min 无菌状态 装入灭菌盒 四、验证方法: 1、取样方法: 1.1 取样点:无菌过滤器滤液出口。 1.2 取样液:最终冲洗水(洗出液)——按《中国药典》2000年版二部相关项 下检验合格的新鲜注射用水冲洗的最终洗出液; 1.3 取样方法:于上述取样点接取最终冲洗水作为被验样品。 Ⅰ、用经注射用水清洗的具塞三角烧瓶,接取最终冲洗水约500ml,供理化检验用。
Ⅱ、用经灭菌处理的具塞三角烧瓶,接取最终冲洗水约100ml,供无菌检查用。 1.4 空白对照品: 空白对照(1)——灭菌注射用水 空白对照(2)——已接种细菌的蒸馏水 2、试验方法及判断标准: 对上述样品按《中国药典》2000年版二部相关项下方法进行检查。 2.1 PH值测定:5.0~7.0。 2.2 澄明度检查:应符合规定。 2.3 无菌检查:样品、空白对照(1)结果均应为阴性,空白对照(2)结果应为阳性。 3、验证步骤: 3.1 完整性测试 按完整性测试仪标准操作维护规程(QJ/HW SB-YQ-08-1997),测定无菌过滤器滤膜的最低起泡点压力。合格标准:最低起泡点压力不低于45Psi。 3.2取样进行无菌检查 无菌过滤器按清洁规程进行清洗后,滤膜经完整性测试合格,接取最终冲洗水进行各项检查。 实验人:日期: 六、验证结论:
超声波清洗机安全操作规程标准范本
操作规程编号:LX-FS-A15178 超声波清洗机安全操作规程标准范 本 In The Daily Work Environment, The Operation Standards Are Restricted, And Relevant Personnel Are Required To Abide By The Corresponding Procedures And Codes Of Conduct, So That The Overall Behavior Can Reach The Specified Standards 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
超声波清洗机安全操作规程标准范 本 使用说明:本操作规程资料适用于日常工作环境中对既定操作标准、规范进行约束,并要求相关人员共同遵守对应的办事规程与行动准则,使整体行为或活动达到或超越规定的标准。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 1. 使用合符设备规格的电源及电源线,电源回路中必需装设专用于清洗机的空气开关以在需要的时侯切开清洗机电源。 2. 设备按安全要求接好接地线; 3. 清洗剂应放置在清洁、干燥以及强腐蚀气体的环境中使用,并避免剧烈震动。 4. 发生器背面应留有足够的散热空间。 5. 确保机器有良好的接触,以避免人身伤害事故。 6. 清洗机工作时,不要将手指浸入清洗液中。
7. 严禁空载状态下开机,开机前必须使用说明的液位将清洗液倒入清洗槽中。 8. 被清洗物不得和槽底接触,建议将工件放入篮筐中清洗。 9. 清洗液不得呈强酸或强碱性,无可靠的安全措施时,不能使用易燃溶液。 10. 清洗液温度会随连续工作时间而升高,清洗机连续工作时间不要超过8小时。 11. 如发现清洗槽有漏水现象,应立即关机使用,并倒空清洗液后与销售商联系。12. 不允许擅自拆开机器。 13. 对有加热装置的清洗机在清洗完毕后,必须先关闭加热器待清洗液冷却后再放空清洗液。 14. 设备采用不燃性洗净剂,设备的使用在必需确保远离有易燃易爆物质的场合,特殊情况下必需采
滤芯相容性验证
南京XX制药有限公司 滤芯相容性验证方案 方案号: QV2-002(2010) 验证内容:滤芯相容性验证 验证部门:生产部 验证地点:冻干粉针车间 验证时间: 2010年06月
方案起草人/日期 方案审核人/日期 部门经理: 质控部经理: 验证主管:方案批准人/日期
目录 一、验证方案 1、验证背景 2、验证目的 3、验证依据及相关文件 4、验证小组职责 5、验证小组人员培训 6、验证实施条件确认 7、验证内容 8、可接受标准 9、验证拟实施时间 二、验证报告 1、验证目的 2、验证情况 3、验证小组人员培训 4、验证实施条件确认 5、验证数据统计 6、验证结论 7、总体评价
1 验证背景 滤芯质量的优劣是影响无菌冻干制剂质量的一个重要因素。滤芯的质量情况主要是从其完整性保证情况和是否会对过滤后的药液产生不良影响两方面来考量。粉针车间冻干制剂药液过滤使用的滤芯为上海金科过滤器材有限公司生产的10in,226型,规格为0.45μm和0.22μm聚醚砜滤芯,因滤芯的长度、规格不影响验证的结果,故本次验证仅选用10in、226型、0.22μm的聚醚砜滤芯作为验证的对象。考虑到药液酸碱度对滤芯质量的影响最大,因此本次验证品种的选取原则是选用药液酸度或碱度最强的品种,公司生产品种Ph大部分在中性左右,注射用泮托拉唑钠在配液时Ph在11左右,相对碱性最大,所以本次验证选择注射用泮托拉唑钠作为验证品种。 验证地点:粉针车间 2 验证目的 通过对聚醚砜滤芯相容性实验以及截留性实验,确认该类型滤芯在过滤前后的完整性和安全性保证,确保生产过程的的稳定性和可靠性。 3 验证依据及相关文件 3.1 注射用泮托拉唑钠工艺规程 3.2 现场管理操作SOP 3.3 质量检验仪器使用SOP 3.4 生产设备使用SOP 4 验证小组职责分工 所在部门姓名职责范围人员确认 生产部XXX* 负责起草验证方案、验证中各过程的全面指导、偏差的分析和处理、验证报告的整理,负责小组协调工作 生产部XXX 验证过程的现场管理、验证数据的收集 质控部XXX 确保仪器、仪表、计量器具运行正常,在计量合格有效期内 工程部XXX 保证生产设备正常运行 QA XXX 按照验证方案进行取样 QC XXXX 取样样品的理化指标分析和数据统计注:姓名后面打“*”者为验证组组长
过滤器标准
空气过滤器 1范围 本标准规定了空气过滤器(简称过滤器)的术语与定义、分类与标记、要求,试验方法、检验规则以及产品的标志、包装、运输和贮存等。 本标准适用于常温、常湿、包括外加电场条件下的通风、空气调节和空气净化系统或设备的干式过滤器。2规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T191包装储运图示标志 GB/T1236—2000工业通风机用标准化风道进行性能试验 GB/T2423.3—2006电工电子产品环境试验第2部分.?试验方法试验C AB:恒定湿热试验GB/T2621 1—2006用安装在圆形截面管道中的差压装置测量满管流体流量第1部分:一般 用安装在圆形截面管道中的差压装置测量满管流体流量用安装在圆形截面管道中的差压装置测量满管流体流量
用安装在圆形截面管道中的差压装置测量满管流 体流量第4部分:文丘 GB—2005家用和类似用途电器的安全通用要求 GB/T4857.23—2003包装运输包装件随机振动试验方法 GB/T6167尘埃粒子计数器性能试验方法GB/T8170数值修约规则GB8624建筑材料及制品燃烧性能分级GB/T18883—2002室内空气质量标准 GB50243通风与空调工程施工质量验收规范3术语与定义 以下术语与定义适于本标准。 干式过滤器DRY TYPE FILTER 滤料既不浸油,也不喷其他液体的过滤器。 亚高效过滤器 SUB^HEP A(HIGH EFFICIENCY PARTICULATE AIR) FILTER 按本标准规定的方法检验,对粒径大于等于〇.5 /IM微粒的计数效率大于或等于95%而小于
安瓿立式超声波清洗机验证方案
安瓿立式超声波清洗机验证方案 上海丽珠制药有限公司
上海丽珠制药有限公司 验证方案审核单 起草 审核 批准
目录 1. 概述 (4) 2. 验证目的 (5) 3. 验证范围 (5) 4. 验证组员和相关职责 (5) 5. 相关文件 (6) 6. 验证内容 (7) 7. 验证结果及评价 (15) 8. 偏差与处理报告...........................................................15 9. 验证周期.............................................................. (15)
ACQL80型安瓿立式超声波清洗机 1.概述 我公司注射剂车间使用的AQCL80型安瓿立式超声波清洗机为湖南楚天科技股份有限公司生产的,该设备适用于制药企业对安瓿瓶、管制瓶及模制西林瓶或类似小型玻璃瓶的洁净清洗。本机既能单机使用,也能与其他单机组成联动线使用。设备安装在主设备车间的D级洁净区车间,设备的主要组成部分为:主体、进瓶网带、管路系统、贮水槽、电控箱(含操作面板)工作流程: 安瓿瓶送入输送网带→淋水→超声波洗涤→螺杆进瓶→提升凸轮提升瓶→机械手开钳夹瓶→机械手翻转瓶→瓶外壁喷淋冲洗→喷针插入瓶内进行第一次冲循环水→喷针插入瓶内进行第二次冲循环水→喷针插入瓶内进行第一次吹净化压缩空气→喷针插入瓶内进行冲注射用水→喷针插入瓶内进行第二次吹净化压缩空气→喷针插入瓶内进行第三次净化吹压缩空气→(瓶外壁吹净化压缩空气)喷针退出瓶身→机械手翻转瓶开钳落瓶→同步带出瓶→进入KSZ620/38型隧道式灭菌干燥机干燥灭菌。 系统工作流程简图:
59-0.2μm过滤器完整性验证方案
华北制药股份有限公司 验证方案 验证编号:验字-2010-114-59 验证名称:过滤器完整性验证 验证单位:114车间 起草人:日期: 单位领导:日期: 审核人:日期: 日期: 批准人:日期:
1、验证名称 过滤器完整性验证 2、验证目的 采用泡点检测法对5-8楼分装岗位用压缩空气过滤器、洗瓶岗位用注射用水过滤器和压缩空气过滤器、消毒剂罐用过滤器、酒精罐用过滤器、纯化水罐用过滤器、注射用水罐用过滤器、蒸馏水机用过滤器、蒸汽灭菌柜用过滤器进行检测,以证明除菌过滤器(0.22μm)完整性良好。 3、验证依据 《药品生产验证指南》(化学工业出版社2003年7月第1版) 《验证控制程序》HYG/QP(7.5.2)01-2010 4、验证的实施小组组成及分工 5、设备描述 5.1 分装机:气流分装机所用压缩空气最后经末端过滤器(0.22μm)过滤后,用于粉针剂的分装,此种过滤器为本项验证的对象。 5.2 洗瓶机:生产用小瓶在洗瓶机上经注射用水清洗后,经压缩空气吹干,其中压缩空气最后经末端过滤器(0.22μm)过滤,注射用水最后经末端过滤器(0.22μm)过滤,此两
种过滤器为本项验证的对象。 5.3 消毒剂罐和酒精罐:消毒罐里消毒液和酒精罐里酒精使用时经压缩空气加压出液,输送到各个使用口。其中压缩空气经过滤器(0.22μm)过滤,消毒液和酒精出口分别经过滤器(0.22μm)过滤,此三种过滤器为本项验证的对象。 5.4 纯化水罐、注射用水罐、蒸馏水机:储罐和水机需要补充空气,空气经过滤器(0.22μm)过滤,此两种过滤器为本项验证的对象。 5.5 蒸汽灭菌柜:灭菌柜在程序运行中需要补充空气,空气经过滤器(0.22μm)过滤,此种过滤器为本项验证的对象。 5.6过滤器滤芯性能指标:
AQCL100型安瓿立式超声波清洗机验证报告
目录 1.验证小组成员及职责 (2) 2.概述 (3) 3.验证目的 (3) 4.验证范围 (3) 5. 验证结果分析和评价 (3) 5.1.验证前的准备 (3) 5.2.设计确认 (3) 5.3.安装确认 (4) 5.4.运行确认 (6) 5.5.性能确认 (7) 6.偏差分析及变更 (9) 7.验证结论 (9) 8.验证时间安排 (10) 9.再验证周期 (10)
文件起草、审核、批准: 起草人审核人审核人批准人部门生产管理部质量管理部生产负责人质量受权人 姓名陈圆何勇夏蕴琼李瑛 签名 日期 1.验证小组成员及职责 公司成立验证领导小组,负责所有确认与验证工作的领导和组织,负责审批确认 与验证方案和报告。验证领导小组针对每一个具体项目成立专门工作小组,负责该项 目的确认和验证方案的起草、实施、组织与协调,负责确认结果记录与评定,负责完 成确认报告。验证小组成员如下: 姓名部门职务职责 夏蕴琼生产负责人负责审核该验证方案及报告 李瑛质量负责人负责该验证方案及报告的批准 负责该验证方案及报告的起草及验证方案实施,验证记录的汇总陈圆生产管理部经理 及验证结果的分析与评价、验证资料的汇总。 负责审核该验证方案及报告何勇质量管理部QA主管 负责监督验证工作的实施及取样工作。 负责验证检测工作的安排, 张得青质量管理部QC主管 收集整理验证数据,做检验相关评价。 汪承华动力工程部主任为验证方案实施在公用系统、生产设备提供支持与保障郑跃小容量车间工艺员负责该验证过程中的记录
2.概述 QCL100 立式超声波洗瓶机是由上海驭发机电设备有限公司生产的清洗去污设备,购买于2011年。本清洗机位于小容量车间,一端连接一般区上瓶间(房间编号:F-XZ-061),另一端连接于D级区隧道烘箱入口处,用于瓶子的清洗去污。 该设备适用于制药企业对1-10ml 规格的安瓿瓶的洁净清洗。其工作原理是自动完成从进瓶、超声波粗洗、瓶外壁精洗、瓶内壁精洗到出瓶的全套生产过程。采用超声波清洗与水气压力喷射清洗相结合方式,不但能达到清洗的目的,还能对瓶内外附着的各种微生物,肠杆菌及类似病菌进行超声粉碎,从而起到洗净、消毒、灭菌的作用,其洗瓶可见异物合格率高,碎瓶率低。 该设备安装在D 级洁净区洗瓶间(房间编号:F-XZ-011),设备的主要组成部分为:进瓶网带、绞龙提升组、大转盘组、冲水冲气组、水箱组、出瓶组、管路系统、电控箱(含操作面板)。洗瓶工艺过程:输瓶→淋水→超声波洗涤→绞龙进瓶→凸轮提升瓶→机械手夹瓶→机械手翻转瓶→水、气反复清洗三次→机械手翻转瓶→同步带出瓶,其生产能力为10000-29000 支/小时,破瓶率不大于0.5%,可见异物合格率不小于99.9%。本机既能单机使用,也能与隧道烘箱同步联动使用。 3.验证目的 通过对该设备的DQ、IQ、OQ、PQ的实施以确认该设备的稳定性、可靠性和适应性,达到设计标准,符合GMP规定及产品工艺要求。 4.验证范围 QCL100 立式超声波洗瓶机的设计情况、安装情况、运行情况以及性能情况。 5.验证结果分析和评价 5.1.验证前的准备 在验证实施前,岗位操作规程内容完整,文件版本为现行版本;人员经过了培训、考核;生产和检验用仪器仪表经过了校验。 5.2.设计确认 5.2.1. 设计确认的目的 设备的设计确认即预确认,主要是对设备选型和订购设备的技术规格、技术参数和指标适用性的审查,参照设备使用说明书,考察它是否适合生产工艺、校准、维修保养、清洗等方面的要求,以及依据用户需求标准(URS)、GMP法规或指南、产品
药液过滤系统筒式滤芯完整性测试验证
编号: 过滤器完整性测试仪验证方案 ********药业有限公司 年月日 目录 1 概述 2 验证项目中各部门及人员责任 3 验证目的 4 验证依据 5 验证方法 6 验证程序 7 再验证周期 8 附表 1 概述 根据GMP要求,各种过滤器在使用前后均应做完整性试验,从而证明过滤器的滤膜或滤芯是否完好无破损,通过压力值测定检查其孔径是否符合生产工艺要求。 本验证方案是对药液过滤系统上安装的筒式过滤器进行完整性测试,以证明该滤芯的完好及孔径是否符合要求,从而确保压缩空气质量,满足生产工艺要求。 2 验证项目中各部门及人员责任 2.1 验证项目小组成员及责任 验证项目小组成员 验证项目小组组长:负责验证方案的编写,组织验证全过程的实施,起草验证报告。
验证项目小组成员:分别负责落实方案实施中各部分验证的具体工作。2.2 验证工作中各部门责任: 验证委员会:负责批准验证立项申请,设立验证项目小组;审批验证方案;批准验证报告;负责组织验证评价工作,发放验证证书。 验证实施人员:负责验证过程的协调工作;负责掌握验证工作进度;负责收集整理验证资料;负责验证归档工作。 生产车间:负责验证期间操作间环境卫生及气源提供工作。 质量管理部:负责验证过程中的质量监控及验证培训工作。 工程部和动力部:负责对公用系统、生产设备、设备维修及校正等各项工作中提供及时可靠的支持和服务。 3 验证目的 通过检测筒式过滤器滤芯是否完整、孔径是否符合要求,来证明过滤效果是否满足工艺要求,从而有效的保证药品质量。 4 验证依据 4.1 《药品生产质量管理规范》(1998年修订) 4.2 压缩空气使用标准操作规程。 4.3 气泡点测试标准操作规程 4.4 《药品生产验证指南》 5 验证方法 本次对药液过滤系统上安装的筒式过滤器验证采用气泡点法。 5.1 气泡点法原理 5.1.1:当滤材被液体浸润后,在滤材的两侧加上气体压差,由于毛细管效应,气体要将毛细管中的液体赶走而冒出气泡,气体的压差必须增大到某一值 P1。 p=4fcosa/D 压差(达因/平方厘米) f-表面张力
薄膜过滤器验证方案
深圳迈德士医疗器械科技有限公司 薄膜过滤器验证方案及报告Array目录 1. 验证方案的起草和审批 1.1 验证方案的起草 1.2 验证方案的审批 2. 验证小组人员名单 3. 概述 4. 验证目的 5. 验证内容 5.1 安装确认 5.1.1 资料档案 5.1.2 设备材质 5.1.3 环境状况 5.1.4 公用介质 5.2 运行确认 5.3 性能确认 6.时间进度表
薄膜过滤器验证方案及报告 7.再验证 8.最终评价及验证报告 1. 验证方案的起草和审批 1.1 验证方案的起草
薄膜过滤器验证方案及报告 1.2 验证方案的审批 2. 验证小组成员名单 3. 概述 本薄膜过滤器采用优质硅酸盐材料制成,能承受热压消毒,法兰口均为精工平磨,密合性能良好。滤膜材质是聚丙酰胺(或醋酸纤维素)。本滤器用于本公司纯化水微生物限度检查及热球导管的无菌检查过滤,正常的使用程序是按照操作规程进行用前或用后清洗,洗好的滤器晾干后装上滤膜,放入高压蒸汽灭
薄膜过滤器验证方案及报告 菌锅0.1MPa121℃灭菌30min待验证。由于滤器本身的无菌度以及其稳定性和可靠的过滤性直接关系到检测结果的准确性,因此,为了确保本滤器的过滤除菌符合检测要求,制定本验证方案对本滤器进行性能验证。 4. 验证目的 通过验证本滤器的过滤除菌符合技术要求,确保微生物检测结果的准确性。 5. 验证内容 5.1 安装确认 5.1.1 资料档案 检查人:检查日期: 5.1.2设备材质 硅酸盐材料制成,能承受热压消毒,法兰口均为精工平磨,密合性能良好。滤膜材质是聚丙酰胺(或醋酸纤维素)
筒式微孔滤膜过滤器验证方案详解
筒式微孔膜过滤器验证方案江西隆莱生物制药有限公司
一、方案的起草与审批 1.1验证方案的起草 1.2方案审核 1.3方案批准 目录
1.基本情况 (3) 2.概述 (3) 3.验证项目和验证方法 (4) 3.1 起泡点试验 (4) 3.2 药液适应性实验 (6) 3.3 微生物挑战性实验 (7) 4. 异常情况处理程序 (8) 5. 再验证周期 (8) 6. 验证结果评定与结论 (9) 7. 附件一:预确认记录 (10) 7. 附件二:验证证书 (11) 1.基本情况
设备器具名称:筒式微孔滤膜过滤器 设备器具型号: 设备器具用途:产品的除菌过滤 生产商: 安装地点及使用单位:车间岗位。 主要技术参数: 2.概述 本滤器是筒式微孔滤膜过滤器,滤器材质为优质不锈钢(316L),滤膜材质是聚丙酰胺(或醋酸纤维素、聚丙烯等)。本滤器用于本公司去除液体或气体中的微粒,微生物等杂质,正常的使用程序是先按照“工器具清洁操作操作规程”进行用前或用后清洗,洗好的滤器在存放间晾干后装上滤膜,如需要按照本滤器要求的灭菌条件进行灭菌后待用。由于滤膜的孔径以及它的稳定和可靠的过滤性能直接关系到成品的微生物限度,因此,为了确保本滤器的完好过滤性能,特制订本验证方案对本
滤器进行验证。 3. 验证项目和判断标准 3.1 起泡点试验 3.1.1 目的 确定使用的药液过滤器孔径与工艺规定使用的孔径是否相符。 3.1.2 实验用材料、介质和器具 无油无菌压缩空气、压力表、纯化水 3.1.3 方法 将已清洁的滤器装上待测滤膜,按照滤器的使用说明固紧罗栓,用注射用水充分浸润,夹闭排气孔,将进液端用高强度管道与压力表和无菌压缩空气或氮气连接,逐渐开启供气阀,向待测过滤器中通入无菌压缩空气或氮气,观察过滤器组合中的压力表示数的变化。当过滤器组合的后部导管出口处出现第一个气泡时,读取压力表指示值,此压力数值即为过滤器滤膜的起泡点压力,将此压力与下表对照,可得出待测过滤器滤膜的实际孔径。 3.1.4 判断标准 待测过滤器起泡点压力应大于或等于下表所示孔径所对应压力数值: 表1.过滤器滤膜孔径与起泡点压力对照表 3.1.5.实验结果 表2.滤器的起泡点实验结果
除菌过滤系统验证方案
除菌过滤系统验证 方案 1 2020年4月19日
xxxxx制药有限公司GMP文件 2 2020年4月19日
除菌过滤系统验证方案 验证方案目录 1.概述 2.验证目的 3.验证范围 4.验证部门职责 5.采用的文件 5.1《中国药典》xxxx版x部xx页 5.2药品生产质量管理规范(xxxx年修订) 5.3药品生产验证指南(xxxx) 5.4无菌制剂质量风险控制验证 5.5标准操作程序 5.6质量标准 3 2020年4月19日
5.7检验标准操作程序 5.8取样标准工作程序 6. 生产操作过程简述 7. 验证程序 7.1除菌过滤系统验证 7.2灭菌后产品检验 除菌过滤系统验证方案 1.概述 xxxx注射剂是我公司生产近上市品种,也是药典品种,是用于xxx病、xxxxxx、xxxxxxx等的治疗的一种液体制剂。该产品的特点是药效明确,药性稳定、安全。确认除菌过滤0.22μm聚醚砜筒式滤芯,使微生物的截留达到除菌过滤目的,因此在该产品的整体工艺设计上采用微生物残存概率百万分之一(SAL=10-6),并采用105℃、30分钟灭菌方式,使最终产品符合质量要求。 4 2020年4月19日
采用的工艺方案流程如下: 原料药→浓配液→稀配液→除菌过滤→灌装→轧盖→灭菌→成品 附图(一) 为此,验证小组对所用的0.22μm聚醚砜筒式滤芯除菌过滤系统进行了验证,以确保按本工艺流程生产出来的产品品质稳定、安全有效。 2.验证目的 除菌过滤系统在整个工艺流程中的地位是极其重要的,我们经过它来达到药液中除菌的目的。这套系统本身的合理性对产品质量保证也有重要影响。因此,我们经过对该系统作前验证,来建立有科学依据,且有可靠质量保证的过滤除菌系统,以维持全套工艺流程的稳定性。 5 2020年4月19日
保安过滤器滤芯清洗恢复方案
. . . . 神华集团SHENHUA GROUP 神华包头 煤化工分公司 保安过滤器滤芯清洗恢复 方案 技术文件0 版 SBCCC-260-T-39 第 1 页共8 页 保安过滤器滤芯清洗恢复方案 0 供实施 版次说明编制人审核人批准人批准日期 编制部门公用工程中心发布日期实施日期 本文件知识产权属神华包头煤化工分公司所有,未经授权许可或批准,不得对公司以外任何组织或个人提供;任何外部组织或个人擅自获取、使用、转让文件的行为均属侵权。 本文件由文件编制部门负责解释。
会签表
目录 1 编制目的 4 2 操作要点 4 3 注意事项8
保安过滤器滤芯清洗恢复方案 1编制目的 针对反渗透进水保安过滤器滤芯因水质复杂,压差升高快,使用寿命较短的现状,制定本清洗方案,通过药剂清洗恢复滤芯的过滤性能,延长使用寿命,确保回用水装置的连续稳定运行。 2操作要点 清洗恢复过程总体分为浸泡和冲洗两步,根据使用的药剂不同分为酸洗和碱洗。 2.1药液配制 2.1.1配制准备 使用循环水装置的塑料加药方桶浸泡滤芯,使用前需要引好生产水线和搅拌风线,并将桶内冲洗干净。 2.1.1.1方桶规格如下: (1)长×宽×高=0.85m×1m×0.9m。 (2)底部带有DN25的放空龙头。 (3)在方桶顶部切0.5m×0.5m的方孔,作为配药和浸泡滤芯的入口。 2.1.1.2将方桶放置在前处理加药间排水沟处,将放空龙头对准排水沟。 2.1.1.3在前处理加药间东侧生产水倒淋管线处接塑料软管,甩至桶口处。 2.1.1.4在前处理加药间东侧的仪表风甩头处接塑料软管,甩至桶口处。 2.1.1.5确认前处理间的气动加药泵已安装好,具备使用条件。 2.1.1.6准备好托盘天平(最大称量200kg)、电子秤(量程10kg)、250mL量筒、pH试纸和 pH计(配制前标定一次)。 2.1.1.7冲洗方桶 (1)全开生产水导淋阀,手持塑料软管,从桶顶部开口冲洗方桶内壁和底部。 (2)打开方桶的放空龙头,将冲洗水排至地沟。 (3)确认桶内的水无杂色和漂浮杂物后,关闭生产水导淋阀。 (4)关闭放空龙头。 2.1.1.8流程示意图如下。
原料车间过滤系统系统验证方案
1. 目的 通过对该系统作验证,以确保按本工艺流程生产出来的产品质量稳定、安全、均一,以保证生产工艺控制的稳定性。 2. 适用范围 原料药车间脱色粗制岗位、结晶精制岗位所用的物料过滤系统。 3. 责任范围 原料药过滤系统验证小组成员对本方案负责。 4. 概述 我公司精烘包原料车间生产头孢类抗生素无菌原料药,该产品的特点是药效明确,药性稳定、安全、卫生、外观是白色或淡黄色粉末。因此在该产品的整体工艺设计上采用了无菌精精制的生产方式,最终产品采用无菌铝桶包装。我们采用的物料过滤系统工艺方案如下: 反应液1→钛棒过滤器粗滤除碳(1μm)→0.45μm微孔过滤器一级粗滤 →0.22μm微孔过滤器除菌过虑→结晶罐结晶。 反应液2→钛棒过滤器粗滤除碳(1μm)→0.45μm微孔过滤器一级粗滤 →0.22μm微孔过滤器除菌过虑→高位滴加罐→结晶罐结晶。 过滤系统的清洁消毒:用注射用水清洗完毕以后,通入纯蒸汽进行灭菌消毒,要求在纯蒸汽压力≥0.2Mpa条件下,温度121℃30分钟. 5.过虑系统安装确认: 5.1过滤系统组件及设备 过滤系统组件及设备的构成如下:
以上过滤系统组件共有2套。 5.2仪器仪表的校验 过滤系统关键性仪表校验见附件2: 6.过虑系统的运行确认 6.1对本过滤系统工作的验证,在内容上,主要包括以下内容: 验证内容及可接受标准 6.2.1过滤器适应性试验和有效成份的截留验证 6.2.1.1实验对象:以头孢西丁生产成盐反应结晶过程,原料药药物中的活性 成份头孢西丁为验证对象,考察其在过滤前后成份含量的变化。 6.2.1.2可接受标准:见上表“验证内容及可接受标准表”第1项 6.2.1.3检验方法:头孢西丁钠检验操作规程 6.2.1.5验证方法:在头孢西丁钠试生产三批,按头孢西丁钠生产工艺投料生产 时过程取样进行验证 6.2.1.5.1过滤器适应性试验:反应药液经过滤系统过滤完成后,取脱炭滤液与精滤后滤液对比检查其外观,并对过滤器过滤前后进行外观检查,2个系统检查结果见附件3:过滤系统适应性试验结果表 6.2.1.5.2有效成份的截留验证 取脱炭滤液与精滤后滤液对比检查头孢西丁钠含量,实验结果见附表4 6.2.2微生物挑战性实验 验证目的用过滤含有定量指示细菌的培养基,模拟实际过滤工艺的方法来确认
熔体过滤器清洗方法及应急处理
熔体过滤器清洗方法及应急处理 l 熔体过滤器的作用 熔体过滤器的主要功能就是去除生产流程中熔体中的杂质.结块和其他一般性污染物.以使通过熔体过滤器的熔体达到一定的均匀度和纯净度.根据不同的产品要求需要选用不同过滤效果的烛式过滤芯. 2 熔体过滤器的清洗(高温水解法) 清洗的目的是使脏的烛式滤芯上聚合物的残留物尽可能的少.以便进行下一步的TEG清洗和碱洗.熔体过滤器的自清洗分为3个大的步骤.水解.预氧化.氧化.其中水解.预氧化这2个步骤又各分为2个阶段.每个阶段的控制温度都‘所不同.清洗过程温度设定.蒸汽和压缩空气压力设定参数如表l所示. 清洗的步骤: 第1个阶段一水解阶段.启动过热加热器E01.并打开蒸汽阀EV2.用经过过热处理的高温蒸汽作为热载体促进滤芯表面的聚合物进行裂解.将聚合物的分子链打断.使之成为小分子的结构.使其黏度下降.在该过程中.蒸汽同时还有一个作用.就是作为输送载体.将裂解产生的裂解气体和裂解产生聚合物颗粒从滤芯上带走.这时蒸汽同时起了输送介质的作用.该阶段主要目的是将高黏度的熔体进行降黏处理.使包在滤芯上的熔体尽可能地变成小颗粒结构.使后面的预氧化.氧化阶段进行的更充分. 第2个阶段--预氧化阶段.此阶段过热加热器E01温度继续升高.蒸汽阀EV2保持打开状态蒸汽继续加入.在此阶段的第1个小步骤中.打开1个小空气阀EV6,在第2个小步骤中.2个小空气阀EV6.EV5都打开.温度继续升高.在水解阶段完成了基本的裂解反应.在经过了长时间的反应后.滤芯表面的熔体形成了有颗粒特性的蜂窝状结构.继续使用蒸汽难以更彻底地将它们清洗干净.在这种情况下.在蒸汽中加入少量的空气可以使颗粒的表面进行微量的氧化反应.由于要控制氧化反应的过程.所以只能少量的增加氧气的数量.减少进入反应的 氧气的浓度.在第1和第2阶段分别开了1个和2个8 mm的小空气阀. 第3个阶段--氧化阶段.将蒸汽阀EV2关闭.2个8 mm的小空气阀EV6.EV5也关闭.开通了2O mm的大空气阀EV1.这时.比较容易反应的熔体小颗粒已经进行比较完全的氧化反应.部分颗粒较大的在表面已经进行了初步的氧化反应.在氧气的浓度加大后.使氧化反应进行的更为完全.众所周知.化学反应的剧烈程度是和反应物质的浓度密切相关的.自清洗的基本原理就是让包在滤芯上的熔体在水解过程中尽可能地变成小颗粒状的结构.在通入氧气后进行氧化反应.使熔体颗粒在滤芯上进行微量的燃烧.从而达到清洗的目的. 第2个阶段--预氧化阶段和第3个阶段-- 氧化阶段其实主要的反应都是氧化反应.只是氧化反应的环境有所区别.氧气的浓度有所不同.实践证明.在增加了第2个阶段一预氧化阶段后.清洗过程的安全性就变得更加可靠了.清洗过程中有一点要特别注意:氧化阶段就是熔体颗粒在滤芯上进行微量燃烧的阶段!在这个阶段中如果控制稍微出现一点偏差.熔体颗粒在滤芯上进行的燃烧就 会失控.变成剧烈的燃烧.而剧烈的燃烧的结果就是滤芯的损坏.常州华源蕾迪斯聚合物有限公司1998年引进的第一套熔体过滤器装置在2000年的一次清洗中就发生了这样的意外情况.共损坏滤芯37根.直接经济损失就达2O多万元.通过事故的分析认识到.当时是刚进入氧化阶段.氧化反应剧烈地发生并失去控制.而当时又未能及时实施应急措施从而导致了严重的后果.在2001年和2003年引进的装置中就增加了预氧化阶段.使安全性大大提高.在2003年对老装置进行技术改造时.增加了预氧化阶段的控制.到目前为止使用一直正常. 3 注意事项及应急处理 3.1 注意事项
除菌过滤系统验证方案
除菌过滤系统 验证方案 编制人:编制日期: 审核人:审核日期: 批准人:批准日期: 实施日期:
验证方案目录 1.概述及验证方案说明 (4) 1.1概述 (4) 1.2验证目的 (4) 1.3验证实施条件 (4) 2.预确认 (4) 2.1目的 (5) 2.2项目 (5) 2.3小结 (5) 3.安装确认 (5) 3.1目的 (5) 3.2项目 (5) 3.3小结 (6) 4.性能确认 (6) 4.1目的 (6) 4.2项目 (6) 4.2.1过滤速度、过滤能力、对微粒截留效果、物料平衡、清洗效果的确认 (6) 4.2.2对药液质量影响的确认 (8) 4.3小结 (8) 5.异常情况处理程序 (8) 6.验证周期的确认 (9) 附表 2.1预确认检查记录 (10) 3.1安装确认检查记录 (11) 4.1最佳泵速确认记录 (12) 4.2过滤能力确认记录 (13) 4.3系统损耗量及完整性确认记录 (14) 4.4清洗效果确认记录 (15)
4.5过滤效果确认记录 (16) 4.6过滤对药液质量影响确认记录 (17) 4.7性能确认小结 (18)
1.概述及验证方案说明 1.1概述 ****为非最终灭菌的无菌制剂,除菌过滤是整个工艺流程中保证药液无菌的重要环节。我公司在生产中使用的除菌过滤系统由粗滤系统和精滤系统组成,包括滤芯、滤壳、硅胶管、蠕动泵。滤芯为****厂生产的聚醚砜滤芯,规格为5英寸、通过精度为0.2μm;滤壳为先维过滤设备厂生产的316L不锈钢滤筒;硅胶管为美国道康宁公司生产的药用级硅胶管,径为**英寸(**mm),壁厚为**英寸(**mm);蠕动泵为****生产的****型工业蠕动泵。 粗滤系统由滤芯(5英寸,0.2μm),滤壳和两根各****m长硅胶管组成;精滤系统由滤芯(5英寸,0.2μm),滤壳和一根****m长、一根****m长硅胶管组成。 1.2验证目的 通过对设备厂家资质、技术文件、设备材质的检查,及对设备各项性能的试验,证明该设备符合生产工艺要求和GMP规定。 1.3验证实施条件 1.3.1验证用仪器设备及试剂 验证用测试仪器设备及试剂 验证相关文件 2.预确认 2.1目的 2.1.1确认验证实施条件符合验证方案要求
12除菌过滤系统验证方案
22页第1页共 除菌过滤系统验证方案 人:编制编制日期: 审核日期:审核人: 准批人:批准日期:
实施日期: 22页第2页共 验证方案目录4 ..................................................................1.概述及验证方案说明......4 ...............................................................1.1概述..............................4 ............................................................1.2验证目的...........................4 .........................................................1.3验证实施条件 (4) ………………………………………………2.预确认……………………………… 5 ……………………………………………2.1目的…………………………………… 5 …………………………………………2.2项目……………………………………… 5 …………………………………………………………………………………小结2.3 5 ……………………………………………………………………………3.安装确认 5 ………………………………………………………………………3.1目的………… 5 …………………………………………………………………3.2项目……………… 6 ..................................................................3.3小结 (6) ……………………………………………………4.性能确认………………………… 6 ………………………………………………4.1目的…………………………………
几种过滤方案的对比(设计师版)
×××××扩建项目深度处理阶段工艺 项目概况 设计规模2.5万m3/d。变化系数1.42. 进水SS≤20 mg/L,出水SS≤10 mg/L. 深度处理工艺比较 目前用于深度处理的滤池种类较多,如普通快滤池(四阀滤池)、双阀滤池,虹吸滤池、V型滤池、转盘式微过滤器、连续砂过滤器等,其主要差别在于滤料级配及冲洗方式的不同,而二者之间又有着有机的联系。 普通快滤池从1840年问世以来,至今已有一百多年的历史,在国内城市水厂中应用较多,其滤料级配为传统的级配,截污能力不如均质滤料和双层滤料滤池,单独水反冲洗较气水反冲洗耗水量也大,由于污水处理厂沉淀出水中所含的SS粘性大、质轻且易碎,过滤过程中,污泥很快在滤料表面积聚,形成泥封,当加大水头时,污泥又很容易穿透滤层,因此普通快滤池不适合城镇污水处理的深度处理。 V型滤池的优点是截污能力强,采用气水反冲洗,反冲洗强度大,反冲洗彻底,清洗效果好;由于空气擦洗时粒间流速大,颗粒互相冲撞和摩擦作用强烈,清洗效率高,如果采用低速反冲洗,滤层不用流化,因而允许采用较粗粒径的滤料,此外由于反冲洗强度的大大降低,从而减少了反冲洗设备的容量,节约了大量的反冲洗水。 连续砂过滤器和转盘式过滤器作为新型的过滤工艺,它们有过滤水头损失小,占地面积小,运行费用低成本低、可连续运行、施工周期短等优点,因此在工程上引起了越来越多的用户的重视。
下面对V型滤池、连续砂过滤器、转盘式过滤器(这里选用转盘滤池)进行详细的介绍和比较。 1.V型滤池 V型滤池是快滤池的一种形式,因为其进水槽形状呈V字形而得名,也叫做均粒滤料滤池(其滤料采用均质滤料,即均粒径滤料),又叫六阀滤池因为在各种管路上有六个主要阀门,在底部采用带长柄滤头底板的排水系统,不用设砾石承托层。V型进水槽和排水槽分别设于滤池两侧,池子可沿着长的方向发展,布水均匀.反冲洗采用气水反冲洗.反冲洗效果好,大大节省了反冲洗的水量和电耗,整个滤料层在深度方向的粒径分布基本均匀,在反冲洗过程中滤料层不膨胀,不发生水力分级现象,保证深层截污,滤层含污能力高. V型滤池的工作过程 过滤过程:待滤水由进水总渠经进水和方孔后,溢过堰口再经恻孔进入被待滤水淹沿的V型槽,分别经槽底均布的配水孔和V型槽堰顶进入滤池。被均粒滤料层过滤的滤后水经长柄滤头流入底部空间,由方孔汇入气水分配管渠,再经管廊中的水封井,出水堰,清水渠流入清水池。 反冲洗过程:关闭进水阀,但有一部分进水仍从两恻常开的方孔流入滤池,由V型槽一侧流向排水渠一侧,形成表面扫洗。而后开启排水阀将池面水从排水槽中排出直至滤池水面与V型槽顶相平。反冲洗经常采用先气冲再气水同时反冲最后水冲三部;
GXP系列西林瓶超声波清洗机GMP验证方案.doc
武汉大安制药有限公司 验 证 方 案
验证项目:GSP卧式洗瓶机再验证 方案编号: 1、再验证方案 1.1再验证方案起草 1.2再验证方案批准: 批准人:日期:2、概述 本机采用国际经典的低硼硅玻璃管制注射剂瓶清洗方法,即超声波预洗后,再经卧转式针鼓间歇回转清洗,其过程为:循环水纯化水注射用水压缩空气吹洗,来洗净低硼硅玻璃管制注射剂瓶,操作简单实用。本验证文件是针对冻干及小容量注射剂车间GSP卧式洗瓶机进行的再验证。 3、验证目的 证明并保证由本机清洗后的西林瓶符合GMP规定,尤其是符合低硼硅玻璃管制注射剂瓶的可见异物、不溶性微粒标准。 4、职责 4.1验证领导小组 (1)负责验证方案的审批。 (2)负责验证的协调工作,以确保本验证方案规定项目的顺利实施。 (3)负责验证数据及结果的审核。
(4)负责验证报告的审批。 (5)负责发放验证证书。 (6)负责再验证周期的确认。 4.2质保部 (1)负责验证所需的标准品、样品、试剂、试液等的准备。 (2)负责取样及对样品的检验。 (3)负责搜集各项验证、试验记录,并对试验结果进行分析。 4.3生产部 (1)负责拟订验证方案,起草验证报告,报验证领导小组。 (2)负责验证所需仪器、仪表、量具的校正。 (3)负责组织对验证前验证实施参与人员的培训。 (4)负责根据验证实验结果,修订相应操作规程。 (5)负责拟订再验证周期。 5、验证内容 5.1验证前的准备 5.1.1检查确认验证所需文件是否完整且为现行版本。 结论: 确认人:确认日期: 5.1.2检查确认验证所需仪器仪表是否经校验合格并在效期内。 结论: 确认人:确认日期: 5.2设备运行确认 5.2.1设备运转确认 5.2.1.1验证目的:确认GSP卧式洗瓶机在空载运转时是否符合工艺及GMP要求
钛棒过滤器清洁验证方案
XX车间钛棒过滤器清洁验证方案 设备编号:
审批
验证实施小组成员及分工
验证方案目录1. 引言 1.1 概述 1.2 验证目的 1.3 人员培训 1.4 验证周期 1.5 验证进度安排 2. 清洁验证前的准备工作 2.1 验证所需文件 2.2 人员培训文件的检查 3. 执行的清洁规程 4. 最难清洁部位的确定 5. 可接受的残留限度 6. 取样 6.1 取样点的确认 6.2 取样方法 6.3 取样方法的验证 7.化学残留限度检验方法 8.清洁验证实施 9.清洁有效期的确定 10.偏差的处理 11. 评价与分析
1. 引言 1.1 概述:钛棒过滤器系指赋形剂制备系统的脱碳专用的滤器,滤器由套筒、套筒底座、套筒密封圈、O型圈、卡箍、卡箍夹组成,物料与套筒、套筒底座内表面直接接触。 1.2 验证目的:通过试验结果证明所制定的钛棒过滤器的清洁规程能够清除滤器表面上的活性药物残留,使设备的清洗效果达到洁净要求,避免产品被残留物料和微生物污染。 1.3 人员培训 1.4 验证周期: 1.4.1 每年进行一次再验证。 1.4.2 出现下列情况之一时,必须进行清洁规程的再验证: 1.4. 2.1 增加新产品; 1.4. 2.2 钛棒过滤器、生产工艺或清洁规程发生变更; 1.4. 2.3 清洁/污染滤器保留时间发生改变; 1.4. 2.4 清洁剂发生变更。 1.5 验证进度安排:XXXX年XX月XX日——XXXX年XX月XX日 2. 清洁验证前的准备工作 2.1 验证所需文件 2.1.1 检查内容: 2.1.2 检查方法:在文件的存放处现场检查。
保安过滤器滤芯清洗恢复方案(4月11日修改)
神华集团
SHENHUA GROUP
神华包头 煤化工分公司
保安过滤器滤芯清洗恢复 方案
第
技术文件 SBCCC-260-T-39 1 页 共 8
0 版
页
保安过滤器滤芯清洗恢复方案
0 版次 编制部门
供实施 说 明 公用工程中心 编制人 发布日期 审核人 批准人 实施日期 批准日期
本文件知识产权属神华包头煤化工分公司所有,未经授权许可或批准,不得对公司以外任何组织或个人提供;任何外 部组织或个人擅自获取、使用、转让文件的行为均属侵权。 本文件由文件编制部门负责解释。
神华集团
SHENHUA GROUP
神华包头 煤化工公司
保安过滤器滤芯清洗恢复 方案
第
技术文件 SBCCC-260-T-39
2
0
版
页
共
8
页
会签表
会签 工艺组 设备组 运行组 安全组
同意签名
日期
备注
神华集团
SHENHUA GROUP
神华包头 煤化工公司
保安过滤器滤芯清洗恢复 方案
第
技术文件 SBCCC-260-T-39
3
0
版
页
共
8
页
目 1 2 3 编制目的 操作要点 注意事项
录 4 4 8
神华集团
SHENHUA GROUP
神华包头 煤化工公司
保安过滤器滤芯清洗恢复 方案
第
技术文件 SBCCC-260-T-39
4
0
版
页
共
8
页
保安过滤器滤芯清洗恢复方案 保安过滤器滤芯清洗恢复方案
1 编制目的 针对反渗透进水保安过滤器滤芯因水质复杂,压差升高快,使用寿命较短的现状,制定 本清洗方案,通过药剂清洗恢复滤芯的过滤性能,延长使用寿命,确保回用水装置的连 续稳定运行。 2 操作要点 清洗恢复过程总体分为浸泡和冲洗两步,根据使用的药剂不同分为酸洗和碱洗。 2.1 2.1.1 药液配制 配制准备 使用循环水装置的塑料加药方桶浸泡滤芯,使用前需要引好生产水线和搅拌风线,并将 桶内冲洗干净。 2.1.1.1 方桶规格如下:
(1) 长×宽×高=0.85m×1m×0.9m。 (2) 底部带有 DN25 的放空龙头。 (3) 在方桶顶部切 0.5m×0.5m 的方孔,作为配药和浸泡滤芯的入口。 2.1.1.2 2.1.1.3 2.1.1.4 2.1.1.5 2.1.1.6 将方桶放置在前处理加药间排水沟处,将放空龙头对准排水沟。 在前处理加药间东侧生产水倒淋管线处接塑料软管,甩至桶口处。 在前处理加药间东侧的仪表风甩头处接塑料软管,甩至桶口处。 确认前处理间的气动加药泵已安装好,具备使用条件。 准备好托盘天平(最大称量 200kg)、电子秤(量程 10kg)、250mL 量筒、pH 试纸和 pH 计(配制前标定一次)。 2.1.1.7 冲洗方桶
(1) 全开生产水导淋阀,手持塑料软管,从桶顶部开口冲洗方桶内壁和底部。 (2) 打开方桶的放空龙头,将冲洗水排至地沟。 (3) 确认桶内的水无杂色和漂浮杂物后,关闭生产水导淋阀。 (4) 关闭放空龙头。 2.1.1.8 流程示意图如下。
