2020届好教育云平台高三第三次模拟考试卷 化学(三)

2020届好教育云平台高三第三次模拟测试卷
化学(三)
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形
码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂
黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草
稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39
一、选择题(每小题6分,共42分)
7.中国传统文化博大精深,明代方以智的《物理小识》中有关炼铁的记载:“煤则各处产之,臭
者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石,殊为省力。”下列说法中正确的是
A.《物理小识》中记载的是以焦炭作为还原剂的方法来炼铁
B.文中说明以煤炭作为燃料被普遍使用,煤的主要成分为烃
C.生铁是指含硫、磷、碳量低的铁合金
D.工业上可通过煤的干馏获得乙烯、丙烯等化工原料
8.咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
A.咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B.1mol咖啡酸最多能与5mol H2反应
C.咖啡酸分子中所有原子可能共面
D.蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分
子式为C8H10O
9.苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,
并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
+(CH3CO)2O3
AlCl
???→+CH3COOH
N A代表阿伏加德罗常数的值。下列有关说法正确的是
A.气态苯乙酮的密度是气态乙酸密度的2倍
B.1mol苯所含的化学单键数目为12N A
C.0.5mol乙酸酐中含有的电子数目为27N A
D.1L 2mol/L CH3COOH溶液与足量钠反应生成的气体分子数为N A
10.某科研团队研制出“TM-LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件
下氮气和氢气合成NH3的效率,原理示意如下:
下列分析不合理的是
A.状态Ⅰ,吸收能量并有N≡N键发生断裂
B.合成NH3总反应的原子利用率是100%
C.“TM-LiH”能降低合成氨反应的ΔH
D.生成NH3:2LiNH+3H2=2LiH+2NH3
11.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素
中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数
的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
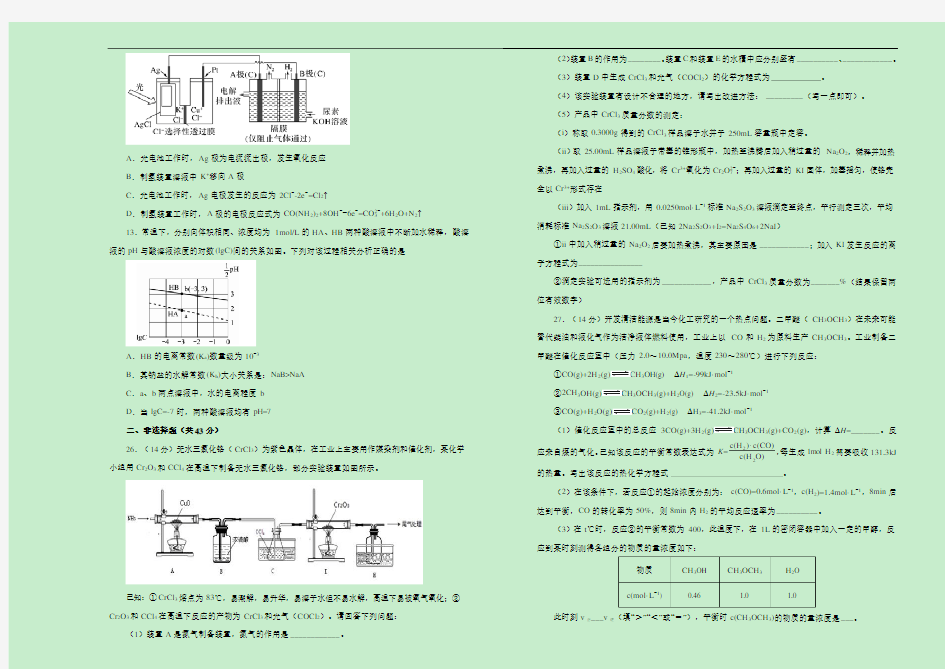
12.在某种光电池中,当光照在表面涂有氯化银的银片上时,发生反应:
AgCl(s)Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:
Cl(AgCl)+e?=Cl?(aq)
+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是此
卷
只
装
订
不
密
封
班
级
姓
名
准
考
证
号
考
场
号
座
位
号
A.光电池工作时,Ag极为电流流出极,发生氧化反应
B.制氢装置溶液中K+移向A极
C.光电池工作时,Ag电极发生的反应为2Cl?-2e?=Cl2↑
D.制氢装置工作时,A极的电极反应式为CO(NH2)2+8OH??6e?=CO2?3+6H2O+N2↑
13.常温下,分别向体积相同、浓度均为1mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lgC)间的关系如图。下列对该过程相关分析正确的是
A.HB的电离常数(K a)数量级为10?3
B.其钠盐的水解常数(K h)大小关系是:NaB>NaA
C.a、b两点溶液中,水的电离程度b D.当lgC=-7时,两种酸溶液均有pH=7 二、非选择题(共43分) 26.(14分)无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。 已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2)。请回答下列问题: (2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。 (3)装置D中生成CrCl3和光气(COCl2)的化学方程式为。 (4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)。 (5)产品中CrCl3质量分数的测定: (i)称取0.3000g得到的CrCl3样品溶于水并于250mL容量瓶中定容。 (ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O2?7;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在 (iii)加入1mL指示剂,用0.0250mol·L?1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2=Na2S4O6+2NaI) ①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________ ②滴定实验可选用的指示剂为____________,产品中CrCl3质量分数为_______%(结果保留两位有效数字) 27.(14分)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol?1 ②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol?1 ③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol?1 (1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K =2 2 c(H)c(CO) c(H O) ,每生成1mol H2需要吸收131.3kJ 的热量。写出该反应的热化学方程式。 (2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L?1,c(H2)=1.4mol·L?1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。 (3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下: 物质CH3OH CH3OCH3H2O c(mol·L?1) 0.46 1.0 1.0 此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。 (4)在(1)小题中催化反应室的总反应3CO(g)+3H 2(g)CH 3OCH 3(g)+CO 2(g),CO 的平衡转化率a(CO)与温度、压强的关系如图所示,图中X 代表___(填“温度”或“压强”),且L 1___L 2(填“>”“<”或“=”) (5)在催化剂的作用下同时进行三个反应,发现随着起始投料比2n(H ) n(CO) 的改变,二甲醚和甲 醇的产率(产物中的碳原子占起始CO 中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因: 。 28.(15分)NiCl 2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe 、Al 等杂质)为原料生产NiCl 2的工艺流程如下: 下表列出了相关金属离子生成氢氧化物沉淀的pH 氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Ni(OH)2 开始沉淀的 pH 2.1 6.5 3.7 7.1 沉淀完全的 pH 3.3 9.7 4.7 9.2 (1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。 (2)加入H 2O 2时发生主要反应的离子方程式为 。 (3)“调pH”时,控制溶液pH 的范围为__________。 (4)“沉镍”过程中,若滤液A 中c(Ni 2+)=1.0mol/L ,欲使100mL 该滤液中的Ni 2+沉淀完全[即溶液中c(Ni 2+)≤1.0×10?5],则需用托盘天平称取Na 2CO 3固体的质量至少为_____g 。(已知K sp (NiCO 3)=6.5×10?6,忽略溶液体积的变化) (5)流程中由溶液得到NiCl 2·6H 2O 的实验操作步骤依次为______、过滤、洗涤、干燥。 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计 分。) 35.【化学——选修3:物质结构与性质】(15分) Al 、Ti 、Co 、Cr 、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题: (1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。 A .[Ne]3s 1 B .[Ne]3s 2 C .[Ne]3s 23p 1 D .[Ne] 3s 13p 2 (2)熔融AlCl 3时可生成具有挥发性的二聚体Al 2Cl 6,二聚体Al 2Cl 6的结构式为_____;(标出配位键)其中Al 的配位数为_________。 (3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有____种。 (4)Co 2+的价电子排布式____________________。NH 3分子与Co 2+结合成配合物[Co(NH 3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小” 或 “相同 ”),解释原因 。 (5)已知CrO 5中铬元素为最高价态,画出其结构式:_________________________。 (6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的X 射线衍射图象分析,可以得出其晶胞如图1所示,图2是该晶胞沿z 轴的投影图,请在图中圆球上涂“●”标明Zn 的位置_____。若晶体中Te 呈立方面心最密堆积方式排列,Te 的半径为a pm ,晶体的密度为ρ g/cm 3,阿伏加德罗常数N A =_____mol ?1(列计算式表达)。 36.【化学——选修5:有机化学基础】(15分) 有机物M 是有机合成的重要中间体,制备M 的一种合成路线如下(部分反应条件和试剂略去): 已知:①A 的密度是相同条件下H 2密度的38倍;其分子的核磁共振氢谱中有3组峰 ② (-NH 2容易被氧化) ③R-CH 2COOH 请回答下列问题: (1)B 的化学名称为______。A 中官能团的电子式为______。 (2)C D 的反应类型是 ,I 的结构简式为 。 (3)F G 的化学方程式为 。 (4)M 不可能发生的反应为______(填选项字母)。 a .加成反应 b .氧化反应 c .取代反应 d .消去反应 (5)请写出任意两种满足下列条件的E 的同分异构体有______。 ①能与FeCl 3溶液发生显色反应 ②能与NaHCO 3反应 ③含有-NH 2 (6)参照上述合成路线,以 为原料(无机试剂任选),设计制备 的合成路线:_______________。 2020届好教育云平台高三第三次模拟测试卷 化学(三)答案 7.【答案】A 【解析】A.由《物理小识》中记载语句“臭者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石”可知是以焦炭作为还原剂的方法来炼铁,A选项正确;B.煤其主要成分为碳、氢、氧和少量的氮、硫或其它元素,而烃只由C、H两种元素组成,B选项错误;C.生铁的含碳量比钢的含碳量较高,故生铁不是指含碳量很低的铁合金,C选项错误;D.工业上可通过石油的裂化、裂解获得乙烯、丙烯等化工原料,D选项错误;答案选A。 8.【答案】B 【解析】A,咖啡酸中含酚羟基能发生取代反应、氧化反应,含碳碳双键能发生加成反应、氧化反应、加聚反应,含羧基能发生取代反应、酯化反应,A项正确;B,咖啡酸中含有1个苯环和1个碳碳双键,苯环和碳碳双键能与H2发生加成反应,1mol咖啡酸最多能与4mol H2发生加成反应,B项错误;C,咖啡酸中碳原子形成1个苯环、1个碳碳双键、1个羧基,其中C原子都为sp2杂化,联想苯、乙烯的结构,结合单键可以旋转,咖啡酸中所有原子可能共面,C项正确;D,由咖啡酸的结构简式写出咖啡酸的分子式为C9H8O4,A为一元醇,蜂胶水解的方程式为C17H16O4(蜂胶)+H2O→C9H8O4(咖啡酸)+A,根据原子守恒,A的分子式为C8H10O,D项正确;答案选B。 9.【答案】C 【解析】A.气态苯乙酮的摩尔质量为120g/mol,气态乙酸的摩尔质量为60g/mol,根 据ρ=m V ,二者气态物质的状态条件未知,体积无法确定,则密度无法确定,故A错误; B.苯的结构中,只有碳氢单键,碳碳之间是一种介于单键与双键之间的一种特殊键,则1个苯分子中有6个单键,1mol苯中含有6mol单键即6N A个,故B错误;C.一个乙酸酐分子中含有54个电子,1mol乙酸酐分子中含有54mol电子,则0.5mol乙酸酐中含有27mol 电子,即电子数目为27N A,故C正确;D.1L 2mol/L CH3COOH的物质的量为2mol,与钠反应生成氢气1mol,足量钠,醋酸消耗完可继续与水反应,则生成的气体分子数大于N A个,故D错误;答案选C。 10.【答案】C 【解析】A.状态Ⅰ为氮气生成LiNH的过程,N≡N键发生断裂要吸收能量,故A正确;B.由流程可知氮气和氢气反应,生成物只有氨气,原子利用率为100%,故B正确;C.催化剂可降低反应的活化能,但不能降低反应物和生成物的总能量,不能改变反应热,故C错误;D.由状态Ⅲ可知生成NH3:2LiNH+3H2=2LiH+2NH3,故D正确。故选C。 11.【答案】B 【解析】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,则X为Na元素;根据结构,W最外层有6个电子,原子序数小于11,则W为O元素;Y最外层有4个电子,原子序数大于11,则Y为Si元素;W的核外电子数为8,与X、Z的最外层电子数之和相等,则Z最外层有7个电子,只能为Cl元素;Y的原子序数是Z的最外层电子数的2倍,符合题意。根据上述分析,W为O元素,X为Na元素,Y为Si元素,Z为Cl元素。A.同一周期,从左向右,非金属性增强,同一主族,从上到下,非金属性减弱,则元素非金属性强弱的顺序为Cl>Si,即Z>Y,故A错误;B.硅为原子晶体,熔点高于钠,即Y单质的熔点高于X单质,故B正确;C.O与Na能够形成氧化钠和过氧化钠2种,故C错误;D.根据,阴离子带2个单位负电荷,其中O都满足8电子稳定结构,故D错误;故选B。 12.【答案】D 【解析】根据题意,左边装置为原电池,右边装置为电解池,原电池中当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s)Ag(s)+Cl(AgCl),接着发生反应:Cl(AgCl)+e?=Cl?(aq)+ AgCl(s),银上的电极反应为AgCl(s)+e?=Ag(s)+Cl?,得电子发生还原反应,所以银作正极、铂作负极。A.左侧Ag电极上得电子作正极、Pt作负极,则Ag电极发生还原反应,故A 错误;B.左侧Ag电极上得电子作正极、Pt作负极,则连接Ag的电极为阳极、连接Pt的电极为阴极,制取氢气装置溶液中阳离子向阴极移动,所以K+移向B电极,故B错误;C.光电池工作时,Ag电极上AgCl得电子生成Ag,电极反应式为AgCl(s)+e?=Ag(s)+Cl?,故C错误;D.制取氢气装置工作时,A电极为阳极,尿素失电子和氢氧根离子反应生成碳酸根离子和氮气、水,电极反应式为CO(NH2)2+8OH??6e?=CO2?3+N2↑+6H2O,故D正确;故选:D。 13.【答案】B 【解析】A .b 点,c=10?3mol·L ?1,c(H +)=10?6mol·L ?1,c(B ?)=10?6mol·L ?1,HB 的电离常数(K a )=10?6×10?6/10?3=10?9,故A 错误;B .与A 同理,K a =10?4×10?4/10?3=10?5,HB 酸性弱,对应的盐水解能力强,故B 正确;C .a 、b 两点溶液中,酸性HB 度大,水的电离程度b>a ,故C 错误;D .当lgC=-7时,HB 中c(H +)==0.1mol·L ?1, HA 中c(H +)==10mol·L ?1,pH 均不为7,故D 错误;故选B 。 26. 【答案】(1)排出空气、吹出CCl 4蒸汽、吹出产物及尾气 (2)除去氮气中水蒸气 热水 冷水 (3)Cr 2O 3+3CCl 42CrCl 3+3COCl 2 (4)将连接装置D 、E 的细导管改成粗导管 (5)除去溶解的氧气,防止将I ?氧化 Cr 2O 2?7+6I ?+14H +=2Cr 3++3I 2+7H 2O 淀粉溶液 92.5 【解析】A 装置中氨气和氧化铜在加热条件下生成氮气,B 装置干燥氮气,C 装置中的CCl 4是反应物,氮气将CCl 4吹入反应装置D 中,E 装置收集制得的产物。(1)氮气的作用是排出空气、吹出CCl 4蒸汽、吹出产物及尾气,故答案为:排出空气、吹出CCl 4蒸汽、吹出产物及尾气;(2)由信息①可知装置D 中必须保持无水环境,故装置B 的作用是干燥氮气;装置C 中热水的作用是使CCl 4汽化,提供反应所需的反应物;装置E 中冷水的作用是冷凝生成的CrCl 3,故答案为:除去氮气中水蒸气;热水;冷水;(3)由题意可知,反应物是Cr 2O 3和CCl 4,产物为CrCl 3和COCl 2,故方程式为:Cr 2O 3+3CCl 42CrCl 3+3COCl 2,故答案为:Cr 2O 3+3CCl 42CrCl 3+3COCl 2;(4)由信息①可知CrCl 3易升华,题中装置图中D 、E 之间的导管太细,易发生堵塞,故应将细导管换成粗导管,故答案为:将连接装置D 、E 的细导管改成粗导管;(5)①溶液中有溶解的氧气,氧气可以氧化I ?,若不除去其中溶解的 氧气使生成的I 2的量增大,产生偏高的误差,故加热煮沸;Cr 2O 2?7和I ? 发生氧化还原生成碘单质和铬离子,离子方程式为:Cr 2O 2?7+6I ?+14H +=2Cr 3++3I 2+7H 2O ,故答案为:除去溶解的氧气,防止将I ?氧化;Cr 2O 2?7+6I ?+14H +=2Cr 3++3I 2+7H 2O ;②利用223Na S O 滴定生成I 2,I 2 遇淀粉显蓝色,所以可以用淀粉作指示剂;设25.00mL 溶液中n(Cr 3+),由Cr 元素守恒及方程式可得关系式:3+ 2- 2722232Cr Cr O 3I 6Na S O ~~~, 27 223 3+22Cr Cr O 3I 6Na S O 6 n Cr 0.0250mol/L 0.021L ?:::() 27 22233+22Cr Cr O 3I 6Na S O 6n Cr 0.0250mol/L 0.021L ?: : :() 故3+ 1 n Cr 0.0250/0.0210.0001753 mol L L mol =??=() ,所以250mL 溶液中Cr 3+的物质的量为0.00175mol ,根据Cr 元素守恒可知3n CrCl =0.00175mol () ,所以样品中3m CrCl 0.00175158.5/0.2774mol g mol g =?=(),故样品中无水三氯化铬的质量分数为: 0.2774100%92.5%0.3000g g ?=,故答案为:淀粉溶液;92.5。 27. 【答案】(1)-262.7kJ·mol ?1 C(s)+H 2O(g)H 2(g)+CO(g) ΔH =+131.3kJ·mol ?1 (2)0.075mol· L ?1·min ?1 (3)> 1.2mol·L ?1 (4)温度 > (5)当投料比大于1时,随着c (H 2)增大,反应①被促进,而反应③被抑制,c (H 2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小 【解析】 (1)催化反应室中的总反应3CO(g)+3H 2(g)CH 3OCH 3(g)+CO 2(g)可按以下方法联立得到:①× 2+②+③,根据盖斯定理,该反应ΔH =-99kJ·mol ?1×2+(-23.5kJ·mol ?1)+(-41.2kJ·mol ?1)= -262.7kJ·mol ?1;根据煤的气化平衡常数表达式以及质量守恒,可写出该反应的化学方程式为:H 2O(g)+C(s) H 2(g)+CO(g),根据生成1mol H 2需要吸收131.3kJ 的热 量可知该反应的ΔH =+131.3kJ?mol ?1,则该反应的热化学方程式为:C(s)+H 2O(g)H 2(g)+CO(g) ΔH =+131.3kJ·mol ?1。答案为:-262.7kJ·mol ?1;C(s)+H 2O(g) H 2(g)+CO(g) △H =+131.3kJ· mol ?1;(2)根据题给数据,CO 的反应量为0.6mol/L×50%=0.3mol/L ,H 2的反应量为0.6mol/L ,则8min 内H 2的平均反应速率为: v (H 2)=0.6/8mol L min =0.075mol?L ?1?min ?1。 答案为:0.075mol?L ?1?min ?1;(3)该时刻反应的浓度熵为:Q c = -1-1 -13322 23m (CH OCH )(H O) 1.0 1.0==4.7(C ol L mol L (0.46mol ) H OH)L c c c ?????<400,平衡正向移动,所以,v 正>v 逆;设平衡时CH 3OCH 3物质的量浓度为x ,则有: 2CH 3OH(g) CH 3OCH 3(g)+H 2O(g) 33322CH OH(g)CH OCH (g)H O(g) 0.46mol L 1mol L 1mol L 20.46mol L 21mol L 1mol L x x x x x x +-++垐?噲?起始///反应平衡/// 3322 23(CH OCH )(H O)(1)(1) ==400(CH OH)(0.462)x c c x x K c ?++?-= ,得x=0.2mol/L ,则平衡时c (CH 3OCH 3) =1mol/L+ 0.2mol/L=1.2mol/L 。答案为:>;1.2mol/L ;(4)根据催化反应室的总反应放热,化学方程式3CO(g)+3H 2(g) CH 3OCH 3(g)+CO 2(g) ΔH =-262.7kJ·mol ?1可知,正向反应气体减少,反 应放热。所以,CO 的平衡转化率a(CO)随温度的升高而减小、随压强的增大而增大,图中曲线随X 增大而减小,可判断X 是温度,则L 1、L 2是压强,且L 1>L 2。答案为:温度;>; (5)结合图象,根据平衡移动原理分析:随着 2(H ) (CO) n n 增大,反应①CO 转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着2(H ) (CO) n n 增大,反应③被抑制,c (H 2O) 增大,进而抑制了反应②;图中二甲醚产率随着2(H ) (CO) n n 增大先增大后减小的原因就是这两种 因素共同作用的结果。题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可解释为:当投料比大于1时,随着c (H 2)增大,反应①被促进,而反应③被抑制,c (H 2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。 28. 【答案】(1)将镍废料磨成粉末(或搅拌,或适当升高温度,或提高酸的浓度) (2)H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O (3)4.7≤pH<7.1或[4.7,7.1) (4)17.5 (5)蒸发浓缩、冷却结晶 【解析】根据流程:金属镍废料(含Fe 、Al 等杂质),加盐酸酸浸后的酸性溶液中主要含有H +、Ni 2+、Fe 2+、Al 3+,加入过氧化氢氧化亚铁离子为铁离子,反应为:H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O ,加入Na 2CO 3溶液调节溶液的pH 范围4.7≤pH<7.1,使Fe 3+、Al 3+全部沉淀,滤渣为Fe(OH)3、Al(OH)3,滤液主要含有Ni 2+,加入Na 2CO 3溶液沉淀Ni 2+,将得到的NiCO 3沉淀用盐酸溶解得到二氧化碳和NiCl 2溶液,将NiCl 2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl 2· 6H 2O ,据此分析作答。(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:将镍废料磨成粉末、搅拌、适当升高温度、提高溶液中酸的浓度,都可以提高镍元素的浸出率;(2)H 2O 2具有氧化性,加入H 2O 2氧化Fe 2+为Fe 3+,离子方程式为:H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O ;(3)“调pH”的目的是沉淀Fe 3+、Al 3+,但不沉淀Ni 2+,根据表格数据可知,应该控制溶液pH 的范围为 4.7≤pH <7.1或[4.7,7.1);(4)滤液A 中 c(Ni 2+)=1.0mol/L ,欲使100mL 该滤液中含有n(Ni 2+)=0.1mol ,则生成NiCO 3需要CO 2?3为 0.1mol ,Ni 2+ 刚好沉淀完全时,溶液中c(CO 2? 3)= 65 6.5101.010 --??=0.65mol/L ,此时溶液中CO 2? 3为0.065mol ,故至少需要 Na 2CO 3固体 0.1mol+0.065mol=0.165mol ,其质量 m(Na 2CO 3)=0.165mol×106g/mol=17.49g≈17.5g ; (5)将NiCl 2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl 2· 6H 2O 。 35. 【答案】(1)D (2) 4 (3)4 (4)3d 7 较大 NH 3通过配位键与Co 2+结合后,原来的孤电子对变为成键电子对,对其他N-H 成键电子对的排斥力减小,N-H 键之间的键角增大 (5) (6) (或Te 与Zn 的位置互换) -1034(65+128) 4a (10)2 ρ?? 【解析】(1)电离最外层的一个电子所需的能量:基态原子>激发态原子,第一电离能<第二电离能<第三电离能, D 为激发态原子,D 状态的铝电离最外层的一个电子所需能量最小,故答案为:D ;(2)熔融AlCl 3时可生成具有挥发性的二聚体Al 2Cl 6,该二聚体由Al 提供空轨道,Cl 原子提供孤电子对形成配位键,其结构式为 ,配合物中的配位 数是指直接同中心离子(或原子)配位的原子数目,二聚体Al 2Cl 6中与Al 直接相连的原子有4个,故Al 的配位数为4,故答案为: ;4;(3)Ti 元素最外层有2个电子, 与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有Sc 、V 、Mn 、Zn ,共4种,故答案为:4;(4)Co 为27号元素,根据构造原理可知其价电子排布式为3d 74s 2,则Co 2+的价电子排布式为3d 7;NH 3分子与Co 2+结合成配合物[Co(NH 3)6]2+,与游离的氨分子相比,NH 3通过配位键与Co 2+结合后,原来的孤电子对变为成键电子对,对其他N-H 成键电子对的排斥力减小,N-H 键之间的键角增大,故答案为:3d 7;较大;NH 3通 过配位键与Co 2+结合后,原来的孤电子对变为成键电子对,对其他N-H 成键电子对的排斥力减小,N-H 键之间的键角增大;(5)已知CrO 5中铬元素为最高价态,则Cr 为+6价,在该化合物中,设-1价氧原子为x 个,-2价氧原子为y 个,则可得x+y=5,x+2y=6,解得x=4,y=1,则该化合物中含有两个过氧键,则其结构式 ,故答案为: ;(6)根 据碲化锌的晶胞结构图可知,该晶胞沿z 轴的投影图为(或Te 与Zn 的位置互 换),根据均摊法可知,在该晶胞中Zn 原子的数目为4,Te 原子的数目为11 8+6=482 ?? ,若晶体中Te 呈立方面心最密堆积方式排列,则晶胞的面对角线为4a pm ,则晶胞的边长为4a pm 2,则晶体的密度-03 31A 4(65+128)=4a (10)2 g/cm N ρ??,阿伏加德罗常数-1 A -1034(65+128) =mol 4a (10)2 N ρ??,故答案为: (或Te 与Zn 的位置互换);-1034(65+128) 4a (10)2 ρ??。 36. 【答案】(1)丙二醛 (2)取代反应 (3)+(CH 3CO)2O +CH 3COOH (4)d (5)、(符合要求均可) (6) 【解析】A的密度是相同条件下H2密度的38倍,则A的相对分子质量为76,其分子的核磁共振氢谱中有3组峰,A能连续被氧化生成二元酸,则A为二元醇,A、B、C中碳原子个数相等,则A为HOCH2CH2CH2OH,B为OHCCH2CHO,C发生取代反应生成D;根据已知②知,E发生还原反应生成F为,F发生取代反应生成G,D 与G发生取代反应生成H,H加热发生已知③的反应生成的I为, I发生取代反应生成M;(1)B为OHCCH2CHO,B的化学名称为丙二醛,A是HOCH2CH2CH2OH,A中官能团为羟基,A中官能团的电子式为;(2)C的结构简式为HOOC-CH2-COOH,D的结构简式为HOOCCHBrCOOH,C与Br2发生取代反应产生HOOC-CHBr-COOH和HBr;I的结构简式为;(3)F发生取代反应生 成G,F→G的化学方程式为+(CH3CO)2O +CH3COOH;(4)a.M中苯环能发生加成反应,a不符合题意;b.酚羟基能发生氧化反应,b不符合题意;c.羧基、酚羟基和肽键都能发生取代反应,c不符合题意;d.羧基、酚羟基和肽键都不能发生消去反应,d符合题意;故合理选项是d;(5)E的同分异构体符合下列条件:①能与FeCl3溶液发生显色反应,说明含有酚羟基;②能与NaHCO3反应,说明含有羧基,③含有-NH2,如果-OH、-COOH相邻,有4种;如果-OH、-COOH相间,有4种;如果-OH、-COOH相对,有2种,所以符合条件的有10种,其中两种同分异构体的结构简 式是:、;(6)以为原料(无机试剂任选), 设计制备的合成路线, 可由对氨基苯甲酸发生缩聚反应得到,氨基可由硝基还原得到,羧基可由醛基氧化得到,醛基可由醇羟基氧化得到,醇羟基可由卤代烃发生水解反应得到,其合成路线为 。
