2 吸收与解吸(讲稿)
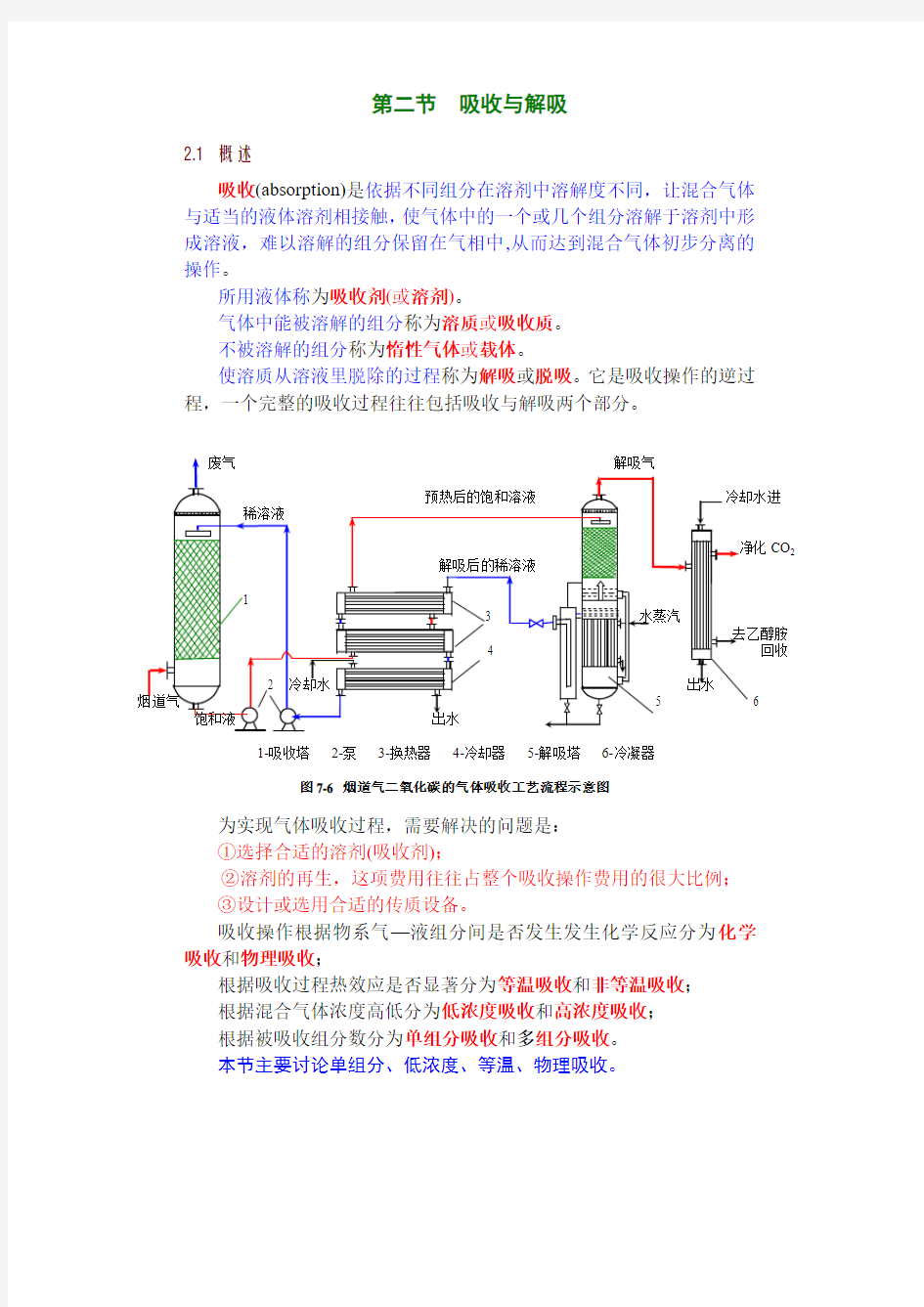
第二节吸收与解吸
2.1 概述
吸收(absorption)是依据不同组分在溶剂中溶解度不同,让混合气体与适当的液体溶剂相接触,使气体中的一个或几个组分溶解于溶剂中形成溶液,难以溶解的组分保留在气相中,从而达到混合气体初步分离的操作。
所用液体称为吸收剂(或溶剂)。
气体中能被溶解的组分称为溶质或吸收质。
不被溶解的组分称为惰性气体或载体。
使溶质从溶液里脱除的过程称为解吸或脱吸。它是吸收操作的逆过程,一个完整的吸收过程往往包括吸收与解吸两个部分。
为实现气体吸收过程,需要解决的问题是:
①选择合适的溶剂(吸收剂);
②溶剂的再生,这项费用往往占整个吸收操作费用的很大比例;
③设计或选用合适的传质设备。
吸收操作根据物系气—液组分间是否发生发生化学反应分为化学吸收和物理吸收;
根据吸收过程热效应是否显著分为等温吸收和非等温吸收;
根据混合气体浓度高低分为低浓度吸收和高浓度吸收;
根据被吸收组分数分为单组分吸收和多组分吸收。
本节主要讨论单组分、低浓度、等温、物理吸收。
2.2 气液相平衡
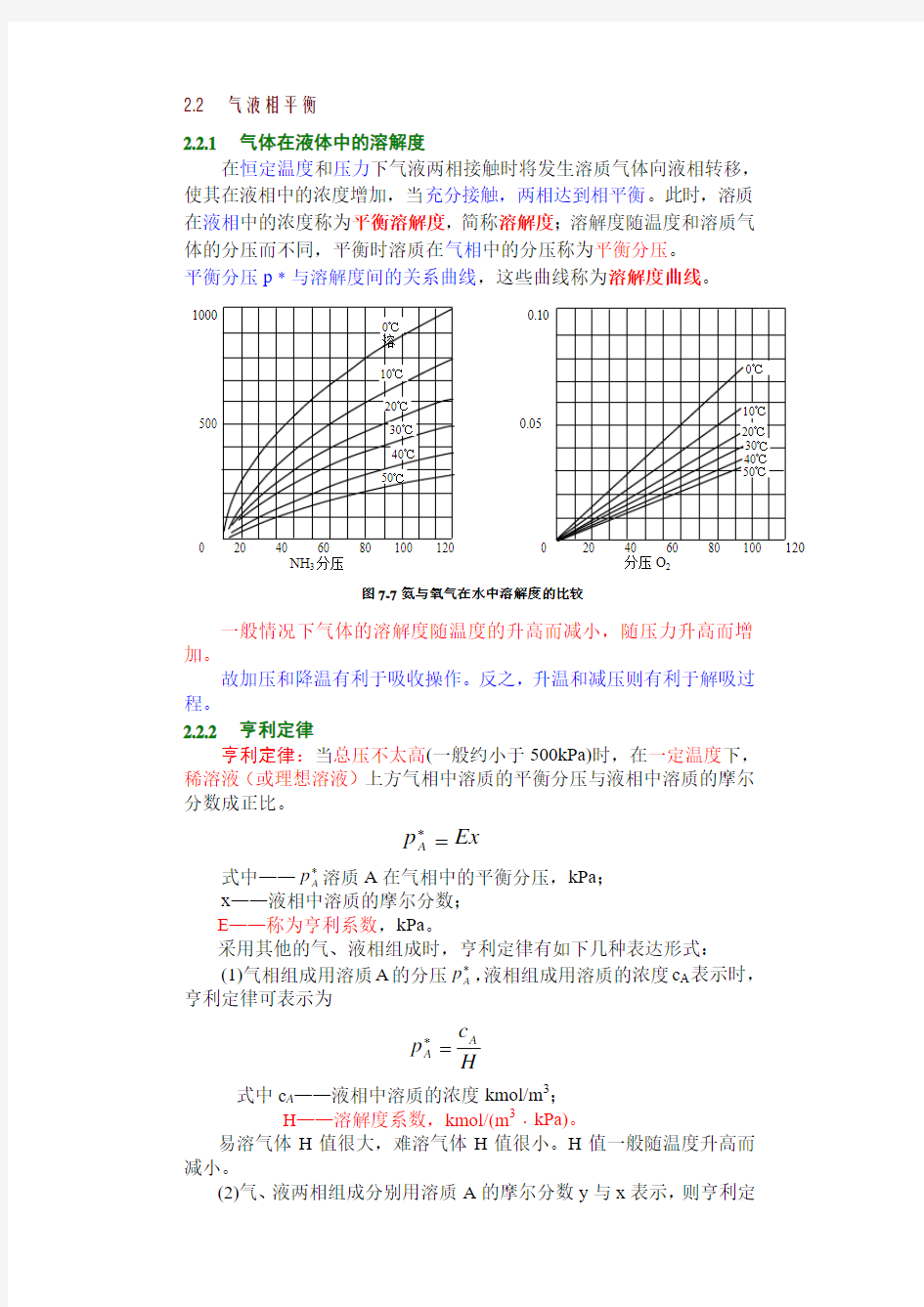
2.2.1 气体在液体中的溶解度
在恒定温度和压力下气液两相接触时将发生溶质气体向液相转移,
使其在液相中的浓度增加,当充分接触,两相达到相平衡。此时,溶质
在液相中的浓度称为平衡溶解度,简称溶解度;溶解度随温度和溶质气
体的分压而不同,平衡时溶质在气相中的分压称为平衡分压。
平衡分压p ﹡与溶解度间的关系曲线,这些曲线称为溶解度曲线。
加。
故加压和降温有利于吸收操作。反之,升温和减压则有利于解吸过
程。
2.2.2 亨利定律
亨利定律:当总压不太高(一般约小于500kPa)时,在一定温度下,
稀溶液(或理想溶液)上方气相中溶质的平衡分压与液相中溶质的摩尔
分数成正比。
Ex p A =*
式中——*
A p 溶质A 在气相中的平衡分压,kPa ;
x ——液相中溶质的摩尔分数;
E ——称为亨利系数,kPa 。
采用其他的气、液相组成时,亨利定律有如下几种表达形式:
(1)气相组成用溶质A 的分压*A p ,
液相组成用溶质的浓度c A 表示时,亨利定律可表示为
H
c p A A =*
式中c A ——液相中溶质的浓度kmol/m 3;
H ——溶解度系数,kmol/(m 3﹒kPa)。
易溶气体H 值很大,难溶气体H 值很小。H 值一般随温度升高而
减小。
(2)气、液两相组成分别用溶质A 的摩尔分数y 与x 表示,则亨利定
律可表示为
y ﹡=mx
式中 y ﹡——溶质在气相中的平衡摩尔分率;
m ——相平衡常数。m 值大,则表示溶解度小。
(3)摩尔比表示气相(X)和液相(Y)的组成时,则亨利定律可表示为: A A X X x +=1 A
A A Y Y y +=1
1,则得气液平衡关系式为
*A Y =mX A
式中 X A ——溶液中溶质的比摩尔分率;
*A Y ——溶质在气相中的平衡比摩尔分率。 2.2.3 亨利定律各系数之间的关系
mP E =
x=C/C m 及C=ρ/M 的定义得: C H C C E EX p m ?=?
==1
所以, 对稀溶液,溶液的浓度接近纯溶济的Ms ≈M m ,
故 s
s
HM E ρ= P HM m s s
ρ≈
上式中,下标“m ”和“S ”分别指混合溶液和溶剂的性质参数,M 指物质分子量。
在压力不太大时,E 与压力无关,H 也几乎不变;而m 随压力增大p 而减小;温度对亨利定律各参数的影响是温度升高时E 一般增大,H 变小,m 增大溶解度降低。
例7-3 总压为101.3kPa 、温度为20℃时,l000kg 水中溶解15kgNH 3,此时溶液上方气相中NH 3的平衡分压为2.266kPa 。试求此时之溶解度系数E 、亨利系数H 、相平衡常数m 。若总压增倍,维持溶液上方气相分率不变,则问此时NH 3的溶解度及各系数的值。
解:首先将此气液相组成换算为y 与x 。
NH 3的摩尔质量为17kg/kmol ,溶液的量为15kgNH 3与1000kg 水之和。故
0156.018/100017/1517/15=+=+==
B A A A n n n n n x 0224.03.101266.2===**P
p y A 436.10156
.00224.0===*
x y m Ex p A =*
E=2.266/0.0156=145.3kPa
溶剂水的密度ρs =1000kg/m 3,摩尔质量M s =18kg/kmol ,
382.018
3.1451000=?==s s EM H ρ (kmol/m 3?Pa ) 若总压增倍,维持溶液上方气相分率不变,则E 不变,H 也几乎不变
m=E/P=436.1/2=0.718
0312.0718.00224.0===
*m y x 18
/100017/17/+=*A A c c x c A =28.55 kg/1000kg 水
2.2.4 相平衡与吸收过程的关系
1)相平衡指明传质过程的方向
p A >*A p ( x A < x A *)为吸收 p A <*
A p ( x A > x A *)为解吸
p A =*
A p ( x A = x A *) 为平衡状态
2)相平衡是过程的极限
在吸收塔的底部,出塔溶液浓度将随吸收剂用量的减少而增大,但即使塔很高、吸收剂用量很小的情况下,x 1也不会无限制增高,其极限即为与气相分压相平衡的溶液浓度x 1﹡即
x 1﹡≤ p A1/E
而在吸收塔的顶部,当以大量吸收剂、在无限高的塔内逆流进行吸
收时,出口气体的浓度p A2也不能无限降低,溶质分压的极限*
2A p 受塔
顶进口液相浓度x 2控制,即
p A2≥*
2A p =Ex 2
3) 相平衡关系可判断吸收过程推动力大小
(p A -*
A p )为以气相分压差表示的吸收过程推动力。
(*
2A x -x A )为以液相浓度差表示的吸收过程推动力。
例7-4在总压100kPa ,温度20℃下,含O 20.21摩尔分数的空气与含为0.005g/L 的水溶液接触,试问:
(1) 将发生吸收还是解吸?
(2) 以分压差表示的推动力为多少?
(3) 如气体与水溶液逆流接触,水中O 2的浓度最高可能达到多少?
解:(1)判别过程方向
气体中的分压:p O2=100×0.21=21 kPa
查表7-5得20℃下O 2溶解在水中的享利系数E 为4.13×106 kPa 。 因为水溶液O 2浓度很低,其密度与平均分子量皆接近纯水,所以溶液的总摩尔浓度c 为
c=ρ/M=998.4/18=55.5kmol/m 3。
O 2在水中的摩尔分数:610815.25
.5532/005.0-?==x 平衡分压:kPa x E p O 63.1110815.21013.4662
=???=?=-*
*>22O O p p 故该过程为O 2由气相转入液相的吸收过程。
(2)推动力
kPa p p p O O 37.963.112122=-=-=?*
(3)吸收过程的极限
出塔水溶液中O 2的浓度将随塔的增高及水量的减少而增大,对逆流吸收操作,出塔水中O 2的浓度最大极限即为与进塔气相分压相平衡的溶液浓度x ﹡即
6610085.51013.4/21/22
-*?=?==E p x O O 水溶液总L gO M n x c O O O /009.0325.5510085.526222=???=??=-*
2.2.5 吸收剂的选择
吸收剂性能是吸收操作良好与否的关键,评价吸收剂性能优劣的依据是:
(1)对需吸收的组分要有较大的溶解度。
(2)对所处理的气体要有较好的选择性。即对溶质的溶解度甚大而对
惰性气体几乎不溶解。
(3)要有较低的蒸汽压,以减少吸收过程中溶剂的挥发损失。要有较好的化学稳定性,以免使用过程中变质。
(4)吸收后的溶剂应易于再生。
(5) 在操作温度下,具有较低的粘度,以利于气、液良好接触及便于输送。
此外,溶剂还应尽可能满足来源丰富、价格低廉、无毒、不易燃烧等经济和安全条件。实际上很难找到一种能够满足所有这些要求的溶剂,因此,对可供选用的溶剂应作经济评价后合理的选取。
2.3 总传质速率方程
总传质速率(N A )即相间传质速率,总传质速率方程式是反映吸收过程进行得快慢的特征量,其推动力是以主体浓度与平衡浓度差为推动力的;对稳定体系来说,总传质速率等于相内传质速率,原则上,根据式(7-10)和(7-11)已可以对传质速率N A 进行计算。但是,这种做法必须引入界面浓度;而界面浓度是难以得到的。与传热过程类似,为实用方便,希望能够避开界面浓度,直接根据气液两相的主体浓度计算相际传质速率N A ,下面我们在传质“双膜模型理论”的基础上讨论总传质速率。
2.3.1 总传质速率方程
在吸收过程中,相际传质是由气相主体至界面的对流传质、界面上溶质组分的溶解、界面至液相主体的对流传质三个步骤串联而成(参见图7-9)。在吸收塔某截面气液两相浓度为y 、x(因讨论的是单组分吸收,故x A 、y A 的下标可省略),则此三个步骤可根据相内传质方程(7—10a)和(7-11a )及相平衡关系分别用以下方程式表征
气膜内传质速率 )(i y A y y k N -=
相界面
)(i i x f y = (平衡服从亨利定律)
i i mx y =
液膜内传质速率 )(x x k N i x A -=
式中y 、x ——溶质的气相与液相主体浓度,以摩尔分率表示;
y i 、x i ——紧贴界面两侧气、液相的溶质浓度,以摩尔分率表示; k y 、k x ——分别为以(y-y i 与(x i -x)为推动力的气相与液相传质分系数,kmol/s?m 2
对稳定吸收体系,各步传质速率相等即为总传质速率,并将上述速率方程写成
N A =推动力/阻力
则 x i y i A k x x k y y N /1/1-=-=
为消去界面浓度,将上式的右端分子、分母同乘以m ,并根据数学上的合比定律得
x y x y i i A k m k y y k m k x x m y y N //1//1)(+-=+-+-=*
于是相际传质速率方程式可表示为
N A =K y (y-y*)
式中 x
y y k m k K //11+= 式即为总传质速率方程,K y 称为以气相浓度差(y-y*)为推动力的总传质系数kmol/s?m 2。类似地也可将式(7-20)中每一项的分子、分母同除以m ,便得到
x
y x y i i A k mk x x k mk x x m y y N /1/1/1/1)(/)(+-=+-+-=* 故相际传质速率方程也可写成
N A =K x (x*-x)
式中 x
y x k mk K /1/11+= K x 称为以气相浓度差(x*-x)为推动力的总传质系数kmol/s?m 2 比较式(7-22)和(7-22a)可知
mK y =K x
同理若以气相分压和液相体积浓度为推动力相际传质速率方程也可写成
N A =K G (p-p*)
N A =K L (c*-c)
式中 L
G G Hk k K 111+= L G L k k H K 11+=
K G = HK L
参照图7-7(b )不难导出解吸的速率方程为
N A =K y (y*-y)
或 N A =K x (x- x*)
这些公式看起来繁多复杂,但只要把握住各自定义,按上述过程进行分析、对比后,并不难掌握。一般用K y 、K x 的形式在吸收计算中用得多,而K G 、K L 得形式则在实验测定等获取传质系数时用得多。
2.3.2 传质阻力
x y y k m k K +=11 即总传质阻力1/K y 为气相阻力1/k y 与液相阻力m/k x 之和。 当y k 1》x
k m 时, K y ≈k y 此时的传质阻力集中于气相,称为气相阻力控制。显然,气相阻力控制的条件是1/>>y x k k 或溶质在吸收剂中的溶解度很大,即平衡线斜率m 很小。
表7-6 传质速率方程的各种形式与关系
总阻力
总推动力=-=*-=*y y A K y y y y N 1)(K
由图7-10(a)可见,此时x x i ≈,界面浓度接近于液相主体浓度,而*y y y y i -=-,即气相传质推动力接近于总推动力。这是由于在定态传质过程中,气液两相的传质速率相等,阻力较大的一相,消耗的推动力就多,其中的浓度差也较大。 若x y k mk 11<<,由式(7-22a )可知 x x k K ≈
此时的传质阻力集中于液相,称为液相阻力控制。液相阻力控制的条件为1/< 由图7-10(b)可见,此时y y i ≈,界面浓度接近于气相主体浓度,而x x x x i -≈-*,液相传质推动力接近于总推动力。 不难看出,传质总推动力在各传递步骤中的分配情况与传热过程极为相似,所不同的是,对于吸收过程,气液平衡关系对各传递步骤阻力的大小及传质总推动力的分配有着极大的影响。易溶气体溶解度大而平衡线斜率m 小,其吸收过程通常为气相阻力控制,例如用水吸收NH 3、便是如此;难溶气体溶解度小而平衡线斜率m 大,其吸收过程多为液相阻力控制,如在通气发酵中,溶解氧的供给是液相阻力控制的吸收过程。分析清楚阻力控制的分配对如何在吸收操作中有效采取措施,提高或降低传质速率有着重要的指导依据。 例7-5 含氨极少的空气于101.33kPa ,20℃被水吸收。已知气膜传质系数k G =3.15×10-6kmol/(m 2?s ?kPa),液膜传质系数k L =1.81×10-4kmol/(m 2?s ?kmol/m 3),溶解度系数H=1.5kmol /(m 3?kPa)。气液平衡关系服从亨利定律。 求:1)气相总传质系数K G 、K Y ;液相总传质系数K L 、K X ; 2)气膜与液膜阻力的相对大小; 3)若气相主体氨浓度的摩尔分率为0.03,液相主体浓度为0.5 kmol/m 3,求界面浓度。 解1)因为物系的气液平衡关系服从亨利定律,故可由式(7—25)求K G ; 54 61024.31081.15.111015.31111?=??+?=+=--L G G Hk k K K G =3.089×10-6kmol /(m 2?s ?kPa) 依题意此系统为低浓度气体的吸收,由表7-6可知 K Y ≈PK G =101.33×3.089×10-6 kmol/(m?s)= 3.13×10-6 kmol /(m 2?s) K L =K G /H=3.089×10-6/1.5=2.06×10-6 kmol /(m 2?s ?kmol/ m 3) 由于溶液浓度极稀,总浓度C 可按纯水来计算。 C ≈ρs /M s =1000/18=55.6 kmol/m 3 K X =cK L =2.06×10-6×55.6=1.15×10-4 kmol /(m 2?s) 2) 气膜阻力=1/k G =1/3.15×10-6=1.942×105 m 2?s ?kPa /kmol 液膜阻力=1/Hk L =1/(1.5×1.81×10-4)=3.683×103 m 2?s ?kPa /kmol 981.010683.3101.942101.9423 55 =?+??=总阻力气膜阻力 由计算结果可见,气膜阻力占总阻力的98.1%,吸收总阻力几乎全部集中于气膜,故属“气膜控制”系统。 3)对稳定吸收过程,由传质基本速率方程得: N A =k G (p-p i ) =k L (c i -c) 即 k G (p-p i ) =k L (c i -c) (A) 在界面处气液相接触处于平衡状态,则 p i =c i /H (B) 其中氨的气相分压为 p=P ?y=101.33×0.03=3.04 kPa 将数据分别代入(A)、(B)得: 3.15×10-6(3.04-p i )= 1.81×10-4(c i -0.5) (A′) p i =c i /1.5 (B′) 上两式联解得: c i =0.547 kmol/m 3, p i =0.364 kPa 即 y i =0.364/101.33=3.592×10-3 二氧化碳填料吸收与解吸实验装置说明书 天津大学化工基础实验中心 2013.06 一、实验目的 1.了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测定数据的处理分析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。 2.掌握填料吸收塔传质能力和传质效率的测定方法,练习对实验数据的处理分析。 二、实验内容 1. 测定填料层压强降与操作气速的关系,确定在一定液体喷淋量下的液泛气速。 2. 固定液相流量和入塔混合气二氧化碳的浓度,在液泛速度下,取两个相差较大的气相流量,分别测量塔的传质能力(传质单元数和回收率)和传质效率(传质单元高度和体积吸收总系数)。 3. 进行纯水吸收二氧化碳、空气解吸水中二氧化碳的操作练习,同时测定填料塔液侧传质膜系数和总传质系数。 三、实验原理: 气体通过填料层的压强降:压强降是塔设计中的重要参数,气体通过填料层压强降的大小决定了塔的动力消耗。压强降与气、液流量均有关,不同液体喷淋量下填料层的压强降P ?与气速u 的关系如图一所示: 图一 填料层的P ?~u 关系 当液体喷淋量00=L 时,干填料的P ?~u 的关系是直线,如图中的直线0。当有 一定的喷淋量时,P ?~u 的关系变成折线,并存在两个转折点,下转折点称为“载点”,上转折点称为“泛点”。这两个转折点将P ?~u 关系分为三个区段:既恒持液量区、载液区及液泛区。 传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。 1.二氧化碳吸收-解吸实验 根据双膜模型的基本假设,气侧和液侧的吸收质A 的传质速率方程可分别表达为气膜 )(Ai A g A p p A k G -= (1) 液膜 )(A Ai l A C C A k G -= (2) 式中:A G —A 组分的传质速率,1-?s kmoI ; A —两相接触面积,m 2; A P —气侧A 组分的平均分压,Pa ; Ai P —相界面上A 组分的平均分压,Pa ; A C —液侧A 组分的平均浓度,3-?m kmol Ai C —相界面上A 组分的浓度3-?m kmol g k —以分压表达推动力的气侧传质膜系数,112---???Pa s m kmol ; l k —以物质的量浓度表达推动力的液侧传质膜系数,1-?s m 。 以气相分压或以液相浓度表示传质过程推动力的相际传质速率方程又可分别表达为: )(*-=A A G A p p A K G (3) )(A A L A C C A K G -=* (4) 式中:*A p —液相中A 组分的实际浓度所要求的气相平衡分压,Pa ; * A C —气相中A 组分的实际分压所要求的液相平衡浓度,3-?m kmol ; G K —以气相分压表示推动力的总传质系数或简称为气相传质总系数, 112---???Pa s m kmol ; 溴化锂吸收式制冷机的工作原理是: 冷水在蒸发器内被来自冷凝器减压节流后的低温冷剂水冷却,冷剂水自身吸收冷水热量后蒸发,成为冷剂蒸汽,进入吸收器内,被浓溶液吸收,浓溶液变成稀溶液。吸收器里的稀溶液,由溶液泵送往热交换器、热回收器后温度升高,最后进入再生器,在再生器中稀溶液被加热,成为最终浓溶液。浓溶液流经热交换器,温度被降低,进入吸收器,滴淋在冷却水管上,吸收来自蒸发器的冷剂蒸汽,成为稀溶液。另一方面,在再生器内,外部高温水加热溴化锂溶液后产生的水蒸汽,进入冷凝器被冷却,经减压节流,变成低温冷剂水,进入蒸发器,滴淋在冷水管上,冷却进入蒸发器的冷水。该系统由两组再生器、冷凝器、蒸发器、吸收器、热交换器、溶液泵及热回收器组成,并且依靠热源水、冷水的串联将这两组系统有机地结合在一起,通过对高温侧、低温侧溶液循环量和制冷量的最佳分配,实现温度、压力、浓度等参数在两个循环之间的优化配置,并且最大限度的利用热源水的热量,使热水温度可降到66℃.以上循环如此反复进行,最终达到制取低温冷水的目的。 溴化锂吸收式制冷机以水为制冷剂,溴化锂水溶液为吸收剂,制取0℃以上的低温水,多用于空调系统。 溴化锂的性质与食盐相似,属盐类。它的沸点为1265℃,故在一般的高温下对溴化锂水溶液加热时,可以认为仅产生水蒸气,整个系统中没有精馏设备,因而系统更加简单。溴化锂具有极强的吸水性,但溴化锂在水中的溶解度是随温度的降低而降低的,溶液的浓度不宜超过66%,否则运行中,当溶液温度降低时,将有溴化锂结晶析出的危险性,破坏循环的正常运行。溴化锂水溶液的水蒸气分压,比同温度下纯水的饱和蒸汽压小得多,故在相同压力下,溴化锂水溶液具有吸收温度比它低得多的水蒸气的能力,这是溴化锂吸收式制冷机的机理之一。 工作原理与循环 溶液的蒸气压力是对平衡状态而言的。如果蒸气压力为0。85kPa的溴化锂溶液与具有1kPa 压力(7℃)的水蒸气接触,蒸气和液体不处于平衡状态,此时溶液具有吸收水蒸气的能力,直到水蒸气的压力降低到稍高于0.85kPa(例如:0。87kPa)为止. 图1 吸收制冷的原理 TAS-990 AFG原子吸收分光光度计确认报告 项目名称:TAS-990 AFG原子吸收分光光度计确认报告 项目编号:YZ(SB)-BG5018 验证形式:TAS-990 AFG原子吸收分光光度计的安装、运行、性能确认 验证日期: 项目签名日期 起草人 审核人 批准人 河南省青山药业有限公司 目录 1、验证小组成员 2、验证小组责任 3、安装确认 4、验证方法及标准 5、验证合格标准 6、运行确认 7、性能确认 8、试验记录及结果处理 9、偏差及处理 10、再验证周期 11、审核意见及建议 12、验证小组签名: 13、批准意见及结论: 14、验证证书 题目TAS-990 AFG原子吸收分光光度计验证方案编码YZ(SB)-BG5018制订人审核人批准人 制订日期年月日审核日期年月日批准日期年月日制定部门质量管理部生效日期年月日目的:本方案规定了TAS-990 AFG原子吸收分光光度计的验证。 范围:本方案适用于对TAS-990 AFG原子吸收分光光度计的设备验证。 职责:验证工作小组:负责本方案的制定和按本方案组织对TAS-990 AFG原子吸收分光 光度计的设备验证; 验证领导小组:负责本方案的批准和监督实施。 内容: 设备名称:TAS-990 AFG原子吸收分光光度计 设备编号: 验证形式:前验证()同步验证() 回顾性验证()再验证() 验证编号:YZ(SB)-BG5018 验证日期:年月日至年月日 1、验证小组成员: 验证小组成员姓名岗位职务 组长质量部 成员化验室 成员化验室 成员化验室 成员质量部 2、验证小组职责: 化验室:负责验证方案的起草;负责按验证方案的要求参与并组织实施验证;负责收集验证记录,对验证结果进行分析,起草验证报告;负责对参与验证的检验人员进行验证方案及操作规程培训;按验证方案,参与验证实验的操作; 质量部:负责监督验证实施的进展情况; 3、安装确认: 概述:原子吸收分光光度计是根据被测元素的基态原子对特征辐射的吸收程度进行定量分析的仪器,其测量原理是基于光吸收定律:KCL - =lg = ) lg( - I T I A= 原子吸收分光光度计是根据质量控制的目的和要求购置的精密仪器,主要用于样品的铬含量的分析测试。该仪器由主机、GFA加热系统、ASC自动进样系统、冷却循环水系统、空压机组成。 确认条件:仪器名称及型号:TAS-990 AFG原子吸收分光光度计;设备编号:5018 产地:北京普析通用仪器有限责任公司 安装位置:精密仪器室环境温度:10~35℃相对温度:20%~80% 电源电压:220V(波动:220V±10%) 50HZ 环境要求:台面水平、有减震垫,无强震动源、无干扰气流、无腐蚀性其他、无强电磁干扰源,避免阳光直射,室内清洁。 通过本验证证明TAS-990 AFG原子吸收分光光度计能够达到设计的技术要求,能够满足日常检验工作的需要,能达到规定的准确度灵敏度。 4、验证方法及标准: 4.1验证前必须对设备所用仪表进行校验,且在有效期内。 4.2验证试验过程中所用的去离子水、标准溶液、空白溶液在使用前必须符合规定。4.3验证试验所用的清洁器具和玻璃容器应按SOP程序清洁并符合要求。 5验证合格标准 第二节吸收与解吸 2.1 概述 吸收(absorption)是依据不同组分在溶剂中溶解度不同,让混合气体与适当的液体溶剂相接触,使气体中的一个或几个组分溶解于溶剂中形成溶液,难以溶解的组分保留在气相中,从而达到混合气体初步分离的操作。 所用液体称为吸收剂(或溶剂)。 气体中能被溶解的组分称为溶质或吸收质。 不被溶解的组分称为惰性气体或载体。 使溶质从溶液里脱除的过程称为解吸或脱吸。它是吸收操作的逆过程,一个完整的吸收过程往往包括吸收与解吸两个部分。 为实现气体吸收过程,需要解决的问题是: ①选择合适的溶剂(吸收剂); ②溶剂的再生,这项费用往往占整个吸收操作费用的很大比例; ③设计或选用合适的传质设备。 吸收操作根据物系气—液组分间是否发生发生化学反应分为化学吸收和物理吸收; 根据吸收过程热效应是否显著分为等温吸收和非等温吸收; 根据混合气体浓度高低分为低浓度吸收和高浓度吸收; 根据被吸收组分数分为单组分吸收和多组分吸收。 本节主要讨论单组分、低浓度、等温、物理吸收。 2.2 气液相平衡 2.2.1 气体在液体中的溶解度 在恒定温度和压力下气液两相接触时将发生溶质气体向液相转移, 使其在液相中的浓度增加,当充分接触,两相达到相平衡。此时,溶质 在液相中的浓度称为平衡溶解度,简称溶解度;溶解度随温度和溶质气 体的分压而不同,平衡时溶质在气相中的分压称为平衡分压。 平衡分压p ﹡与溶解度间的关系曲线,这些曲线称为溶解度曲线。 加。 故加压和降温有利于吸收操作。反之,升温和减压则有利于解吸过 程。 2.2.2 亨利定律 亨利定律:当总压不太高(一般约小于500kPa)时,在一定温度下, 稀溶液(或理想溶液)上方气相中溶质的平衡分压与液相中溶质的摩尔 分数成正比。 Ex p A =* 式中——* A p 溶质A 在气相中的平衡分压,kPa ; x ——液相中溶质的摩尔分数; E ——称为亨利系数,kPa 。 采用其他的气、液相组成时,亨利定律有如下几种表达形式: (1)气相组成用溶质A 的分压*A p , 液相组成用溶质的浓度c A 表示时,亨利定律可表示为 H c p A A =* 式中c A ——液相中溶质的浓度kmol/m 3; H ——溶解度系数,kmol/(m 3﹒kPa)。 易溶气体H 值很大,难溶气体H 值很小。H 值一般随温度升高而 减小。 (2)气、液两相组成分别用溶质A 的摩尔分数y 与x 表示,则亨利定 化工原理氧解吸实验报告 This model paper was revised by the Standardization Office on December 10, 2020 北京化工大学 化原实验报告学院:化学工程学院 姓名:娄铮 学号: 45 班级:环工1302 同组人员:郑豪,刘定坤,邵鑫 课程名称:化工原理实验 实验名称:氧解吸实验 实验日期: 2014-4-15 实验名称:氧解吸实验 报告摘要:本实验首先利用气体分别通过干填料层、湿填料层,测流体流动引起的填料层压降与空塔气速的关系,利用双对数坐标画出关 系。其次做传质实验求取传质单元高度,利用 K x a =G A /(V p △x m )]) ()(ln[) ()x -x (112221e22m e e e x x x x x x ----= ?X G A =L (x 2-x 1)求出 HOL= Ω a K L X 一、实验目的及任务: 1) 熟悉填料塔的构造与操作。 2) 观察填料塔流体力学状况,测定压降与气速的关系曲线。 3) 掌握液相体积总传质系数Kx a 的测定方法并分析影响因素。 学习气液连续接触式填料塔,利用传质速率方程处理传质问题的方法。 二、基本原理: 本装置先用吸收柱使水吸收纯氧形成富氧水后,送入解吸塔顶再用空气进行解吸,实验需要测定不同液量和气量下的解吸液相体积总传质系数K x a ,并进行关联,得到K x a=AL a V b 关联式,同时对四种不同填料的传质效果及流体力学性能进行比较。 1、 填料塔流体力学特性 气体通过干填料层时,流体流动引起的压降和湍流流动引起的压降规律相一致。填料层压降—空塔气速关系示意图如下,在双对数坐标系中,此压降对气速作图可得一斜率为~2的直线(图中aa ’)。当有喷淋量时,在低气速下(c 点以前)压降正比于气速的~2次幂,但大于相同气速下干填料的压降(图中bc 段)。随气速的增加,出现载点(图中c 点),持液量开始 溴化锂吸收式制冷原理 溴化锂吸收式制冷机以水为制冷剂,溴化锂水溶液为吸收剂,制取0℃以上的低温水,多用于空调系统。 溴化锂的性质与食盐相似,属盐类。它的沸点为1265℃,故在一般的高温下对溴化锂水溶液加热时,可以认为仅产生水蒸气,整个系统中没有精馏设备,因而系统更加简单。溴化锂具有极强的吸水性,但溴化锂在水中的溶解度是随温度的降低而降低的,溶液的浓度不宜超过66%,否则运行中,当溶液温度降低时,将有溴化锂结晶析出的危险性,破坏循环的正常运行。溴化锂水溶液的水蒸气分压,比同温度下纯水的饱和蒸汽压小得多,故在相同压力下,溴化锂水溶液具有吸收温度比它低得多的水蒸气的能力,这是溴化锂吸收式制冷机的机理之一。 溴化锂吸收式制冷原理同蒸汽压缩式制冷原理有相同之处,都是利用液态制冷剂在低温、低压条件下,蒸发、气化吸收载冷剂(冷水)的热负荷,产生制冷效应。所不同的是,溴化锂吸收式制冷是利用“溴化 锂一水”组成的二元溶液为工质对,完成制冷循环的。 在溴化锂吸收式制冷机内循环的二元工质对中,水是制冷剂。在真空(绝对压力:870Pa)状态下蒸发,具有较低的蒸发温度(5℃),从而吸收载冷剂热负荷,使之温度降低,源源不断地输出低温冷水。 工质对中溴化锂水溶液则是吸收剂,可在常温和低温下强烈地吸收水蒸气,但在高温下又能将其吸收的水分释放出来。制冷剂在二元溶液工质对中,不断地被吸收或释放出来。吸收与释放周而复始,不断循环,因此,蒸发制冷循环也连续不断。制冷过程所需的热能可为蒸汽,也可利用废热,废汽,以及地下热水(75'C以上)。在燃油或天然气充足的地方,还可采用直燃型溴化锂吸收式制冷机制取低温水。这 些特征充分表现出溴化锂吸收式制冷机良好的经济性能,促进了溴化锂吸收式制冷机的发展。 因为溴化锂吸收式制冷机的制冷剂是水,制冷温度只能在o℃以上,一般不低于5℃,故溴化锂吸收式制冷机多用于空气调节工程作低温冷源,特别适用于大、中型空调工程中使用。溴化锂吸收式制冷机在某些生产工艺中也可用作低温冷却水。 第一节吸收式制冷的基本原理 一、吸收式制冷机基本工作原理 从热力学原理知道,任何液体工质在由液态向气态转化过程必然向周围吸收热量。在汽化时会吸收汽化热。水在一定压力下汽化,而又必然是相应的温度。而且汽化压力愈低,汽化温度也愈低。如一个大气压下水的汽化温度为100~C,而在o.05大气压时汽化温度为33℃等。如果我们能创造一个 压力很低的条件,让水在这个压力条件下汽化吸热,就可以得到相应的低温。 一定温度和浓度的溴化锂溶液的饱和压力比同温度的水的饱和蒸汽压力低得多。由于溴化锂溶液和水之间存在蒸汽压力差,溴化锂溶液即吸收水的蒸汽,使水的蒸汽压力降低,水则进一步蒸发并吸收热量,而使本身的温度降低到对应的较低蒸汽压力的蒸发温度,从而实现制冷。 蒸汽压缩式制冷机的工作循环由压缩、冷凝、节流、蒸发四个基本过程组成。吸收式制冷机的基本工作过程实际上也是这四个过程,不过在压缩过程中,蒸汽不是利用压缩机的机械压缩,而是使用另一种方法完成的。如图2—1所示,由蒸发器出来的低压制冷剂蒸汽先进人吸收器,成在吸收器中用一种液态吸收剂来吸收,以维持蒸发器内的低压,在吸收的过程中要放出大量的溶解热。热量由管内冷却水或其他冷却介质带走,然后用溶液泵将这一由吸收剂与制冷剂混合而成的溶液送人发生器。溶液在发 原子吸收光谱仪高效、精确、可靠 Agilent 200 系列原子吸收系统 2Agilent 240Z AA Agilent 240FS AA 原子吸收解决方案系列 –A gilent 240 AA 将灵活性和硬件的可靠性相结合,为预算有限的用户提供高性价比的高性能火焰/石墨炉/氢化物分析原子吸收仪器 –A gilent 240FS/280FS AA 是快速高效的火焰原子吸收系统,其快速序列式操作可将样品通量增加一倍,从而大幅降低运行成本。它们可以轻松地进行多元素分析,是食品与农业或任何高通量实验室的理想选择 –A gilent 240Z/280Z AA 塞曼石墨炉原子吸收 (GFAA) 系统高效而精确,提供优异的石墨炉性能和准确的背景校正 –A gilent Duo系统可以成倍提高您的工作效率,它能够真正实现火焰和石墨炉同时分析,没有转换延时 安捷伦 AA 系列具有高效、易用和极其可靠的特性。该系列产品具有适用于任何分析所需要的高性能,并且同样适用于重视可靠性和易用性的常规实验室。 高效、精确、可靠 3 Agilent 280FS AA Agilent 280Z AA 满足您的应用需求 安捷伦始终致力于为您的应用提供有效的解决方案。我们的各种技术、平台和专家指导可帮助您 获得成功。 FS 火焰原子吸收系统 240FS/280FS AA + SIPS 20铁、钾、镁和钠FAME (脂肪酸甲酯) 中的钠和钾(SIPS 配件提供自动校准常量元素 银和铂族元素240Z/280Z AA 纯工艺用水中的钠、钙和硅元素 铅、钴和镍 水和土壤中的有毒元素 (US EPA 方法 200.9)电子产品与塑料产品中的铅、镉和铬 (WEEE/RoHs) 氧吸收/解吸系数测定实验报告 一、实验目的 1、了解传质系数的测定方法; 2、测定氧解吸塔内空塔气速与液体流量对传质系数的影响; 3、掌握气液吸收过程液膜传质系数的实验测定方法; 4、关联圆盘塔液膜传质系数与液流速率之间的关系; 4、掌握VOC 吸收过程传质系数的测定方法。 二、实验原理 1) 吸收速率 吸收是气、液相际传质过程,所以吸收速率可用气相内、液相内或两相间传质速率表示。在连续吸收操作中,这三种传质速率表达式计算结果相同。对于低浓度气体混合物单组分物理吸收过程,计算公式如下。 气相内传质的吸收速率: )(i y A y y F k N -= 液相内传质的吸收速率: )(x x F k N i x A -= 气、液相相际传质的吸收速率: )()(**x x F K y y F K N x y A -=-= 式中:y ,y i ——气相主体和气相界面处的溶质摩尔分数; x ,x i ——液相主体和液相界面处的溶质摩尔分数; x *,y *——与x 和y 呈平衡的液相和气相摩尔分数; k x ,K x ——以液相摩尔分数差为推动力的液相分传质系数和总传质系数; k y ,K y ——以气相摩尔分数差为推动力的气相分传质系数和总传质系数; F ——传质面积,m 2。 对于难溶气体的吸收过程,称为液膜控制,常用液相摩尔分数差和液相传质系数表达吸收速率式。 对于易溶气体的吸收过程,称为气膜控制,常用气相摩尔分数差和气相传质系数表达吸收速率式。 本实验为一解吸过程,将空气和富氧水接触,因富氧水中氧浓度高于同空气处于平衡的水中氧浓度,富氧水中的氧向空气中扩散。解吸是吸收的逆过程,传质方向与吸收相反,其 原理和计算方法与吸收类似。但是传质速率方程中的气相推动力要从吸收时的(y -y * )改为 解吸时的(y *-y ),液相推动力要从吸收时的(x *-x )改为解吸时的(x -x * )。 2) 吸收系数和传质单元高度 吸收系数和传质单元高度是反映吸收过程传质动力学特性的参数,是吸收塔设计计算的必需数据。其数值大小主要受物系的性质、操作条件和传质设备结构形式及参数三方面的影响。由于影响因素复杂,至今尚无通用的计算方法,一般都是通过实验测定。 本实验计算填料解吸塔的体积传质系数K x a (kmol/(m 3 ·h))的公式如下: 原子吸收分光光度计试卷 答卷人:评分: 一、填空题(共15 分1 分/空) 1. 为实现峰值吸收代替积分吸收测量,必须使发射谱线中心与吸收谱线中心完全重合,而且发射谱线的宽度必须比吸收谱线的宽度窄。 2. 在一定条件下,吸光度与试样中待测元素的浓度呈正比,这是原子吸收定量分析的依据。 3. 双光束原子吸收分光光度计可以减小光源波动的影响。 4. 为了消除火焰发射的干扰,空心阴极灯多采用脉冲方式供电。 5. 当光栅(或棱镜)的色散率一定时,光谱带宽由分光系统的出射狭缝宽度来决定。 6. 在火焰原子吸收中,通常把能产生1%吸收的被测元素的浓度称为特征浓度。 7. 与氘灯发射的带状光谱不同,空心阴极灯发射的光谱是线状的光谱。 8. 用原子吸收分析法测定饮用水中的钙镁含量时,常加入一定量的镧离子,其目的是消除磷酸根离子的化学干扰。 9. 使用火焰原子吸收分光光度法时,采用乙炔-空气火焰,使用时应先开空气,后开乙炔。 10. 待测元素能给出三倍于空白标准偏差的吸光度时的浓度称为检出限。 11. 采用氘灯校正背景时,空心阴极灯测量的是原子吸收+背景吸收(或AA+BG)信号,氘灯测量的是背景吸收(或BG)信号。 12、空心阴极灯灯电流选择的原则是在保证放电稳定和有适当光强输出的情况下,尽量选择低的工作电流。 二、选择题(共15 分1.5 分/题) 1.原子化器的主要作用是( A )。 A.将试样中待测元素转化为基态原子; B.将试样中待测元素转化为激发态原子; C.将试样中待测元素转化为中性分子; D.将试样中待测元素转化为离子。 2.原子吸收的定量方法—标准加入法,消除了下列哪种干扰?( D ) A.分子吸收B.背景吸收C.光散射D.基体效应 3.空心阴极灯内充气体是( D )。 A.大量的空气 B. 大量的氖或氮等惰性气体 C.少量的空气D.低压的氖或氩等惰性气体 4.在标准加入法测定水中铜的实验中用于稀释标准的溶剂是。(D ) A.蒸镏水 B.硫酸 C.浓硝酸 D.(2+100)稀硝酸 5.原子吸收光谱法中单色器的作用是( B )。 A.将光源发射的带状光谱分解成线状光谱; B.把待测元素的共振线与其它谱线分离开来,只让待测元素的共振线通过;C.消除来自火焰原子化器的直流发射信号; D.消除锐线光源和原子化器中的连续背景辐射 6.下列哪个元素适合用富燃火焰测定?( C ) A.Na B.Cu C. Cr D. Mg 7.原于吸收光谱法中,当吸收为1%时,其对应吸光度值应为( D )。 A.-2 B.2 C.0.1 D.0.0044 8.原子吸收分析法测定钾时,加入1%钠盐溶液其作用是( C )。 A.减少背景B.提高火焰温度 C.减少K 电离D.提高K 的浓度 9.原子吸收光谱法中的物理干扰可用下述哪种方法消除?( D ) A.释放剂B.保护剂C.缓冲剂D.标准加入法 10.下列哪一个不是火焰原子化器的组成部分?(A ) A.石墨管 B.雾化器 C.预混合室 D.燃烧器 三、简答题(共30 分) 1.用火焰原子吸收法测定水样中钙含量时,PO43-的存在会干扰钙含量的准确测定。请说明这是什么形式的干扰?如何消除?(8 分) 二氧化碳吸收与解吸实验 一、实验目的 1.了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测定数据的处理分析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。 2.掌握填料吸收塔传质能力和传质效率的测定方法,练习实验数据的处理分析。 二、实验内容 1. 测定填料层压强降与操作气速的关系,确定在一定液体喷淋量下的液泛气速。 2. 固定液相流量和入塔混合气二氧化碳的浓度,在液泛速度下,取两个相差较大的气相流量,分别测量塔的传质能力(传质单元数和回收率)和传质效率(传质单元高度和体积吸收总系数)。 3. 进行纯水吸收二氧化碳、空气解吸水中二氧化碳的操作练习,同时测定填料塔液侧传质膜系数和总传质系数。 三、实验原理: 气体通过填料层的压强降:压强降是塔设计中的重要参数,气体通过填料层压强降的大小决定了塔的动力消耗。压强降与气、液流量均有关,不同液体喷淋量下填料层的压强降P ?与气速u 的关系如图一所示: 1 2 3 L 3L 2L 1 L 0 = >>0 图一 填料层的P ?~u 关系 当液体喷淋量00=L 时,干填料的P ?~u 的关系是直线,如图中的直线0。 ΔP , k P a 当有一定的喷淋量时,P ?~u 的关系变成折线,并存在两个转折点,下转折点称为“载点”,上转折点称为“泛点”。这两个转折点将P ?~u 关系分为三个区段:既恒持液量区、载液区及液泛区。 传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。 1.二氧化碳吸收-解吸实验 根据双膜模型的基本假设,气侧和液侧的吸收质A 的传质速率方程可分别表达为 气膜 )(Ai A g A p p A k G -= (1) 液膜 )(A Ai l A C C A k G -= (2) 式中:A G —A 组分的传质速率,1-?s kmoI ; A —两相接触面积,m 2 ; A P —气侧A 组分的平均分压,Pa ; Ai P —相界面上A 组分的平均分压,Pa ; A C —液侧A 组分的平均浓度,3-?m kmol Ai C —相界面上A 组分的浓度3-?m kmol g k —以分压表达推动力的气侧传质膜系数,112---???Pa s m kmol ; l k —以物质的量浓度表达推动力的液侧传质膜系数,1-?s m 。 以气相分压或以液相浓度表示传质过程推动力的相际传质速率方程又可分别表达为: )(*-=A A G A p p A K G (3) )(A A L A C C A K G -=* (4) 式中:*A p —液相中A 组分的实际浓度所要求的气相平衡分压,Pa ; * A C —气相中A 组分的实际分压所要求的液相平衡浓度,3-?m kmol ; G K —以气相分压表示推动力的总传质系数或简称为气相传质总系数,112---???Pa s m kmol ; 溴化锂吸收式制冷机的工作原理是: https://www.360docs.net/doc/07211380.html,/showProduct.asp?f_id=737 冷水在蒸发器内被来自冷凝器减压节流后的低温冷剂水冷却,冷剂水自身吸收冷水热量后蒸发,成为冷剂蒸汽,进入吸收器内,被浓溶液吸收,浓溶液变成稀溶液。吸收器里的稀溶液,由溶液泵送往热交换器、热回收器后温度升高,最后进入再生器,在再生器中稀溶液被加热,成为最终浓溶液。浓溶液流经热交换器,温度被降低,进入吸收器,滴淋在冷却水管上,吸收来自蒸发器的冷剂蒸汽,成为稀溶液。另一方面,在再生器内,外部高温水加热溴化锂溶液后产生的水蒸汽,进入冷凝器被冷却,经减压节流,变成低温冷剂水,进入蒸发器,滴淋在冷水管上,冷却进入蒸发器的冷水。该系统由两组再生器、冷凝器、蒸发器、吸收器、热交换器、溶液泵及热回收器组成,并且依靠热源水、冷水的串联将这两组系统有机地结合在一起,通过对高温侧、低温侧溶液循环量和制冷量的最佳分配,实现温度、压力、浓度等参数在两个循环之间的优化配置,并且最大限度的利用热源水的热量,使热水温度可降到66℃。以上循环如此反复进行,最终达到制取低温冷水的目的。 溴化锂吸收式制冷机以水为制冷剂,溴化锂水溶液为吸收剂,制取0℃以上的低温水,多用于空调系统。 溴化锂的性质与食盐相似,属盐类。它的沸点为1265℃,故在一般的高温下对溴化锂水溶液加热时,可以认为仅产生水蒸气,整个系统中没有精馏设备,因而系统更加简单。溴化锂具有极强的吸水性,但溴化锂在水中的溶解度是随温度的降低而降低的,溶液的浓度不宜超过66%,否则运行中,当溶液温度降低时,将有溴化锂结晶析出的危险性,破坏循环的正常运行。溴化锂水溶液的水蒸气分压,比同温度下纯水的饱和蒸汽压小得多,故在相同压力下,溴化锂水溶液具有吸收温度比它低得多的水蒸气的能力,这是溴化锂吸收式制冷机的机理之一。 工作原理与循环 溶液的蒸气压力是对平衡状态而言的。如果蒸气压力为0.85kPa的溴化锂溶液与具有1kPa 压力(7℃)的水蒸气接触,蒸气和液体不处于平衡状态,此时溶液具有吸收水蒸气的能力,直到水蒸气的压力降低到稍高于0.85kPa(例如:0.87kPa)为止。 图1 吸收制冷的原理 ①检查雾室的废液是否畅通无阻,如果有水封,一定要设法排除后再进行点火; ②防止“回火”点火的操作顺序为先开助燃气,后开燃气;熄灭顺序为先关燃气,待火熄灭后再关助燃气。一旦发生“回火”,应镇定地迅速关闭燃气,然后关闭助燃气,切断仪器的电源。若回火引燃了供气管道及附近物品时,应采用CO2灭火器灭火。 (2)采用石墨炉原子吸收光谱法测定时的注意事项主要注意冷却水的使用,首先接通冷却水源,待冷却水正常流通后方可开始执行下一步的操作。 (3)空心阴极灯的维护当发现空心阴极灯的石英窗口有污染时,应用脱脂棉蘸无水乙醇擦拭干净。 (4)供气管道的检漏当发现有漏气时,可采用简易的肥皂水检漏法或检漏仪检漏。 (5)燃烧器的维护当燃烧器的缝口存积盐类时,火焰可能出现分叉,这时应当熄灭火焰,用滤纸插入缝口擦拭,或用刀片插入缝口轻轻刮除积盐,或用水冲洗。 (6)雾化器的金属毛细管的检修当雾化器的金属毛细管被堵塞时,可用软而细的金属丝疏通或用洗耳球从出样口吹出堵塞物。 一、对于各种样品都有最适应它的分析方法,要了解原子吸收光谱法的应用范围,考虑它的适应性 众所周知,石墨炉原子吸收的绝对检出限值是很高的,单从这一点来看,有人错误地认为浓度高的样品用石墨炉原子吸收法也能够测定,或者错误地认为石墨炉原子吸收法测定的动态范围很宽,并有很高的精度。 例如:一个厂家在购买仪器时,认为还是检出限指标好的仪器好,觉得能测定低浓度的溶液当然也就一定能够测定高浓度的溶液。但是,当买回仪器一用才明白,这种判断是错误的,对于高浓度的溶液必须稀释到适当的浓度范围才能测定。因此,对于高浓度样品的测定来说,选用高精度的测定方法,如选用分光光度法比选用原子吸收法进行测定要好。这是因为原子吸收光谱法是测量光的吸收,而吸收线和空心阴极灯的发射线的半宽度之比不过10左右,所以不能像发射光谱法那样,同时测定浓度范围很宽的样品。 二、绘制正确的工作曲线 由于原子吸收法的线性范围窄,因此绘制正确的工作曲线就显的尤为重要。在做工作曲线时要注意以下几点: (1)绘制一条工作曲线至少要取5至7点,并且每一个点要重复测定两次或多次,直到平行样的测定值满足要求后,再进行下一个点的测定。 (2)标准样品和待测样品必须使用相同的溶剂系统。 北京化工大学 化原实验报告 学院:化学工程学院 姓名:娄铮 学号: 2013011345 班级:环工1302 同组人员:郑豪,刘定坤,邵鑫 课程名称:化工原理实验 实验名称:氧解吸实验 实验日期: 2014-4-15 实验名称: 氧 解 吸 实 验 报告摘要:本实验首先利用气体分别通过干填料层、湿填料层,测流体流动引起的填料层压 降与空塔气速的关系,利用双对数坐标画出关系。其次做传质实验求取传质单元高度,利用 K x a =G A /( V p △x m )]) ()(ln[) ()x -x (112221e22m e e e x x x x x x ----=?X G A =L (x 2-x 1)求出 H OL = Ω a K L X 一、实验目的及任务: 1) 熟悉填料塔的构造与操作。 2) 观察填料塔流体力学状况,测定压降与气速的关系曲线。 3) 掌握液相体积总传质系数K x a 的测定方法并分析影响因素。 学习气液连续接触式填料塔,利用传质速率方程处理传质问题的方法。 二、基本原理: 本装置先用吸收柱使水吸收纯氧形成富氧水后,送入解吸塔顶再用空气进行解吸,实验需要测定不同液量和气量下的解吸液相体积总传质系数K x a ,并进行关联,得到K x a =AL a V b 关联式,同时对四种不同填料的传质效果及流体力学性能进行比较。 1、 填料塔流体力学特性 气体通过干填料层时,流体流动引起的压降和湍流流动引起的压降规律相一致。填料层压降—空塔气速关系示意图如下,在双对数坐标系中,此压降对气速作图可得一斜率为1.8~2的直线(图中aa ’)。当有喷淋量时,在低气速下(c 点以前)压降正比于气速的1.8~2次幂,但大于相同气速下干填料的压降(图中bc 段)。随气速的增加,出现载点(图中c 点),持液量开始增大,压降—气速线向上弯,斜率变陡(图中cd 段)。到液泛点(图中d 点)后,在几乎不变的气速下,压降急剧上升。 2、传质实验 在填料塔中,两相传质主要在填料有效湿表面上进行,需要计算完成一定吸收任务所需的填料高度,其计算方法有传质系数、传质单元法和等板高度法。 本实验是对富氧水进行解吸,如图下所示。由于富氧水浓度很低,可以认为气液两相平衡关系服从亨利定律,及平衡线位置线,操作线也是直线,因此可以用对数平均浓 l g △p 原子吸收分光光度计的结构说明 原子吸收分光光度计分为单光束型和双光束型。其结构可分为五个部分:光源、原子化器、光学系统、检测系统与数据处理系统。1、光源 为测出待测元素的峰值吸收,须采用锐线光源,应满足以下一些要求:辐射强度大、辐射稳定、发射普线宽度窄。空心阴极灯是目前原子吸收光谱仪器使用的主光源,属于辉光放电气体光源。 空心阴极灯是一种由被测元素或含有被测元素的材料制成的圆筒形空心阴极和一个阳极(钨、钛或锆棒),密封在充有低压惰性气体的带有石英窗的玻璃壳内的电真空器件。 当在两极之间施加几百伏的高压,两极之间会产生放电,电子将从空心阴极内壁射向阳极,并在电子的通路上又与惰性气体原子发生碰撞并使之电离,带正电荷的惰性气体离子在电场的作用下,向阴极内壁猛烈地轰击,使阴极表面的金属原子溅射出来,而这些溅射出来的金属原子再与电子、惰性气体原子及离子发生碰撞并被激发,于是阴极内的辉光便出现了阴极物质的光谱。 空心阴极灯的阴极材料的纯度必须很高,内充气体也必须为高纯,以保证阴极元素的共振线附近不含内充气体或杂质元素的强谱线。 空心阴极灯的操作参数是灯电流,灯电流的大小可决定其所发射的谱线的强度。但是需根据具体操作情况来选择灯电流的大小。 通常情况下,空心阴极灯在使用前需预热10~15min。 2、原子化系统 原子吸收光谱中常用的原子化技术是:火焰原子化和电热原子化。此外还有一些特殊的原子化技术如氢化发生法、冷原子蒸气原子化等。 1)火焰原子化系统——火焰原子化器 火焰原子化器由雾化器、雾化室、燃烧器三部分组成。常见的燃烧器有全消耗型和预混合型。目前主要使用的是预混合型燃烧器。 2)、电热原子化系统——石墨炉原子化器 非火焰原子化器中适用广的是管式石墨炉原子化器。组成部分为:石墨管、炉体、电源。样品直接放置在管壁上或放置在嵌入管内的石墨平台上,用电加热至高 原子吸收实验室基本要求 一、仪器室环境要求: 1.要有一个单独房间放置仪器。 2.室内有通风设备,抽气量1700-2500L/min,罩口高仪器通风窗40cm。 3.室内温度:15-30℃,湿度≤80%,(最好配有温湿度计监制),有空调,防尘条件较好, 没有腐蚀性气体,室内不要有强烈震动和强烈电磁干扰。 4.电压:220V±10%,频率50Hz±1Hz,有良好的接地线。 5.工作台:长2.5×宽0.8平方米,高80cm,离墙50cm的大理石或水泥平台,贴面有橡 皮板。 6.电脑一台(操作系统为WinXP),打印机一台。 二、化学处理室的要求及配套设备: 应用原子吸收分光光度计分析前,必须对样品进行预处理。如果有的单位已有化学分析室,一般就可以利用原来的设备,缺什么再添什么,如果没有化学试验室,要从事原子吸收分析,要具备以下基本条件(是分析对象定): 1.空心阴极灯:根据所要测元素配相应的空心阴极灯,另外购买。 2.标准溶液:根据要测的元素进行配置相应元素的标准溶液,另外购买。 3.乙炔气源:钢瓶装乙炔,配有减压阀和防回火装置,纯度99.6%以上。(减压器用户自备) 4.玻璃器皿:数量根据实际情况和工作量采购,容量瓶(200mL,100 mL,50Ml),烧杯 (150mL,200mL),试管(10mL),移液管(1mL,2mL,5mL, 10mL),微量滴定管(含支架5mL,,10mL),量筒(500mL),蒸馏水平。 5.万分之一天平一台。 6.电热板1KV以上,马福炉KV 7.烘箱1KV以上(根据需要) 8.超纯水器 9.盐酸,硝酸,硫酸,高铬酸,若配氢化物发生器需要必备相关的化学试剂。 10.最好配有功率3KV以上精密净化稳压电源。 11.接线板(三插头)2付,一付固定墙上,另一付可移动。 12.标准液柜,以便放置标准溶液和样品及仪器配件。 氧化碳吸收与解吸实验 一、 实验目的 1. 了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测 定数据的处理分析,加深对填料塔流体力学性能基本理论的理解, 加深对填料塔传 质性能理论的理解。 2. 掌握填料吸收塔传质能力和传质效率的测定方法,练习实验数据的处理分析。 二、 实验内容 1. 测定填料层压强降与操作气速的关系,确定在一定液体喷淋量下的液泛气速。 2. 固定液相流量和入塔混合气二氧化碳的浓度,在液泛速度下,取两个相差较 大的气相流量,分别测量塔的传质能力(传质单元数和回收率)和传质效率(传 质单元高度和体积吸收总系数)。 3. 进行纯水吸收二氧化碳、空气解吸水中二氧化碳的操作练习,同时测定填料 塔液侧传质膜系数和总传质系数。 三、 实验原理: 气体通过填料层的压强降:压强降是塔设计中的重要参数,气体通过填料层压强 降的大小决定了塔的动力消耗。压强降与气、液流量均有关,不同液体喷淋量下 填料层的压强降JP 与气速U 的关系如图一所示: 图一填料层的P ?U 关系 当液体喷淋量L o =0时,干填料的丄P ?U 的关系是直线,如图中的直线 当有一定的喷淋量时,厶P?U的关系变成折线,并存在两个转折点,下转折点称为“载点”,上转折点称为“泛点”。这两个转折点将P?U关系分为三个区段:既恒持液量区、载液区及液泛区。 传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。 1. 二氧化碳吸收-解吸实验 根据双膜模型的基本假设,气侧和液侧的吸收质A的传质速率方程可分别表达为气膜G A = k g A( P A - P Ai) ( 1) 液膜G^k I A(C Ai -C A) (2) 式中:G A —A组分的传质速率,kmoI S J; A —两相接触面积,m; P A —气侧A组分的平均分压,Pa; P Ai —相界面上A组分的平均分压,Pa; C A—液侧A组分的平均浓度,kmol m j3 C Ai —相界面上A组分的浓度kmol m J3 k g —以分压表达推动力的气侧传质膜系数,kmol m^ s^1 Pa j; kι—以物质的量浓度表达推动力的液侧传质膜系数,m S J。 以气相分压或以液相浓度表示传质过程推动力的相际传质速率方程又可分别表 达为:G A=K G A(P A-P A)(3) G A=K L A(C A -C A)(4) 式中:P A —液相中A组分的实际浓度所要求的气相平衡分压,Pa; C A —气相中A组分的实际分压所要求的液相平衡浓度,kmol m^ ; K G —以气相分压表示推动力的总传质系数或简称为气相传质总系数, kmol m ^2SV Pa 4; 新疆医科大学卫生化学教学大纲供预防医学类专业用) 编写者:哈及尼沙 药学院分析/ 药分教研室 2012年12月 I 前言 课程名称:卫生化学英文名称:Sanitary Chemistry 课程类别:专业基础课(必修) 面向专业:预防医学专业(本科)选用教材:《卫生化学》(第六版),郭爱民主编出版单位:人民卫生出版社 学时:54 学时(理论课36 学时,实验课18 学时) 卫生化学(Sanitary chemistry)是高等医学教育预防医学专业学生必修的专业基础课。是探讨和研究预防医学中所需要的检验方法、理论和新分析技术的一门学科。其主要任务是为学生讲授专业课和生产实习所必需的分析课学基础理论、基本知识及基本技能。在医学教育中,卫生化学与分析化学、仪器分析和统计学等前期基础课程有着密切联系,并为环境卫生学、营养与食品卫生学、劳动卫生学及流行病学等后期专业课程提供基础理论和相关知识。 本大纲适用于预防医学类专业五年制汉、民族本科学生使用。现将大纲使用中有关问题说明如下: 1、为了使教师和学生更好地掌握教材,大纲每一章节均由教学目的、教学要求和教学内容三部分组成。教学目的注明教学目标,教学要求分掌握、熟悉和了解三个级别,教学内容与教学要求级别对应,并统一标示(重点掌握内容下画实线,熟悉内容下画虚线,一般内容不作标示)便于学生重点学习。 2、教师在保证大纲核心内容的前提下,可根据本专业的要求与教学手段,讲授重点内容和介绍一般内容。 3、总教学参考学时为54 学时,分12 周,理论与实验比值2:1,即讲课36 学时,实验18 学时。 II正文 第一章绪论 一、教学目的:通过本章学习,了解卫生化学的性质及发展,掌握卫生化学中分析方法的分类与作用,熟悉卫生化学的基本内容、相关参考书和文献。 二、教学要求 1、了解卫生化学的学科性质。 一、实验目的 12 3 4 二、实验原理 ㈠、吸收实验 根据传质速率方程,在假定Kxa 低浓、难溶等] 条件下推导得出吸收速率方程: Ga=Kxa ·V ·Δx m 则: Kxa=Ga/(V ·Δx m ) 式中:Kxa ——体积传质系数 [kmolCO 2/m 3hr Ga ——填料塔的吸收量 [Kmol CO 2 V ——填料层的体积 [m 3] Δx m ——填料塔的平均推动力 1、Ga 的计算 已知可测出:Vs[m 3/h]、V B [m 3/h](可由色谱直接读出) Ls[Kmol/h]=Vs ×ρ水/M 水 101 1'29]/[ρρρρV M V h Kmol G B B B =?=?= 空气 标定情况:T 0=273+20 P 0=101325 测定情况:T 1=273+t1 P 1=101325+ΔP 因此可计算出L S 、G B 。又由全塔物料衡算:G a =Ls(X 1-X 2)=G B (Y 1-Y 2) 2 2 21 1111y y Y y y Y -= -= 且认为吸收剂自来水中不含CO 2,则X 2=0,则可计算出G a 和X 1 2、Δx m 的计算 根据测出的水温可插值求出亨利常数E[atm],本实验为P=1[atm] 则 m=E/P m y x m y x x x x x x x x x x x x e e e e m 1 1221 112221 2 1 2ln = = -=?-=????-?= ? ㈡、解吸实验 低浓、难溶等] Ga=K Y a ·V 则: K Y a=Ga/(V 式中:K Y a Ga V ΔY m 1、Ga 的计算 已知可测出:y 2 ]/[h Kmol G B 标定情况:T 0 测定情况:T 1因此可计算出L S 、G B 。又由全塔物料衡算:G a =Ls(X 1-X 2)=G B (Y 1-Y 2) 0112 2 21 11=-= -= y y Y y y Y 且认为空气中不含CO 2,则y 2=0;又因为进塔液体中X 1有两种情况,一是直接将吸收后的液体用于解吸,则其浓度即为前吸收计算出来的实际浓度X 1;二是只作解吸实验,可将CO 2用文丘里吸碳器充分溶解在液体中,可近似形成该温度下的饱和浓度,其X 1*可由亨利定律求算出: m m y x 1 *1== 则可计算出G a 和X 2 2、ΔY m 的计算 根据测出的水温可插值求出亨利常数E[atm],本实验为P=1[atm] 则 m=E/P 1 12 21112221 2 1 2ln x m y x m y Y Y Y Y Y Y Y Y Y Y Y e e e e m ?=?=-=?-=????-?= ? 根据 e e Y y y y Y 换算成将-= 1 三、实验装置二氧化碳填料吸收与解吸实验.
溴化锂吸收式制冷机的工作原理讲解
原子吸收验证方案
2 吸收与解吸(讲稿)
化工原理氧解吸实验报告
溴化锂吸收式制冷原理
原子吸收光谱仪
氧吸收解吸系数测定实验报告
原子吸收试题_答案解析
二氧化碳吸收与解吸实验
溴化锂吸收式制冷机的工作原理最详细的讲解
原子吸收注意事项
化工原理氧解吸实验报告
原子吸收分光光度计的结构说明
原子吸收实验室基本要求
二氧化碳吸收与解吸实验.docx
原子吸收分光光度法
吸收与解吸实验
