(人教版)高中化学选修四:4.4.2《化学电源》学案(1)
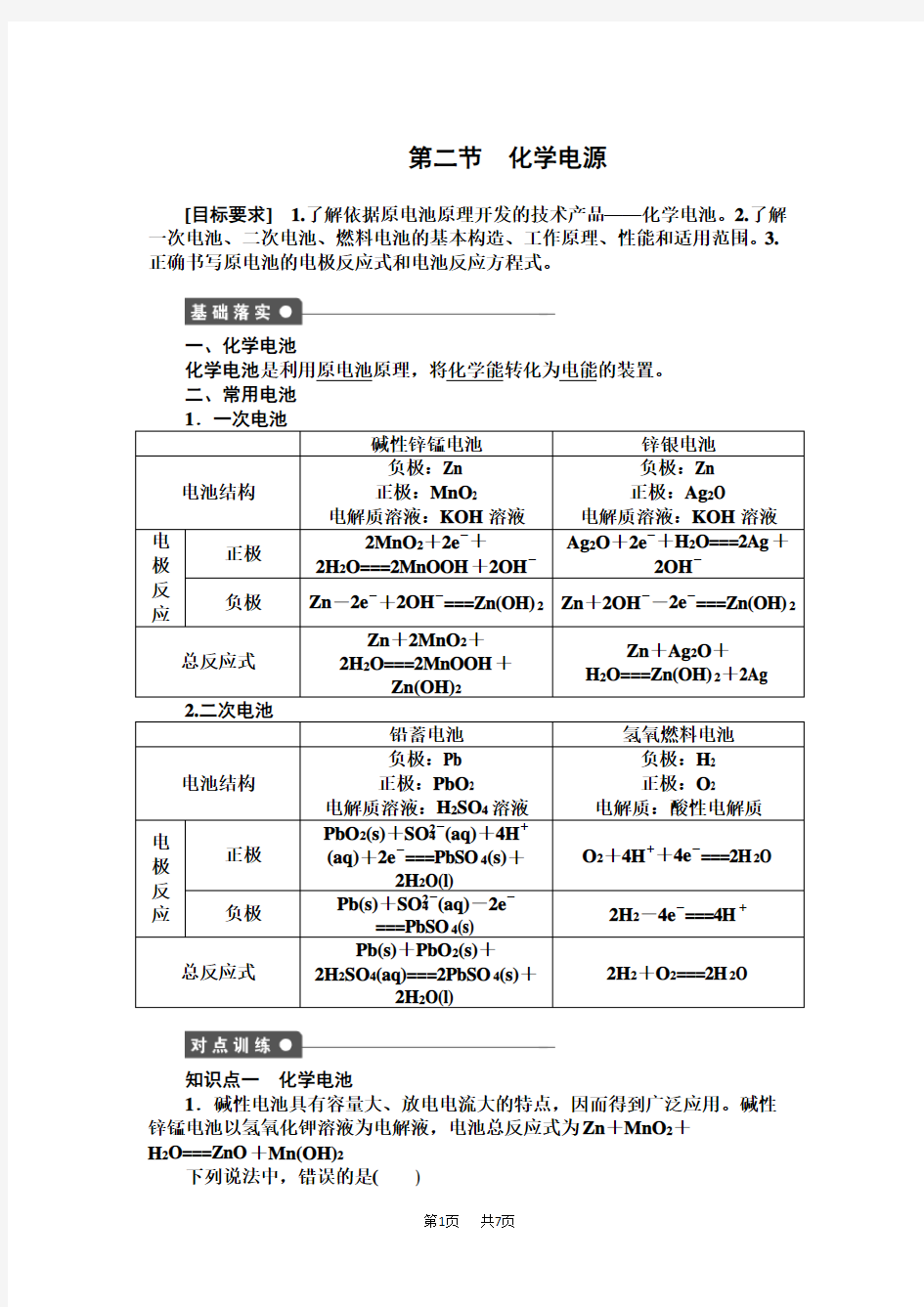

第二节化学电源
[目标要求] 1.了解依据原电池原理开发的技术产品——化学电池。2.了解一次电池、二次电池、燃料电池的基本构造、工作原理、性能和适用范围。3.正确书写原电池的电极反应式和电池反应方程式。
一、化学电池
化学电池是利用原电池原理,将化学能转化为电能的装置。
二、常用电池
碱性锌锰电池锌银电池电池结构
负极:Zn
正极:MnO2
电解质溶液:KOH溶液
负极:Zn
正极:Ag2O
电解质溶液:KOH溶液电
极
反
应
正极
2MnO2+2e-+
2H2O===2MnOOH+2OH-
Ag2O+2e-+H2O===2Ag+
2OH-
负极Zn-2e-+2OH-===Zn(OH)2Zn+2OH--2e-===Zn(OH)2总反应式
Zn+2MnO2+
2H2O===2MnOOH+
Zn(OH)2
Zn+Ag2O+
H2O===Zn(OH)2+2Ag
2.二次电池
铅蓄电池氢氧燃料电池电池结构
负极:Pb
正极:PbO2
电解质溶液:H2SO4溶液
负极:H2
正极:O2
电解质:酸性电解质
电
极
反
应
正极
PbO2(s)+SO2-4(aq)+4H+
(aq)+2e-===PbSO4(s)+
2H2O(l)
O2+4H++4e-===2H2O 负极
Pb(s)+SO2-4(aq)-2e-
===PbSO4(s)
2H2-4e-===4H+总反应式
Pb(s)+PbO2(s)+
2H2SO4(aq)===2PbSO4(s)+
2H2O(l)
2H2+O2===2H2O
知识点一化学电池
1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+
H2O===ZnO+Mn(OH)2
下列说法中,错误的是()
A .电池工作时,锌失去电子
B .电池正极的电极反应式为
MnO 2+2H 2O +2e -===Mn(OH)2+2OH -
C .电池工作时,电子由正极通过外电路流向负极
D .外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g
答案 C
解析 本题要求利用原电池的原理,分析碱性锌锰电池:锌为负极,在反
应中失去电子,故A 正确;电池工作时,电流由正极通过外电路流向负极,而
电子定向移动方向与电流方向相反,故C 错误;由电子守恒知D 项正确;由该
电池反应的总反应式和原电池的原理写出正极反应式知B 正确。
2.某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应
式为3Zn +2K 2FeO 4+8H 2O 3Zn(OH)2+2Fe(OH)3+4KOH ,以下说法不
正确的是( )
A .放电时负极反应式为Zn -2e -+2OH -===Zn(OH)2
B .放电时正极反应式为FeO 2-4+4H 2O +3e -===Fe(OH)3+5OH -
C .放电时每转移3 mol 电子,正极有1 mol K 2FeO 4被氧化
D .充电时阳极附近的溶液的碱性减弱
答案 C
解析 选项A ,放电时,在碱性条件下,Zn 失去电子为电池的负极:Zn
-2e -+2OH -===Zn(OH)2;选项B ,根据放电时总电池反应式减去负极反应式
(电子数需相等)可得放电时正极反应式为FeO 2-4+4H 2O +3e -===Fe(OH)3+
5OH -;选项C ,放电时,K 2FeO 4被还原;选项D ,充电是放电的逆向反应,
所以充电时,阳极消耗OH -,导致阳极附近的溶液的碱性减弱。
3.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的
PbSO 4,干燥后再安装,充电后即可使用,发生的反应是2PbSO 4+2H 2O
PbO 2+Pb +2H 2SO 4
下列对铅蓄电池的说法错误的是( )
A .需要定期补充硫酸
B .工作时铅是负极,PbO 2是正极
C .工作时负极上发生的反应是Pb -2e -+SO 2-4===PbSO 4
D .工作时电解质的密度减小
答案 A
解析 铅蓄电池放电时相当于原电池,Pb 是负极,PbO 2是正极,负极发
生的反应是Pb 失去电子生成Pb 2+,Pb 2+与溶液中的SO 2-4生成PbSO 4沉淀,
放电时消耗的硫酸与充电时生成的硫酸相等,在电池制备时,PbSO 4的量是一
定的,制成膏状,干燥后再安装,说明H 2SO 4不用补充;放电时,H 2SO 4被消
耗,溶液中的H 2SO 4的物质的量浓度减小,所以溶液的密度也随之减小。
知识点二 燃料电池
4.固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电
解质在高温下允许氧离子(O 2-)在其间通过。该电池的工作原理如下图所示,其
中多孔电极a 、b 均不参与电极反应。
放电 充电 放电
充电
下列判断正确的是( )
A .有O 2参加反应的a 极为电池的负极
B .b 极的电极反应式为H 2-2e -+O 2-===H 2O
C .a 极对应的电极反应式为O 2+2H 2O +4e -===4OH -
D .该电池的总反应式为2H 2+O 2=====高温2H 2O
答案 D
解析 因为电子从b 电极流向a 电极,所以b 电极为负极,H 2在该极发生
氧化反应;a 电极为正极,O 2在该极发生还原反应。由此推断该原电池的负极
反应式为H 2-2e -===2H +,正极电极反应式为12
O 2+2e -===O 2-,则电池总反应式为2H 2+O 2=====高温2H 2O 。
5.有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之
一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极
通入空气,另一个电极通入甲烷,电解质是掺杂了Y 2O 3的ZrO 2晶体,它在高
温下能传导O 2-。以下判断错误的是( )
A .电池正极发生的反应:O 2+4e -===2O 2-
B .电池负极发生的反应:CH 4+4O 2--8e -===CO 2+2H 2O
C .固体电解质里的O 2-的移动方向:由正极流向负极
D .向外电路释放电子的电极:正极(即电子由正极流向负极)
答案 D
解析 因为放电时,电池正极发生还原反应(元素化合价降低),负极发生
氧化反应(元素化合价升高)。所以正极反应式是O 2+4e -===2O 2-,负极反应式
是CH 4+4O 2--8e -===CO 2+2H 2O 。由上述电池的正、负极反应式可以看出:
正极反应“源源不断”地产生O 2-,负极反应要持续进行,则需要“持续不
断”的O 2-供应,故电池内O 2-的移动方向是由正极流向负极。电池的负极发
生氧化反应,失去电子,故外电路电子从负极流出,所以D 错误。
练基础落实
1.铅蓄电池的两极分别为Pb 、PbO 2,电解质溶液为H 2SO 4,工作时的电
池反应式为Pb +PbO 2+2H 2SO 4===2PbSO 4+2H 2O ,下列结论正确的是( )
A .Pb 为正极被氧化
B .溶液的pH 不断减小
C .SO 2-4只向PbO 2处移动
D .电解质溶液的pH 不断增大
答案 D
解析 由题给电极反应式可以看出H 2SO 4不断被消耗,故pH 不断增大,
所以B 不正确,D 正确;由Pb 元素化合价的变化,可以看出Pb 是负极,所以
A 不正确;原电池工作时,整个电路中负电荷的流向是一致的,外电路中,电
子由Pb极流向PbO2极;内电路中,负电荷(SO2-4和OH-)移向Pb极,所以C 不正确。
2.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为
Zn+2OH--2e-===ZnO+H2O
Ag2O+H2O+2e-===2Ag+2OH-
总反应式为Ag2O+Zn===ZnO+2Ag
根据上述反应式,判断下列叙述中正确的是()
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn极发生还原反应,Ag2O极发生氧化反应
答案 C
解析(1)根据电极反应式可知Zn失电子被氧化而溶解,Ag2O得电子被还原,故Zn是负极,Ag2O是正极,所以C正确;(2)负极(即Zn极)在反应时消耗OH-,则负极区溶液的pH应减小,故A错误;(3)发生原电池反应时,电子由负极经外电路到正极,即电子从Zn极经外电路到Ag2O极,故B错误;
(4)在原电池中,负极发生氧化反应,正极发生还原反应,故D错误。
3.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是()
①每消耗1 mol CH4可以向外电路提供8 mol e-②负极上CH4失去电子,电极反应式为CH4+10OH--8e-===CO2-3+7H2O③负极上是O2获得电子,电极反应式为O2+2H2O+4e-===4OH-④电池放电后,溶液的pH不断升高
A.①②B.①③C.①④D.③④答案 A
解析CH4在铂电极上发生类似于CH4在O2中燃烧的反应,即
CH4→CO2,严格地讲生成的CO2还与KOH反应生成K2CO3,化合价升高,失去电子,是电池的负极,电极反应式为CH4-8e-+10OH-===CO2-3+
7H2O,1 mol CH4参加反应有8 mol e-发生转移,O2在正极上发生反应,获得电子,电极反应式为O2+2H2O+4e-===4OH-。虽然正极产生OH-,负极消耗OH-,但从总反应式CH4+2O2+2KOH===K2CO3+3H2O可看出是消耗了KOH,所以电池放电时溶液的pH值不断下降,故①②正确,③④错误。
练方法技巧
4.锌锰干电池在放电时,电池总反应方程式可以表示为Zn+2MnO2+
2NH+4===Zn2++Mn2O3+2NH3+H2O,此电池放电时,在正极(碳棒)上发生反应的物质是()
A.Zn B.碳C.MnO2和NH+4D.Zn2+和NH3
答案 C
解析根据原电池原理,锌为负极,碳棒为正极,锌应参加负极反应,而MnO2在反应中得到电子,应当在正极区发生反应,又由于NH+4移向正极,在正极发生反应生成NH3。本题考查原电池电极反应式的书写,阳离子移动的方向。
5.氢氧燃料电池用于航天飞机,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应式如下:
负极:2H2+4OH--4e-===4H2O
正极:O2+2H2O+4e-===4OH-
当得到1.8 L饮用水时,电池内转移的电子数约为()
A.1.8 mol B.3.6 mol C.100 mol D.200 mol
答案 D
解析n(H2O)=1.8×103 g
18 g·mol-1
=100 mol
2H2+O4e-2===2H2O
即每生成1 mol H2O则转移2 mol e-,当生成100 mol H2O时,转移200 mol e-。
6.乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应式为C2H5OH+3O2===2CO2+3H2O,电池示意图,下列说法中正确的是()
A.电池工作时,质子向电池的负极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O+12e-===2CO2+12H+
D.b极上发生的电极反应是2H2O+O2+4e-===4OH-
答案 B
解析通入乙醇的一极(a极)为负极,发生氧化反应;通入氧气的一极(b 极)为正极,发生还原反应。电池工作时,阳离子(质子)向电池的正极迁移,A 项不正确;电流方向与电子流向相反,电流由b极沿导线流向a极,B项正
确;a极上乙醇应该失电子被氧化,所以C项不正确;因为电池中使用的是磺酸类质子溶剂,所以电极反应式中不能出现OH-,D项不正确。
练综合拓展
7.科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式:
_________________________________________________________________ _______
_________________________________________________________________ _______。
(1)此电池的正极发生的电极反应:
_________________________________________________________________ _______,
负极发生的电极反应:
_____________________________________________________。
(3)电解液中H+向________极移动,向外电路释放电子的电极是
________。
(4)使用该燃料电池的另一个好处是
________________________________________
_________________________________________________________________ _______。
答案(1)2CH3OH+3O2===2CO2+4H2O
(2)3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
(3)正负极(4)对环境无污染
解析(1)燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电池总反应式为2CH3OH+3O2===2CO2+4H2O。
(2)电池的正极O2得电子,由于是酸性环境,所以会生成H2O,用电池总反应式减去正极反应式即可得出负极的电极反应式。
(3)H+移向正极,在正极生成水。
(4)产物是CO2和H2O,不会对环境造成污染。
8.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1) 氢氧燃料电池的能量转化主要形式是________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为
_________________________________________________________。
(3)电极表面镀铂粉的原因为
______________________________________________
_________________________________________________________________ _______。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此,大量安全储氢是关键技术之一。
金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=====
△2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________,反应Ⅱ中的氧化剂是________。
②已知LiH固体密度为0.82 g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
答案(1)化学能转变为电能a到b(2)2H2+4OH--4e-===4H2O或H2+2OH--2e-
===2H2O(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率(4)①Li H2O②1/1 148或8.71×10-4③32
解析(1)电池是把化学能转变为电能的装置;在电池中,电子从负极经导线流向正极,而氢氧燃料电池中通入H2的一极是负极,故电子由a流动到b。
(2)H2在负极失电子,因为电解质溶液是KOH溶液,故负极反应式为2H2+4OH--4e-===4H2O。
(3)电极表面镀铂粉可以增大电极单位面积吸附H
2、O
2
的分子数,从而增大
反应速率。
(4)LiH中Li为+1价,H为-1价,故反应Ⅰ中还原剂是Li,反应Ⅱ中氧
化剂是H
2O。由反应Ⅰ可知吸收标准状况下224 L H
2
时生成160 g LiH,则生成
的LiH的体积是
160 g
0.82 g·cm-3
,则生成的LiH的体积与被吸收的H
2
的体积之比
为160
0.82×224×103=
1
1 148
。由②生成的20 mol LiH与H
2
O反应,由反应Ⅱ可
知生成20 mol H
2,H
2
~2e-,能量转化率为80%,则通过的电子的物质的量为
20 mol×2×80%=32 mol。
