信号通路5—Tyrosine Kinase

信号通路5—Tyrosine Kinase
APExBIO
一、Tyrosine Kinase
酪氨酸激酶(tyrosine kinase)是细胞中将磷酸基团从ATP转移到蛋白质的酶。
磷酸基与蛋白质上的酪氨酸连接。酪氨酸激酶属于蛋白激酶的较大类别亚组,将磷酸基团连接到其它氨基酸(丝氨酸和苏氨酸)。
酪氨酸残基的磷酸化影响蛋白质的很多性质,如酶活性,亚细胞定位和分子之间的相互作用。酪氨酸激酶在许多信号转导级联中发挥重要作用。
突变可能导致一些酪氨酸激酶具有组成型活性,促进癌症的发生或发展。
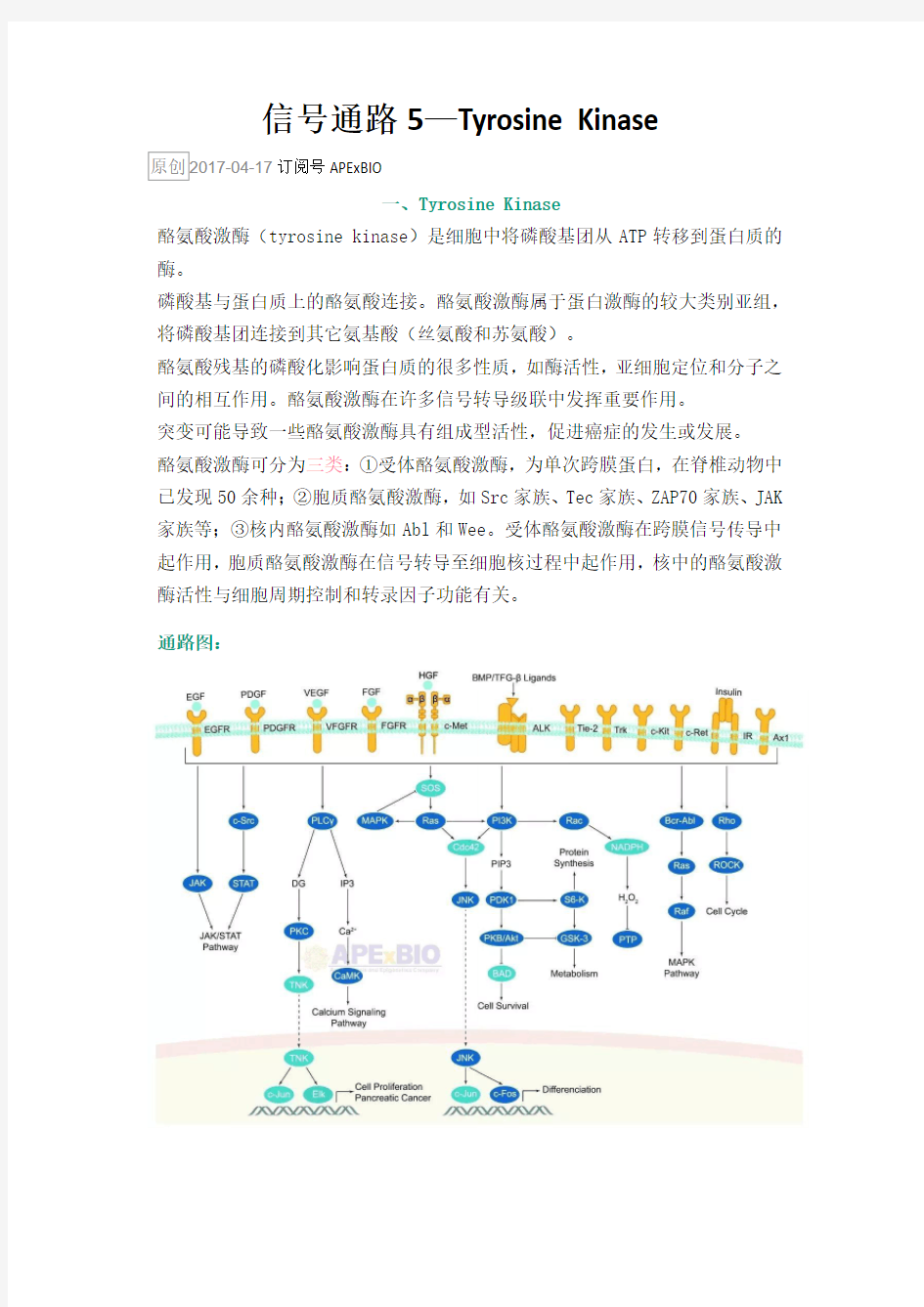
酪氨酸激酶可分为三类:①受体酪氨酸激酶,为单次跨膜蛋白,在脊椎动物中已发现50余种;②胞质酪氨酸激酶,如Src家族、Tec家族、ZAP70家族、JAK 家族等;③核内酪氨酸激酶如Abl和Wee。受体酪氨酸激酶在跨膜信号传导中起作用,胞质酪氨酸激酶在信号转导至细胞核过程中起作用,核中的酪氨酸激酶活性与细胞周期控制和转录因子功能有关。
通路图:
二、相关蛋白或基因
1. Bcl-Abl
Bcl-Abl是组成型激活的嵌合酪氨酸激酶。Bcr-Abl酪氨酸激酶失活导致慢性粒细胞白血病(CML)。Bcr-Abl酪氨酸激酶抑制剂用于大多数CML患者的一线治疗。
2. GSK-3
Glycogen synthase kinase 3,糖原合成酶激酶3。GSK-3是一种丝氨酸/苏氨酸激酶,主要作用是使糖原合成酶发生磷酸化而失活。GSK-3基因家族包括GSK-3α和 GSK-3β。胰岛素引起的Akt激活,上皮生长因子、血小板衍化生长因子等引起的Ras/Raf/ERK/p90Rsk1激活以及p90Rsk、P70S6K均能引起GSK-3α和 GSK-3β磷酸化使其失去活性,参与调节多种疾病的生理过程,包括II型糖尿病,阿尔茨海默病,炎症,癌症和双相情感障碍。
3. Syk
Spleen tyrosine kinase,脾脏酪氨酸激酶。Syk是非受体细胞质酪氨酸激酶家族,在各种细胞表面受体(包括CD74,Fc受体和整合素)信号传导中起作用。SYK与Zap-70是Syk酪氨酸激酶家族的成员。Syk在上皮性恶性肿瘤中的作用是有争议的,有人认为Syk功能异常促进鼻咽癌和头颈癌的转化,而其他人则提出Syk在乳腺癌和胃癌中具有肿瘤抑制作用。
4. DDR
Discoidin domain receptors,盘状结构域受体。盘状结构域受体是一类受体型酪氨酸激酶(receptor tyrosine kinases,RTKs),可分为DDR1和DDR2,其结合胶原并在几种信号通路中被激活,包括Shp-2,Src和MAPK。它们与纤维化,动脉粥样硬化和癌症等疾病有关。
5. ALK
Anaplastic lymphoma kinase,间变性淋巴瘤激酶。也称为ALK酪氨酸激酶受体或CD246。ALK是胰岛素受体蛋白酪氨酸超家族的成员,在胚胎发育中起作用,并参与细胞增殖。
6. FLT3
FMS-like tyrosine kinase 3,FMS样酪氨酸激酶3。FLT3是属于III型受体酪氨酸激酶的细胞因子受体,在细胞存活、增殖和分化中起作用。
7. Axl
Axl (Anexelekto)是受体酪氨酸激酶,与配体Gas6结合可激活Axl的酪氨酸激酶活性,激活下游信号转导途径。Axl将信号从细胞外基质转导到细胞质中并参与刺激细胞增殖。
8. Ack1
Activated Cdc42-associated tyrosine kinase 1,活化的Cdc42相关酪氨酸激酶1。Ack1是一种非受体酪氨酸激酶,与EGFR、MERTK、AXL、HER2、AKT、胰岛素受体、雄激素受体等结合。
9. Bmx kinase
Bmx激酶是Tec激酶家族的成员。它参与不同的信号通路并控制几种癌症的分化和致瘤性。
10. c-Fms
称为colony-stimulating factor-1 receptor(CSF-1R),集落刺激因子-1受体。c-Fms是M-CSF(巨噬细胞集落刺激因子)的唯一受体,是受体酪氨酸激酶。c-Fms基因缺失会造成自发性破骨细胞缺陷型骨骼石化症。
11. c-kit
c -kit是一种受体酪氨酸激酶,一种肿瘤标志物,也称为CD117和干细胞因子受体。
12. c-RET
c-RET原癌基因的表达产物Ret是受体酪氨酸激酶家族的一员,在神经内分泌系统和肾的发育中以及精子发生、甲状腺功能调节中具有重要作用。
13. c-Met
c-Met是MET基因编码的蛋白产物,为肝细胞生长因子受体,具有酪氨酸激酶活性,是对胚胎发育和伤口愈合至关重要的膜受体。
14. EGFR
Epidermal growth factor receptor,表皮生长因子受体。EGFR是一种糖蛋白,属于酪氨酸激酶型受体。EGFR分为三区:胞外配体结合区,跨膜区和胞内激酶区。EGFR位于细胞膜表面,靠与配体结合来激活,包括EGF和TGFα(transforming gro wth factor α)。EGFR属于ErbB受体家族的一种,该家族包括EGFR (ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3) 和Her 4(ErbB-4)。
15. EphB4
Ephrin type-B receptor 4,Ephrin型-B受体4。EphB4是调节细胞粘附和迁移的酪氨酸激酶受体。它在心/血管形态发生和血管生成中起着重要作用,与前列腺/乳腺癌等相关。
16. FAK
Focal adhesion kinase,局部粘着斑激酶。FAK也称为PTK2,是一种酪氨酸激酶,在肿瘤向恶性侵袭表型演进的过程中起着重要的作用。
17. FGFR
Fibroblast growth factor receptors,成纤维细胞生长因子受体。FGFR是跨膜酪氨酸激酶受体。它参与致癌作用,在细胞分化、存活和增殖等方面起重要作用。
18. HER2
Human epidermal growth factor receptor-2,人类表皮生长因子受体2。具有酪氨酸激酶活性。HER2是重要的乳腺癌预后判断因子。
19. IGF1R
Insulin-Like growth factor 1 receptor,胰岛素样生长因子1受体。IGF1R 是以高亲和力结合胰岛素样生长因子1的受体酪氨酸激酶。它在细胞生长、细胞存活和恶性转化等过程中起重要作用。
20. insulin receptor
胰岛素受体家族属于受体酪氨酸激酶家族的ò型亚家族,成员包括胰岛素受体( insulin receptor,IR) ,胰岛素样生长因子受体( insulin-like growth factor receptor,IGFR),胰岛素受体相关受体( insulin receptor-related receptor,IRR) 。
21. IRAK
Interleukin receptor-associated kinase,白介素受体相关激酶。IRAK是丝氨酸/苏氨酸 - 蛋白激酶家族,在先天免疫免疫中起重要作用。它涉及与自身免疫和炎性疾病相关的TLR和IL-1R信号通路。
22. ITK
IL2-inducible T-cell kinase,IL2诱导型T细胞激酶。ITK是调节适应性免疫应答的细胞内酪氨酸激酶。它在T细胞发育和分化中起作用。
23. Lck
lymphocyte-specific protein tyrosine kinase,淋巴细胞特异性蛋白酪氨酸激酶。Lck是酪氨酸激酶,其磷酸化涉及淋巴细胞的细胞内信号传导途径的某些蛋白质的酪氨酸残基。
24. LRRK2
Leucine-rich repeat kinase 2,富含亮氨酸的重复激酶2。LRRK2是与parkin 相互作用并与帕金森病以及克罗恩病相关的酶。
25. PDGFR
Platelet-derived growth factor receptor,血小板衍生生长因子受体。PDGFR 是PDGF(血小板衍生生长因子)家族成员的一组细胞表面酪氨酸激酶受体。
Notch信号通路研究进展
224 中国医药生物技术 2009年6月第4卷第3期Chin Med Biotechnol, June 2009, V ol. 4, No. 3 DOI:10.3969/cmba.j.issn.1673-713X.2009.03.012 · 综述·Notch信号通路研究进展 王利祥,华子春 1917 年,Morgan 及其同事在果蝇体内发现一种基因,因其功能部分缺失可导致果蝇翅缘出现缺口,故命名该基因为 Notch。随后的研究发现,Notch 从无脊椎动物到脊椎动物的多个物种中表达,其家族成员的结构具有高度保守性,在细胞分化、发育中起着关键作用。迄今研究已阐明 Notch 信号通路的主要成员及核心转导过程,然而随着研究的深入,人们逐渐认识到该通路实际上处于十分复杂的调控网络之中,而这与其在发育过程中功能的多样性相符合。本文结合最新进展,系统阐述 Notch 信号通路的组成,功能,作用机制及调控,并揭示该通路异常与疾病的联系。 1 Notch 受体 Notch 受体是一个相对分子量约为 30 000 的 I 型膜蛋白,由胞外亚基和跨膜亚基组成,2 亚基之间通过 Ca2+ 依赖的非共价键结合形成异源二聚体。胞外亚基包含一组串联排列的 EGFR 和 3 个家族特异性的 LNR 重复序列。EGFR 在 Notch 受体与配体的结合中起关键作用,在果蝇中,Notch 受体的第 11 位和 12 位 EGFR 介导了其与配体的结合。LNR 位于 EGFR 的下游,富含半胱氨酸,介导了 2 亚基之间 Ca2+ 依赖的相互作用。跨膜亚基包括跨膜区、RAM 序列、锚蛋白重复序列、核定位序列、多聚谷氨酰胺序列以及 PEST 序列。RAM 结构域是 Notch 信号效应分子 CBF1/RBPJk 主要的结合部位。ANK 重复序列结构域是 Deltex、Mastermind 等的结合部位,这些蛋白对Notch 信号通路有修饰作用。PEST 结构域与泛素介导的Notch 胞内段降解有关[1]。 2 Notch 配体 Notch 配体与受体一样为 I 型跨膜蛋白。果蝇 Notch 配体有 2 个同源物 Delta 和 Serrate,线虫的 Notch 配体为 Lag 2,故又称 Notch 配体为 DSL 蛋白。脊椎动物体内也发现了多个 Notch 配体,与 Delta 同源性高的称为Delta 样分子,与 Serate 同源性高的被称作 Jagged。目前,发现人的 Notch 配体有 D ll l、3、4和 Jagged l、2。配体胞外 DSL 结构域在进化中高度保守,是配体与受体结合、激活 Notch 信号所必需的。Notch 配体的胞内域较短,仅70 个左右氨基酸残基,功能尚未阐明。近来研究发现,Delta 1 的胞内域能够诱导细胞的生长抑制[2]。有人推测,配体胞内段可能类似与受体胞内段,具有信号转导功能,但具体机制有待进一步研究。3 Notch 信号传递与效应因子 迄今研究发现主要有 6 种信号通路在多细胞生物的生长中发挥关键作用,分别是刺猬、骨形态发生蛋白、无翅、类固醇激素受体、Notch 和受体酪氨酸激酶。Notch 相对于其他信号通路结构较简单,没有第二信使的参与。现有研究提出了 Notch 信号活化的“三步蛋白水解模型”[3]。首先,Notch 以单链前体模式在内质网合成,经分泌运输途径,在高尔基体内被 Furin 样转化酶切割成相对分子质量为180 000 含胞外区的大片段和 120 000 含跨膜区和胞内区的小片段。两者通过 Ca2+依赖性的非共价键结合为异源二聚体,然后被转运到细胞膜。当 Notch 配体与受体结合,Notch 受体相继发生 2 次蛋白水解。第一次由 ADAM 金属蛋白酶家族的 ADAM 10/Kuz 或 ADAM 17/TACE 切割为 2 个片段。N 端裂解产物(胞外区)被配体表达细胞内吞,而 C 端裂解产物随后由早老素 1/2,Pen-2,Aph1 和Nicastrin 组成的γ-促分泌酶复合体酶切释放 Notch 受体的活化形式 NICD。 经典的 Notch 信号通路又称为 CBF-1/RBP-Jκ依赖途径。CBF-1/RBP-Jκ本身是 1 个转录抑制因子,能够特异性地与 DNA 序列“CGTGGGAA”相结合,并招募 SMRT,SKIP,I/II 型组蛋白去乙酰化酶等蛋白形成共抑制复合物,抑制下游基因的转录。当 Notch 信号激活后,NICD 通过上述酶切反应被释放进入胞核,通过 RAM 结构域及 ANK 重复序列与 CBF-1/RBP-Jκ结合使共抑制复合物解离,并募集 SKIP,MAML 1 组成共激活复合体,激活下游基因的转录。Notch 信号的靶基因多为碱性螺旋-环-螺旋转录抑制因子家族成员,如哺乳动物中的 HES、非洲爪蟾中的XHey-1,以及近来发现的 BLBP [3]。此外,存在非CBF-1/RBP-Jκ依赖的 Notch 信号转导途径。最近有研究报道,果蝇 Notch 结合蛋白 Deltex 是某些组织特异性非 Su (H)依赖性信号所必需的,同时发现 Deltex 也具有拮抗Notch 的功能 [4]。 4 Notch 信号途径功能 Notch 信号途径的功能最初是在果蝇神经系统发育的 基金项目:国家自然科学基金(30425009,30730030);江苏省自然科学基金(BK2007715) 作者单位:210093 南京大学医药生物技术国家重点实验室 通讯作者:华子春,Email:zchua@https://www.360docs.net/doc/099176914.html, 收稿日期:2009-02-01
常见的信号通路
1JAK-STAT信号通路 1)JAK与STAT蛋白 JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。(1)酪氨酸激酶相关受体(tyrosinekinaseassociatedreceptor) 许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生 长激素)、EGF(表皮生长因子)、PDGF(血小板衍生因子)以及IFN(干扰素)等等。这些细胞因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK 的结合位点。受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2)酪氨酸激酶JAK(Januskinase) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosinekinase,RTK),而JAK却是一类非跨膜型的酪氨酸激酶。JAK是英文Januskinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸、JAK1个成员:4蛋白家族共包括JAK结构域的信号分子。SH2化多个含特定
JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAKhomologydomain,JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3)转录因子STAT(signaltransducerandactivatoroftranscription)STAT被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3结构域、SH2结构域及C-端的转录激活区。其中,序列上最保守和功能上最重要的区段是SH2结构域,它具有与酪氨酸激酶Src的SH2结构域完全相同的核心序列“GTFLLRFSS”。 2)JAK-STAT信号通路 与其它信号通路相比,JAK-STAT信号通路的传递过程相对简单。信号传 递过程如下:细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点”(dockingsite),同时含有SH2结构域的STAT蛋白被招募到这个“停泊位点”。最后,激酶JAK 催化结合在受体上的STAT蛋白发生磷酸化修饰,活化的STAT蛋白以二 聚体的形式进入细胞核内与靶基因结合,调控基因的转录。值得一提的是,一种JAK激酶可以参与多种细胞因子的信号转导过程,一种细胞因子的信号通路也可以激活多个JAK激酶,但细胞因子对激活的STAT分子却具有一定的选择性。例如IL-4激活STAT6,而IL-12 。STAT4却特异性激活
代谢组研究利器之脂质组-定量脂质组
一、研究热点--脂质组 近年来,脂质组学研究非常热门,经常出现在CNS期刊上。 脂质是重要的生物大分子物质之一,在生物体的生命活动中起着重要作用。2003年韩贤林教授等首次提出脂质组学的概念,对生物体系脂质进行全面系统的研究分析。它主要研究生物体系(生物体、组织、细胞甚至亚细胞)受刺激或扰动后,脂质种类、亚种类或单个脂质分子的变化。通过系统的研究机体内脂类物质代谢的变化,从而揭示与其他分子间相互作用的机理。 脂质组学是代谢组学的一个分支。脂类代谢(如血浆中约70%的代谢物是脂类)是动植物的代谢中第一大类物质,是动植物代谢研究中最为关注的热点,参与能量运输、细胞间的信息通讯与网络调控等生长发育过程。 脂类作为脂质组学研究的内容,依据“脂质代谢途径研究计划”(LIPIDMAPS)可分为8个大的类别:1.脂肪酰,2.甘油脂,3.甘油磷脂,4.鞘脂,5.甾醇酯,6.丙烯醇脂,7.糖脂,8.聚酮。脂类物质不仅是我们人体的重要组成成分,而且不少疾病也与脂类异常代谢有关,如阿兹海默症、糖尿病、肥胖以及肿瘤发生发展等。 我们都知道细胞膜的主要成分是磷脂双分子层,大多数脂类参与构建了细胞膜和亚细胞膜。脂类既是结构分子,也是信号分子。一个典型的例子是磷脂酰肌醇-4,5-二磷酸转化成二酰基甘油和三磷酸肌醇,后者作为第二信使,激活下游的激酶并诱导细胞内钙离子的释放。 脂质组学领域中最核心的研究手段是电喷雾电离-质谱技术,能对各种脂质尤其是磷脂进行高分辨率、高灵敏度、高通量的分析。 二、定量脂质组 脂类具有数目众多、结构多样的特点,这就给定量脂质组分析带来了一定的难度。定量脂质组学是通过一种或多种稳定同位素标记内标对脂质进行大规模绝对定量的一种方法。因此定量脂质组分析具有以下要点: 1.LC-MS/MS仪器进行脂质定量,最优的检测模式是SRM/MRM; 2.不同类别的脂质在仪器中响应强度不一样,变化趋势不一样,因此内标
ERK5信号通路研究现状
World Journal of Cancer Research 世界肿瘤研究, 2014, 4, 41-46 Published Online October 2014 in Hans. https://www.360docs.net/doc/099176914.html,/journal/wjcr https://www.360docs.net/doc/099176914.html,/10.12677/wjcr.2014.44008 Review of the ERK5 Signaling Pathway Research Song Luo*, Shengfa Su, Weiwei Ouyang#, Bing Lu# Teaching and Research Section of Oncology, Guiyang Medical University, Guiyang Email: 4567436@https://www.360docs.net/doc/099176914.html,, #ouyangww103173@https://www.360docs.net/doc/099176914.html,, #lbgymaaaa@https://www.360docs.net/doc/099176914.html, Received: Sep. 25th, 2014; revised: Oct. 16th, 2014; accepted: Oct. 20th, 2014 Copyright ? 2014 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). https://www.360docs.net/doc/099176914.html,/licenses/by/4.0/ Abstract Extracellular signal regulated kinase 5 (ERK5) is an important part of mitogen activated protein kinase (MAPK) system, and also is a new signal transduction pathway of MAPK signaling system, which has attracted much attention in recent years. ERK5 can be activated by many stimulating factors and plays an important role in cell survival, proliferation and differentiation. Furthermore, ERK5 is closely related to vascular development and proliferation, and other critical functions. This paper focuses on the origin, structure, property, physiological features of ERK5, and the relation-ship between ERK5 and tumor and non-oncologic diseases, and reviews the research direction in the future. Keywords ERK5, Signaling Pathways, MAPK ERK5信号通路研究现状 罗松*,苏胜发,欧阳伟炜#,卢冰# 贵阳医学院肿瘤学教研室,贵阳 Email: 4567436@https://www.360docs.net/doc/099176914.html,, #ouyangww103173@https://www.360docs.net/doc/099176914.html,, #lbgymaaaa@https://www.360docs.net/doc/099176914.html, 收稿日期:2014年9月25日;修回日期:2014年10月16日;录用日期:2014年10月20日 *第一作者。 #通讯作者。
信号通路研究思路
信号通路研究思路
证明一个药物能通过抑制P38表达而发挥保护细胞的作用,需要做的是: 要证明你的药物是通过抑制P38表达而发挥保护作用,首先要证明P38表达增加会导致损伤。 其次,要证明你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 首先证明P38表达增加会导致损伤。 这里需要建立一个损伤模型。正如你提到的,钙离子导致P38mapk的增高,如果某种损伤可以通过钙离子导致P38mapk的增高,那么你就建立起了一个损伤模型。这时,对P38做个RNA干扰,使其表达下降,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说P38mapk的增高会导致损伤。 这里最好不要用P38的抑制剂SB来处理,因为这个抑制剂是针对P38活性的抑制剂,抑制的是P38的磷酸化,而不是表达量。 如果说明的问题是p38磷酸化水平增加而导致损伤,那么我建议用抑制剂。这时还可以用Dominant-negative。抑制剂的实验证实该药物不影响P38表达,而影响其活化。(应该首先考虑选用抑制剂,因为目前一些药物的作用机制不是抑制靶点的表达,而是抑制靶点的激活。如果在此应用RNAi的话,很可能会漏掉这个机制或增加实验步骤。) 其次,要证明你的药物存在保护作用。
当然就是用你的药物先处理一下,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 用你的药物先处理一下,再来损伤刺激,再检测P38表达,如果用药组相对于没有用药组P38表达下降,那么可以说你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 这一步看似不必要,其实是最重要的步骤,而国内的文章往往忽略了这一关键环节。 这里建议还是用RNA干扰P38表达,再用你的药物处理,再进行损伤刺激,如果用药组与没有用药组的损伤程度一致,那么才可以说你的药物是由于抑制了P38表达而发挥保护作用。 抑制剂也有其局限性,有时是“致命”的,主要原因是抑制剂缺乏特异性。虽然我们在文章里看到用抑制剂的时候都说是什么什么的特异性抑制剂,但真的那么特异吗?其实往往是作者为了写文章发文章的需要而夸大了抑制剂的特异性。细胞里无数的信号通路,谁也不能保证抑制剂在作用于靶分子时不会影响其他信号通路。其实无论什么抑制剂,对剂量的要求都相对比较苛刻,为什么?就是因为一旦浓度高了,就不知道会干扰到其他哪些信号通路,从而产生很多说不清道不明的现象。 PI3K的抑制剂---LY294002和wortmannin,它们都能抑制PI3K和相关的激酶,但LY294002的浓度达到200μM常用来抑制DNA依赖的蛋白激酶(DNA-PK);wortmannin在浓度超过3μM常用来抑制运动失调性毛细血管扩张基因
ERK信号转导通路
ERK信号转导通路 在MAPK家族中,ERK是最先被发现并被了解最多的成员。ERK包括了两种异构体ERKl 和ERK2(分别为P44和P42)。两个磷酸化受体位点即酪氨酸和苏氨酸被谷氨酸残基分隔开来,故其磷酸化位点基序是TEY。目前认为,P38和JNK属于“应激诱导”的MAPK,而ERK被认为是与细胞增殖、转化和分化相关的MAPK。 ERK级联反应包括典型的3个层次MAPKs的序贯激活过程。Raf蛋白(MAPKKK)的激活能磷酸化MEKl/2(MAPKK),并使后者激活,从而使随后的ERKl/2(MAPK)发生双重磷酸化而被缉获。ERK的激活对于Ras诱导的细胞反应、转录因子(如Elkl、cEtsl和c—Ets2)的激活以及激酶(如P90rskl、MNKl和MNK2)的激活是至关重要的。 ERK通路的激活包括了以下3种方式:酪氨酸激酶受体对Ras的激活、Ca2+对Ras的激活以及PKC对ERK通路的激活。生长因子与细胞表面的受体酪氨酸激酶(RTK)结合,诱发生长因子受体胞质中的酪氨酸残基自身磷酸化,导致受体二聚体化与活化。细胞表面的生长因子受体具有募集Grb2和SOS复合物的能力。SOS在与生长因子受体结合的过程中移位至胞质,并与Ras相互作用,促进Ras与GTP结合,使Ras活化。此外,Ca2+可通过不同的作用机制激活Ras蛋白:①通过l型电压依赖性的钙离子通道流人细胞内,经由Src家族蛋白激酶的介导,导致表皮生长因子受体(EGFR)酪氨酸磷酸化,进而通过Shc—Grb2—SOS复合物激活Ras;②通过Ca2+敏感性的Ras鸟嘌呤核苷酸释放因子(Ras—GRF)和Ca2+—钙调蛋白复合物与Ras—GRF结合,通过诱导Ras进行GTP交换而激活Ras;③在大鼠嗜铬细胞瘤PCI2细胞中,胞质Ca2+的升高,可诱发酪氨酸磷酸化,激活蛋白酪氨酸激酶(PYK2)。PYK2与Grb2和SOS形成复合物,同时伴随着Shc的激活。活化的PYK2通过直接募集Srb2—SOS复合物,或间接通过Shc而激活Ras。Ras是一种G蛋白,可通过与Grb2—SOS复合物发生相互作用而被激活。在这一过程中,SOS催化鸟嘌吟二磷酸盐发生转位,从而形成Ras—GTP复合体,使Ras激活,成为具有功能活性的Ras蛋白。Ras被激活后将Raf募集于细胞膜,随后Raf 发生磷酸化作用和寡聚化作用。PKC的同工酶也可以磷酸化并激活Raf—1蛋白激酶,使Raf —1发生自身磷酸化。 Raf家族属于MAPKKK,是高度保守的丝氨酸—苏氨酸激酶,通过与Ras蛋白的相互作用而被缉获。Raf家族成员包括A—Raf、B—Raf和Raf—1(即c—Raf或c—Raf—1)。每一异构体包括3个保守区域,称为CRl、CR2和CR3。前面的两个保守区域位于氨基末端,并含有调节Raf催化区域的部分,其激酶区域位于CR3。Raf被激活后使MEKl/2磷酸化,最终使ERKl/2发生磷酸化而被激活。激活的ERKl/2转位至核内,通过使P90RSK、MSK以及转录因子ELK—1、Stat3磷酸化而激活转录,引起细胞生长、增殖与分化。
信号通路研究思路
证明一个药物能通过抑制P38表达而发挥保护细胞的作用,需要做的是: 要证明你的药物是通过抑制P38表达而发挥保护作用,首先要证明P38表达增加会导致损伤。 其次,要证明你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 首先证明P38表达增加会导致损伤。 这里需要建立一个损伤模型。正如你提到的,钙离子导致P38mapk的增高,如果某种损伤可以通过钙离子导致P38mapk的增高,那么你就建立起了一个损伤模型。这时,对P38做个RNA干扰,使其表达下降,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说P38mapk的增高会导致损伤。 这里最好不要用P38的抑制剂SB来处理,因为这个抑制剂是针对P38活性的抑制剂,抑制的是P38的磷酸化,而不是表达量。 如果说明的问题是p38磷酸化水平增加而导致损伤,那么我建议用抑制剂。这时还可以用Dominant-negative。抑制剂的实验证实该药物不影响P38表达,而影响其活化。(应该首先考虑选用抑制剂,因为目前一些药物的作用机制不是抑制靶点的表达,而是抑制靶点的激活。如果在此应用RNAi的话,很可能会漏掉这个机制或增加实验步骤。) 其次,要证明你的药物存在保护作用。 当然就是用你的药物先处理一下,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 用你的药物先处理一下,再来损伤刺激,再检测P38表达,如果用药组相对于没有用药组P38表达下降,那么可以说你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 这一步看似不必要,其实是最重要的步骤,而国内的文章往往忽略了这一关键环节。 这里建议还是用RNA干扰P38表达,再用你的药物处理,再进行损伤刺激,如果用药组与没有用药组的损伤程度一致,那么才可以说你的药物是由于抑制了P38表达而发挥保护作用。 抑制剂也有其局限性,有时是“致命”的,主要原因是抑制剂缺乏特异性。虽然我们在文章里看到用抑制剂的时候都说是什么什么的特异性抑制剂,但真的那么特异吗?其实往往是作者为了写文章发文章的需要而夸大了抑制剂的特异性。细胞里无数的信号通路,谁也不能保证抑制剂在作用于靶分子时不会影响其他信号通路。其实无论什么抑制剂,对剂量的要求都相对比较苛刻,为什么?就是因为一旦浓度高了,就不知道会干扰到其他哪些信号通路,从而产生很多说不清道不明的现象。 PI3K的抑制剂---LY294002和wortmannin,它们都能抑制PI3K和相关的激酶,但LY294002的浓度达到200μM常用来抑制DNA依赖的蛋白激酶(DNA-PK);wortmannin在浓度超过3μM常用来抑制运动失调性毛细血管扩张基因突变(ATM)以及DNA-PK。相对而言,MEK1/2
生物化学代谢复习之糖代谢、脂质代谢
一、糖代谢 (一)糖的无氧氧化 1.基本概念糖酵解:一分子葡萄糖在胞质中可裂解生成两分子丙酮酸的过程称之为糖酵解,是葡萄糖无氧氧化和有氧氧化的共同起始途径。 糖的无氧氧化:在不能利用氧或氧供应不足时,机体分解葡萄糖生成乳酸的过程称为糖的无氧氧化,也称为乳酸发酵。 2.糖酵解的基本过程①葡萄糖在己糖激酶的催化下消耗1分子ATP生成葡糖-6-磷酸。②葡糖-6-磷酸异构为果糖-6-磷酸。 ③果糖-6-磷酸在磷酸果糖激酶-1的催化下消耗1分子的ATP生成果糖-1,6-二磷酸。 ④果糖-1,6-二磷酸在醛缩酶的催化下裂解为1分子磷酸二羟丙酮和1分子3-磷酸甘油醛。⑤磷酸二羟丙酮异构为3-磷酸甘油醛。(前面的步骤相当于1分子葡萄糖裂解产生了2分子3-磷酸甘油醛) ⑥3-磷酸甘油醛在3-磷酸甘油醛脱氢酶的催化下与1分子无机磷酸结合,脱下的氢由NAD+携带,生成1,3-二磷酸甘油酸(高能化合物)。⑦1,3-二磷酸甘油酸在磷酸甘油酸激酶的催化下水解高能磷酸键(底物水平磷酸化),产生ATP,生成3-磷酸甘油酸。⑧3-磷酸甘油酸变位为2-磷酸甘油酸。⑨2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸(高能化合物) 。⑩磷酸烯醇式丙酮酸在丙酮酸激酶的催化下生成丙酮酸,产生1分子A TP(底物水平磷酸化)。 该过程需要关注的几点:(1)三个限速反应:①③⑩,同时催化这三个反应的酶为关键酶(己糖激酶、磷酸果糖激酶-1、丙酮酸激酶) (2)该过程有两次底物水平磷酸化,包含了两个高能化合物(3)调节糖酵解流量最关键的酶是磷酸果糖激酶-1 (4)能量的产生与消耗 思考:1.1分子葡萄糖完全分解产生2分子丙酮酸可以产生多少个ATP? 2.糖原分子中葡萄糖酵解时可以净产生多少个ATP? 3.丙酮酸在在乳酸脱氢酶的作用下,由NADH+H+提供氢,使丙酮酸还原为乳酸 4.糖的无氧氧化的生理意义:①迅速提供能量,这对肌肉收缩很重要②成熟红细胞没有线粒体,只能依赖无氧氧化③神经细胞、白细胞、骨髓细胞等代谢极为活跃,即使不缺氧也常由糖的无氧氧化提供部分能量 (二)糖的有氧氧化 1.基本概念糖的有氧氧化是指机体利用氧将葡萄糖彻底氧化为CO2和H2O的反应过程。这个过程是体内糖分解供能的主要方式。 2.糖的有氧氧化的三个阶段 (1)同糖酵解(2)丙酮酸进入线粒体,丙酮酸在丙酮酸脱氢酶复合体(由转乙酰酶、二氢硫辛酸胺脱氢酶、丙酮酸脱氢酶组成)的催化下与辅酶A反应氧化脱羧,脱下的氢由NAD+携带,生成乙酰CoA和CO2。(参与的辅酶有TPP、硫辛酸、FAD、NAD+、CoA) (3)三羧酸循环(柠檬酸循环) ①乙酰CoA与草酰乙酸在柠檬酸合酶的催化下生成柠檬酸,反应所需的能量来自乙酰CoA。 ②柠檬酸经酶-顺乌头酸复合体异构为异柠檬酸。③异柠檬酸在异柠檬酸脱氢酶的催化下氧化脱羧,脱下的氢由NAD+携带,反应生成α-酮戊二酸及CO2。 ④α-酮戊二酸在α-酮戊二酸脱氢酶复合体的催化下与辅酶A反应氧化脱羧,脱下的氢由NAD+携带,反应生成琥珀酰CoA及CO2。 ⑤琥珀酰CoA在琥珀酰CoA合成酶的催化下水解掉高能硫酯键,与GDP磷酸化偶联,生成琥珀酸、GTP及CoA。 ⑥琥珀酸在琥珀酸脱氢酶的催化下生成延胡索酸,脱下的氢由FAD携带。 ⑦延胡索酸加水生成苹果酸。 ⑧苹果酸在苹果酸脱氢酶的催化下生成草酰乙酸,脱下的氢由NAD+携带。 该过程需要关注的几点:(1)三个限速反应:①③④,同时催化这三个反应的酶为关键酶(柠檬酸合酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶复合体)丙酮酸脱氢酶复合体也是关键酶(2)该过程只有一步水平磷酸化,只有一个高能化合物(当然乙酰CoA也是高能化合物) (3)生成三个NADH+H+和一个FADH2 (4)两次氧化脱羧(5)能量的产生与消耗 思考:1分子葡萄糖完全分解生成CO2和H2O可以产生多少ATP?(两种情况均思考)
参与细胞信号转导通路的蛋白简写及全拼
参与细胞信号转导通路的蛋白简写及全拼 4E-BP eIF4E binding protein Abl Ableson protein tyrosine kinase ACTR A histone acetyltransferase AIF Programmed cell death protein 8 ANT Adenine nucleotide translocation channel Apaf-1 Apoptotic protease activating factor 1 APP beta-Amyloid precursor protein APPs Acute phase proteins ASIP Agouti switch protein ASK Apoptosis signal-regulating kinase (e.g., ASK1) ATF-2 Activating transcription factor 2 ATM Ataxia telangiectasia?mutated protein kinase ATR ATM and Rad3?related protein kinase Bam32 B-cell adaptor molecule 32 kDa BCAP B-cell adaptor for PI3K Bcl-10 B-cell leukemia 10 protein Bfl-1 Bcl-2-related protein A1 Bid A BH3 domain?only death agonist protein Bimp1 B-lymphocyte-induced maturation protein 1 BLNK B-cell linker protein BRCA Breast cancer growth suppressor protein Btk Brutonís tyrosine kinase C3G Guanine nucleotide?releasing factor 2 CAD Caspase-activated deoxyribonuclease Cam Calmodulin CaMK Calcium/calmodulin-dependent kinase CAP c-Cbl-associated protein Cas p130CAS, Crk-associated substrate Caspase Cysteine proteases with aspartate specificity CBL Cellular homologue of the v-Cbl oncogene CBP CREB binding protein CD19 B-lymphocyte antigen CD19 CD22 B-cell receptor CD22 CD40 B-cell surface antigen CD40 CD45 Leukocyte common antigen, a phospho-tyrosine phosphatase CD5 Lymphocyte antigen CD5 cdc2 Cell division cycle protein 2, CDK1 cdc34 Cell division cycle protein 34, a ubiquitin conjugating (E2) enzyme cdc42 Cell division cycle protein 42, a G-protein CDK Cyclin-dependent kinase Chk Checkpoint kinase CHOP C/EBP homologous protein 10
肿瘤常见信号通路
1 JAK-STAT 信号通路 1) JAK 与STAT 蛋白 JAK-STAT 信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。 (1) 酪氨酸激酶相关受体( tyrosine kinase associated receptor ) 许多细胞因子和生长因子通过JAK-STAT 信号通路来传导信号,这包括白介素2?7 (IL-2?7 )、GM-CSF (粒细胞/巨噬细胞集落刺激因子)、GH (生长激素)、EGF (表皮生长因子)、PDGF (血小板衍生因子)以及IFN (干扰素)等等。这些细胞 因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK 的结合位点。受体与配体结合后,通过与之相结合的JAK 的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2) 酪氨酸激酶JAK ( Janus kinase ) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体( receptor tyrosine kinase, RTK ),而JAK 却是一类非跨膜型的酪氨酸激酶。JAK 是英文Janus kinase 的缩写,Janus 在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸化多个含特定 SH2结构域的信号分子。JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAK homology domain, JH ),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3) 转录因子STAT ( signal transducer and activator of transcription ) STAT 被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性 的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3结构域、SH2结构域及C-端的转录激活区。其中,序列上最保守和功能上最重要的区段是SH2结构域,它具 有与酪氨酸激酶Src的SH2结构域完全相同的核心序列“ GTFLLRFSS ”。 2) JAK-STAT 信号通路 与其它信号通路相比,JAK-STAT 信号通路的传递过程相对简单。信号传递过程如下:细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残 基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位
雌激素通过瘦素信号通路途径调节脂肪细胞代谢生成
雌激素通过瘦素信号通路途径调节脂肪细胞代谢生成
雌激素通过瘦素信号通路途径调节脂肪细 胞代谢生成# 李文娟,许良智,陈焱,牟丽,许文明,程萌,庄静,李婷婷,詹晶**
10 15 20 25 30 35 40
(四川大学华西第二医院,成都 610041) 摘要:目的:探讨雌激素是否是通过瘦素相关信号通路对女性形体改变产生影响。方法:二 月龄雌性 SD 大鼠随机为去势组及假手术组,术后 14 周收集生殖器周围脂肪、内脏脂肪和 皮下脂肪,并分别检测瘦素受体表达,同时通过 17-β雌二醇及瘦素对脂肪细胞前体细胞 MSCs 进行干预,检验瘦素受体亚型、瘦素表达及成脂分化的指标 PPARγ的变化。结果: 通过对造模期间大鼠体重的每周监测,发现去势组体重增长及术后 14 周Lee’s 指数均明显 高于假手术组 P 0.001 。瘦素受体在去势组的脂肪组织中表达显著增加,内脏脂肪中尤为明 显。体外实验显示,随着瘦素和雌激素浓度的增加,MSCs 上瘦素长形受体和短受体的表达 均随之下降;随雌激素浓度的增加,MSCs 中瘦素表达呈下降趋势,同时,MSCs 中 PPAR γ表达也受到抑制。结论:在低雌激素的影响下,去势后大鼠发生类似绝经后女性样的形体 改变,高浓度雌激素可抑制大鼠间充质干细胞向脂肪细胞分化,雌激素对瘦素及瘦素受体的 影响可能是绝经后女性体型变化发生变化的原因。
关键词:妇产科学;雌激素;瘦素;瘦素受;脂肪;间充质干细胞 中图分类号:R339.6 Estrogen regulate adipocyte metabolism through leptin signaling pathway LI Wenjuan, XU Liangzhi, CHEN Yan, MU Li, XU Wenming, CHENG Meng, ZHUANG Jing, LI Tingting, ZHAN Jing West China Second University Hospital, Sichuan University, Chengdu 610041 Abstract: Postmenopausal women often present obvious body composition changes under the absence of estrogen, including overweight, obesity and android-like body fat distribution, therefore poses serious threaten for women’s health. Although the intimate relationship between estrogen and body appearance have been noticed, mechanism remains unclear. We assumed that estrogen may regulate fat distribution through affecting leptin signal pathway, which has been shown playing major role in energy homeostasis. To test this hypothesis, we randomized female SD rat into ovariectomy OVX and sham group, and then collected adipose tissue around genital,
第九章 细胞信号转导知识点总结
第九章细胞信号转导 细胞通讯:一个信号产生细胞发出的信息通过介质(又称配体)传递到另一个靶细胞并与其相应的受体相互作用,然后通过信号转导产生靶细胞内一系列的生理生化变化,最终表现为靶细胞整体的生物学效应。 信号传导:是指信号分子从合成的细胞中释放出来,然后进行传递。信号传导强调信号的产生、分泌与传送。 信号转导:是指信号的识别、转移与转换,包括配体与受体的结合、第二信使的产生及其后的级联反应等。信号转导强调信号的接收与接收后信号转换的方式与结果。 受体:是一类能够结合细胞外特异性信号分子并启动细胞反应的蛋白质。 第二信使:细胞外信号分子不能进入细胞,它作用于细胞表面受体,经信号转导,在细胞内产生非蛋白类小分子,这种细胞内信号分子称为第二信使。 分子开关:细胞信号传递级联中,具有关闭和开启信号传递功能的分子。 信号通路:细胞接受外界信号,通过一整套特定机制,将胞外信号转化为胞内信号,最终调节特定基因表达,引起细胞的应答反应,这种反应系列称为细胞信号通路。 G蛋白偶联受体:指配体-受体复合物与靶细胞的作用是要通过与G蛋白的偶联,在细胞内产生第二信使,从而将细胞外信号跨膜传递到胞内影响细胞行为的受体。 cAMP信号通路:细胞外信号与细胞相应受体结合,导致细胞内第二信使cAMP 水平的变化而引起细胞反应的信号通路。 (磷脂酰肌醇信号通路)双信使系统:胞外信号分子与细胞表面G蛋白偶联受体结合,激活膜上的磷脂激酶C,使质膜上的PIP2分解成IP3和DAG两个第二信使,将胞外信号转导为胞内信号,两个第二信使分别激活两种不同的信号通路,即IP3-Ca2+和DAG-PKC途径,实现对胞外信号的应答,因此将这种信号通路称为“双信使系统”。 钙调蛋白:真核细胞中普遍存在的Ca2+应答蛋白。 Ras蛋白:Ras基因的产物,分布于质膜胞质侧,结合GTP时为活化状态,结合GDP时失活状态,因此Ras蛋白属于GTP结合蛋白,具有GTP酶活性,具有分子开关的作用。
猪脂肪代谢的整个网络
猪脂肪代谢的整个网络(消化---吸收---转运---贮存---分解合成) (一)脂肪的消化 猪的口腔和胃几乎不消化脂肪。脂类到达十二指肠后,在肠蠕动的作用下与胰液和胆汁混合,胆汁中的胆汁酸盐使脂肪乳化并形成水包油的小胶体颗粒,以便于脂肪和胰液在油水界面充分接触,脂肪被充分的消化。胰液中含多种消化脂肪的酶类,包括胰脂肪酶,辅脂酶,胆固醇酯酶和磷脂酶A2等。胰脂肪酶在辅酯酶的协助下将甘油三酯水解为甘油二酯和甘油一酯;磷脂酶A2将饲粮磷脂水解为溶血磷脂和脂肪酸;胆固醇酯酶将胆固醇酯水解为胆固醇和游离脂肪酸。 (二)脂肪的吸收 脂肪消化产物在十二指肠下段和空场被吸收。甘油和短中链脂肪酸直接经小肠粘膜细胞吸收入门静脉血液,而长链脂肪酸和2-甘油一酯以混合微粒到达小肠粘膜细胞被吸收,随后在黏膜细胞中转化为甘油三酯,磷脂,胆固醇酯及少量胆固醇,再与黏膜细胞内合成的载脂蛋白一起形成能溶于水的乳糜微粒,乳糜微粒以胞饮作用的逆过程溢出黏膜细胞,经细胞间隙进入乳糜管,再经淋巴系统进入血液,然后由血管内皮细胞的脂蛋白酶水解为游离脂肪酸和甘油而被组织利用。 (三)脂类的转运 血浆中所含的脂类叫做血脂,包括甘油三酯,磷脂,胆固醇及其酯和游离脂肪酸。 游离脂肪酸是与血浆清蛋白结合形成可溶性复合物运输,其他血浆中的脂类常与肝脏和小肠粘膜细胞合成的载脂蛋白结合形成脂蛋白,并以脂蛋白的形式运输。脂蛋白酯酶LPL对其运输有重要的调节作用,LPL活性的高低是脂肪蓄积程度的标志,也是决定脂肪细胞大小的重要因素。血浆中各种脂蛋白的基本结构基本相似,由疏水性较强的甘油三酯和胆固醇酯形成的内核和由双极性分子以单分子层形式形成的表层结构。根据不同脂蛋白所含脂类,蛋白质的多少,用超速离心法将脂蛋白分为五类,即乳糜微粒,极低密度脂蛋白,中密度脂蛋白,低密度脂蛋白和高密度脂蛋白。 血中脂肪转运到脂肪组织,肌肉,乳腺等的毛细血管后,游离脂肪酸通过被动扩散进入细胞内,甘油三酯经毛细血管壁中的酶分解成游离脂肪酸后再被吸收,未被细胞吸收的物质经血液循环回至肝脏代谢。 (四)脂类的代谢 动物体内脂类的代谢受饲粮营养物质含量的影响,超过需要时多余的营养物质转变成脂肪沉积在脂肪组织中,低于需要时分解体脂肪供能。 1肝脏中脂肪的代谢:肝脏是脂肪合成,运转和利用的主要器官,进入肝脏的脂肪来自于消化道的吸收,少部分来自体内脂肪组织。肝细胞可氧化游离脂肪酸 转变为能量,供细胞代谢利用。饲料来源的游离脂肪酸和内源性脂肪酸都可被 肝细胞摄取并重新合成甘油三酯,新合成的甘油三酯很快以脂蛋白的形式释放 入血液,少部分的内源性脂肪酸还可合成磷脂和胆固醇。多余的沉积在肝中。 2脂肪组织中脂肪的代谢:猪和反刍动物在脂肪组织中进行脂肪代谢,脂肪组织也是储存脂肪的主要部位,沉积在脂肪组织的甘油酯是预先合成的,或是在机 体内脂酰辅酶A和L-3-磷酸甘油反应合成。 脂酰辅酶A的合成:一是在细胞液中由乙酰辅酶A或丁酰辅酶A合成棕榈酸, 棕榈酸可转化成几乎所有其他脂肪酸。二是主要在内质网也有少量在线粒体中 合成丙二酰CoA,丙二酰辅酶A与酰基载体蛋白(ACP)结合形成丙二酰ACP复 合物,乙酰辅酶A与ACP结合,使脂肪酸连接上两个碳原子而延长,最终形成 棕榈酸ACP复合物。三是仅在内质网中进行,其作用是使饱和脂肪酸去饱和,
