化学选修4综合检测试卷

(g)
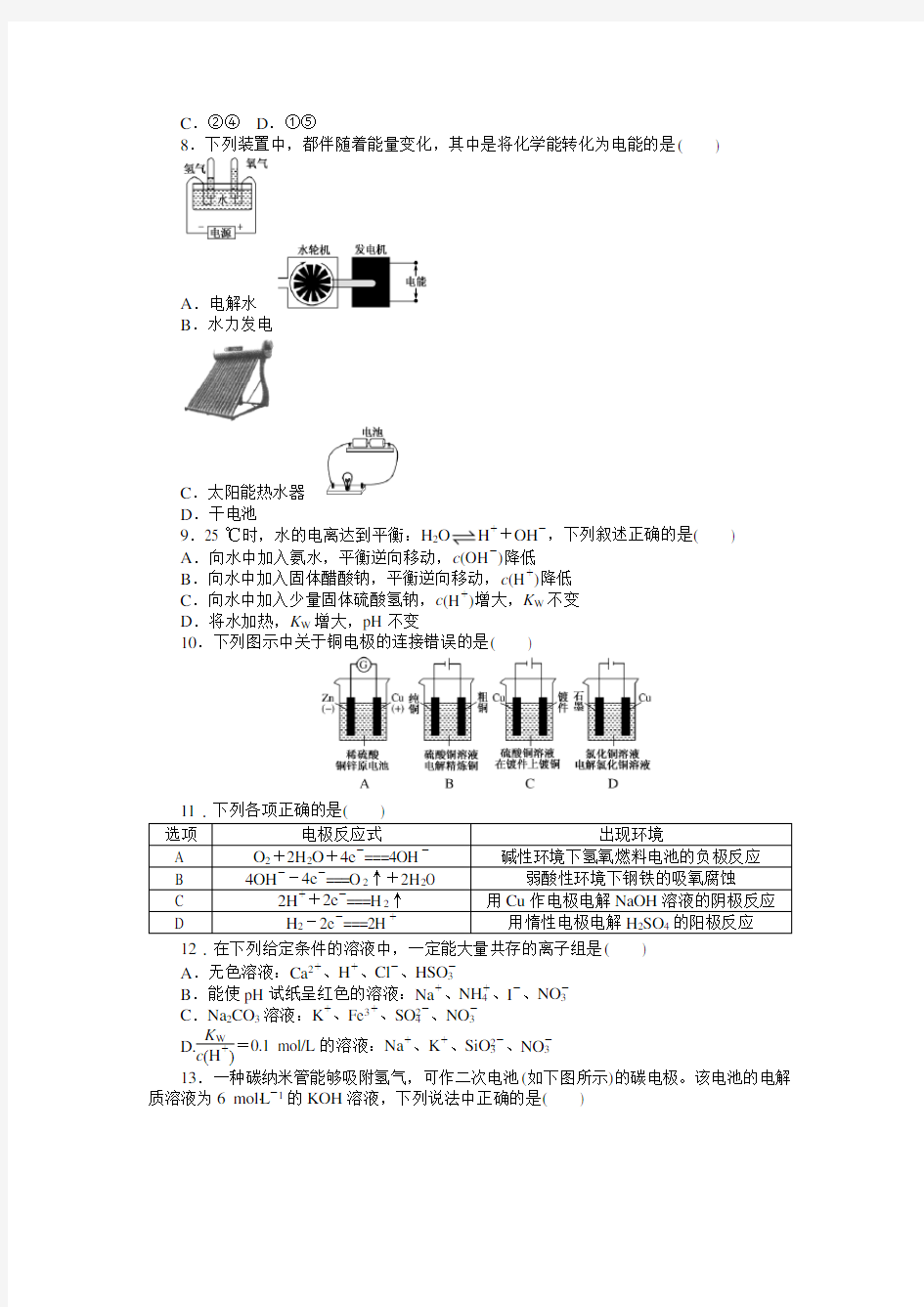
8.下列装置中,都伴随着能量变化,其中是将化学能转化为电能的是
A.电解水
B.水力发电
C.太阳能热水器
℃时,水的电离达到平衡:O H
.向水中加入氨水,平衡逆向移动,
.下列图示中关于铜电极的连接错误的是()
下列各项正确的是()
电极反应式出现环境
O+4e-===4OH-碱性环境下氢氧燃料电池的负极反应
-===O
↑+2H2O 弱酸性环境下钢铁的吸氧腐蚀
2
+2e-===H2↑用Cu作电极电解NaOH
-2e-===2H+用惰性电极电解H SO
.放电时电池负极的电极反应为H2-2e-===2H+
.放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)
.该电池充电时将碳电极与外接电源的正极相连,发生氧化反应
2A(g)+B(g) 2C(g)ΔH<0,下列各图中正确的是
=3的醋酸溶液中加入水稀释后,下列说法正确的是
.溶液中导电粒子的数目减少
-)
不变
(OH-)
.醋酸的电离程度增大,c(H+)亦增大
的NaOH溶液,混合液的pH=7
B(g)2C(g),根据下表中的数据判断下列图象错误的是
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。
.燃料电池工作时,正极反应为O2+4H++4e-===2H2O
极是铜时,b极逐渐溶解,a极上有铜析出
极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与
两极均是石墨时,在相同条件下,a极产生的气体与电池中消耗的
AgCl(s)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
c点变到d点
-浓度减小
点对应的K
20.有关下列四个常用电化学装置的叙述中,正确的是(
碱性锌锰电池图Ⅱ铅-硫酸蓄电
池
电解精炼铜银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
二、非选择题(本题包括5小题,共60分)
21.(12分)Ⅰ.下列有关实验的说法正确的是________。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明K sp(ZnS) 实验序号待测液体积(mL) 所消耗NaOH标准液的体积(mL) 滴定前滴定后 1 20.00 0.50 20.54 2 20.00 6.00 26.00 3 20.00 1.40 21.36 (1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点________________________________________________________________________ ________________________________________________________________________。 (2)盐酸的物质的量浓度为 ________________________________________________________________________。 (3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是______________(填“偏高”或“偏低”或“无影响”)。 (4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,该反应的离子方程式为 ________________________________________________________________________ ________________________________________________________________________。 22.(12分)研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:Ⅰ.(1) 已知一氧化碳与水蒸气反应过程的能量变化如图所示: ①反应的热化学方程式为 ________________________________________________________________________ ________________________________________________________________________。 ②已知:C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g)ΔH=________。 (2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=________________________________________________________________________。 Ⅱ.下图是一个化学过程的示意图,回答下列问题: 的密闭容器内,加入 (g) 该反应的化学平衡常数表达式为________。 根据图甲数据,反应开始至达到平衡时,平均速率v(HI)为________ 反应达到平衡后,第8分钟时: 化学平衡常数K________(填“增大”“减小”或“不变” 用图乙中a~c的编号回答)。 浓度的变化正确的是________(用图乙中d~f的编号回答 (4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。 25.(12分) 某课外活动小组用如图装置进行实验,试回答下列问题: (1)若开始时开关K与a连接,则B极的电极反应式为________。 (2)若开始时开关K与b连接,则B极的电极反应式为__________________,总反应的离子方程式为 ________________________________________________________________________。 有关上述实验,下列说法正确的是________(填序号)。 ①溶液中Na+向A极移动②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度④若标准状况下B极产生2.24 L 气体,则溶液中转移0.2 mol电子 (3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。 ①该电解槽的阳极反应式为 ________________________________________________________________________ ________。此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。 ②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。 ③通电开始后,阴极附近溶液pH会增大,请简述原因。 ________________________________________________________________________。 ④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 ________________________________________________________________________。
