高一化学计算题专题学生
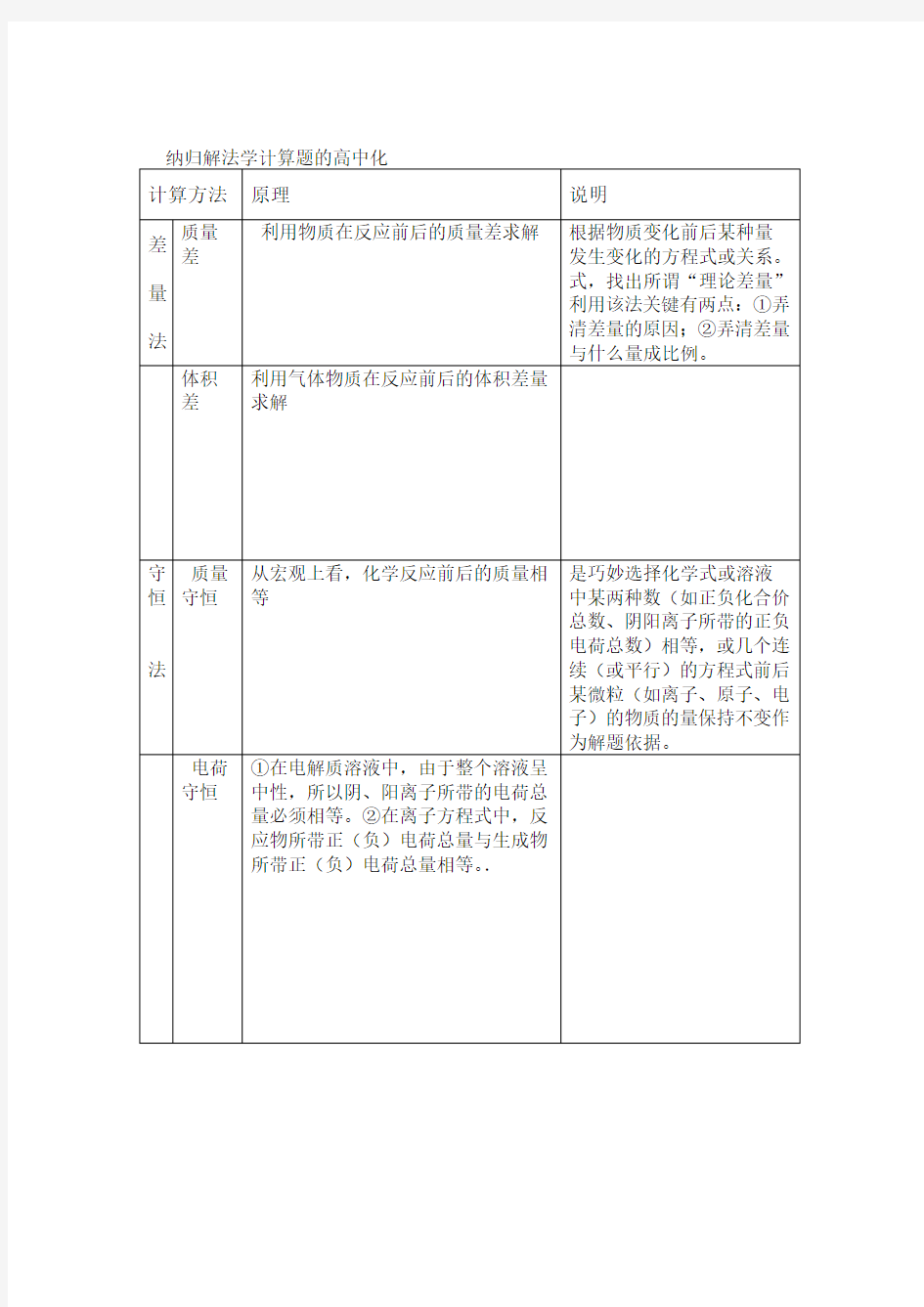

)一(化学计算的解题方法与技巧.
一、守恒法如化合价数、正负电荷(利用电荷守恒和原子守恒为基础,就是巧妙地选择化学式中某两数总数)始终保持相等,或几个连续的化学方程式前后某微粒(如原子、电子、离子)的物质的量保持不变,作为解题的依据,这样不用计算中间产物的数量,从而提高解题速度和准确性。(一)原子个数守恒
【例题1】某无水混合物由硫酸亚铁和硫酸铁组成,测知该混合物中的硫的质量分数为a ,求混合物中铁的质量分数2--的HCO0.8molCO,求所得的溶液中CO 和的【例题2】用1L 1mol/LNaOH溶液吸收323物质的量之比为(二)电荷守恒--即对任一电中性的体系,如化合物、混和物、溶液等,电荷的代数和为零,即正电荷总数和负电荷总数相等。
+2-+]=y L, [K ]= x mol/[Na,]=0.2mol/L[SO的混和溶液中,Na【例题3】在SO 和KSO如果42244mol/L,则x和y的关系是
) (
0.1 (D)y=2x-(B)x=0.1+0.5y (C)y=2(x-0.1) )(Ax=0.5y
3--HCO和,求所得的溶液中0.8molCONaOH1mol/L】用4【例题】1L 的溶液吸收CO322的物质的量之比为
(三)电子守恒--是指在发生氧化还原反应时,氧化剂得到的电子数一定等于还原剂失去的电子数,无论是自发进行的氧化-还原反应还是原电池或电解池中均如此。
【例题5】将纯铁丝5.21克溶于过量稀盐酸中,在加热条件下,用2.53克KNO 去氧化溶32+2+溶液才能完全氧化,0.3mol/L KMnO离子尚需液中Fe12ml ,待反应后剩余的Fe4完全反应的方程式。和FeCl写出KNO23(标况)氯气,反应完全后,溶液中有2.24L溶液中缓缓通入6】往150mLFeBr【例题2的物质的量浓度。FeBr21/3的溴离子被氧化成溴单质。求原溶液(四)质量守恒--质量守恒就是化学反应前后各物质的质量总和不变,在配制或稀释溶液的过程中,溶质
的质量不变。
【例题7】取一定量的KClO和MnO的混合物共热制取O,反应开始时MnO在混合物中2223的质量分数为20%,当反应进行到MnO在混合物中的质量分数为25%时,求KClO的分32解百分率。【例题8】:某盐的饱和溶液的质量分数为26.8%,取一定量的此饱和溶液,加入wg该无水盐,在温度不变的情况下,析出mg含有一定量结晶水的该盐晶体,则从饱和溶液中析出溶质的质量为
( )
26.8%×(m-w)(D) 26.8% (m+w)(C) (B ) (A) 26.8%w m-w
×【例题10】:将某二价金属R的单质粉末投入到200mL浓度为溶液中,H2SO4的L1mol/
待完全反应后滤去过量的金属粉末,蒸发溶液到剩余84g时,保持温度为t℃,
开始析出RSO4·7H2O晶体。在该温度下继续蒸发,当析出20.5g晶体时,还留下49g溶液。求金属的相对原子质量。R【例题11】:向一定量的NaOH固体中
加入由硫酸铜和硫酸组成的混合物的溶液,充分搅拌,恰好完全反应,有蓝色沉淀生成,过滤,所得滤液的质量与加入的原混合物溶液的质量相等。则与硫酸铜反应的氢氧化钠和与硫酸反应的氢氧化钠的物质的量之比为
时,碳酸铵完全分解产生气态混合物,其密度是相同条件下氢气密度的1500C12】【例题) (
倍)32 (D )12倍(A)96倍(B)48倍(C(五)原子的物质的量守恒--即反应前后各元素种类不变,各元素原子个数不变,其物质的
量、质量也不变。
K2CO3 含经分析测知其含水2.8%、【例题13】有一在空气中放置了一段时间的KOH固体,37.3% 取1克该样品投入25毫升2摩/升的盐酸中后,多余的盐酸用1.0摩/升KOH溶液) ( 毫升恰好完全中和,蒸发中和后的溶液可得到固体30.8
克2.836D 0.797C 3.725B 1A()克()克()克()(六)化合价
数值守恒.
,则该氧化物5144.0%,已知该元素的相对原子质量为【例题14】某元素X的氧化物含氧)的化学式为(
O( D)X (C)XO OB A()XO ()X 53523(七)体积守恒
【例题15】有一真空瓶的质量为M1 g,该瓶充入空气总质量为M2 g,在相同状况下,若该A的相对分子质量为后,总质量为瓶充某气体AM3g。则差量法
二
根据物质变化前后某种量发生变化的方程式或关系式,找出所谓“理论差量”。利用该法关键有两点:①弄清差量的原因;②弄清差量与什么量成比例。1、12.4g FeO与CuO的混合物与足量的CO充分反应后,固体质量减少3.1g,求原混合物32中FeO与CuO的质量比为多少。322、已知常温下H的密度是0.893g/L,某烧杯中加入50.0ml水,并放入一小块金属钠,反2应完全后冷却,称量所得溶液,其质量为52.2g,试求:
1)加入钠的质量(用差量法求解)
2)所得H在常温下的体积2的质量分数NaOH)所得溶液中3.
3、在120摄氏度,一个大气压下有CO2和水蒸气的混合气体4.76g,将混合气体缓缓通入37.16g足量的Na2O2中充分反应后,固体质量变为40g求
1.混合气体中CO2和水蒸气的物质的量
4、将氢氧化钠和碳酸氢钠的固体混合物20.8g在密闭容器中加热到约250摄氏度,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9g。试计算原混合物中氢氧化钠的质量分数。
5、将铁棒放入硫酸铜溶液中,在铁棒上析出红色物质,过一段时间后,取出铁棒称量,发现质量比原来增加4g,问有多少克铜析出?参加反应的铁是多少克?
6、天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为a mol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡。
7、将一定质量的小苏打和铜混合物在空气中加热到质量不再变化时,发现加热前后质量不变,则原混合物铜的质量分数。
8、将质量为m的NaHCO固体加热分解一段时间后,测得剩余固体的质量为m(1)未分解31的NaHCO的质量为___________。3(2)生成的NaCO 的质量为__________。32(3)当剩余的固体的质量为___________,可以断定NaHCO已完全分解。3.
【例题9】mg Fe与含有HSO的CuSO溶液中完全反应后,剩余固体m g。则参加反应442的CuSO与HSO的物质的量之比为
424)(
8:7 D C 7:8 A 7:1 B 1:7
【例题10】为了检验某含有NaHCO杂质的NaCO样品的纯度,现将w1g样品加热,其323质量变为w2g,则该样品的纯度为(质量分数)是
()A (84w2 —53w1)/31w1 B 84(w1—w2)/31w1/31w184w1)D (115w2— C (73w2—42w1)/31w1
平均值法极值法关系式法三) ( 水中,完全反应后溶液中溶质的质量分数为【例题1】将2.3g 金属钠放入100g
100% ×4/100+4-1.8 B A 4 / 100+2.3 ×100%
100% × D 4/100+2.3-0.1 ×100% C
4/100+4
【例题2】铝分别与足量稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸与氢氧化钠的物质的量之比为
