杂环化合物命名

杂环化合物命名
一)特定杂环的俗名合半俗名
IUPAC 原则规定,具有特定俗名和半俗名的杂环共45 个
HH
Thiophene Furan1H-Imidazole1H-Pyrazole Thiazole
噻吩呋喃1H- 咪唑1H- 吡咯噻唑
O
N
N
N
N N
N N
2H-Pyran Pyridine Pyrazine Pyrimidine
2H-b 吡喃吡啶哌嗪嘧啶
Oxazole
恶唑
Pyridazine
哒嗪
4H-Quinolizine Quinoline
4H-喹嗪喹啉
Phthalazine [1,8]Naphthyridine Quinoxaline 酞嗪[1,8]萘
啶喹喔啉
7
Phenanthroline
654
Phenoxathiine
Phenanthridine
菲啶菲咯啉(1 ,7
位)
吲嗪1H- 吲哚
7H-Purine
7H- 嘌呤
吩噻恶
64 9H-beta-
Carboline 9H-bete-
咔啉
1H-Indazole
1H- 吲唑
Acridine
丫啶
Phenazine
吩嗪
9H-Carbazole
10H-Phenothiazine
10H- 吩噻嗪以上杂环氢的位置不同者,把H(大写、斜体)及其标号放在词首,在并环
上者,注明边号(用 a 、b 、c 表示)
当杂原子在环上的位置不同时,可视为异构体
几点说明
( 1) 杂环的写法可以不同,但是位号不变。
( 2) 单杂环的编号从杂原子开始, 并使其他杂原子或指示氢位号尽可能小; 杂 原子不
同时,要使优先的杂原子号小,常见的位 O ,S ,-NH- ,-N=顺序; 只含一个杂原子的单杂环,也可对杂原子旁的碳用 αβ γ进行编号。
( 3) 稠杂环有其固定的编号顺序, 通常从一端开始,依次编号一周(公用碳不 编号,
如需编号时,用前一位加 a,b,c 表示),并尽可能使杂原子,特别使 优先的杂原子号小; 也有的杂环按相应的环烃编号, 此时杂原子编号最大 (见咔唑,丫啶),嘌呤使个特例,不仅公用碳编号,且编号顺序也很特 别。
( 4) 含两个以上杂原子的五元单杂环, 其中至少含一个氮原子的通称 “某唑”; 含两
个以上杂原子(至少一个位氮)的六元单杂环多称为“某嗪” ;含氧 的称“恶”;含硫的称“噻”。例如:
5) 杂环已经含有最大数目的非聚集双键之外, 还含有的饱和氢原子 (两个二 价元素
中间的饱和氢不算)称做“指示氢”或“额外氢”或“标氢” 。指 示氢不同的异构体,以其位号加“ H ”(斜体大写)作词首来表示。
6) 若杂环尚未含有最大数目的非聚集双键, 这样的饱和氢原子为外加氢。 命 名时要
指明加氢的位置和数目,全部饱和可以省略位置。
7) 含活泼氢的杂环及其衍生物, 可能存在互变异构体, 结构不同,名称也异; 命名
时尚需标明两种可能的位号 。
8) 杂环母环的名称确定之后。 就可参照芳香化合物的命名方法, 将环上取代 基位
置,数目及名称,以词首或词尾的形式加在环名的前后,有时杂环也
NN [1,3,4]Oxadiazole 1, 3, 4-恶二唑
[1,2,5]Thiadiazole 1, 2, 5-噻二唑
N
N N N
[1,2, 4]Tr iazine 1,2, 4-三嗪
O
4H-Pyran 4H-吡喃
3H-Indole 3H- 吲 哚
4aH-Carbazole 4aH- 咔 唑
2H-Isoindole
异吲 哚
Isothiazole
异噻唑
Isoxazole
异恶唑
Isoquinoline
异喹啉
可以作为取代基命名。
(二) 无特定名称的稠杂环母环的命名规则 以下为单边稠和的稠杂环的命名规则。
1. 选择基本环的次序规则 芳环与杂环稠和,以杂环为基本环;杂杂稠和, 按以下先
后次序选择基本环。命名时,附加部分在前,基本环在后,二 者之间加一“并”字。
(1) 选含氮的组分为基本环。例如
3) 选环数最多且有特定名称的环为基本环。例如:
H
称作:吡啶并咔唑 不可称作: 吲哚并异喹啉
4) 选较大的环为基本环。例如:
(5) 选杂原子数目最多的为基本环。例如:
NN
N
称作:吡啶并嘧啶 不可称作:嘧啶并吡啶
(6) 选杂原子种类较多的为基本环。例如:
H
称作 :苯并异喹啉 (名称步完整) 不可称作: 吡啶并萘或萘并吡啶
称作:噻吩并吡咯 不可称作:吡咯并噻吩
2) 如无含氮杂环,可选含较优先杂原子的杂环为基本环。例如:
称作: 噻吩并呋喃
不可称作:呋喃并噻吩
O O O
称作:
呋喃并吡喃
不可称作:吡喃并呋喃
H
ON
O N N
N称作:吡唑并恶唑不可称作:恶唑并吡唑
7)
如果组分所含杂原子数目,种类及环大小均相同,选择并联前杂原子编号最小的为基本环。例如:
8) 如果仇恨处有杂原子,可视为两组分均含此杂原子,然后按上述 规则选择基
本环。例如:
2. 稠和边是用附加环很基本环两组分的位号表示。基本上按原编号规则, 附加环仍用 1,2,3,?标注原子;基本环改用 a,b,c ?表示各边( 1,2 之间为 a ;2,3 之间为 b ? );当有选择时(例如都是氮原子) ,应使仇恨 边位号尽可能小。命名时阿拉伯
数字在前,因为字母在后,中间用一横 线相连,外面加方括号,置“并”字之后。基本环名称之前。例如 :
1
S 2 a O b a
c
aNb
c
h
e
d
H2
a
O N 1 N a b O c d N N 1
3
H3
gf
4
* 称作: 噻吩并 [2, 3-b]呋喃
** 称作:噻吩并 [3, 2-b]吡咯(数字先后要与基本环边的走向一致) *** 称作:苯并 [h] 异喹啉噻唑 **** 称作:吡唑并 [4, 3-d]恶唑
不可称作:吡唑并 [4,5-d] 恶唑(标氢所在位置将以周边编号表示)
3. 周边编号方法 在环系画法正确的前提下,从右上角最远环的自由角(即邻接稠和边
的 顶端原子)开始,按顺时针方向以次编号,公用碳不编号,例如:
* 全名称作: 7H-吡啶并 [4,3-c]咔唑( 7H-Pyrido[4,3-c]carbazole )
** 全名称作:5-苯基咪唑并 [2,1-b] 噻唑(5-Phenylimidazo[2,1-b]thiazole )
环系正确画法:
1) 六元环要竖写, 五元环角向上或向下。 要使横排环数最多; 如右选择, 使
右上象限环数最多,且左下象限环数最少。例如:
2) 如按上述规则, 仍右两种不同的写法时, 则按下列编号要求以次选择:
不可称作:哒嗪并吡嗪
称作:咪唑并噻唑
2 3
课题:配位化合物的基本概念
课题:配位化合物的基本概念 课型:课时:上课时间: 学习目标: 1、了解配合物的形成原理 2、知道配位键、配合物、配离子等基本概念 3、掌握配合物的组成和命名 重、难点: 1、配合物的组成 2、配合物的命名 学习过程: 课前检测: (一)完成下面方程式: 1、硫酸铜与氨水反应 2、硫酸铜与氯化钡反应 3、硝酸银与氨水反应 (二)溶度积规则Qi与Ksp的关系 学习新课 一、配合物的定义 [实验探究] 1、取一支试管加入5mL 0.1mol/L CuSO4溶液,然后逐滴加入2mol/L NH3·H2O 溶液至过量,观察并记录现象 。 2、将上述溶液分成两份,一份滴加数滴0.1mol/L BaCl2溶液,另一份滴加数滴1mol/L NaOH溶液,观察并记录现象 。 3、分析实验现象,你能得出什么结论: 。 (沉淀-溶解平衡考虑) [自学反馈]预习P130配合物的定义,理解下列几个基本概念 1、配位键 2、配离子 3、配合物 二、配合物的组成 [自学反馈]预习P131配合物的组成,掌握配合物的组成 以[Cu(NH3)4]SO4为例,分析其组成 [Cu(NH3)4]SO4
1、中心原子:通常是, 例如:。 2、配位体:提供的分子和离子叫配位体 例如:。 配位原子:配位体中原子叫配位原子 例如:。 3、配位数:作为直接与结合的的数目,即形成配位键的数目称为配位数。 4、配离子的电荷数:配离子的电荷数等于和电荷数的代数和。 5、内界和外界:配合物分为内界和外界,其中称为内界,与内界发生电性匹配的称为外界。 三、配合物的命名 [自学反馈]预习P132配合物的命名,熟悉配合物的命名规则 1、配离子的命名: 2、配位酸: 3、配位碱: 4、配位盐: 自学检测:命名下列配合物 (1)K2[PtCl6] (2)K4[Fe(CN)6] (3)[Co(NH3)6]Cl3; (4)[CrCl2(H2O)4]Cl (5)[Co(NO3)3(NH3)3] (6)[Fe(CO)5]
完整版化合物英文命名规则
Nomenclature of Inorganic Compounds无机化合物的命名 (Prefix词头,前缀Suffix词尾,后缀Stem词根) 1.Trivial Names俗名 H2O water不说dihydrogen oxide NH3 ammonia不说nitrogen trihydride CaO quicklime CaCO3 limestone 2.Systematic Nomenclature系统命名 1)Oxide氧化物——先命名非氧元素 ZnOzinc oxide CaO calcium oxide CO carbon oxide Na2O2 sodium peroxide H2O2hydrogen peroxide 注:peroxide过氧化物 2)Hydroxide氢氧化物(base碱) Ba(OH)2 barium hydroxide KOH potassium hydroxide 3)Acid酸 Hydro acid氢酸General formula通式:HnX 命名:hydro- + stem of X + -ic acid H2S hydrosulfuric acid(英) hydrosulphuric(美) 氢硫酸S:sulfur(英)、sulphur(美) HBr 氢溴酸hydrobromic acidBr: bromine HCl 氢氯酸(盐酸)hydrochloric acidCl: chlorine HF 氢氟酸hydrofluoric acidF: fluorine Oxoacid or Oxyacid含氧酸General formula通式:HnXOm 命名:Stem of X + -ic acid 注:oxo-(oxy-) 含氧, 氧代 H2SO4 sulfuric acid(英) sulphuric acid(美) H2CO3 carbonic acid H3PO4 phosphoric acid P: phosphorus H3BO3 boric acid B: boron HNO3 nitric acid N: nitrogen If X has two oxidation states: -ic:the higher oxidation state -ous:the lower oxidation state H2SO4 sulfuric acid H2SO3 sulfurous acid 1/5 HNO3 nitric acid HNO2 nitrous acid If X (such as halogens) has more than two oxidation states: halogen卤素 per- (过,高) + -ic:the still higher oxidation state hypo- (次,在?下) + -ous:the still lower oxidation state HClO3 chloric acid HClO2 chlorous acid HClO4 perchloric acid
杂环化合物命名
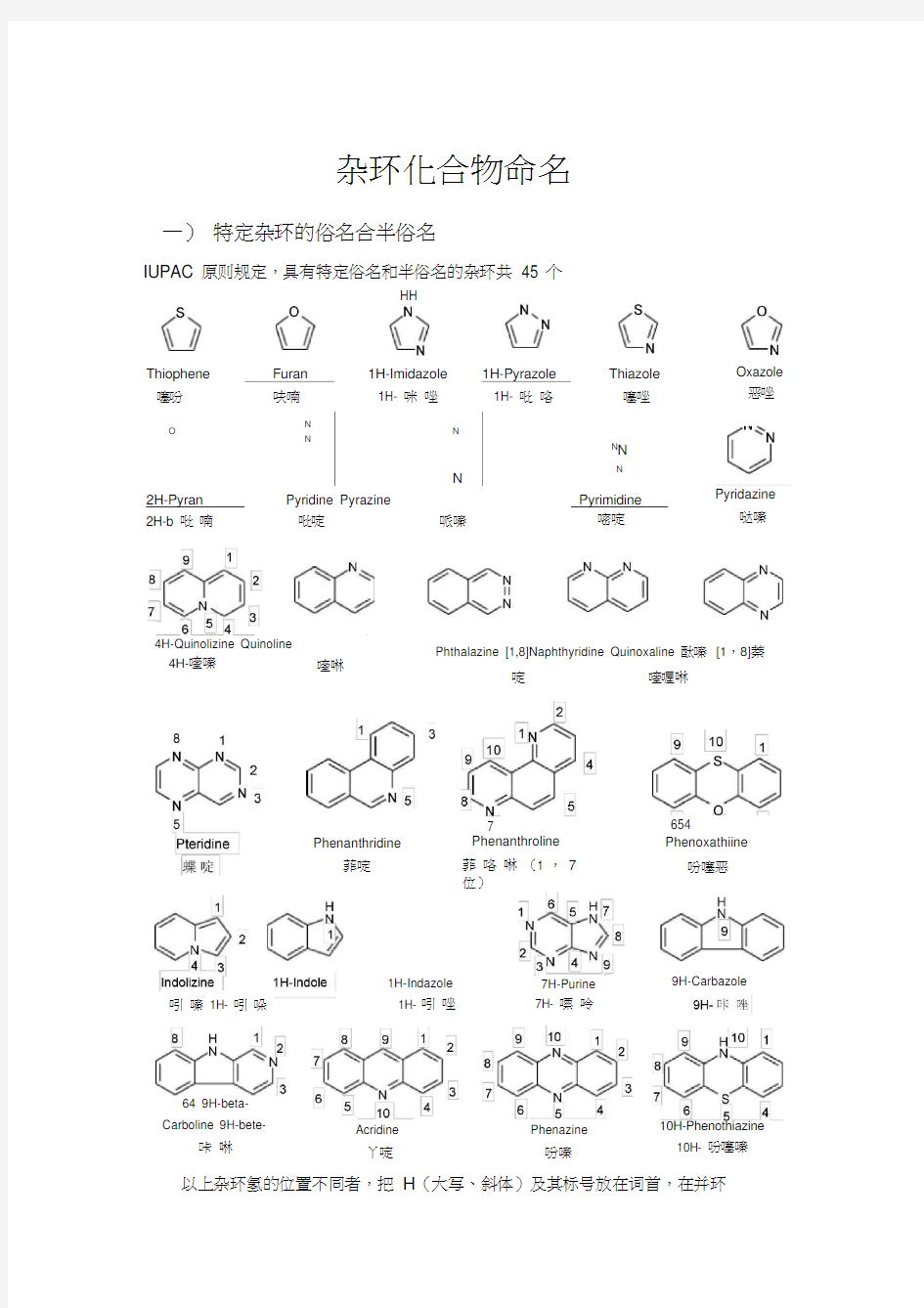
杂环化合物命名 一)特定杂环的俗名合半俗名 IUPAC 原则规定,具有特定俗名和半俗名的杂环共45 个 HH Thiophene Furan1H-Imidazole1H-Pyrazole Thiazole 噻吩呋喃1H- 咪唑1H- 吡咯噻唑 O N N N N N N N 2H-Pyran Pyridine Pyrazine Pyrimidine 2H-b 吡喃吡啶哌嗪嘧啶 Oxazole 恶唑 Pyridazine 哒嗪 4H-Quinolizine Quinoline 4H-喹嗪喹啉 Phthalazine [1,8]Naphthyridine Quinoxaline 酞嗪[1,8]萘 啶喹喔啉 7 Phenanthroline 654 Phenoxathiine Phenanthridine 菲啶菲咯啉(1 ,7 位) 吲嗪1H- 吲哚 7H-Purine 7H- 嘌呤 吩噻恶 64 9H-beta- Carboline 9H-bete- 咔啉 1H-Indazole 1H- 吲唑 Acridine 丫啶 Phenazine 吩嗪 9H-Carbazole 10H-Phenothiazine 10H- 吩噻嗪以上杂环氢的位置不同者,把H(大写、斜体)及其标号放在词首,在并环
上者,注明边号(用 a 、b 、c 表示) 当杂原子在环上的位置不同时,可视为异构体 几点说明 ( 1) 杂环的写法可以不同,但是位号不变。 ( 2) 单杂环的编号从杂原子开始, 并使其他杂原子或指示氢位号尽可能小; 杂 原子不 同时,要使优先的杂原子号小,常见的位 O ,S ,-NH- ,-N=顺序; 只含一个杂原子的单杂环,也可对杂原子旁的碳用 αβ γ进行编号。 ( 3) 稠杂环有其固定的编号顺序, 通常从一端开始,依次编号一周(公用碳不 编号, 如需编号时,用前一位加 a,b,c 表示),并尽可能使杂原子,特别使 优先的杂原子号小; 也有的杂环按相应的环烃编号, 此时杂原子编号最大 (见咔唑,丫啶),嘌呤使个特例,不仅公用碳编号,且编号顺序也很特 别。 ( 4) 含两个以上杂原子的五元单杂环, 其中至少含一个氮原子的通称 “某唑”; 含两 个以上杂原子(至少一个位氮)的六元单杂环多称为“某嗪” ;含氧 的称“恶”;含硫的称“噻”。例如: 5) 杂环已经含有最大数目的非聚集双键之外, 还含有的饱和氢原子 (两个二 价元素 中间的饱和氢不算)称做“指示氢”或“额外氢”或“标氢” 。指 示氢不同的异构体,以其位号加“ H ”(斜体大写)作词首来表示。 6) 若杂环尚未含有最大数目的非聚集双键, 这样的饱和氢原子为外加氢。 命 名时要 指明加氢的位置和数目,全部饱和可以省略位置。 7) 含活泼氢的杂环及其衍生物, 可能存在互变异构体, 结构不同,名称也异; 命名 时尚需标明两种可能的位号 。 8) 杂环母环的名称确定之后。 就可参照芳香化合物的命名方法, 将环上取代 基位 置,数目及名称,以词首或词尾的形式加在环名的前后,有时杂环也 NN [1,3,4]Oxadiazole 1, 3, 4-恶二唑 [1,2,5]Thiadiazole 1, 2, 5-噻二唑 N N N N [1,2, 4]Tr iazine 1,2, 4-三嗪 O 4H-Pyran 4H-吡喃 3H-Indole 3H- 吲 哚 4aH-Carbazole 4aH- 咔 唑 2H-Isoindole 异吲 哚 Isothiazole 异噻唑 Isoxazole 异恶唑 Isoquinoline 异喹啉
有机化合物命名规则大全
有机化合物命名规则大全 有机化合物种类繁多,数目庞大,即使同一分子式,也有不同的异构体,若没有一个完整的命名(nomenclature)方法来区分各个化合物,在文献中会造成极大的混乱,因此认真学习每一类化合物的命名是有机化学的一项重要内容。现在书籍、期刊中经常使用普通命名法和国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry)命名法, 后者简称IUPAC命名法。 一、链烷烃的命名 1. 系统命名法 (1)直链烷烃的命名 直链烷烃(n?alkanes)的名称用“碳原子数+烷”来表示。当碳原子数为1?10时,依次用天干——甲、乙、丙、丁、戊、己、庚、辛、壬、癸——表示。碳原子数超过10时,用数字表示。例如:六个碳的直链烷烃称为已烷。十四个碳的直链烷烃称为十四烷。烷烃的英文名称是alkane,词尾用ane。表1列出了一些正烷烃的中英文名称: 表1 正烷烃的名称
以上20个碳以内的烷烃要比较熟悉,以后经常要用。烷烃的英文名称变化是有规律的,认真阅读上表即可看出。表中的正(n ?)表示直链烷烃,正(n ?)可以省略。 (2)支链烷烃的命名 有分支的烷烃称为支链烷烃(branched ?chain alkanes )。 (i )碳原子的级 下面化合物中含有四种不同碳原子: CH 3 C CH 33C CH 3H C H H CH 3 (i) (i) (i) (i) (i) (ii)(iii)(iv) ① 与一个碳相连的碳原子是一级碳原子,用1?C 表示(或称伯碳,primary carbon ),1?C 上的氢称为一级氢,用1?H 表示。 ② 与两个碳相连的碳原子是二级碳原子,用2?C 表示(或称仲碳,secondary carbon ),2?C 上的氢称为二级氢,用2?H 表示。 ③ 与三个碳相连的碳原子是三级碳原子,用3?C 表示(或称叔碳,tertiary carbon ),3?C 上的氢称为三级氢,用3?H 表示。 ④ 与四个碳相连的碳原子是四级碳原子,用4?C 表示(或称季碳,quaternary carbon ) (ii )烷基的名称 烷烃去掉一个氢原子后剩下的部分称为烷基。英文名称为alkyl ,即将烷烃的词尾?ane 改为?yl 。烷基可以用普通命名法命名,也可以用系统命名法命名。表2列出了一些常见烷基的名称。
有机化合物的命名
有机化合物的命名 Corporation standardization office #QS8QHH-HHGX8Q8-GNHHJ8
第三节有机化合物的命名 一、烷烃命名时要注意哪些问题命名的基本原则有哪些 1.烷烃命名的步骤 口诀为:选主链,称某烷;编号位,定支链;取代基,写在前;标位置,短线连;不同基,简到繁;相同基,合并算。 (1)找主链:最长、最多定主链 ①选择最长碳链作为主链。 应选含6个碳原子的碳链为主链,如虚线所示。 ②当有几个不同的碳链时,选择含支链最多的一个作为主链。如 含7个碳原子的链有A、B、C三条,因A有三个支链,含支链最多,故应选A为主链。 (2)编碳号:编号位要遵循“近”、“简”、“小” ①以离支链较近的主链一端为起点编号,即首先要考虑“近”。如: ②有两个不同的支链,且分别处于距主链两端同近的位置,则从较简单的支链一端开始编号。即同“近”,考虑“简”。如 ③若有两个相同的支链,且分别处于距主链两端同近的位置,而中间还有其他支链,从主链的两个方向编号,可得两种不同的编号系列,两系列中各位次和最小者即为正确的编号,即同“近”、同“简”,考虑“小”。如: (3)写名称 按主链的碳原子数称为相应的某烷,在其前写出支链的位号和名称。原则是:先简后
繁,相同合并,位号指明。阿拉伯数字之间用“,”相隔,汉字与阿拉伯数字用“-”连接。如 命名为:2,4,6-三甲基-3-乙基庚烷。 2.烷烃命名的5个原则和5个必须 (1)5个原则 ①最长原则:应选最长的碳链作主链; ②最近原则:应从离支链最近的一端对主链碳原子编号; ③最多原则:若存在多条等长主链时,应选择含支链较多的碳链作主链; ④最小原则:若相同的支链距主链两端等长时,应以支链位号之和为最小为原则,对主链碳原子编号; ⑤最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子编号。 (2)5个必须 ①取代基的位号必须用阿拉伯数字“2,3,4……”表示; ②相同取代基的个数,必须用中文数字“二,三,四,……”表示; ③位号2,3,4等相邻时,必须用逗号“,”表示(不能用顿号“、”); ④名称中凡阿拉伯数字与汉字相邻时,必须用短线“-”隔开; ⑤若有多种取代基,不管其位号大小如何,都必须把简单的写在前面,复杂的写在后面。 二、烯烃和炔烃的命名与烷烃的命名有哪些不同之处 1.主链选择不同 烷烃命名时要求选择分子结构中的所有碳链中的最长碳链作为主链,而烯烃或炔烃要求选择含有碳碳双键或三键的最长碳链作为主链,也就是烯烃或炔烃选择的主链不一定是分子中的最长碳链。 2.编号定位不同 编号时,烷烃要求离支链最近,即保证支链的位置尽可能的小,而烯烃或炔烃要求离双键或三键最近,保证双键或三键的位置最小。但如果两端离双键或三键的位置相同,则从距离取代基较近的一端开始编号。 3.书写名称不同 必须在“某烯”或“某炔”前标明双键或三键的位置。 以CH3CH2CCH2CHCH3CHCH3CHCH2CH3CH3为例 4.实例 (1)选主链:将含碳碳双键或碳碳三键的最长碳链作为主链,并按主链中所含碳原子数称为“某烯”或“某炔”。(虚线框内为主链) (2)编序号:从距离双键或三键最近的一端给主链上的碳原子依次编号,使双键或三键碳原子的编号为最小。 (3)写名称:先用大写数字“二、三……”在烯或炔的名称前表示双键或三键的个数;然后在“某烯”或“某炔”前面用阿拉伯数字表示出双键或三键的位置(用双键或三键碳原
高中化学有机物化合物专题汇总
认识有机物化合物 考点一 有机化合物的分类及官能团 1.按碳的骨架分类 (1)有机物??? 链状化合物 环状化合物??? ?? 脂环化合物 芳香化合物 (2)烃 2.按官能团分类 (1)官能团:决定化合物特殊性质的原子或原子团。 (2)有机物主要类别、官能团 考点二 有机化合物的结构特点、同分异构现象及命名 1.有机化合物中碳原子的成键特点 2.有机化合物的同分异构现象
3.同系物 CH 2原子团的化合物互称同系物。如CH 3CH 3 和CH 3CH 2CH 3,CH 2===CH 2和CH 2===CHCH 3 (1)烷烃 ①烷烃的习惯命名法 ②烷烃系统命名三步骤 (2)烯烃和炔烃的命名 选主链—将含有碳碳双键或碳碳三键的最长碳链 作为主链,称为“某烯”或“某炔”。 定编号—从距离碳碳双键或碳碳三键最近的一端对 主链上的碳原子进行编号。
写名称—将支链作为取代基,写在“某烯”或“某炔”的前面, 并用阿拉伯数字标明碳碳双键或碳碳三键的位置。 (3)苯的同系物的命名 苯作为母体,其他基团作为取代基。例如,苯分子中的氢原子被甲基取代后生成甲苯,被乙基取代后生成乙苯。如果有多个取代基取代苯环上的氢原子,根据取代基在苯环上的位置不同,分别用“邻”、“间”、“对”表示。也可对连接取代基的苯环上的碳原子进行编号,选取最小的位次进行命名。 考点三 研究有机物的一般步骤和方法 1.研究有机化合物的基本步骤 2.分离、提纯有机化合物的常用方法 (1)蒸馏和重结晶 适用对象 要求 蒸馏 常用于分离、提纯液态有机物 ①该有机物热稳定性较强。 ②该有机物与杂质的沸点相差较大 重结晶 常用于分离、提纯固态有机物 ①杂质在所选溶剂中溶解度很小或很大。 ②被提纯的有机物在此溶剂中溶解度受温度影响较大 ①液-液萃取 利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。 ②固-液萃取 用有机溶剂从固体物质中溶解出有机物的过程。 3.有机物分子式的确定 (1)元素分析 (2)相对分子质量的测定——质谱法 质荷比(分子离子、碎片离子的相对质量与其电荷的比值)最大值即为该有机物的相对分子质量。 4.分子结构的鉴定 (1)化学方法:利用特征反应鉴定出官能团,再制备它的衍生物进一步确认。 (2)物理方法
有机化合物的命名
第三节有机化合物的命名 一、烷烃命名时要注意哪些问题?命名的基本原则有哪些? 1.烷烃命名的步骤 口诀为:选主链,称某烷;编号位,定支链;取代基,写在前;标位置,短线连;不同基,简到繁;相同基,合并算。 (1)找主链:最长、最多定主链 ①选择最长碳链作为主链。 应选含6个碳原子的碳链为主链,如虚线所示。 ②当有几个不同的碳链时,选择含支链最多的一个作为主链。如
含7个碳原子的链有A、B、C三条,因A有三个支链,含支链最多,故应选A为主链。 (2)编碳号:编号位要遵循“近”、“简”、“小” ①以离支链较近的主链一端为起点编号,即首先要考虑“近”。如: ②有两个不同的支链,且分别处于距主链两端同近的位置,则从较简单的支链一端开始编号。即同“近”,考虑“简”。如 ③若有两个相同的支链,且分别处于距主链两端同近的位置,而中间还有其他支链,从主链的两个方向编号,可得两种不同的编号系列,两系列中各位次和最小者即为正确的编号,即同“近”、同“简”,考虑“小”。如: (3)写名称 按主链的碳原子数称为相应的某烷,在其前写出支链的位号和名称。原则是:先简后繁,相同合并,位号指明。阿拉伯数字之间用“,”相隔,汉字与阿拉伯数字用“-”连接。如 命名为:2,4,6-三甲基-3-乙基庚烷。
2.烷烃命名的5个原则和5个必须 (1)5个原则 ①最长原则:应选最长的碳链作主链; ②最近原则:应从离支链最近的一端对主链碳原子编号; ③最多原则:若存在多条等长主链时,应选择含支链较多的碳链作主链; ④最小原则:若相同的支链距主链两端等长时,应以支链位号之和为最小为原则,对主链碳原子编号; ⑤最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子编号。 (2)5个必须 ①取代基的位号必须用阿拉伯数字“2,3,4……”表示; ②相同取代基的个数,必须用中文数字“二,三,四,……”表示; ③位号2,3,4等相邻时,必须用逗号“,”表示(不能用顿号“、”); ④名称中凡阿拉伯数字与汉字相邻时,必须用短线“-”隔开; ⑤若有多种取代基,不管其位号大小如何,都必须把简单的写在前面,复杂的写在后面。 二、烯烃和炔烃的命名与烷烃的命名有哪些不同之处? 1.主链选择不同 烷烃命名时要求选择分子结构中的所有碳链中的最长碳链作为主链,而烯烃或炔烃要求选择含有碳碳双键或三键的最长碳链作为主链,也就是烯烃或炔烃选择的主链不一定是分子中的最长碳链。 2.编号定位不同 编号时,烷烃要求离支链最近,即保证支链的位置尽可能的小,而烯烃或炔烃要求离双键或三键最近,保证双键或三键的位置最小。但如果两端离双键或三键的位置相同,则从距离取代基较近的一端开始编号。 3.书写名称不同 必须在“某烯”或“某炔”前标明双键或三键的位置。 以CH3CH2CCH2CHCH3CHCH3CHCH2CH3CH3为例 4.实例 (1)选主链:将含碳碳双键或碳碳三键的最长碳链作为主链,并按主链中所含碳原子数称为“某烯”或“某炔”。(虚线框内为主链) (2)编序号:从距离双键或三键最近的一端给主链上的碳原子依次编号,使双键或三键碳原子的编号为最小。
化合物命名原则
根据IUPAC命名法及1980年中国化学学会命名原则,按各类化合物分述如下. 1.带支链烷烃 主链选碳链最长、带支链最多者. 编号按最低系列规则.从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何).例如, 命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列. 取代基次序IUPAC规定依英文名第一字母次序排列.我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子.例如, 称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面. 2.单官能团化合物 主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……).卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置. 编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面.例如, 3.多官能团化合物 (1)脂肪族 选含官能团最多(尽量包括重键)的最长碳链为主链.官能团词尾取法习惯上按下列次序, —OH>—NH2(=NH)>C≡C>C=C 如烯、炔处在相同位次时则给双键以最低编号.例如, (2)脂环族、芳香族 如侧链简单,选环作母体;如取代基复杂,取碳链作主链.例如: (3)杂环 从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号.例如: 4.顺反异构体 (1)顺反命名法 环状化合物用顺、反表示.相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式.例如, (2)Z,E命名法 化合物中含有双键时用Z、E表示.按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E. 次序规则是: (Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:为最小;(Ⅱ)同位素质量高的优先,如D>H; (Ⅲ)二个基团中第一个原子相同时,依次比较第二、第三个原子; (Ⅳ)重键 分别可看作 (Ⅴ)Z优先于E,R优先于S. 例如 (E)-苯甲醛肟 5.旋光异构体 (1)D,L构型 主要应用于糖类及有关化合物,以甘油醛为标准,规定右旋构型为D,左旋构型为L.凡分子中离羰基最远的手性碳原子的构型与D-(+)-甘油醛相同的糖称D型;反之属L型.例如, 氨基酸习惯上也用D、L标记.除甘氨酸无旋光性外,α-氨基酸碳原子的构型都是L型. 其余化合物可以通过化学转变的方法,与标准物质相联系确定.例如:
有机化合物命名大全
有机化合物的命名 有机化合物种类繁多,数目庞大,即使同一分子式,也有不同的异构体,若没有一个完整的命名(nomenclature)方法来区分各个化合物,在文献中会造成极大的混乱,因此认真学习每一类化合物的命名是有机化学的一项重要内容。现在书籍、期刊中经常使用普通命名法和国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry)命名法, 后者简称IUPAC命名法。 一、链烷烃的命名 1. 系统命名法 (1)直链烷烃的命名 直链烷烃(n?alkanes)的名称用“碳原子数+烷”来表示。当碳原子数为1?10时,依次用天干——甲、乙、丙、丁、戊、己、庚、辛、壬、癸——表示。碳原子数超过10时,用数字表示。例如:六个碳的直链烷称为已烷。十四个碳的直链烷烃称为十四烷。烷烃的英文名称是alkane,词尾用ane。表1列出了一些正烷烃的中英文名称: 表1 正烷烃的名称
以上20个碳以内的烷烃要比较熟悉,以后经常要用。烷烃的英文名称变化是有规律的,认真阅读上表即可看出。表中的正(n ?)表示直链烷烃,正(n ?)可以省略。 (2)支链烷烃的命名 有分支的烷烃称为支链烷烃(branched ?chain alkanes )。 (i )碳原子的级 下面化合物中含有四种不同碳原子: CH 3 C CH 33C CH 3H C H H CH 3 (i) (i) (i) (i) (i) (ii)(iii)(iv) ① 与一个碳相连的碳原子是一级碳原子,用1?C 表示(或称伯碳,primary carbon ),1?C 上的氢称为一级氢,用1?H 表示。 ② 与两个碳相连的碳原子是二级碳原子,用2?C 表示(或称仲碳,secondary carbon ),2?C 上的氢称为二级氢,用2?H 表示。 ③ 与三个碳相连的碳原子是三级碳原子,用3?C 表示(或称叔碳,tertiary carbon ),3?C 上的氢称为三级氢,用3?H 表示。 ④ 与四个碳相连的碳原子是四级碳原子,用4?C 表示(或称季碳,quaternary carbon ) (ii )烷基的名称 烷烃去掉一个氢原子后剩下的部分称为烷基。英文名称为alkyl ,即将烷烃的词尾?ane 改为?yl 。烷基可以用普通命名法命名,也可以用系统命名法命名。表2列出了一些常见烷基的名称。
(完整版)配位化合物习题及解析
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
杂环化合物的命名
杂环化合物(hetero cyclic compounds)属于环状有机化合物的一种,是指由碳原子和非碳原子共同参与组成环的环状化合物。这种参与成环的非碳原子称为杂原子。杂原子大都属于周期表中Ⅳ、Ⅴ、Ⅵ三族的主族元素,最常见的是氮、氧、硫,其中以氮原子最为多见。按照这个定义,在前面一些章节中曾讨论过的内酯、交酯、环状酸酐和内酰胺等,也应属于杂环化合物。但这些化合物通常容易开环成原来的链状化合物,其性质又与相应的链状化合物相同,因此一般不把它们列入杂环化合物的范围。有机化学中所要讨论的杂环化合物,一般都比较稳定,不容易开环,有些杂环化合物的性质与苯、萘等相似,具有不同程度的芳香性。 杂环化合物的种类繁多,数目庞大。据统计,在已发现的几百万种有机化合物中,杂环化合物约占总数65%以上。这说明杂环化合物在有机化学的各个研究领域中都占有相当重要的地位。 杂环化合物广泛地存在于自然界中,动植物体内所含的生物碱、苷类、色素等往往都含有杂环结构。许多药物,包括天然药物和人工合成药物,例如头孢菌素(抗生素)、羟基树碱(抗肿瘤药)、小檗碱(抗菌药)等也都含有杂环。与人类生命活动及各种代谢关系非常密切的物质 ──核酸,其碱基部分也含有杂环。近几十年来,在杂环化合物的理论和应用方面的研究不断取得重 大进展,许多天然杂环化合物,包括维生素B那样结构极其复杂的杂环分子,已经能够用人工方法进行全合成;同时,人类也合成了许多自然界不存在的杂环化合物。这些化合物作为药物,作为超导材料,作为工程材料,也都具有很重要的意义。 杂环化合物的分类 杂环化合物的种类繁多,其常见的分类方法按所依据的原则不同,可分为按分子所含环系的多少及其连接方式分类和按分子中所含π电子的状态和数量多少分类两种。 按分子所含环系的多少及其连接方式分类 根据这种方法可将杂环化合物分为以下几类: 按分子中所含π电子的状态和数量多少分类
化合物命名规则复习过程
一般规则 取代基的顺序规则 当主链上有多种取代基时,由顺序规则决定名称中基团的先后顺序。一般的规则是: 取代基的第一个原子质量越大,顺序越高; 如果第一个原子相同,那么比较它们第一个原子上连接的原子的顺序;如有双键或三键,则视为连接了2或3个相同的原子。 以次序最高的官能团作为主要官能团,命名时放在最后。其他官能团,命名时顺序越低名称越靠前。 主链或主环系的选取
以含有主要官能团的最长碳链作为主链,靠近该官能团的一端标为1号碳。 如果化合物的核心是一个环(系),那么该环系看作母体;除苯环以外,各个环系按照自己的规则确定1号碳,但同时要保证取代基的位置号最小。 支链中与主链相连的一个碳原子标为1号碳。 数词 位置号用阿拉伯数字表示。 官能团的数目用汉字数字表示。
碳链上碳原子的数目,10以内用天干表示,10以外用汉字数字表示。 各类化合物的具体规则 烷烃 找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙...)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。 从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以- 隔开。 有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙
基、丙基的顺序列出所有取代基。 有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以, 隔开,一起列于取代基前面。 烯烃 命名方式与烷类类似,但以含有双键的最长键当作主链。 以最靠近双键的碳开始编号,分别标示取代基和双键的位置。 若分子中出现二次以上的双键,则以“二烯”或“三烯”命名。 烯类的异构体中常出现顺反异构体,故须注明“顺”或”反”。
有机化学人名反应大全
一、Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷R'X 的烷基和亚磷酸三烷基酯(RO) 3 P 的烷基相同(即R' = R),则Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯RP(OR') 2和次亚膦酸酯R 2 POR' 也能发 生该类反应,例如:
反应机理 2 进行的分子内重排反应: 一般认为是按S N 反应实例 二、Arndt-Eister 反应
酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 三、Baeyer----Villiger反应 反应机理
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例
化合物的命名
第四章 化合物的命名 4.1、烷烃的命名 烷烃常用的命名法有普通命名法和系统命名法两种。 一、 普通命名法 根据分子中碳原子数目称为“某烷”,碳原子数十个以内的依次用甲、乙、丙、丁、戊……癸表示,十以上的用汉字数字表示碳原子数,用正、异、新表示同分异构体。例如: 正戊烷 异戊烷 新戊烷 普通命名法简单方便,但只能适用于构造比较简单的烷烃。对于比较复杂的烷烃必须使用系统命名法。 二、系统命名法 1、 烷基 烷基 烷烃分子中去掉一个氢原子而剩下的原子团称为烷基。常见的烷基如下: CH 3-CH 2-CH 2-CH 2-CH 3CH 3 CH CH 2-CH 3CH 3CH 3 C CH 3CH 3CH 3 CH 3CH CH 2 H H CH 3CH 2CH 2 CH 3CH CH 3 简写成 (CH 3)2CH n _C 3H 7 简写成 或i _ C 3H 7 (正)丙基 异丙基 CH 3CH 2CH CH 2 H H CH 3CH 2CH 2CH 2 CH 3CH 2CH CH 3CH 3C CH 3 CH 2 H H CH 3CH CH 3 CH 2 CH 3C CH 3 CH 3 (CH 3)3C 或(正)丁基仲丁基 异丁基叔丁基 CH 2C =CH H H H CH 3CH =CH CH 2=CHCH 2CH 2=C CH 3 丙烯基烯丙基异丙烯基 或 C 6H 5 CH 2 或 C 6H 5CH 2 苯基 苄基
2、系统命名法(IUPAC 命名法) 系统命名法是中国化学学会根据国际纯粹和应用化学联合会(IUPAC )制定的有机化合物命名原则,再结合我国汉字的特点而制定的。系统命名法规则如下:(1)选择主连(母体)。 a 、选择含碳原子数目最多的碳链作为主链,支链作为取代基。 b 、分子中有两条以上等长碳链时,则选择支链多的一条为主链。 例如: (2)、碳原子的编号。 a 、从最接近取代基的一端开始,将主链碳原子用1、2、3……编号。 选择正确C C C C C C C C 2346781C C C 876543215C C C C C C C C 234615162编号正确编号错误编号正确编号错误 CHCH CHCH CH 3 2 , 3 , 5_ 4三甲基丙基庚烷 正确:(有四个支链)CH 3CH 2 CH CH CH 2CH CH CH 3 CH CH 45672 , 5__ _4正确:二甲基异丁基庚烷 支链编号:2 , 5 , 4错误: 2 , 6_ _ _4二甲基仲丁基庚烷支链编号:2 , 6 , 4
有机化学大全 知识点总结
组成结构特点 有机化合物:种类繁多、数目庞大(已知有3000多万种、且还在不断增加) 但组成元素少有C、H、O、N 、P、S、X(卤素:F、Cl、Br、I )等 得。 和无机物相比,有机物数目众多,可达几百万种。而无机物目前却只发现数十万种,因为有机化合物的碳原子的结合能力非常强,可以互相结合成碳链或碳环。碳原子数量可以是1、2个, 可以有几十万个碳原子。此外,有机化合物中同分异构现象非常普遍,这也是有机化合物数目繁多的原因之一。 物理性质特点 1) 挥发性大,熔点、沸点低(熔点一般不超过400℃) 2) 水溶性差(大多不容或难溶于水,易溶于有机溶剂,如:酒精、汽油、四氯化碳、乙醚、苯) 化学性质特点 1) 可燃性
2) 稳定性差(有机化合物常会因为温度、细菌、空气或光照的影响分解变质) 3)反应速率比较慢 4)反应产物复杂 总体来说,有机化合物除少数以外,一般都能燃烧。和无机物相比,它们的热稳定性比较差,电解质受热容易分解。有机物 不溶于水。有机物之间的反应,大多是分子间的反应,往往需要 且有机物的反应比较复杂,在同样条件下,一个化合物往往可以同时进行几个不同的反应,生成不同的产物。 有机化合物一般密度小于2,而无机化合物正好相反。在溶解部份,有机化合物一般可溶于油,无机化合物则溶于水。 有机物种类繁多,可分为烃和烃的衍生物两大类。根据有机 炔、芳香烃和卤代烃、醇、酚、醚、醛、酮、羧酸、酯等等。按碳的骨架分类 1.链状化合物
这类化合物分子中的碳原子相互连接成链状,因其最初是在脂肪中发现的,所以又叫脂肪族化合物。其结构特点是碳与碳间连接成不闭口的链。 2.环状化合物 环状化合物指分子中原子以环状排列的化合物。环状化合物又分为脂环化合物和芳香化合物。 (1)脂环化合物:不含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环状的化合物。如环丙烷、环己烯、环己醇等。 (2)芳香化合物:含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环状的化合物。如苯、苯的同系物及衍生物,稠环芳烃及衍生物,吡咯、吡啶等。 按组成元素的种类分类 1.烃 仅由碳和氢两种元素组成的化合物总称为碳氢化合物,简称烃。如甲烷、乙烯、乙炔、苯等。 2.烃的衍生物 烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物称为烃的衍生物。如卤代烃、醇、氨基酸、核酸等按官能团分类
稠杂环化合物的命名规则教学文案
稠杂环化合物的命名: 对这类杂环化合物,可将其母核分解成两个有特定名称的环系,并将其中一个定为基本环,另一个定为附加环。命名时将附加环名称放在前,基本环名称放在后,两环名称间缀以方括号,方括号内分别用阿拉伯数字和小写英文字母表示两环的稠合情况。现就其具体方法说明如下: 一、关于基本环的选择,主要按以下几条规则依次考虑。 ①由杂环和芳环构成的稠杂环,优先选择杂环作基本环。如还有选择时,应优先选择环数较多,且有特定名称的杂环作基本环。例如: Ⅰ中噻唑为基本环,苯为附加环,称为苯并噻唑;Ⅱ称为苯并异喹啉(不称萘并吡啶)。 ②由杂环和杂环构成的稠杂环,环大小不同时,优先选择大环作基本环;环大小相同时,按N、O、S的顺序优先选择基本环。例如:Ⅲ的基本环是吡喃,称呋喃并吡喃;Ⅳ的基本环是呋喃,称噻吩并呋喃。 ③杂环中杂原子数目不同时,含杂原子数目多的环优先;数目相同时,则含杂原子种类多的环优先。例如:Ⅴ应称吡啶并哒嗪(杂原子数目多的优先);Ⅵ应称咪唑并噻唑(杂原子种类多的优先);但Ⅶ应称噻吩并吡咯(含氮杂环优先)。 ④环的大小、杂原子的数目、种类都相同时,优先选择稠合前杂原子编号较小的杂环为基本环。例如:Ⅷ应称吡嗪并哒嗪。 ⑤含有共用杂原子的稠杂环,应视为两环都含有该共用杂原子来进行选择。例如:Ⅸ应称为咪唑并噻唑(含杂原子种类多的优先)。 除以上规定外,尚有一些其他习惯使用的规定,此处不再赘述。
二、稠合方式的表达: 为了将基本环与附加环的稠合方式表达清楚,应先将两部分各自按编号原则编号,再将基本环的每条边按编号方向依次用a、b、c、d……代表,然后将附加环稠合边原子序号写在前,基本环稠合边字母写在后,二者之间用“-”隔开,一起放到两环系名称之间的方括号内。附加环稠合边原子序号在书写时应与基本环字母次序的方向一致,两者顺序相同时小数字在前,大数字在后;反之则大数字在前,小数字在后。例如: 该化合物两环稠合边编号方向相反,命名时应使其一致,所以应称为咪唑并[2,1-b]噻唑,而不称咪唑并[1,2-b]噻唑。 又例如前面所见到的Ⅰ应称为苯并[d]唑(苯环的稠合边原子序号在此无需标出),Ⅳ称为噻吩并[2,3-b]呋喃,Ⅵ称为咪唑并[5,4-d]噻唑,Ⅷ称为吡嗪并[2,3-d]哒嗪。 三、整个稠杂环的编号: 当此类化合物分子中存在有其他取代基或官能团时,需要对整个化合物进行统一编号(此编号方式与表示稠合方式的编号无关),其编号方式应注意以下几点: ①应尽可能使所有杂原子都有最低位次,其次按O、S、NH、N的顺序选择优先编号的杂原子,例如: ②共用碳原子一般不编号(个别例外),但在满足上一条规则的前提下,应尽可能使其具有较低的序号(其编号方式是依整个分子的编号方向在其前一个原子的编号下加注“a”、“b”、“c”等)。例如:下面化合物可有三种不同的编号方式,得到杂原子的编号均为1、4、5、8,但第一种共用碳原子的编号为4a,后两种则为8a,故正确的编号方式应为第一种。 ③氢原子和指示氢的编号应尽可能低。例如:
有机化学(试卷集锦)【10套含答案】
一、命名下列化合物或根据化合物结构写出其名称(20分) (1);(2);(3);(4);(5) ; (6)叔丁基苯;(7)邻苯二甲酸酐;(8)5-甲基-4-硝基-2-己烯; (9)2-甲基丙醛;(10)1-甲其环戊醇 二、选择题(20分) 1、根据当代的观点,有机物应该是(??) A.来自动植物的化合物 B.来自于自然界的化合物 C.人工合成的化合物 D.含碳的化合物 2、在自由基反应中化学键发生(??) A.异裂 B.均裂 C.不断裂 D. 3、A.环丙烷、B.环丁烷、C.环己烷、 A.C>D>B>A B.A>B>C>D C.D>C>B>A D.D>A>B>C 4、 A.对称轴 B.对称面 C.对称中心 D. 5、卤代烷的烃基结构对SN1 6 7 8 9 10(??) 三、填空题(20分) 1、 2、 3、
4、 5、 6、 7、 8、 9、 10、 1、 2、环丙烷、丙烯、丙炔 五、合成题(10分) 1、 2、 六、推测化合物的结构(10分) 1、化合物A(C 13H 16 O 3 )能使溴水退色.与FeCl 3 水溶液反应生成紫色物质,在稀而冷的NaOH溶液中 溶解。A与40%NaOH水溶液共热后酸化并加以分离,得到三个化合物B(C 8H 8 O 2 )、C(C 2 H 4 O 2 )、D(C 3 H 8 O)。 B和C能溶于冷的NaOH水溶液和NaHCO 3 水溶液,B经热的高锰酸钾氧化生成苯甲酸。D遇金属钠生
成可燃气体,与卢卡斯试剂的混合物在室温下放置不浑浊分层,只有加热才浑浊分层。试推测A—D的结构式。 2、某烃化合物A,分子式为C 5H 10 。它和溴无作用,在紫外光照射下与溴作用只得一产物B(C 5 H 9 Br)。 B与KOH醇溶液作用得C(C 5H 8 ),C经臭氧化并在Zn存在下水解得到戊二醛,试写出化合物A、B和 C的结构式及各步反应方程式。 一、选择题(20分) 1、有机物的结构特点之一就是多数有机物都以(??) A.配价键结合 B.共价键结合 C.离子键结合 D.氢键结合 2、下列烷烃沸点最低的是(??) A.正己烷 B.2,3-二甲基戊烷 C.3-甲基戊烷 D.2,3-二甲基丁烷 3、下列四种环己烷衍生物其分子内非键张力大小顺序应该 (??) A.A>B>C>D B.A>C>D>B C.D>C>B>A D.D>A>B>C 4、 A.非对映异构体 B.互变异构体 C. 5、Walden转化指的是反应中(??) A.生成外消旋化产物 B. C.旋光方向改变 D.生成对映异构体 6、碳正离子a.R2C=CH—C+R2、 A.a>b>c>d B.b>a>c>d C.a>b 7 8(??) 9 10 1、 2、 3、
