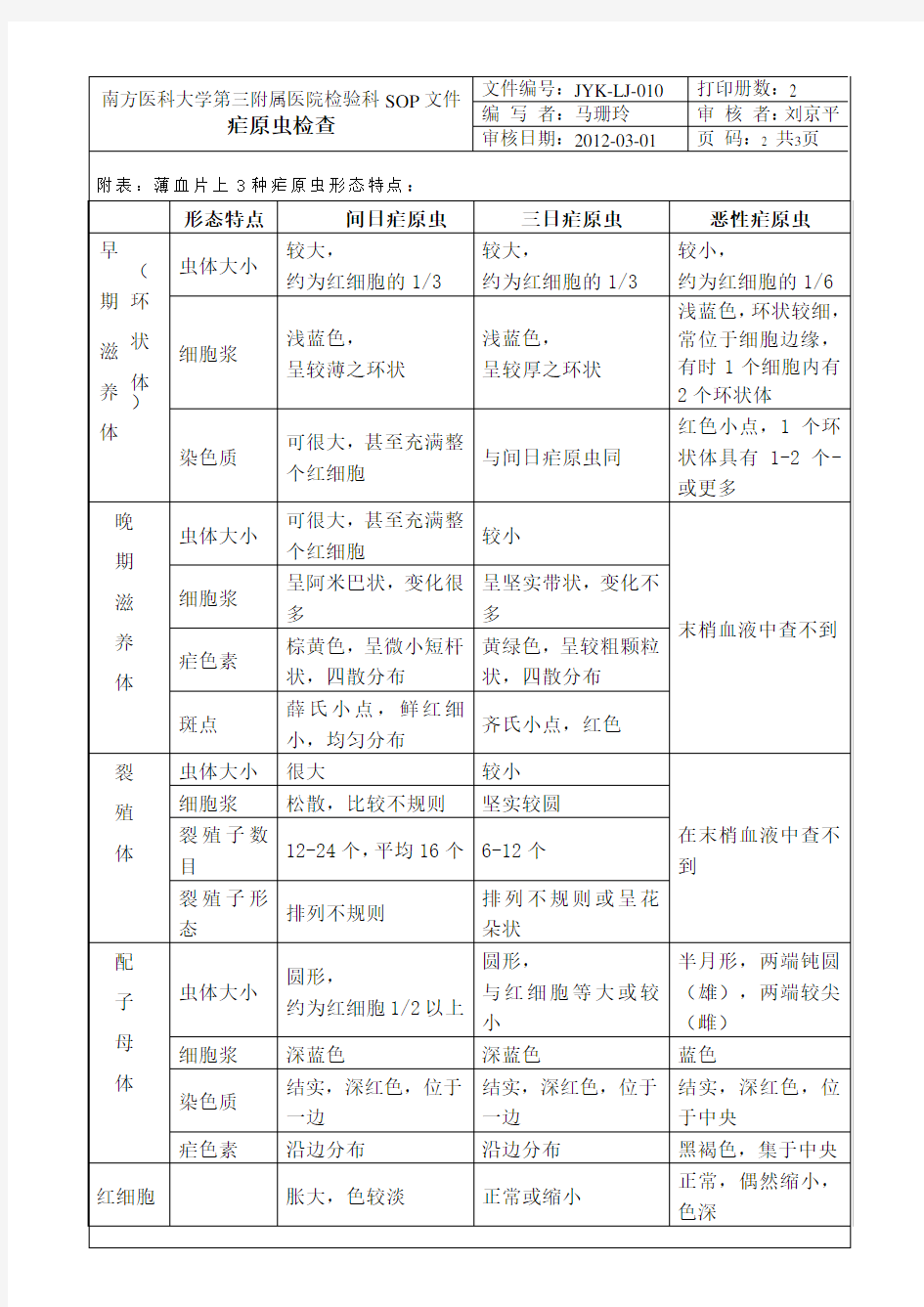
疟原虫检查sop

附图:镜下所见疟原虫形态:
间日疟原虫三日疟原虫恶性疟原虫
环
状
体
————滋
养
体
——裂
殖
体
配
子
体
无菌检测操作规程
无菌操作规程 1.目的 建立无菌检查标准操作规程,确保检查结果准确、可靠。 2.适用范围 本公司无菌产品的无菌检查 3.职责 质量部QC 4.依据 2015版《中国药典》通则1101 5.内容 5.1无菌检查环境保障 5.1.1无菌检查的所有操作均需在严格控制微生物污染的环境下进行,即无菌检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内或隔离系统中进行。 5.1.2操作环境的无菌保障程度将直接影响无菌检查结果,为了保证无菌检查用洁净室(区)环境的稳定性,确保检查结果的可靠性,对洁净室(区)的环境定期检测并采取合理的措施保证洁净环境符合要求。 5.1.3无菌检查全过程必须严格遵守无菌操作,防止微生物污染。 5.1.4洁净区的温度、湿度等参数必须符合相应洁净级别的要求 5.1.5无菌检查操作还需要对环境进行监控, 5.2培养基、稀硫酸、缓冲液 5.2.1硫乙醇酸盐流体培养基,市售培养基干粉。除另有规定,接种后应置30-35℃培养。 5.2.2胰酪大豆胨液体培养基,市售培养基干粉。接种后应置20-35℃培养。 5.2.3中和或灭活用培养基,按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基的处方及制法,在培养基灭菌或使用前加入适宜的中和剂、灭活剂或表面活性剂,其用量同方法实用性试验。 5.2.4胰酪大豆胨琼脂培养基,市售培养基干粉。 5.2.5沙氏葡萄糖液体培养基,市售培养基干粉。 5.2.6沙氏葡萄糖琼脂培养基,市售培养基干粉。 5.2.7PH7.0氯化钠蛋白胨缓冲液,市售培养基干粉。 5.2.80.9%无菌氯化钠溶液。 5.2.9培养基使用性检查 无菌检查用的硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基等应符合培养基的无菌性检查及灵敏度检查的要求。本检查可在供试品的无菌检查或与供试品的无菌检查同时进行5.2.9.1无菌性检查:每批培养基随机取5支(瓶),按各培养基规定的温度下培养14天,用无菌生长。 5.2.9.2灵敏度检查 5.2.9.2.1菌种:培养基灵敏度检查所用的菌株传代数不得超过5代(从菌钟存中心获得的干菌种第0代),并采用适宜的菌种保藏技术进行保存,以证试验菌株的生物学特性。 金黄色葡萄球菌【CMCC(B)26 003】 铜绿假单胞菌[CMCC(B)10 104] 枯草芽孢杆菌[CMCC(B)63 501] 生孢梭菌[CMCC(F)64 941] 白色念球菌[CMCC(F)98 001] 黑曲霉[CMCC(F)98 003]
GMP-无菌检查操作规程
1.目的: 建立无菌检查的标准操作规程,确保检验结果的准确性。 2.范围: 适用于本厂质监科化验室对本厂生产的注射剂进行无菌检查。 3.责任: 化验员有责任按本操作规程操作,并对检验结果负责。 4.定义: 无菌检查法系指检查药品是否无菌的一种方法。 5.内容: 5.1无菌操作设备: 无菌操作室或超净工作台,无菌衣、口罩、帽子、消毒鞋、酒精灯等。5.1.1无菌室分无菌操作室和缓冲间。在缓冲间内应有洗手盆、干手器、无菌衣放置架及挂钩、拖鞋等。无菌操作室应具有空气除菌过滤的层流装置,局 部洁净度100级超净工作台。缓冲间及操作室内均设置能达到空气消毒的紫外光灯和照明灯,操作室或工作台应保持空气正压。 5.1.2无菌室应每周和每次操作前用0.1%新洁尔灭或2%甲酚液擦拭操作台及可能污染的死角,开动无菌空气过滤器及紫外光灯杀菌1小时。在每次操作完毕,同样用2%甲酚或0.1%新洁尔灭溶液擦拭工作台面,用紫外光灯杀菌半小时。 5.1.3无菌室的无菌程度检查:无菌室在消毒处理后,无菌试验前及操作过程中需检查空气中菌落数。取直径90mm双碟,在接种室内点燃酒精灯,在酒精灯旁,以无菌操作,将双碟半开注入溶化的营养琼脂培养基约20ml,制成平板:
在35-37℃预培养48小时,证明无菌后将3个平板以无菌方式带入无菌操作间的洁净区域左、中、右各放1个;打开碟盖扣置,平板在空气中暴露30分钟后将盖盖好,置35-37℃培养48小时,取出检查,3个平板上生长的菌落数相加总数不得超过10个。 无菌操作台面或超净工作台应定期请有关部门检测其洁净度,应达到100 级(一般用尘埃粒子计数仪),检测尘埃粒径≤5μm的粒数不得超过3.5个/升;空气流量应控制在0.75-1.0m3/s;细菌菌落数平均<1个,可根据无菌状况定期置换过滤器。 5.1.4无菌室内应准备好盛有消毒用5%甲酚的玻璃缸、酒精灯、火柴、镊子、75%酒精棉及拖鞋等。 5.2仪器、用具: 5.2.1真空泵、恒温培养箱、生物显微镜、托盘天平(精度0.1g)、抽滤瓶(500ml)、三角瓶(100、500 ml)、移液管(1、10ml)、注射器(要求规格)、试管、双碟(9cm)、注射针、镊子、剪刀、白金耳、橡皮管、纱布、棉花(原棉)、不锈钢吸管筒、接种环、微孔滤膜(直径约5cm),孔径应在0.45±0.02μm )载玻片、洒精灯、取样勺、吸耳球、喷雾瓶。 5.2.2用具的包扎: 5.2.2.1移液管 在移液管上端管内,松松地塞进少许原棉,然后放入不锈钢灭菌筒内。 5.2.2.2试管 在管口塞上纱布棉塞。 5.2.2.3无菌衣、裤、帽、口罩
产品无菌检验操作规程
产品无菌检验操作规程 产品无菌检验操作规程 编制日期 审核日期 批准日期 版号生效日期 公司
1 目的 通过无菌检验,确保灭菌后产品能够达到无菌的要求。 2 适用范畴 适用于灭菌后医疗器械产品(列举)的无菌检验。 3 检验依据 本厂产品注册标准(编号) EN1174-1996 医疗器械灭菌产品中微生物数量的评估 《中国药典》(2005年版) GB14233.2-2005 医用输液、输血、注射器具检验方法第二部分:生物试验方法 GB15980-1995 一次性使用医疗用品卫生标准 4 仪器、设备 百级层流超净工作台、电热干燥箱、电热恒温培养箱、霉菌培养箱、压力蒸汽灭菌器、集菌仪(器)、电子天平、PH计、冰箱、恒温水浴锅、酒精灯、三角烧瓶,接种环、无菌棉签、镊子,试管架,大试管若干等。 5 无菌检验室的环境要求 5.1 无菌检验应在环境洁净度10000级下的局部百级的单向流空气区域内进行。 5.2 缓冲区与外界环境、无菌检验室与缓冲区之间空气应保持正压,阳性对比室与缓冲区之间空气应保持负压。无菌检验室与室外大气之间静压差应大于10Pa。无菌检验室的室温应保持18~26℃,相对湿度:45~65%。 5.3 无菌检验室的单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行悬浮粒子、浮游菌和沉降菌的监测。每年至少检测一次。 5.4 无菌检验过程中应同时检查超净工作台单向流空气中的菌落数:每次操作时在层流空气所及台面的左中右置3个营养琼脂平板,暴露30min,于30~35℃培养48小时,菌落数平均应不超过1CFU/平板。 6 无菌检验前的预备 6.1 器具灭菌、消毒 6.1.1 灭菌:试验过程中与供试品接触的所有器具必须采纳可靠方法灭菌。可经电热干燥箱160℃以上干烤2小时,或置压力蒸汽灭菌器内121℃蒸汽灭菌30分钟后使用(依照灭菌成效验证决定灭菌参数)。所有的灭菌物品不应超过2周即用毕,否则应重新灭菌。 6.1.2 消毒:凡检验中使用的器材无法灭菌处理的,使用前必须经消毒处理。如无菌检验室的试管架、电子天平、工作台面、工作人员的手、橡胶吸头等。可采纳消毒剂浸泡或擦拭。消毒剂应每月更换,以防止产生耐药菌株。 6.1.3 标识:器具的灭菌、消毒后必须做好标识,标明灭菌、消毒时刻和使用有效期。 6.2 人员、物料进入无菌检验室
无菌检查操作规程2015 (1)
无菌检查操作规程 1.目的 建立无菌检查标准操作规程,确保检查结果准确、可靠。 2.使用范围 本公司无菌产品的无菌检查 3.职责 质量部QC 4.依据 2015版《中国药典》通则1101 GB/T 19973.2-2005(ISO11737-2:1998) 《疗器械的灭菌微生物学方法第2部分:确认灭菌过程的无菌试验》 GB/T 14233.2-2005 《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》 5.内容 5.1.无菌检查环境保障 5.1.1.无菌检査的所有操作均需在严格控制微生物污染的环境下进行,即无菌检 査应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内或隔离系统中进行。 5.1.2.操作环境的无菌保障程度将直接影响无菌检查结果,为了保证无菌检查用 洁净室(区)环境的稳定性,确保检查结果的可靠性,对洁净室(区)的环境定期监测并采取合理的措施保证洁净环境符合要求。 5.1.3.无菌检查全过程必须严格遵守无菌操作,防止微生物污染。 5.1.4.洁净区的温度、湿度等参数必须符合相应洁净级别的要求。 5.1.5.无菌检查操作还需要对检查环境进行监控, 5.2.培养基、稀释液、缓冲液 5.2.1.硫乙醇酸盐流体培养基,市售培养基干粉。除另有规定,接种后应置 30~35℃培养。 5.2.2.胰酪大豆胨液体培养基,市售培养基干粉。接种后应置20~35℃培养。 5.2.3.中和或灭活用培养基,按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培
养基的处方及制法,在培养基灭菌或使用前加入适宜的中和剂、灭活剂或表面活性剂,其用量同方法适用性试验。 5.2.4.胰酪大豆胨琼脂培养基,市售培养基干粉。 5.2.5.沙氏葡萄糖液体培养基,市售培养基干粉。 5.2. 6.沙式葡萄糖琼脂培养基,市售培养基干粉。 5.2.7.PH7.0氯化钠蛋白胨缓冲液,市售培养基干粉。 5.2.8.0.9%无菌氯化钠溶液。 5.2.9.培养基使用性检查 无菌检査用的硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基等应符培养基的无菌性检査及灵敏度检査的要求。本检查可在供试品的无菌检査或与供试品的无菌检査同时进行。 5.2.9.1.无菌性检查:每批培养基随机取5支(瓶),按各培养基规定的温度下 培养14天,应无菌生长。 5.2.9.2.灵敏度检查 5.2.9.2.1.菌种:培养基灵敏度检查所用的菌株传代数不得超过5代(从菌种存中 心获得的干菌种第0代),并采用适宜的菌种保藏技术进行保存,以 证试验菌株的生物学特性。 金黄色葡萄球菌[CMCC(B)26 003] 铜绿假单胞菌[CMCC(B)10 104] 枯草芽孢杆菌[CMCC(B)63 501] 生孢梭菌[CMCC(B)64 941] 白色念珠菌[CMCC(F)98 001] 黑曲霉[CMCC(F)98 003] 5.2.9.2.2.菌液制备:接种金色葡萄球菌、铜绿假胞菌、枯草芽孢杆菌的培养物 至胰酪大豆胨液体培养基中或胰酪大豆胨琼脂培养基上,接种生孢梭 菌的培养物至硫乙醇酸盐流体培养基中,30?35℃培养18?24小时; 接种白色念珠菌的培养物至沙氏葡萄糖液体培养基中或沙氏葡萄糖琼 脂培养基上,20?25℃培养24?48小时,上述培养后的新鲜培养物用 PH7.0无菌化钠-蛋白胨缓冲液或0.9%无菌化钠溶液制成每lml菌数小
无菌技术操作流程及评分标准
无菌技术操作流程 开始:各位老师下午好,我操作的项目是无菌技术操作。 1.无菌技术操作的目的:保持无菌物品无菌区域不被污染,防止一切微生物侵入机体,避免给患者带来不应有的损失和危害 2.环境评估:操作前30分钟停止清扫,操作中减少人员走动,开窗、通风、换气,操作台宽敞、平坦、整洁、干燥。 3.用物准备:治疗盘无菌包:包内置无菌巾若干无菌容器内置无菌持物钳棉签无菌包:内置治疗碗一个,镊子两把,弯盘一个无菌纱布罐无菌棉球罐无菌生理盐水一次性无菌手套 铺无菌盘 1.洗手戴口罩。 2.治疗盘清洁,干燥。铺无菌换药盘。 3.开无菌包:化学指示胶带有变色,在有效期内,无潮湿、无破损。斜角打开(打开无菌包内角时,手不可触及包布内面,不得跨越无菌区域)看化学指示卡,有变色。用无菌持物钳夹取一块无菌巾放入治疗盘内,将无菌包按原折痕“一字”包好后,看时间:记录日期、时间、并签名、24小时内有效。 4.铺无菌巾:双手捏住无菌巾一侧两角外面轻轻抖开,由近及远的将治疗巾一半铺于治疗盘上,将上下对齐后上层扇形折三次,开口外边向外,使治疗巾内面构成一无菌区。 5.开无菌包,前述指示胶带变色,在有效期内,侧孔、底孔闭合 1)打开无菌包,看化学指示卡变色 2)用无菌钳分别取治疗碗(内含两把镊子)、弯盘入无菌盘内。 3)打开无菌纱布罐夹取纱布置无菌盘内;同法夹取无菌棉球置治疗碗内(手不可触及容器边缘或内侧),无菌容器盖内面朝下直接盖上。 6.倒无菌溶液:(拿起溶液瓶,看瓶签)述:瓶身干净,标签完整、字迹清楚,0.9%Nacl500ml,在有效使用期内,瓶盖无松动,瓶身瓶底无无裂缝,对光检查:溶液澄清、无杂质。除盖:查棉签(无漏气,在有效试用期内)写好开包日期,消毒瓶盖、手指,开瓶盖。倒溶液于治疗碗内,再次消毒瓶口,盖回瓶盖看时间:记录日期、时间、签名,24小时有效。 7.铺完盘,看时间口述:记录名称、时间并签名(小标签贴于盘缘)、4小时内有效。述:已铺好换药盘,可以给病人进行换药护理。一份无菌物品只供一位病人使用,以防交叉感染。 8.注意事项:在操作中应注意:无菌容器盖放于稳妥处时,应内面朝上。到远处夹取无菌物品,应同时搬移无菌持物钳和容器。无菌持物钳和浸泡容器每周灭菌2次,同时更换消毒液,干燥保存4小时更换一次 带无菌手套 1.目的:用于进行无菌操作,防止患者受到感染,用于接触某些无菌物品或区域,保持无菌物
无菌检查用培养基的适用性检查标准操作规程
无菌检查用培养基的适用性检查标准操作规程 目的:建立无菌检查用培养基适用性检查标准操作规程。 范围:适用于无菌检查使用培养基的适用性检查。 依据:中国药典》2015年版 《药品生产质量管理规范》2010年修订 《中国药品检验标准操作规程》2010年版 责任:QC化验员对实施本规程负责。 内容: 1、概要:无菌检查用的硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基等应符合培养基的无菌检查及灵敏度检查要求。本检查可在供试品的检查前或与供试品的检查同时进行。 2、材料及设备 2.1 生化培养箱 2.2 生物安全柜 2.3 中国浊度标准管(由中国药品生物制品检定所提供) 2.4 灭菌试管、灭菌注射器 2.5 0.9%无菌氯化钠溶液 2.6 0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液:取聚山梨酯80 0.05ml,加pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%氯化钠至100ml,混匀,灭菌即可。3、无菌检查培养基的适用性检查 3.1无菌性检查 取新鲜配制灭菌的培养基各5瓶,硫乙醇酸盐流体培养基置30~35℃,胰酪大豆胨液体培养基置20~25℃,培养14天,应无菌生长。 3.2灵敏度检查 3.2.1菌种 培养基灵敏度检查所用的菌株传代次数不得超过5代(从菌种保存中心获得的干燥菌种为第0代),
并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。 金黄色葡萄球菌[Staphylococcus aureus CMCC(B) 26003] 铜绿假单胞菌[Pseudomonas aeruginosa CMCC(B) 10104] 枯草芽孢杆菌[Bacillus subtilis CMCC(B) 63501] 生孢梭菌[Clostridium sporogenes CMCC(B) 64941] 白色念珠菌[Candida albicans CMCC(F) 98001] 黑曲霉[Aspergillus niger CMCC(F) 98003] 3.2.2菌液制备 3.2.2.1 金黄色葡萄球菌菌悬液制备 3.2.2.1.1 取金黄色葡萄球菌的新鲜培养物至胰酪大豆胨液体或胰酪大豆胨琼脂培养基上,30~35℃培养18~24小时,取新鲜传代菌种一支待用。取一支灭菌中试管,加入3ml 0.9%无菌氯化钠溶液,把新鲜传代菌种培养物用接种环轻轻刮取,在加入pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液的试管壁上研磨,使之成为均匀悬液。 3.2.2.1.2 取菌悬液1ml于比浊管中,用0.9%无菌氯化钠溶液逐步稀释至与标准管的浊度一致。记录下所加入的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液的量,余下的2ml菌液盖上试管塞以备用。 3.2.2.1.3 打开试管塞,取1ml菌液于中试管中,加入比浊时所需的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液的量一致的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,此时试管中的细菌浓度与标准比浊管相一致。根据细菌浊度标准菌数表的菌数,将菌悬液用pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液系列稀释至不大于100cfu/ml。 3.2.2.1.4 铜绿假单胞菌、枯草芽孢杆菌的菌悬液制备方法同金黄色葡萄球菌。 3.2.2.2 生孢梭菌菌悬液的制备 3.2.2.2.1取生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基上,30~35℃培养18~24小时,取一支灭菌中试管,用灭菌注射器吸取硫乙醇酸盐流体培养基中底部三分之二处的新鲜菌液1ml,加入
产品无菌方法验证
产品无菌方法验证 一、概述 1、简介 无菌检查法是指检查无菌药品、医疗器械等是否无菌的一种方法。无菌检查是在洁净度百级的单向流空气区域内进行,其全过程严格遵守无菌操作,防止微生物污染。本验证方案参考《中华人民共和国药典2010版二部》附录无菌检查法和GB/T19973.2-2005/ISO 11737-2:1998 医疗器械的灭菌微生物学方法第二部分:确认灭菌过程的无菌试验。二、验证目的 通过对无菌方法的培养基适用性检查、无菌检查方法的适用性检查,并且结果符合规定,证明培养基的适用性以及无菌检验方法的适用性,以达到用适合的方法对样品进行无菌检查的目的。 三、范围 本验证方案适用于X公司医疗器械无菌检查方法。本文件规定了无菌验证的程序、方法、标准和记录。 四、验证参考文件 五、验证人员及职责 1质量部QC:负责验证计划、方案起草、按监控计划执行,做好检验工作,并进行记录,出具报告。 2质量部:质量部经理负责验证方案的审核、记录的审核和报告的审核。按文件管理要求,作好验证方案文件的控制工作。 六、验证内容 1、验证试验项目
1.1 培养基的的适用性检查。 1.2方法适用性检查 2、验证实施步骤 2.1 所用培养基 胆盐硫乙醇酸盐流体培养基 改良马丁培养基 2.2 培养基的配制 硫乙醇酸盐流体培养基:称取硫乙醇酸盐流体培养29.3g,加入蒸馏水或去离子水1L,煮沸至完全溶解,分装试管,121℃灭菌15min。 改良马丁:称取改良马丁28.5g加入蒸馏水或去离子水1L,搅拌加热至完全溶解,分装试管,121℃灭菌30min。 2.3 菌悬液配制 所用菌种:金黄色葡萄球菌CMCC(B)26003 铜绿假单胞菌CMCC(B)10104 枯草芽孢杆菌CMCC(B)63501 生孢梭菌CMCC(B)64941 白色念珠菌CMCC(F)98001 黑曲霉CMCC(F)98003 用无菌生理盐水将所用菌种稀释至30-100CFU/ml(2~8℃保存24h内使用)。 2.3 检验方法以及培养条件的选择 依据产品特点和标准推荐,优先选用直接浸泡于生长培养基(硫乙醇酸盐流体培养基和改良马丁培养基)中,然后硫乙醇酸盐流体培养基和改良马丁培养基分别在23~28℃和30~35℃培养14天,逐日观察,并记录结果。 2.4 培养基的适用性检查 2.4.1 培养基的无菌检查 硫乙醇酸盐流体培养基和改良马丁培养基分别取5支,培养14天,应无菌生长。2.4.2 灵敏度检查 2.4.2.1 接种 取每管装量12ml的硫乙醇酸盐流体培养基9支,分别接种小于100CFU的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌各2支,另一支不接种作空白对照,培养3天;取每管装量9ml的改良马丁培养基5管,分别接种白色念珠菌、黑曲霉2支,另一支不接种作空白对照,培养5天。逐日观察结果。 2.4.2.2 结果判断 空白对照管应无菌生长,加菌的培养基管均生长良好,判该培养基的灵敏度检查符合规定。 2.5 无菌方法适用性检查 2.5.1 接种 取装量为25ml的硫乙醇酸盐流体培养基8管,分别接入小于100cfu的金黄的葡萄球
无菌检查法标准操作规程
无菌检查法标准操作规程 目的: 建立无菌检查的基本操作,为无菌检查人员提供正确的操作规程。 2.依据: 《中华人民共和国药典》2000年版二部。 3.范围: 本标准适用于QC无菌检查的操作。 4. 职责: QC无菌检查人员对本标准的实施负责。 5.程序: 5.1. 定义: 无菌检查法:系指检查药品、无菌器具及适用于药典要求无菌检查的其它品种是否无菌的一种方法。 5.2. 无菌操作室应具有空气除菌过滤的层流装置,局部洁净度100级或放置同等级别的超净工作台,室内温控(18~26)℃及除湿装置,操作室或工作台应保持空气正压。 5.2.1. 无菌室的清洁与消毒应符合QC洁净室清洁、消毒规程(SOP ZL0014)。 5.2.1.无菌室无菌程度的检查应符合规定:见沉降菌监测规程(SOP ZL0006)、悬浮粒 子监测规程(SOP ZL0005)。 实验设备及用具: 5.3.1.电热干燥箱、电热手提式压力蒸汽灭菌器、电热恒温培养箱、试管、注射器、针头、试管架、刻度吸管、手术剪、手术镊、砂轮、注射器盒、搪瓷托盘、双碟、75%酒精棉球、无菌工作服(衣、裤、帽、口罩等)。 5.3.2.微孔滤膜:直径50mm、孔径0.45μm,应符合规定。 5.3.3.除菌滤器: 除菌滤器采用的是HTY-2000型全封闭式薄膜过滤器。 5.3.4. 所有进入无菌室的物品必须经过消毒或灭菌,应严格按照进入QC无菌室物品清洁、消毒、灭菌规程(SOP ZL0015)进行操作。
5.4. 稀释剂:灭菌注射用水。 5.5. 培养基: 5.5.1.需气菌、厌气菌培养基(流体硫乙醇酸盐培养基);真菌培养基。 5.5.2. 培养基的使用,配制、管理及灵敏度检查应按照培养基管理规程(SMP ZL0036)、培养基灵敏度检查规程(SOP ZL0019)、培养基配制规程(SOP ZL0016)进行操作。 5.6. 对照用菌液: 5.6.1. 金黄色葡萄球菌(Staphyoccus sureus)菌液:取金黄色葡萄球菌[CMCC(B)26 003]的营养琼脂斜面新鲜培养物1白金耳,接种至营养肉汤培养基内,在30~35℃培养16~18小时后,用0.9%无菌氯化钠溶液稀释至每1ml中含10~100个菌。 5.6.2. 生孢梭菌(Clostridum sporgenes)菌液:取生孢梭菌[CMCC(B)64 941]的需气菌、厌气菌培养基新鲜培养物1白金耳,接种至相同培养基内,在30~35℃培养18~24小时后,用0.9%无菌氯化钠溶液稀释至1ml中含10~100个菌。 5.6.3. 白色念珠菌(Candida albicans)菌液:取白色念珠菌[CMCC(F)98 001]的 真菌琼脂培养基斜面新鲜培养物1白金耳,接种至真菌培养基内,在20~25℃培养24小时后,用0.9%无菌氯化钠溶液稀释至每1ml中含10~100个菌。 5.7. 操作法: 5.7.1. 供试品、培养基在移入缓冲间之前应先编号,并用75%酒精棉球擦拭瓶(管)外壁,然后连同其它用具(包括无菌衣、帽、口罩等)移入缓冲间,打开无菌间紫外光 灯和空气过滤装置开关,并使其工作在30分钟以上。 5.7.2. 将所需物品移入无菌室,每次试验中所用物品,必须计划好,并有备用物。操作人员进入无菌室应严格遵守QC洁净室进出规程(SOP ZL0013)。 5.7.3. 供试品外部消毒: 5.7.3.1. 橡皮塞、铝盖、压封小瓶:先用75%酒精棉球擦拭外壁及瓶塞,待干,用消毒镊子剔去铝盖上的铝质小圆片,用酒精棉球擦拭瓶盖及橡皮塞,并将酒精棉球盖于橡皮塞上待取样。 5.7.3.2. 安瓶:先用酒精棉球将安瓶外部擦拭消毒待干,用砂轮轻轻割安瓶颈部,便于折开安瓶。 5.7.4. 供试品溶液的制备:取供试品加入该药品项下规定的稀释剂用量,制成该药品项下规定浓度的供试品溶液。 5.7.5. 根据供试品的抑真菌和抑细菌试验,判定该供试品有无抑菌性,而决定采用直接
无菌检查法标准操作程序
1目的 建立一个无菌检查法标准操作程序,保证实验的准确性、可靠性。 2范围 适用于原料、辅料及成品的无菌检查。 3职责 微生物检验员遵照执行。 4内容 无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。 无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区、工作台面及环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。日常检验还需对试验环境进行监控。 4.1 培养基 硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌的培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。 4.1.1 培养基的制备及培养条件 培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。配制后应采用验证合格的灭菌程序灭菌。制备好的培养基应保存在2?25°C、避光的环境,若保存于非密闭容器中,一般在3 周内使用;若保存于密闭容器中,一般可在一年内使用。 4.1.1.1 硫乙酵酸盐流体培养基
胰酪胨15. 0g 氯化钠 2. 5g 酵母浸出粉 5. 0g 新配制的0. 1 % 刃天 无水葡萄糖 5.0g 青溶液 1.0ml L-胱氨酸0. 5g 琼脂0. 75g 硫乙醇酸钠0.5g 水1000ml (或硫乙醇酸)(0.3ml) 除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节p H 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节p H , 使灭菌后在25℃的p H 值为7.1 土0.2。分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。灭菌。在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100°C水浴加热至粉红色消失(不释过2 0分钟),迅速冷却只限加热一次,并防止被污染。 除另有规定外,硫乙醇酸盐流体培养基置30?35C培养。 4.1.1.2 胰酪大豆胨液体培养基 胰酪胨 1 7 . 0g 氯化钠 5.0g 大豆木瓜蛋白酶水解物 3. 0g 磷酸氢二钾 2. 5g 葡萄糖/无水葡萄糖 2. 5g/2. 3g 水1000m l 除葡萄糖外,取上述成分,混合,微温溶解,滤过,调节p H 使灭菌后在2 5℃的p H 值为7. 3±0. 2,加入葡萄糖,分装,灭菌。 胰酪大豆胨液体培养基置20?2 5 ℃培养。 4.1.1.3 中和或灭活用培养基 按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基的处方及制法,在培养基灭菌或使用前加入适宜的中和剂、灭活剂或表面活性剂,其用量同方法适用性试验。 4.1.1.4 0.5% 葡萄糖肉汤培养基(用于硫酸链霉素等抗生素的无菌检查) 胨 1 0 . 0g 氯化钠 5 . 0g 牛肉浸出粉 3 . 0g 水1000m l 葡萄糖 5. 0g 除葡萄糖外,取上述成分混合,微温溶解,调节p H 为弱碱性,煮沸,加入葡萄糖溶解后,摇匀,滤清,调节pH使灭菌后在25℃的p H 值为7. 2士0.2,分装,灭菌。 4.1.1.5 胰酪大豆胨琼脂培养基 胰酪胨15.0g 琼脂 1 5 . 0g
20无菌检验操作规程
余姚市吉康医疗器械厂 无菌检验操作规程 1 目的 确保本企业所生产的成品符合产品标准要求。 2 范围 本规程供检验员成品的无菌检验用。 3 职责 检验员负责做好成品(指无菌产品)的无菌检验,并作好检验记录。 4 工作程序 4.1试剂 质量浓度为9g/L的无菌氯化钠溶液、其他符合《中国药典》要求的稀释液和冲洗液。 4.2主要设备 超净工作台、恒温培养箱、恒温水浴箱、压力蒸汽灭菌器、电热干燥箱。 4.4试验前准备 4.4.1 器具灭菌 与供试液接触的所有器具应采用可靠方法灭菌,置压力蒸汽灭菌器内120℃30min,或置电热干燥箱内160℃2h。 4.4.2 无菌室要求 4.4.2.1超净工作台局部应符合洁净弃100级单向流空气区域要求。无菌室在消毒处理完毕后,应检查空气中的菌落数,方法如下:取直径约90mm培养皿,无菌操作注入融化的营养琼脂培养基约20mL,在30℃~35℃培养48 h证明无菌后,取3只培养皿在超净工作台平均位置打开上盖,在暴露30min后盖好置30℃~35℃培养48h后取出检查。3只培养皿上生长的菌落数平均应不超过1个。 4.4.2.2 无菌试验过程中应检查空气中的菌落数,方法同上。在试验开始进行时打开培养皿盖,至试验结束后盖好照上法培养,应符合上述要求。 4.5培养基 用于培养需(厌)气菌和真菌的培养基的制备、培养基灵敏度检查及其他各项要求应符合《中国药典(二部)》附录中《无菌检查法》的规定。 4.6 供试品抑菌性验证试验 对未知或可疑的供试品,在进行无菌试验前,应按照《中国药典(二部)》附录中“无菌检查法”的规定进行方法验证试验,以确认供试品在该试验条件下无抑菌活性或其抑菌活性可以忽略不计。 4.7试验方法 4.7.1 供试品数量 同一批号(灭菌批)3个~5个单位供试品。 4.7.2 浸提介质 质量浓度为9g/L的无菌氯化钠溶液或其他符合《中国药典》要求的稀释液和冲洗液。 4.7.3 供试液制备 优先采用将供试品或其有代表性的各部分直接投放入培养基内培养。如供试品不适宜直接投放,可按下列方法制备供试液,应使浸提介质充分洗提供调节器的浸提表面。供试液制备应按无菌操作法进行,在制备后2h内使用。 质量浓度为9g/L的无菌氯化钠溶液、其他符合《中国药典》要求的稀释液和冲洗液。 4.7.4 接种、培养和观察 根据供试品具体特性选择《中国药典(二部)》附录中“无菌检查法”规定的适宜接种方式,以无菌操作法进行。 供试品的培养观察按《中国药典(二部)》附录中“无菌检查法”的规定。 4.7.5 结果判定 按《中国药典(二部)》附录中“无菌检查法”的规定。 4.8记录 对每一产品的灭菌批作好《细菌检验原始记录》记录保存期限为五年。 起草人/日期:批准人/日期:实施日期:2008-12-10
无菌检查操作规程
无菌检查操作规程 1、目的 建立无菌检查标准操作规程,规范无菌检查操作过程,确保检查结果的准确性。 2、范围 本规程适用于广州赛哲生物科技股份有限公司无菌检查操作过程。 3、职责 相关操作人员负责本规程的具体实施,质检部负责对本规程的实施过程进行监督。 4、工作程序 4.1培养基的制备及培养条件 培养基可按以下给出的处方制备,也可使用按处方生产的符合规定的脱水培养基或成品培养基。配制后应采用验证合格的灭菌程序灭菌。制备好的培养基应保存在2~25℃、避光环境下,三周内使用。 4.1.1硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌的培养。配方如下: 除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节p H 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH,使灭菌后在25℃的pH值为7.1土0.2。 分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。灭菌。在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100°C水浴加热至粉红色消失(不释过20分钟),迅速冷却,只限加热一次,并防止被污染。 除另有规定外,硫乙醇酸盐流体培养基置30?35℃培养。 4.1.2胰酪大豆胨液体培养基用于真菌和需氧菌的培养。配方如下:
除葡萄糖外,取上述成分,混合,微温溶解,滤过,调节pH使灭菌后在25℃的pH 值为7.3±0.2,加入葡萄糖,分装,灭菌。 胰酪大豆胨液体培养基置20?25℃培养。 4.1.3胰酪大豆胨琼脂培养基配制方法如下: 除琼脂外,取上述成分,混合,微温溶解,调节pH使灭菌后在25℃的pH值为7.3±0.2,加人琼脂,加热溶化后,摇匀,分装,灭菌。 4.1.4沙氏葡萄糖琼脂培养基用于黑曲霉的培养。培养如下: 除葡萄糖、琼脂外,取上述成分,混合,微温溶解,调节pH使灭菌后在25℃的pH 值为5.6士0.2,加入琼脂,加热溶化后,再加入葡萄糖,摇匀,分装,灭菌。 4.2培养基的无菌性检查 每批培养基随机取不少于5支(瓶),置各培养基规定的温度培养14天,应无菌生长。 4.3培养基的灵敏度检查 4.3.1菌种培养基灵敏度检查所用的菌株传代次数不得超过5代(从菌种保存中心获得的干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。 金黄色葡萄球菌(Staphylococcusaureus)〔CMCC(B)26 003〕 铜绿假单胞菌(Pseudomonasaeruginosa ) 〔CMCC(B)10 104〕 枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63 501〕
无菌检测规程
无菌检测规程 1.目的: 建立无菌检查的标准操作规程,确保检验结果的准确性。 2.适用范围 本规程适用于本公司质检科对本厂生产的的无菌检测。 3.引用相关文件 制定本规范参考了下列文件中的一些信息,但没有直接引用里面的条文。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T 14233.2-2005 医用输液、输血、注射器具检验方法第2部分:生物学试验方法《中华人民共和国药典2010年版二部》附录Ⅺ H 无菌检查法 4.设备、用具与试剂 4.1 设备要求 无菌操作室、超净工作台、培养箱、高压消毒锅、高温烘箱。 4.1.1 无菌室应每周用0.1%新洁尔灭或2%甲酚液擦拭操作台及可能污染的死角,每次操作前开动无菌空气过滤器及紫外光灯杀菌1小时。在每次操作完毕,用2%甲酚或0.1%新洁尔灭溶液擦拭工作台面,用紫外光灯杀菌0.5小时。每次使用无菌室都应详细填写无菌室使用记录。 4.1.2 无菌室、超净台在消毒处理完毕后,应检查空气中的菌落数,方法如下:取直径90mm 培养皿,无菌操作注入融化的营养琼脂培养基20ml,在30~35℃培养48h证明无菌后,取3只培养皿在无菌室超净工作台内平均位置打开培养皿上盖,暴露30min后盖好,置30-35℃培养48小时后取出检察, 3只培养皿上生长的菌落数平均不得超过1个。 4.1.3 无菌试验过程中检查空气中的菌落数,方法同上。在试验开始进行时,打开平皿盖在空气中暴露,至试验结束,盖好。照上法培养,应符合上述要求。
无菌检查标准操作程序
无菌检查标准操作程序 1.目的:建立无菌检查标准操作程序,规范检验操作。 2.范围:适用于本公司产品无菌检查—薄膜过滤法的操作。 3.职责:检验人员对本程序的实施负责。 4.本规程的编制依据为2010年版《中华人民共和国药典》二部附录“无菌检查法”中的“薄膜过滤法”。 5.检验环境要求: 5.1本项检查应在环境洁净度C级下的局部洁净度A级的单向流空气区域内或隔离系统中进行。 5.2检验全过程必须严格遵守无菌操作,防止微生物污染。 5.3单向流空气区、工作台面及环境应按《洁净厂房环境监测规程》(SOP-)及《沉降菌监测的标准操作规程》(SOP-)、《洁净室悬浮粒子数测定的标准操作规程》(SOP-)定期进行洁净度监测。隔离系统按相关要求进行验证,其内部环境的洁净度须符合无菌检查的要求。 6.操作规程: 6.1培养基的准备: 6.1.1培养基的制备:按《培养基配制、灭菌的标准操作规程》(SOP-)制备。 ①硫乙醇酸盐流体培养基(用于培养好氧菌、厌氧菌)。 注意:在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并应防止污染。 ②改良马丁培养基(用于培养真菌)。 6.2培养基的适用性检查 每批培养基应按《无菌检查的标准操作规程》(SOP-)进行培养基的无菌性检 查及灵敏度检查。 只有本项检查合格的培养基方可用于供试品无菌检查。 本项检查可在供试品的无菌检查前或与供试品的无菌检查同时进行。 6.3稀释液、冲洗液及其制备方法: 6.3.1 0.1%蛋白胨水溶液取蛋白胨1.0g,加水1000ml,微温溶解,滤清,调节pH值至 7.1±0.2,分装,灭菌。
医疗器械产品无菌检验操作规程新整理
医疗器械产品无菌检验操作规程 1 目的 通过无菌检验,确保灭菌后产品能够达到无菌的要求。 2 适用范围 适用于灭菌后医疗器械产品(列举)的无菌检验。 3 检验依据 本厂产品注册标准(编号) EN1174-1996 医疗器械灭菌产品中微生物数量的评估 《中国药典》(2005年版) 医用输液、输血、注射器具检验方法第二部分:生物试验方法 GB15980-1995 一次性使用医疗用品卫生标准 4 仪器、设备 百级层流超净工作台、电热干燥箱、电热恒温培养箱、霉菌培养箱、压力蒸汽灭菌器、集菌仪(器)、电子天平、PH计、冰箱、恒温水浴锅、酒精灯、三角烧瓶,接种环、无菌棉签、镊子,试管架,大试管若干等。 5 无菌检验室的环境要求 无菌检验应在环境洁净度10000级下的局部百级的单向流空气区域内进行。 缓冲区与外界环境、无菌检验室与缓冲区之间空气应保持正压,阳性对照室与缓冲区之间空气应保持负压。无菌检验室与室外大气之间静压差应大于10Pa。无菌检验室的室温应保持18~26℃,相对湿度:45~65%。 无菌检验室的单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行悬浮粒子、浮游菌和沉降菌的监测。每年至少检测一次。 无菌检验过程中应同时检查超净工作台单向流空气中的菌落数:每次操作时在层流空气所及台面的左中右置3个营养琼脂平板,暴露30min,于30~35℃培养48小时,菌落数平均应不超过1CFU/平板。 6 无菌检验前的准备 器具灭菌、消毒 6.1.1 灭菌:试验过程中与供试品接触的所有器具必须采用可靠方法灭菌。可经电热干燥箱160℃以上干烤2小时,或置压力蒸汽灭菌器内121℃蒸汽灭菌30分钟后使用(根据灭菌效果验证决定灭菌参数)。所有的灭菌物品不应超过2周即用毕,否则应重新灭菌。 6.1.2 消毒:凡检验中使用的器材无法灭菌处理的,使用前必须经消毒处理。如无菌检验室的试管架、电子天平、工作台面、工作人员的手、橡胶吸头等。可采用消毒剂浸泡或擦拭。消毒剂应每月更换,以防止产生耐药菌株。 6.1.3 标识:器具的灭菌、消毒后必须做好标识,标明灭菌、消毒时间和使用有效期。 人员、物料进入无菌检验室 6.2.1 开启紫外线灯或臭氧发生器进行空间灭菌处理,消毒时间不得少于30min。 6.2.2 物料进入无菌检验室流程 6.2.2.1 脱包:进入无菌检验室的物品若有双重包装的,需将外包装在传递窗/缓冲间拆除后,传入试验室。 6.2.2.2 消毒:进入无菌操作室的所有培养基、供试品等的外表都应采用适用的方法进行消毒处理,以避免将外包装污染的微生物带入无菌检验室。 6.2.2.3 传递:查看所有进入无菌检验室的器具上的灭菌、消毒标识,是否在有效期内。符合要求的经传递窗传入无菌检验室。
(2015年版药典)非无菌药品微生物限度检查操作规程
1. 目的:建立非无菌药品微生物限度检查检验标准操作规程,规范检验操作,确保检验结果准确。 2. 适用范围:适用于本公司所有采用非无菌药品微生物限度检查法测定的供试品。 3. 责任者:QC检验员、QC经理。 4. 正文: 4.1 非无菌产品微生物限度检查:微生物计数法 4.1.1 简述 微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。 当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。除另有规定外,本法不
适用于活菌制剂的检查。 本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。 微生物计数试验应在受控洁净环境下的局部洁净度不低于B 级的单向流空气区域内进行。检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区域、工作台面及环境应定期进行监测。 如供试品有抗菌活性,应尽可能去除或中和。供试品检查时, 若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。 供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。 4.1.2 计数方法 计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-NumberMethod,简称MPN 法)。MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。 供试品检查时, 应根据供试品理化特性和微生物限度标准等因素选择计数方法,所选的方法必须具备检测充足样品量的能力,以保证所获得的试验结果能够判断供试品是否符合规定。所选方法的适用性须经确认。 4.1.3 计数培养基适用性检查和供试品计数方法适用性试验 供试品微生物计数中所使用的培养基应进行适用性检查。 供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。 若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试
无菌检测标准操作规程(培养法)
起草人:起草日期: 审核人:审核日期: 批准人:批准日期: 武汉仝干生物科技有限公司 Wuhan Togo Biotechnology Co.,Ltd
1、目的 建立无菌检测的基本操作,为无菌检测人员提供正确的操作规程。通过无菌检验后,确保产品能够达到无菌的要求。 2、适用范围 适用于我公司进行细胞质量检验的技术人员。 3、内容 3.1 简述:无菌检测系用于检查细胞是否无菌的一种方法。检查项目包括需氧菌、厌氧菌及真菌检查。若供试品符合该项检查方法的有关规定,仅表明在该检验条件下未发现微生物污染。 3.2 环境要求:该项检查应在环境洁净度万级背景下的局部百级的单向流区域内或隔离系统中进行。其过程必须严格遵守无菌操作,日常检验需对试验环境进行监控。 3.3人员要求:无菌检测人员应具备微生物及检验专业知识,并经过无菌检验培训。 4、无菌检验前的准备 4.1器具灭菌、消毒 试验过程中与供试品接触的所有器具必须采用可靠方法灭菌,可置高压灭菌锅内121℃蒸汽灭菌30分钟后使用(根据灭菌效果验证决定灭菌参数)。所有的灭菌物品不应超过2周即用毕,否则应重新灭菌。凡检验中使用的器材无法灭菌处理的,使用前必须经消毒处理,如无菌检验室的电子天平,工作台面等,可采用消毒剂浸泡或擦拭。 器具的灭菌、消毒后必须做好标识,标明灭菌、消毒时间和使用有效期。 4.2人员、物料进入无菌检验室
开启紫外灯或臭氧发生器进行空间灭菌处理,消毒时间不得少于30分钟。人员进入无菌检验室需在一更区脱去一般区工作鞋,换无菌检验室工作鞋,并在二更区穿戴无菌服、口罩和手套,口罩掩住口鼻,帽子包裹所有头发。 进入无菌检验室的所有培养基、供试品等需将外包装在传递窗拆除后,查看所有进入无菌检验室的器具上的灭菌、消毒标识,是否在有效期内,符合要求的于传递窗进行表面紫外消毒,传入无菌检验室。 5、无菌检验室操作要求 1)人员进入后,首先进一步消毒擦拭工作台面。 2)全过程必须严格执行无菌操作,防止微生物污染。 3)使用玻璃器皿应轻取轻放,避免破损,以防培养物扩散。 4)所有操作均应在近火焰区进行,且不得有大幅度或快速动作,以免搅动空气中的尘埃微粒。 5)使用金属接种器具时,用前、用后均需灼烧灭菌。 6)在接种培养物时,动作应轻、准,防止培养物溅出,产生汽溶胶,造成污染。 7)操作过程中所有的带菌物品,用后均应作消毒、灭菌处理。可在检验过程中随用随时放入消毒液缸内浸泡或消毒桶内,或在检验完成后经传递窗传至一般区,立即用压力蒸汽灭菌锅121℃灭菌30分钟。 6、培养基制备 6.1需氧菌、厌氧菌培养基(硫乙醇酸盐流体培养基)的制备 所用试剂: 酪胨(胰酶水解) 15.0g 葡萄糖 5.0g L-胱氨酸 0.5g 硫乙醇酸钠 0.5g (或硫乙醇酸)(0.3ml) 酵母浸出粉 5.0g 氯化钠 2.5g 新配制的0.1%刃天青溶液 1.0ml 琼脂 0.75g 水 1000ml
