2017-2018学年度第一学期期末考试高一化学试题

2017-2018学年第一学期第二学段模块考试高一化学试题
考试时间:90分钟满分:100可能用到的相对原子质量:C: 12 0:16 Mg:24 Cl: 35.5
第I卷(共47分)一?选择题(1-7题每小题2分,8-18题每小题3分,共47分)
1?化学与生活、社会密切相关。下列说法正确的是()
A .正常雨水的pH值为7.0,酸雨的pH值小于7.0
B ?亚硝酸盐常做食品防腐剂,可以大量添加于食物中
C ?大量燃烧化石燃料是造成雾霾天气的重要原因之一
D ?自然界中的固氮作用对植物的生长有害无益
2. 胶体区别于其它分散系的本质特征是()
A ?能透过滤纸
B ?久置不分层
C .有丁达尔效应
D .分散质粒子的直径在1?100 nm之间
3. 下列关于硫及其化合物的说法中正确的是()
A ?用酒精清洗附着在试管壁上的硫黄
B ? SO2具有氧化性,故可用于漂白纸浆
C ?不能用浓硫酸干燥SO2、CO等气体,因具有还原性
D .二氧化硫能使滴有酚酞的氢氧化钠溶液退色,体现了其酸性
4. 下列关于金属钠的说法中,不正确..的是()
A ?钠长期置于空气中,最后变成碳酸钠
B .钠能从硫酸铜溶液中中置换出铜
C 钠和氧气反应,条件不同,产物不同
D .钠与水反应时,钠熔成小球在水面四处游动
5?下列叙述中正确的是(
A ?可用酒精萃取溴水中的单质溴
B ?液溴易挥发,在存放液溴的试剂瓶中应加水封
C .能使润湿的淀粉KI试纸变成蓝色的物质一定是CI2
D .某溶液加入CCl4 , CCl4层显紫色,证明原溶液中存在「
6. 下列有关NaHCO3与
Na2CO3的性质说法中,正确的是()
A .相同温度时,Na2CO3的溶解度小于NaHCO3的溶解度
B .除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法
C. 与同浓度稀盐酸反应,NaHCO3放出气泡的速率更快
D. 将二者配成溶液,再分别滴加Ca(OH)2溶液,无白色沉淀生成的是NaHCO3
7. 下列溶液中c(CI-)最大的是()
A. 65 mL 1 mol L-1的KCl 溶液
B. 25 mL 3 mol L-1的NaCl 溶液
C. 20 mL 2 mol L-1的MgCI 2溶液
D. 10 mL 1.5 mol L-1的AlCl 3 溶液
8. 配制1mol L-1 H2SO4溶液250mL,下列仪器中,不需要的是
①托盘天平②量筒③容量瓶④烧杯⑤玻璃棒⑥酒精灯⑦胶头滴管
A. 只有①
B.只有①⑥
C.只有⑦
D.只有④⑤
9. 用N A表示阿伏加德罗常数的值,下列说法正确的是()
A. 将22.4 L HCl配成1 L溶液,溶液中H+数目为N A
B. 1mo1?L1的FeC13溶液中C「离子的数目为
3 N A
C. 常温常压下,28 g CO中所含的原子数目为2N A
D. 2.4 g镁变成镁离子时,失去的电子数是
0.1N A
B. Ca2+、NO3—、Ag+、Cl—
D. K+、Ba2+、C「、NO3一
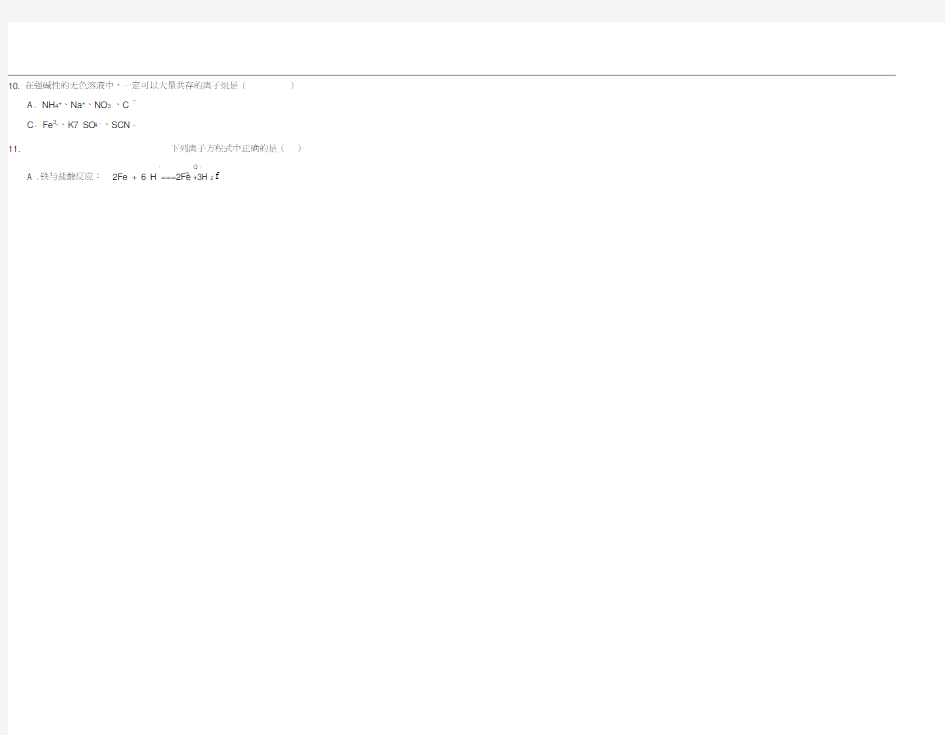
10. 在强碱性的无色溶液中,一定可以大量共存的离子组是()
A. NH4+、Na+、NO3-、C「
C. Fe3*、K7 SO4「、SCN一
11. 下列离子方程式中正确的是()
+ Q +
A .铁与盐酸反应:2Fe + 6 H ===2Fe3 +3H 2 f
B .向氯化钙溶液中通入CO2:Ca2+ + H20 + CO2===CaCO3j + 2H
C .将氯气通入氢氧化钠溶液中:CI2+ 20H 一=== C「+C10一+H20
D .碳酸氢钠溶液与氢氧化钠溶液混合:HC03「+0H —===H2O+CO2f
12?为了除去粗盐中的Ca2+, Mg 2+, SO42-及泥沙,得到纯净的NaCI,可将粗盐溶于水,然后下列操作中选取必要的步骤和正确的操作顺序()
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A .④②⑤
B .②⑤④①③
C .①④②⑤③
D .④①②⑤③
13.对于某些离子的检验及结论一定正确的是()
A .加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有C03「
B ?加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有S0£
C ?加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
D .加入澄清石灰水,变浑浊,再加盐酸,有无色无味的气体,不能确定一定有C03「
B. n可用于除去C02中的HCI
C. 用川制备并收集少量N02气体
D. 用V中操作制备氢氧化亚铁并观察其颜色
15. 在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是(
)
①只有Fe" ②Fe2+和Fe3+③Fe2+和Cu2+④Cu2+和Fe3+
A .①③
B .②④
C .①④
D .②③
16. 新型纳米材料MFe2O x (3v x v4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2O x能使工业废气中的S02转化为S,流程如下,则下列判断正确的是()
A .1可用于制备并检验氢气的可燃性
14?下列实验能达到实验目的且符合操作要求的是(
H老氧化
钠溶液
新制硫酸
菲诙溶液IV
A. MFe2O x是氧化剂
B. S02是该反应的催化剂
C. x>y D . MFe2O y是氧化产物
17. 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应Fe2O3 +
3Na2O2===2Na2FeO4+ Na2O,下列说法正确的是()
A. Na2O2既是氧化剂又是还原剂
B. Fe2O3在反应中得到电子
C . Na2FeO4能消毒杀菌是因其具有强氧化性
D . 3 mol Na2O2发生反应,有12 mol e发生转移
18. 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl 2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原
混合溶液中钾离子的浓度为()
l?r
! /t I 2(6—a). M2(2^—…
T T
molf 1, -n- mol/ L —vy— ----- n-----
A .
B .
C .
D .
------ 常温下--------- MFe2O x| ――孑I MFe2O y
第H卷(共53分)
二、非选择题(共计5个大题,53分)
19. ( 9 分)
化学是一门以实验为基础的自然科学,实验是进行科学研究的重要手段。
I ?下列有关实验操作或判断正确的是______________________ 。
A. NH 3能使湿润的红色石蕊试纸变蓝色
B. 金属钠着火时,可立即用沾水的毛巾覆盖
C. 实验中当有少量的过氧化钠剩余时,用纸包裹好后将其放入垃圾桶中
D. 实验室制取NO气体时,既可用排水法收集又可用排空气法收集
E. 配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
F. 配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌n .已知二氧化硫可使高锰酸钾溶液褪色。反应的化学方程式为:5SO2+2KMnO 4+2H2O= K2SO4+2MnSO4+2H2SO4 右图为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置。
(1)实验时,从 ___ 端连接盛有澄清石灰水的实验装置(用a或b 填(2)A瓶的溶液中出现的现象是_________________________________ 。(3)____________________________________________________________ C瓶溶液的作用是
20. (12 分)
I .冬季雾霾多发,空气质量堪忧,研究SO2、NO x等对改善空气质量具有重要意义。(1)NO x是汽车尾气中的主要污染物之一。
①汽车发动机工作时会引发N2和O2反应,反应的化学方程式是______________________________
②NO x能形成酸雨,形成酸雨过程中__________________________ NO2
发生反应的离子方程式。
(2)为减少SO2的排放,常采取一些有效措施。
①含硫煤燃烧产生的烟气中的SO2会加重空气的污染,危害环境。燃煤中加入适量生石灰可以起到
固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
。
②利用钠碱循环法也可脱除烟气中的SO2,用作吸收液的Na2SO3溶液可由NaOH溶液吸收SO2制
得,该反应的离子方程式是____________________________________________ 。
n .以黄河水为水源,经过沉降、杀菌消毒等环节生产自来水。将可溶性铝盐、铁盐等投入水中,可以
除去水中的悬浮性杂质,请你写出在水处理过程中加入FeCb发生反应的离子方程式。
CIO2是一种比氯气更加安全高效的消毒剂,其消毒效率(以单位质量得到电子数表示)是氯气的
______ 倍(结果保留两位小数)(提示:ClO2的氯元素被还原为-1价)
21. (8 分)
以下反应①、②可用于从不同原料中提取碘:
①2NaI + Mn O2 + 3H2SO4===2NaHSO4 + Mn SO4+ 2H2O+ 12
②2NaIO 3+ 5NaHSO3===2Na2SO4+ 3NaHSO4+ H20+ 12
(1) ________________________ 反应①中的还原剂是______________________ ;反应②中的氧化产物是
。(均填化学式)
(2) ________________________ 根据反应①、②可推知。
A .氧化性:IO3 >SO£
B .氧化性:MnO2>NalO3
C.还原性:I >Mn2
D.还原性:I2>NaHSO3
B
O
⑶已知Nal和NalO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③ _____________________________________________________________________________ 。(4)上述三个反应中生成等量的I2时转移的电子数最多的是反应___________ (填序号)。
22. (12 分)
I ?工业生产硝酸的尾气中含有氮氧化物NO x (NO和NO2的混合物,假设不含N2O4),对生态环境和
足量新制氯水I红色I-嗣间后溶液
(1)试齐廿1 是__________________ ,试齐H 2 是______________________ ,加入新制氯水发生氧化还
原反应的离子反应方程式是
__________________________________________________________________________________________________
(2)该同学猜想红色溶液退色的原因是溶液中的Fe3+被还原为Fe2你认为该同学的猜想合理
吗?_______________________ ,理由是________________________________________ ;请设计一个简单的实2装置A中发生反应的化学方。验加以验证______________________________________________________________________________
人类健康带来较大的威胁。工业上可用氨催化吸收法处理NO x,反应原理为: 4x NH3 + 6NO x ■催化剂(2 x + 3)N2 + 6x H2O
某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去)
分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸
要成分为盐酸)。某同学为了检测速力菲”药片中Fe1 2*的存在,设计并进行了如下实验:
药片
碾碎后加入试剂1 |淡黄色
溶液
■
静过滤
式剂淡红色
溶液
23.(12分)铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。速力菲”主要成催化剂
(3)装置B中发生反应的离子方程式______________________________________________________
(4)装置F中浓硫酸的作用是
。
n ?用如图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水
上喷的操作是
___________________________________________________________________ 。
据此实验能够归纳出氨气的性质有_____________________________________ 氨气
(3)该药品须密封保存,若表面出现颜色变化,说明部分Fe2+已变成Fe3*。药品中经常放入维生素C,
可以延长保质期。请你解释原因____________________________________________
对原子质量,其产物之一是氮气,写出该反应的化学方程式
