芳亚胺类化合物的合成研究
芳亚胺类化合物的合成研究
1 前言
芳亚胺是一种重要的有机中间体,主要是用于生产酰胺类除草剂和有机磷杀虫剂,其消费量约占70%~80%。在医药行业重要用于合成消炎、解热、镇痛药双氯灭痛等,其他还用于合成青霉素类抗生素药物以及抗寄生虫类药物等。此外,它还用于生产氨基酸类化合物用于合成食品和饲料添加剂等方面[1]。芳亚胺特别是它同其他适当助剂复配后,对根茎作物、油料作物、谷物、纤维作物等多种农作物均有不同程度的增产效果。它在播种前或苗期施于土壤中,明显促进作物根系的增长。作物的根系发达,株体强大,为后期打下坚实营养基础,同时易于抵抗多种气候和病虫害的侵袭,从而收到增产效果[2]。
合成芳亚胺的常用方法是采用等摩尔苯甲醛和苯胺反应[3]。反应过程是等摩尔苯甲醛和苯胺混合,在50~60℃下搅拌1h ,后将反应液加入乙醇试剂中,冷却至30℃下,静置,过滤干燥得出产物,传统方法中反应时间过长。
微波作为一种传输介质和加热能源已被广泛应用于各学科领域。与传统加热相比, 微波加热可使反应速率大大加快, 可以提高几倍、几十倍甚至上千倍[4] , 同时由于微波为强电磁波, 产生的微波等离子体中常可存在热力学方法得不到的高能态原子、分子和离子, 因而可使一些热力学上不可能发生的反应得以发生[5]。
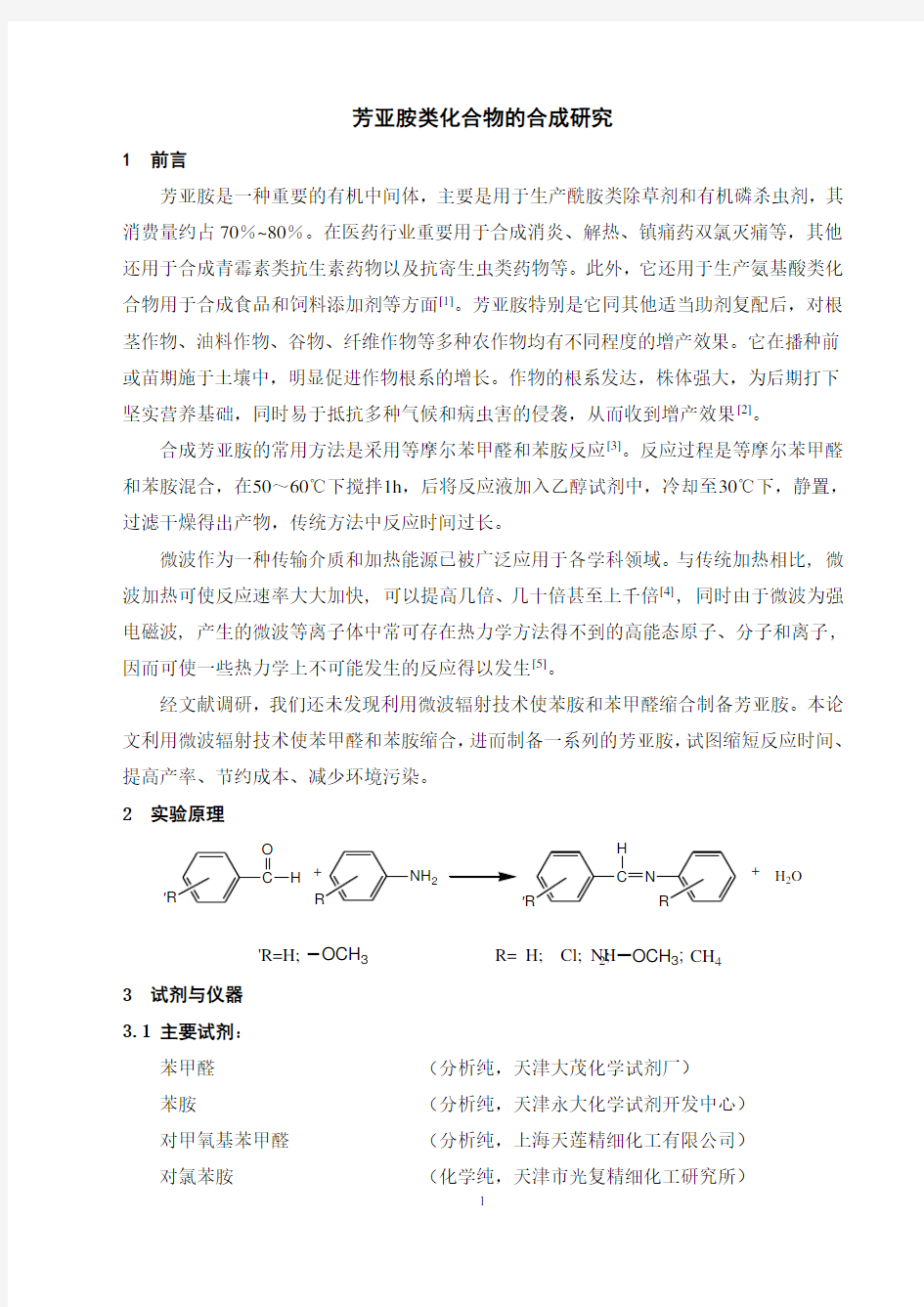
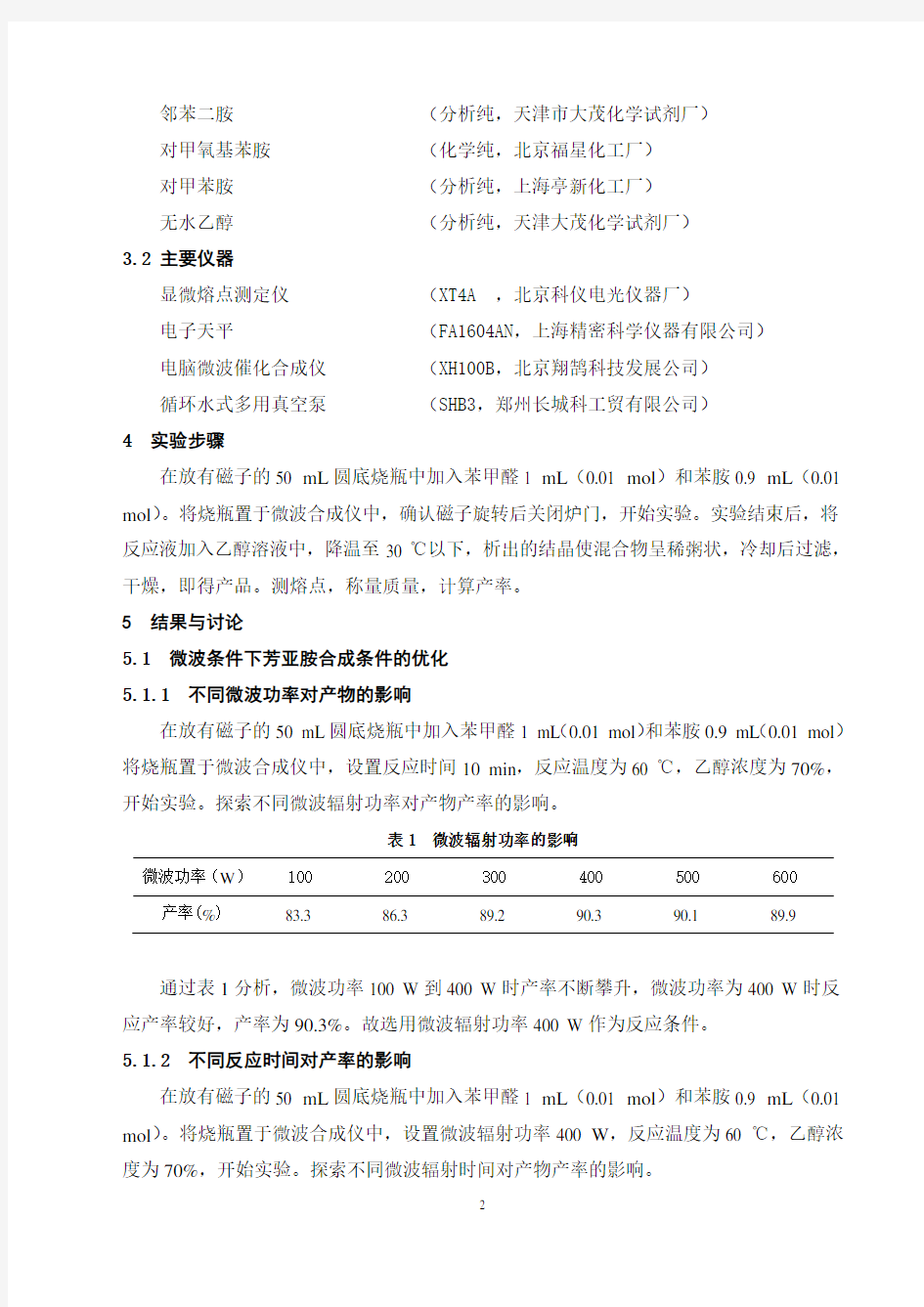
经文献调研,我们还未发现利用微波辐射技术使苯胺和苯甲醛缩合制备芳亚胺。本论文利用微波辐射技术使苯甲醛和苯胺缩合,进而制备一系列的芳亚胺,试图缩短反应时间、提高产率、节约成本、减少环境污染。 2 实验原理
H
O +NH 2
′R
R
H N ′R
R
+H 2
O
'R=H;
OCH 3R= H; Cl; NH 2;OCH 3;CH 4
3 试剂与仪器 3.1 主要试剂:
苯甲醛 (分析纯,天津大茂化学试剂厂) 苯胺 (分析纯,天津永大化学试剂开发中心) 对甲氧基苯甲醛 (分析纯,上海天莲精细化工有限公司) 对氯苯胺 (化学纯,天津市光复精细化工研究所)
邻苯二胺(分析纯,天津市大茂化学试剂厂)
对甲氧基苯胺(化学纯,北京福星化工厂)
对甲苯胺(分析纯,上海亭新化工厂)
无水乙醇(分析纯,天津大茂化学试剂厂)
3.2 主要仪器
显微熔点测定仪(XT4A ,北京科仪电光仪器厂)
电子天平(FA1604AN,上海精密科学仪器有限公司)
电脑微波催化合成仪(XH100B,北京翔鹄科技发展公司)
循环水式多用真空泵(SHB3,郑州长城科工贸有限公司)
4 实验步骤
在放有磁子的50 mL圆底烧瓶中加入苯甲醛1 mL(0.01 mol)和苯胺0.9 mL(0.01 mol)。将烧瓶置于微波合成仪中,确认磁子旋转后关闭炉门,开始实验。实验结束后,将反应液加入乙醇溶液中,降温至30 ℃以下,析出的结晶使混合物呈稀粥状,冷却后过滤,干燥,即得产品。测熔点,称量质量,计算产率。
5 结果与讨论
5.1 微波条件下芳亚胺合成条件的优化
5.1.1 不同微波功率对产物的影响
在放有磁子的50 mL圆底烧瓶中加入苯甲醛1 mL(0.01 mol)和苯胺0.9 mL(0.01 mol)将烧瓶置于微波合成仪中,设置反应时间10 min,反应温度为60 ℃,乙醇浓度为70%,开始实验。探索不同微波辐射功率对产物产率的影响。
表1 微波辐射功率的影响
微波功率(W)100 200 300 400 500 600 产率(%)83.3 86.3 89.2 90.3 90.1 89.9
通过表1分析,微波功率100 W到400 W时产率不断攀升,微波功率为400 W时反应产率较好,产率为90.3%。故选用微波辐射功率400 W作为反应条件。
5.1.2 不同反应时间对产率的影响
在放有磁子的50 mL圆底烧瓶中加入苯甲醛1 mL(0.01 mol)和苯胺0.9 mL(0.01 mol)。将烧瓶置于微波合成仪中,设置微波辐射功率400 W,反应温度为60 ℃,乙醇浓度为70%,开始实验。探索不同微波辐射时间对产物产率的影响。
表2 微波辐射时间的影响
反应时间(min) 5 6 7 8 9 10 产率(%)83.787.390.390.289.890.4
根据表2据分析,当温度超出7 min后实验的产率增长不大,7 min时产率为90.3%,时间在7 min为宜。
5.1.3 不同反应温度对产率的影响
在放有磁子的50 mL圆底烧瓶中加入苯甲醛1 mL(0.01 mol)和苯胺0.9 mL(0.01 mol)。将烧瓶置于微波合成仪中,设置微波辐射功率400 W,微波辐射时间7 min,乙醇浓度为70%,开始实验。探索不同反应温度对产物产率的影响。
表3 不同反应温度的影响
反应温度(℃)30 40 50 60 70 产率(%)71.280.587.390.590.2
通过表3分析,温度达到60 ℃时反应产率达到最高,为90.5%。当反应温度进一步提升,实验产率并没有进一步增加。由实验结果表明,最佳反应温度应为60 ℃。
5.1.4 不同乙醇浓度对实验的影响
在放有磁子的50 mL圆底烧瓶中加入苯甲醛1 mL(0.01 mol)和苯胺0.9 mL(0.01 mol)。将烧瓶置于微波合成仪中,设置微波辐射功率400 W,微波辐射时间7 min,反应温度60 ℃。探索不同乙醇浓度对产物产率的影响。
表4 不同乙醇浓度的影响
乙醇浓度(%)50 60 70 80 90 产率(%)84.387.690.990.891.1
由表4数据分析乙醇浓度达70%,产率达到90.9%,乙醇含量继续增加,产品收率增加幅度很小。所以选定最佳乙醇浓度的为70%。
5.2 设计正交试验
根据前期单因素实验结果,为了优化条件,以产物的产率作为正交试验的目标,设计了A微波功率、B微波时间、C反应温度、D乙醇浓度的四因素三水平的L9(43)正交试验,正交试验因素水平表见表5,正交试验结果及分析见表6。
表5 正交实验数据表及极差分析
正交试验A反应功率B反应时间C反应温度D乙醇浓度产率(%)
a 300 6 50 60 86.2
b 300 7 60 70 89.3
c 300 8 70 80 88.8
d 400 6 60 80 90.1
e 400 7 70 60 89.2
f 400 8 50 70 89.0
g 500 6 70 70 88.7
h 500 7 50 80 87.3
i 500 8 60 60 88.1
K188.100 83.333 87.500 87.833
K289.433 88.600 89.167 89.000
K388.033 88.633 88.900 88.733
R 1.400 0.300 1.667 1.167
由表5极差分析显示反应温度对反应的影响最大,其次是微波功率,然后是乙醇浓度,最后是微波时间,即C>A>D>B。各因素最佳组合为A2、B2、C2、D2,即微波反应功率为400 W,反应温度为60 ℃,反应时间为7 min,乙醇浓度为70%时,可达到最佳、最绿色的反应条件。最佳条件下最3组重复试验,平均产率达90.9%。
6最佳条件下一系列芳亚胺的合成
在放有磁子的圆底烧瓶中分别加入苯甲醛1 mL(0.01 mol)/对甲氧基苯甲醛1.2 mL (0.01 mol)和下表底物于微波合成仪中,在最佳条件下即微波反应功率为400 W,反应温度为60 ℃,反应时间为7 min,开始实验。实验结束后,将反应液加入70%的乙醇溶液中,冷却后过滤,干燥,测量产物熔点。
表6 最佳条件下苯甲醛与以下底物反应合成芳亚胺的实验数据序列号反应底物产率(%) 熔点(℃)
a 苯胺90.9 47~49
b 对氯苯胺92.7 56~59
c 邻苯二胺93.3 91~94
d 对甲氧基苯胺90.0 61~65
e 对甲苯胺92.2 24~27
表7 最佳条件下对甲氧基苯甲醛与以下底物反应合成芳亚胺的实验数据序列号反应底物产率(%) 熔点(℃)
a 对氯苯胺93.5 57~60
b 邻苯二胺94.6 64~67
c 对甲氧基苯胺91.2 135~137
d 对甲苯胺95.4 75~78
由上表可以看出,微波辐射条件下,苯胺和芳香醛的缩合不加催化剂即可得到较高产率的芳亚胺,产率均可达到90%以上。与传统方法相比,该方法不仅时间缩短、反应温度降低,而且产率也较高。
7 芳亚胺的红外谱图与分析
以KBr为压片,在300-4000cm-1范围内对苯甲醛/对甲氧基苯甲醛和芳胺反应的产物进行红外光谱分析。
图1中各官能团吸收峰如下:νC═N(1635.64 cm-1),苯环的特征吸收1457.33cm-1,1400.32 cm-1,918.12 cm-1,761.17 cm-1。
图1 N-亚苄基苯胺的红外谱图
图2中各官能团吸收峰如下:νC═N(1622.13cm-1), 苯环的特征吸收817.82 cm-1,837.11 cm-1,1508.33 cm-1,1570.06 cm-1,1595.13 cm-1。
图2 苯甲醛和对甲苯胺反应产物的红外谱图
图3中各官能团吸收峰如下:νC═N(1625.99cm-1), 苯环的特征吸收688.59 cm-1,756.10 cm-1,881.47cm-1,1485.19 cm-1,1577.77 cm-1。
图3 苯甲醛和对氯苯胺反应产物的红外谱图
图4中各官能团吸收峰如下:νC═N(1624.74cm-1), νC─O (1723.61cm-1) 苯环的特征吸收754.17 cm-1,815.89cm-1,1451.62 cm-1,1507.27 cm-1,1567.19 cm-1。
图4 对甲氧基苯甲醛和对甲苯胺反应产物的红外谱图
图5中各官能团吸收峰如下:νC═N(1602.85cm-1), νC─O (1683.86cm-1),苯环的特征吸收839.03cm-1,1510.26 cm-1,1577.77 cm-1。
图5 对甲氧基苯甲醛和对氯苯胺反应产物的红外谱图
图6中各官能团吸收峰如下:νC═N(1606.70cm-1), νC─O (1622.13cm-1),苯环的特征吸收839.03cm-1,1508.33 cm-1,1575.84 cm-1。
图6 苯甲醛和对甲氧基苯胺反应产物的红外谱图
图7中各官能团吸收峰如下:νC═N(1630.74cm-1), νC─O (1678.52cm-1),苯环的特征吸收742.59cm-1,1458.18cm-1,1510.84 cm-1。
图7 对甲氧基苯甲醛和对甲氧基苯胺反应产物的红外谱图
图8中各官能团吸收峰如下:νC═N(1622.13cm-1), νN─H (3387.00cm-1),苯环的特征吸收742.59cm-1,839.03cm-1,1575.84cm-1。
图8 苯甲醛和邻苯二胺反应产物的红外谱图
图9中各官能团吸收峰如下:νC═N(1608.63cm-1), νN─H (3385.07cm-1),苯环的特征吸收746.45cm-1,837.11cm-1,1448.54cm-1。
图9 对甲氧基苯甲醛和邻苯二胺反应产物的红外谱图
8 结论
在没有催化剂的条件下,芳胺和芳香醛经微波辐射反应得到芳亚胺,最佳实验条件如下:微波反应功率为400 W,反应温度为60 ℃,反应时间为7 min,乙醇浓度为70%。
芳亚胺的产率为90.9~95.4%。此方法产率比较高,操作简便、反应时间短、对环境友好,为合成此类化合物提供了一种洁净而有效的方法。
参考文献
[1] 王树清,高崇.中间体N—亚苄基苯胺的合成研究{J},精细石油化工进展,2006,3,45-47。
[2] 李吉海.植物生长调节剂N-亚苄基苯胺{J},农药,1987,5,34-36。
[3] Gedye R., Smith F., Westaway K., A L H., et al. The uses of mic row ave ovens for rapid
organic synthesis[J],Tetrahedron Lett.,1986, 27 (3), 279-282.
[4] 金钦汉,戴树珊,黄卡玛.微波化学[M].北京:科学出版社,1999,4,27-30。
[5] 邹君华,易林.环戊酮、苯甲醛和芳香胺参加的Mannieh反应{J},重庆师范学院学报,1991,8(2),6-10。
致谢
本论文是在边延江老师悉心指导和关怀下完成的,从论文的选题、实验过程、论文的撰写、修改到校对,无不凝聚着边老师的滴滴心血,在论文期间,无论是实验过程中,还是在日常生活方面,边老师都给予我无微不至的关怀和照顾。边老师忘我的工作热情,开放的思想,严谨的治学态度,以及可贵的做人品质,都令我十分佩服,其一言一行对我都有深远的影响,使我终生受益。在此我首先向给予我悉心培养,不倦教诲和严格要求的边老师表示深深谢意!
在作论文期间,同时还得到了化学系领导、化学系办公室、资料室以及彭晓霞老师、孔洁老师的热情关怀和大力支持,同时还感谢我们小组的同学的热情帮助,特向以上老师和同学表示真诚的感谢!
多芳基脒类化合物的合成
多芳基脒类化合物骨架的合成 郭小玲,王继涛,孟凡超,蒋继军 (西北农林科技大学植物保护学院,陕西杨凌712100 ) [摘要]【目的】合成多芳基脒类化合物无骨架;【方法】三头脒骨架:由均苯三酚在氮气保护下以及碳酸钾存在的条件下与对氰基苄溴进行偶联得到;四头脒骨架:由季戊四醇四对甲苯磺酸酯与对氰基苯酚偶联得到;【结果】合成了以苯环为核的三头芳基脒骨架以及以季戊四基为核的四头芳基脒骨架,并且利用重结晶方法纯化了产物,数据表明,所采用的合成方法产率高、纯度好,为下一步的成脒反应以及活性测定奠定了基础。 [关键词] 季戊四醇四对甲苯磺酸酯,1,3,5-三(4-氰基苯甲氧基)苯,季戊四醇四对氰基苯基醚,合成 近年来,人们在活性寡糖的研究中发现,将母体活性寡糖小分子(α-Gal monomer)制成寡聚物(α-Gal polymers)后,其活性有时可大大增加[10,11],但活性提高程度会有所不同。聚合结构中母体寡糖小分子数目的比例越高,其活性提高程度越大。生命科学基础研究结果表明:蛋白质(受体)与配体(ligand,内源性活性物质或者外源性小分子药物)[12]由于几何互补性而靠近,并主要在几何互补作用下,蛋白质构象受到诱导,以匹配性更好的亚稳态构象进行初步结合。继而在调整结合期,氢键、疏水作用等短程精细作用开始表现并最终使二者微扰调整到合适的构象结合,这就是所谓的“诱导契合”[13]。根据多效价效应原理,多效价能够引起一些蛋白受体的聚合,受体聚合后与配体也将产生诱导契合的效果,从而使它们之间结合力增强,表现出多效价效应。多效价配体可和受体上的主要结合点作用,也可和结合亚点作用结合靶标酶的结构信息,利用多效价效应来发现高效、安全的新型农药分子,可看作是一种基于结构的合理设计。 在生物体系中,多位点结合比单位点结合更具优势。首先,多位点结合更牢固,高亲和性的多效价化合物作为一些防治对象靶标部位的抑制剂具有很大的潜在价值。其次,多效价作用能提高受体的选择性。 农药活性的提高很大程度上取决于其对靶标结合程度的增强。有的防治对象可能存在多个作用位点,如一些杀虫剂既有第一作用位点乙酰胆碱酯酶,也有第二作用位点腺苷酸三磷酸酶(A TPase)。在设计聚合物时也可充分考虑这些靶标的特点,从而进行合理的设计,开发出能与多靶标结合的化合物,以提高目标化合物的生物活性[14]。近几年,日本Kagabu Shinzo等报道了以不同链长的亚甲基、烯基、炔基等连接体合成对称的烟碱类化合物的二聚体,并表现出一定的生物活性[15]。 Pang等针对乙酰胆碱酯酶的结构设计了一系列不同链长的二效价他克林聚合物,旨在目标化合物能同时结合乙酰胆碱酯酶的催化位点和外周位点。结果发现当聚合物的链长为7个亚甲基时活性最好,是其母体的1475倍。 芳基二脒类化合物能够实现与DNA小沟的紧密结合而芳基单脒化合物则不能,这也可以利用多效价效应来解释。这容易使我们想到,更多头的芳基脒类是不是同样具有多效价作用而有可能具有更高的生物活性?于是本文在此假设的基础上,决定设计并合成以不同化学结构为核的具有多个芳基脒头的化合物,并研究其生物活性,目标化合物的合成路线见图1。
1_2_4-三唑的制备
化工与生物技术学院 综合与设计性化学实验实验类型:设计 实验题目:1,2,4-三唑的制备 班级:轻化1101班学号:11140131 姓名:徐得欢实验日期:
1,2,4,-三唑的制备 目的与要求 了解无取代三唑环的合成和应用 了解无取代三唑环的合成和应用; 了解文献资料的收集和整理; 学会对实验数据的处理和分析。 一,前言 1.2.4一三唑类化合物具有广泛的生物活性,如抗菌lll、消炎l 2l、抗癌_3j等。Catheyl4j指出,含有C—C—N—N骨架的有机分子对植物有促进生长的作用。Pathok等指出1.2.4一三唑硫醚类的抗菌性比硫醇类高[5I。考虑到羟基等基团能增加分子水溶性及负电性、有可能提高药物活性。 二、实验原理 1,2,4-三唑环中有两个相邻的氮原子,在合成上可以由NH2NH2来提供,通过和其他带有活性基团的化合物如甲酰胺缩合而成。甲酰胺法是目前工业上生产1,2,4-三唑常有的方法。另一类方法是通过1mol的甲酰胺和1mol甲酰胺环和而成。但用这种方法,甲酰肼尚有需要由甲酸甲酯肼来制备,路线较长,成本较前类方法为高。用肼的衍生物(如酰肼)代替肼,可用类似的方法合成取代的三唑化合物,。3HCONH2 + NH2NH2 .H2O + 2H2O + HCOOH + 2NH3 N N HN 180℃(甲酰胺沸点:210℃水合肼的沸点118.5℃)。 三、仪器和试剂 1.仪器 带机械搅拌回流装置(尾气吸收),蒸馏装置等。 2.试剂 水合肼(C.P.80%或工业品),甲酰胺(C.P.99.5%或工业品),无水乙醇。 四、实验步骤 1、1,2,4_三唑制备 将86g(1.9mol)甲酰胺和5.22g(0.1mol)甲酸加入四颈瓶,加热至180℃,保持温度170-185℃边搅拌边滴入63g(1.0mol)85%的水合肼(当温度低于170℃
5位氟代的嘧啶化合物的合成
5位氟代的嘧啶化合物的合成 【摘要】具有特定结构和实用价值的5-氟嘧啶类化合物作为一种重要的医药中间体越来越受到人们的关注。本论文主要研究的课题是采用工业原料氟乙酸甲酯,以丙酰氯与其发生亲核取代反应制得丙酰氟乙酸甲酯,再与甲脒乙酸盐缩合,采用适当比例的混合溶剂提取得一系列的5位氟代的嘧啶化合物。用红外光谱仪,熔点测定仪等对所取得的物质进行结构鉴定。 【关键词】氟嘧啶;酰化反应;环合 引言 近年来,5氟嘧啶类化合物作为一种重要的医药中间体越来越受到人们的关注,以它们为基础的5-氟尿嘧啶、伏立康唑等化合物的合成研究也取得了很大的进展。5氟嘧啶环的合成、氟嘧啶C2、C4和C6位的烷基化及其卤代一直是合成上的难点和热点。鉴于嘧啶环的药用活性及氟原子的特殊性质,在嘧啶环上引入氟原子已成为合成新药物的重要考虑因素。本文主要进行的是5位氟代的嘧啶类化合物及其衍生物的合成方法和工艺研究,综合考察各相关反应的产率、反应操作的难易程度和中间体的纯度、性状等各方面因素。 1氟嘧啶类化合物的合成方法 目前5氟嘧啶类化合物的合成方法主要有三类:一类是从氟乙酸乙酯出发,经过一系列反应得到最终产物;另一类是直接对现有的氟嘧啶类化合物进行烷基化、a-卤代烷基化以及基团的取代反应;还有一类就是从2,3,3,3-四氟丙酸甲酯出发,经过一系列反应最终得到产物。具体的合成方法举例如下: 1.1从氟乙酸乙酯出发6-(1-溴乙基)-4-氯-5-氟嘧啶的合成[1][2]。本方法采用工业原料氟乙酸乙酯,以丙酰氯与其发生亲核取代反应制得α-氟丙酰乙酸乙酯(2),再与甲脒乙酸盐缩合,采用适当比例的混合溶剂提取得(3),再用POCl3使化合物(3)的羟基氯化、NBS溴代得目标化合物(1)。合成路线如图1所示: 该合成路线工艺简单、反应成本低、反应条件温和,适合工业化生产,并保持了较高的产率,总收率为41.7%[1]。原料氟乙酸乙酯价廉易得,除第一步反应收率较低以外,其余各步收率较为良好。其合成条件对设备要求不高,只要用脲和胍来替换第二步反应中的脒,就可以分别得到不同的反应中间体及产物。 1.2从氟嘧啶类化合物出发2,4-二氯-6-乙基-5-氟嘧啶的合成[3]。本合成方法以2,4-二氯-5-氟嘧啶为原料,经格氏反应,氧化而得。合成路线如图2所示。本实验的格氏试剂的制备中常用碘或碘钾盐作催化剂,然后采用1,2-二溴乙烷作为反应引发剂。导致本反应对溶剂要求高,使用前需经过严格的纯化,去除其中的过氧化物,水,醇,酸等杂质。有副反应产生,产物纯化较为困难。且反应中的原料2,4-二氯-5-氟嘧啶本就是5位氟代的嘧啶类化合物之一,原料难得昂
恶唑类化合物的合成方法综述
2005届本科毕业(学位)论文河西学院化学系 第一章:噁唑类化合物的合成方法综述 1.引言:根据杂原子在环数目很多。的五元环体系叫唑含有两个杂原子且其中 一个杂原子为N,的化合物是噁唑类化合O3-唑。五元环中杂原子为N、中位置不同,有可分为1,2-唑和1,4)等。(物,其种类较多,有噁唑(1)、噁唑啉(2)、噁唑烷(3)、噁唑酮、苯并噁唑111OOOONNNNH4312ONnNO5 [1]。噁唑类化合物是一类重要的杂环化合物,一些具有噁唑环的化合物具有生物活性[2]。同时它们在中间体、药物合成中也具氨基噁唑具有杀真菌、抗菌、抗病毒作用例如2-[345][6],,。5)是耐高温的高聚物有广泛的用途。分子结构中含有噁唑环的聚苯并噁唑(噁唑(1)是1,3位含有O、N原子的五元环,为有像吡啶一样气味且易溶于水的液体,是非常稳定的化合物,它在热的强酸中很稳定,不发生自身氧化反应,不参与任何的正常的生物化学过程。其二氢和四氢杂环化合物叫做噁唑啉或4,5-二氢唑啉(2)和噁唑烷或四氢噁唑啉(3)。 [1]年确定的,但一向没有人作过大量深入的在1887虽然噁唑环这个名称还是Hantzsch研究,因为这个环系不常见于天然产物中,而且制备也相当困难。直到青霉素的出现,才推动了噁唑的研究。青霉素本身虽没有噁唑环,但它最初是疑为是属于这个环系的。青霉素实际含有一个噻唑环,而噁唑是噻唑的氧的类似物。因为青霉素是一个很重要的药品,研究的范围也由噻唑推广到了噁唑。下面我们就将噁唑类化合物的合成方法进行综述。 2.合成方法 噁唑类化合物可由提供N,O原子的化合物来合成。 页37共页1第 2005届本科毕业(学位)论文河西学院化学系 法合成噁唑环2.1.Cornforth[7] 1947年由。其过程如下:Cornforth等人首次合成第一个含有噁唑环的化合物NHCCHEtO222)HN=CHOCH(CHCHOH + HClHCN + (CH) 23223ClNCCEtO 2HC(OEt)3AcOH)EtOCCH-N=CHOCH(CH2232)CHOCH(CHHCKOEt23加热KO HOOCCEtO2NNN水解喹啉加热CuO, OO O[7]羧酸乙酯的路线如下据此设计合成噁唑-4-。 EtCO 2ClNH2NHEtOCCH N222PrOi Et EtOKHCO2OiPr H57%EtCOEtCO22NN AcOH OiPr OKO34%82% 2.2. 碱催化酰氨基磺酰烯关环合成法[8]-1-苯磺酰烯在碱催化下关环可得到噁 唑化合物。用3-酰氨基-2-碘HNPhSOMeNNH2Na IPhSONaOH22PhOSHCMeMe 22aq ,EtAc hv 80℃℃THF 0HOOOI94%38%
【CN109912606A】一种嘧啶并吲唑类化合物的合成方法【专利】
(19)中华人民共和国国家知识产权局 (12)发明专利申请 (10)申请公布号 (43)申请公布日 (21)申请号 201910303026.6 (22)申请日 2019.04.16 (71)申请人 新乡医学院 地址 453003 河南省新乡市红旗区金穗大 道601号新乡医学院 (72)发明人 高庆贺 邱培勇 刘兆敏 杨利敏 吴曼曼 (74)专利代理机构 新乡市平原智汇知识产权代 理事务所(普通合伙) 41139 代理人 路宽 (51)Int.Cl. C07D 487/04(2006.01) (54)发明名称一种嘧啶并吲唑类化合物的合成方法(57)摘要本发明公开了一种嘧啶并吲唑类化合物的合成方法,属于有机合成技术领域。本发明的技术方案要点为:一种嘧啶并吲唑类化合物的合成方法,具体步骤为:将芳香醛类化合物、3-氨基吲唑类生物和三乙胺溶于溶剂中,再加入NH 4I和氧化剂,然后于110-150℃反应制得目标产物嘧啶并吲唑类化合物。本发明合成过程简单高效,通过无过渡金属催化的一锅串联反应一步直接制得嘧啶并吲唑类化合物,避免了由于多步反应中多种试剂的使用以及对各步反应中间体的纯化处理等引起的资源浪费和环境污染,合成过程操作方便,原料简单,反应条件温和,底物适用范围广,同时以三乙胺为原料极大地降低了生产成 本。权利要求书2页 说明书18页CN 109912606 A 2019.06.21 C N 109912606 A
1.一种嘧啶并吲唑类化合物的合成方法,其特征在于具体步骤为:将芳香醛类化合物1、3-氨基吲唑类化合物2和三乙胺溶于溶剂中,再加入NH 4I和氧化剂,然后于110-150℃反应制得目标产物嘧啶并吲唑类化合物3, 该合成方法中的反应方程式为: 其中R 1为苯基、取代苯基、2-萘基、1-萘基、吡啶基或噻吩基,该取代苯基为3,4,5-三甲氧基苯基、3,4-二甲基苯基、2,4-二氯基苯基或一元取代苯基,一元取代苯基苯环上的取代基为甲基、叔丁基、甲氧基、氟、氯、溴、三氟甲基或硝基,R 2为氢、甲氧基、氟、氯、溴、碘或硝基,溶剂为氯苯、甲苯、1,4-二氧六环、乙腈、N -甲基-2-吡咯烷酮或N ,N -二甲基甲酰胺,氧化剂为二叔丁基过氧化物、过氧化二异丙苯、过氧化苯甲酰、过氧化苯甲酸叔丁酯、二甲亚砜、氧气或空气。 2.根据权利要求1所述的嘧啶并吲唑类化合物的合成方法,其特征在于:所述芳香醛类化合物1、3-氨基吲唑类化合物2、三乙胺、NH 4I与氧化剂的投料摩尔比为1:1:2.5:1.5:3,芳香醛类化合物1与溶剂的投料配比为1mmol:4mL。 3.根据权利要求1所述的嘧啶并吲唑类化合物的合成方法,其特征在于:所述氧化剂为二叔丁基过氧化物、过氧化二异丙苯、过氧化苯甲酰、过氧化苯甲酸叔丁酯、二甲亚砜或氧气时,合成过程在密封条件下进行;所述氧化剂为空气时,合成过程在密封或敞开条件下进行。 4.一种嘧啶并吲唑类化合物的合成方法,其特征在于具体步骤为:将苯甲醛1a、3-氨基吡唑并吡啶类化合物4和三乙胺溶于溶剂氯苯中,再加入NH 4I,然后于120℃反应制得目标产物吡啶并吡唑并嘧啶类化合物5, 该合成方法中的反应方程式为: 其中R 3为氢或甲基。 5.根据权利要求4所述的嘧啶并吲唑类化合物的合成方法,其特征在于:所述苯甲醛1a、3-氨基吡唑并吡啶类化合物4、三乙胺与NH 4I的投料摩尔比为1:1:2.5:1.5,苯甲醛1a与溶剂氯苯的投料配比为1mmol:4mL。 6.根据权利要求1或4所述的嘧啶并吲唑类化合物的合成方法,其特征在于:所述嘧啶并吲唑类化合物为下列化合物之一: 权 利 要 求 书1/2页2CN 109912606 A
酰肼类发泡剂的简介--产品知识
深圳市长园特发科技有限公司 酰肼类发泡剂的简介 在有机发泡剂中,酰肼类结构品种占有重要地位,其中以芳香族磺酰肼格外突出。纯的磺酰肼类发泡剂一般为无毒无味的结晶固体,其分解温度范围和发气量低于发泡剂H和发泡剂AC。其分解机理是磺酰肼基内部发生氧化还原反应,二者相互补偿,发泡过程中发热量适中。磺酰肼类发泡剂能定量释放N2和水蒸气,其残渣多为无毒、无色的烷基或芳基二硫代物和硫代亚砜。尽管如此,磺酰肼类发泡剂在一般的储存条件下还是比较稳定的。 就化学结构而言,磺酰肼类发泡剂包括对称性和非对称型两种类型。对称型品种主要有OBSH、3,3-二磺酰肼二苯砜等,以OBSH为代表。非对称型品种包括苯磺酰肼(BSH)、对甲苯磺酰肼(TSH)、2,4-甲苯二磺酰肼、对(N-甲氧基甲酰氨基)苯磺酰肼等,以TSH为典型代表。 OBSH是磺酰肼类发泡剂中产耗量最大的品种,为适应性极广的发泡剂,有“万能发泡剂”之称。在橡胶工业中,OBSH外观为白色微晶粉末,分解温度约160℃,发气量为发泡剂H和发泡剂AC的一半左右,分解气体为N2和水蒸气。OBSH通常很少使用发泡助剂活化,但尿素及其衍生物、胺、有机酸、硬脂酸酯、PVC热稳定剂具有不同程度的活化效能。按照Donald G的活化分类体系,脲和三乙醇胺是OBSH的最强级活化剂;二苯胍属于强活化剂,在橡胶发泡体系中兼有硫化促进和发泡活化双重功效。 OBSH的发泡特征是气孔结构细微均匀,无着色性,几乎可以在所有的塑料和橡胶发泡制品中使用。OBSH价格较高,一定程度上限制了其应用范围。目前OBSH主要用于EPDM 挡风条,氯丁橡胶泡沫制品,PE、PS、PVC的注射和挤出成型加工,还用于PVC壁纸及其他发泡剂性能无法满足的场合。特别指出的是OBSH的分解残渣不影响制品的电气绝缘性,在电线电缆材料中具有显著的优势。OBSH的显著缺陷是分散性较差和吸湿。烷醇胺类抗静电剂对OBSH有促进水解反应的作用,随之生成大量氨气释放,应用中必须慎重。考虑到过氧化物可能引起OBSH急剧分解的问题,OBSH不宜用于以有机过氧化物作交联剂的交联发泡体系。 TSH发泡剂分解速度缓慢,与橡胶硫化条件趋势一致,主要作为橡胶发泡剂使用。近来研究发现TSH属变异性物质,日本劳动省已将其列入限制范围,因消耗量日渐减少。此外,有机发泡剂的重要品种还包括三唑类化合物、叠氮化合物等 深圳市长园特发科技有限公司 技术部:范宇 日期:2012年8月28号
三唑类化合物的研究进展
三唑类化合物的研究进展 摘要:在现有的众多杂环化合物中,三唑类衍生物对过渡金属离子具有良好的配位性能,因而具有很高的生物活性。三唑类衍生物由于其广谱的生物活性及广阔的应用前景一直颇受人们青睐。本文综述了三唑类化合物在农业、医药、材料等领域的应用,展望了三唑类化合物的发展方向。 关键词:三唑化合物农业医药材料 前言:含氮杂环化合物有着独特的生物活性,毒性低,内吸性高,常被用作医药和农药的结构组成单元,在医药和农药合成方面起着重要的作用。其中三唑类化合物作为含氮杂环的重要组成部分,因其独特的结构特征而得到广泛的应用。本文综述了三唑类化合物在农业、医药、材料三方面的应用,对新型三唑化合物的研制和发展具有一定的现实意义。 在农药方面的应用 在农用化学品中,三唑类化合物己经被开发成为一类引人注目的超高效农药,其中已有几十个商业化的品种。目前对该类化合物的研究和开发仍很活跃,其研究的内容和主要目标是通过保留三唑环的分子结构而对其他部分进行适当的改造和修饰,以求达到进一步扩大杀菌谱和应用范围,进一步提高其生物活性和减少用药量。
1.杀菌活性 危害动植物而使动植物致病的有害生物主要是真菌、细菌和病毒。对植物而言,植物的主要病害是真菌病害。近30年来,三唑类杀菌剂以其高效、低毒、广谱而备受青睐。 三唑类化合物的高效杀菌活性引起国际农药界的高度重视,各大公司先后开发出一系列商品化的杀菌剂,如羟菌唑主要用于谷类作物防治矮形诱病、叶诱病、以及壳针孢、镰刀菌等病害;丙环唑主要对担子纲和子囊纲和半知纲中许多真菌有活;粉唑醇主要对担子菌纲和子囊菌纲的真菌有活性,如白粉病、诱病,对谷物白粉病有特效;酰胺唑具有保护、治疗作用,防治担子菌纲、子囊菌纲、半知菌纲引起的谷、水果、蔬菜和观赏植物的真菌病害;糠菌唑能防治谷类作物、葡萄、水稻、果树和蔬菜上的由担子菌纲、子囊菌纲、半知菌类病原菌引起的病害。 近几年来新研制的三唑类杀菌剂的结构出现以下几个特点:以多取代的三唑为母核,并对其它结构进行修饰,如以多个卤原子取代甲基上的氢原子;分子中含两个或两个以上手性碳原子;形成稠杂环等多个方法来达到提高活性或专一性的目的。 三唑苄胺类化合物具有高效、广谱抗真菌活性, 构效关系研究表明, 三唑类化合物的 R1为 2, 4-二氯或 2, 4-二氟取代基时抗真菌活性较好。冯志祥、张万年、周有骏[1]等人改进了 1-[2-(N -甲基)氨基-2-(2, 4-二氯苯基) 乙基] -1H-1, 2, 4-三唑的合成方法, 降
吡啶并嘧啶类化合物的合成研究进展_任青云
2005年第25卷有机化学V ol. 25, 2005第12期, 1530~1541 Chinese Journal of Organic Chemistry No. 12, 1530~1541 * E-mail: he1208@https://www.360docs.net/doc/142504115.html, Received November 16, 2004; revised March 3, 2005; accepted April 20, 2005. 吡啶并[2,3-d]嘧啶类化合物的合成 吡啶并[2,3-d]嘧啶及其氧代衍生物具有潜在的生物 学和药理学活性, 该类化合物是人们合成和研究得最多
No. 12 任青云等:吡啶并嘧啶类化合物的合成研究进展 1531 的一类吡啶并嘧啶类衍生物. 综合近二十年来各类文献, 其合成方法主要分为两大类: (1)从吡啶环出发关环; (2)从嘧啶环出发关环. 本文即依此作为此类化合物合成的主要分类依据. 1.1 从吡啶环出发. 1.1.1 含α,ω-二腈的吡啶环在卤化氢作用下关环 在有机合成反应中α,ω-二腈在卤化氢作用下环化反应历来是制备杂环化合物的一条有效途径[20](Eq. 1). 1995年, Victory 等[21]利用该反应成功合成了一系列吡啶并[2,3-d ]嘧啶化合物, 并发现随卤化氢酸性不同而生成不同的化合物. 如Scheme 1, 当HX 为氯化氢时生成化合物1, 当HX 为溴化氢或碘化氢时则同时生成两种异构体1和2. 后来, 发现不同溶剂对反应的选择性也有很大影响, 如采用甲苯作溶剂, 加热或室温条件下分别与氯化氢或溴化氢反应, 结果都只得到一种关环产物1, 且收率也有明显的提高, 当HX 为溴化氢时1的收率大于 75%. Scheme 1 1.1.2 由氨基烟碱腈在酸或碱作用下关环 1988年, Hosmane 等 [22] 报道由2-氨基烟碱腈与原甲 酸三甲酯在催化剂三氟乙酸作用下生成N -(3-氰基吡啶基-2)-甲脒(3), 再与稍过量的甲基肼反应, 关环生成4-β-甲基肼基吡啶并[2,3-d ]嘧啶(4), 收率为46%. 后来发现在适当的条件下, 氨和肼一样能使甲脒关环(Eq. 2). 采用原甲酸三甲酯生成脒中间体再与各种亲核小分子关环, 这是制备杂环化合物的一条重要途径, 该方法经过改进后在合成步骤与收率等方面均有很大的提高, 在 烟碱腈亦可与盐酸胍在丁醇钠催化下发生Michael 加成关环, 生成吡啶并[2,3-d ]嘧啶化合物5, 收率为61%[23] (Eq. 3). 1997年, Quintela 等[24]合成了具有抗组胺活性的吡啶并[2,3-d ]嘧啶类化合物8, 采用氨基吡啶6与富电碳原子合成子N ,N -二甲基二氯亚甲基亚胺氯(7)反应, 经分子内关环得到目标产物, 收率为80%~90% (Scheme 2). 该方法的特点是反应活性高、收率好, 反应中提到的富电合成子亦可以应用到其他相关合成反应当中 . Scheme 2 2001年, Kumar 等[25]采用硫脲与氨基烟碱腈加热反应, 得到4-氨基-5,7-二取代吡啶并[2,3-d ]嘧啶-2-(1H )-硫酮(9) (Eq. 4), 该系列化合物均具有一定的杀菌活性 .
恶唑类化合物的合成方法综述
恶唑类化合物的合成方法 综述 Prepared on 22 November 2020
第一章:恶唑类化合物的合成方法综述 1.引言: 含有两个杂原子且其中一个杂原子为N的五元环体系叫唑,数目很多。根据杂原子在环中位置不同,有可分为1,2-唑和1,3-唑。五元环中杂原子为N、O的化合物是恶唑类化合物,其种类较多,有恶唑(1)、恶唑啉(2)、恶唑烷(3)、恶唑酮、苯并恶唑(4)等。 恶唑类化合物是一类重要的杂环化合物,一些具有恶唑环的化合物具有生物活性[1]。例如2-氨基恶唑具有杀真菌、抗菌、抗病毒作用[2]。同时它们在中间体、药物合成中也具有广泛的用途[3,4,5]。分子结构中含有恶唑环的聚苯并恶唑(5)是耐高温的高聚物[6]。 恶唑(1)是1,3位含有O、N原子的五元环,为有像吡啶一样气味且易溶于水的液体,是非常稳定的化合物,它在热的强酸中很稳定,不发生自身氧化反应,不参与任何的正常的生物化学过程。其二氢和四氢杂环化合物叫做恶唑啉或4,5-二氢唑啉(2)和恶唑烷或四氢恶唑啉(3)。 虽然恶唑环这个名称还是Hantzsch在1887[1]年确定的,但一向没有人作过大量深入的研究,因为这个环系不常见于天然产物中,而且制备也相当困难。直到青霉素的出现,才推动了恶唑的研究。青霉素本身虽没有恶唑环,但它最初是疑为是属于这个环系的。青霉素实际含有一个噻唑环,而恶唑是噻唑的氧的类似物。因为青霉素是一个很重要的药品,研究的范围也由噻唑推广到了恶唑。下面我们就将恶唑类化合物的合成方法进行综述。 2.合成方法 恶唑类化合物可由提供N,O原子的化合物来合成。 法合成恶唑环 1947年由Cornforth等人首次合成第一个含有恶唑环的化合物[7]。其过程如下:
双酰肼类昆虫生长调节剂的研究进展
双酰肼类昆虫生长调节剂的研究进展 徐志红李俊凯* (长江大学湿地生态与农业利用教育部工程研究中心荆州434205) 摘要: 昆虫生长调节剂以其高选择性,低毒,不易产生抗性,环境友好和生态安全被称认为是一类理想的农药,一直备受关注。本文综述了双酰肼类昆虫生长调节剂的作用机理和高活性化合物合成的最新研究成果,旨在为开展基于双酰肼类新型昆虫生长调节化合物的设计和合成提供参考。 关键词:昆虫生长调节剂双酰肼类作用机理合成 Progress in the diacylhydrazines insect grouth regulative compounds Xu, Zhihong Li, Junkai* 昆虫生长调节剂,包括蜕皮激素、保幼激素、几丁质合成抑制剂等,双酰肼类作为十分重要的商品化的品种,以其高选择性,微毒甚至无毒,不易产生抗药性,环境友好和生态安全成为第三代农药,普遍认为是一类理想的杀虫剂。本文从作用机理和化学物合成研究进展两方面对双酰肼类昆虫生长调节剂进行综述。 1双酰肼类昆虫生长调节剂作用机理的研究进展 蜕皮激素是昆虫前胸腺分泌的一种内激素,主要为类固醇类物质,如20-羟基蜕皮酮(20E)。但是,天然的蜕皮激素结构复杂,分离困难,很难大规模应用。抑食肼以及美国罗姆-哈斯公司随后开发的虫酰肼、甲氧虫酰肼等几种双酰肼类杀虫剂在结构上完全不同于天然蜕皮激素,却能模拟20E与蜕皮激素受体复合物相互作用,实现蜕皮激素的功能。药剂与受体复合物结合后,与蜕皮激素作用类似,激活基因表达,启动蜕皮行为。然而,昆虫正常蜕皮的完成是由蜕皮激素、保幼激素、羽化激素等激素协调作用的结果[1],由于双酰肼类化合物只是模拟蜕皮激素作用,使“早熟的”蜕皮开始后却不能完成而导致昆虫死亡。这种蜕皮的中止可能是由于血淋巴和表皮中的双酰肼类化合物抑制了羽化激素释放所致[2];也可能是由于大量保幼激素的存在造成的,因为只有在保幼激素浓度降低,蜕皮激素大量存在情况下才能完成变态蜕皮[3]。Wing等[4]发现抑食肼(RH-5849)能在烟草天蛾幼虫的任何阶段使蜕皮提前启动,这种提前启动蜕皮的现象不需內源的20E存在。 昆虫取食中毒剂量的双酰肼化合物RH-5849或虫酰肼(RH-5992)后,4-6 h内停止进食,并开始蜕皮,24 h后,中毒昆虫的头壳早熟开裂,准备蜕皮而又不能继续[5,6],造成中毒昆虫头壳下形成的新表皮骨化、鞣化不完全,中毒昆虫排出后肠,血淋巴和蜕皮液流失,导致脱水,最终死亡。RH-5849能抑制鞘翅目、鳞翅目及双翅目的雌性昆虫卵巢管的发育,对雌性成虫有化学不育活性;RH-5849可导致美洲脊胸长蝽绝育[7]。 如同20E一样,双酰肼类似物与受体复合物EcR-USP二聚体结合。组合配体20E-EcR-USP结合到蜕皮应答
恶唑类化合物的合成方法综述
第一章:噁唑类化合物的合成方法综述 1.引言: 含有两个杂原子且其中一个杂原子为N 的五元环体系叫唑,数目很多。根据杂原子在环中位置不同,有可分为1,2-唑和1,3-唑。五元环中杂原子为N 、O 的化合物是噁唑类化合物,其种类较多,有噁唑(1)、噁唑啉(2)、噁唑烷(3)、噁唑酮、苯并噁唑(4)等。 N O N O NH O 1 111 2 34 N O N O N O n 5 噁唑类化合物是一类重要的杂环化合物,一些具有噁唑环的化合物具有生物活性[1]。例如2-氨基噁唑具有杀真菌、抗菌、抗病毒作用[2]。同时它们在中间体、药物合成中也具有广泛的用途[3,4,5]。分子结构中含有噁唑环的聚苯并噁唑(5)是耐高温的高聚物[6]。 噁唑(1)是1,3位含有O 、N 原子的五元环,为有像吡啶一样气味且易溶于水的液体,是非常稳定的化合物,它在热的强酸中很稳定,不发生自身氧化反应,不参与任何的正常的生物化学过程。其二氢和四氢杂环化合物叫做噁唑啉或4,5-二氢唑啉(2)和噁唑烷或四氢噁唑啉(3)。 虽然噁唑环这个名称还是Hantzsch 在1887[1]年确定的,但一向没有人作过大量深入的研究,因为这个环系不常见于天然产物中,而且制备也相当困难。直到青霉素的出现,才推动了噁唑的研究。青霉素本身虽没有噁唑环,但它最初是疑为是属于这个环系的。青霉素实际含有一个噻唑环,而噁唑是噻唑的氧的类似物。因为青霉素是一个很重要的药品,研究的范围也由噻唑推广到了噁唑。下面我们就将噁唑类化合物的合成方法进行综述。 2.合成方法 噁唑类化合物可由提供N ,O 原子的化合物来合成。
2.1.Cornforth 法合成噁唑环 1947年由Cornforth 等人首次合成第一个含有噁唑环的化合物[7]。其过程如下: HCN + (CH 3)2CHOH + HCl H 2N=CHOCH(CH 3)2 222 EtO 2CCH 2-N=CHOCH(CH 3)2 3KOEt AcOH 水解 Cl C N HC CHOCH(CH 3)2K EtO 2C N O EtO 2C N O HOOC N O 据此设计合成噁唑-4-羧酸乙酯的路线如下[7]。 H 2 Oi Pr OiPr N CO 2Et N CO 2Et OiPr N O CO 2Et 222 AcOH 57% 82% 34% HCO 2Et EtOK 2.2. 碱催化酰氨基磺酰烯关环合成法 用3-酰氨基-2-碘-1-苯磺酰烯在碱催化下关环可得到噁唑化合物[8]。 H N O Me O NH I Me PhSO 2 H NaOH N O PhO 2SH 2C Me aq ,EtAc hv 80℃ THF 0℃ 38% 94%PhSO 2Na I 2 2.3.由西佛碱氧化法合成 在温和的反应条件下,用二醋酸碘苯作氧化剂可以以良好产率将西佛碱氧化生成2-芳基-5-甲氧基噁唑化合物[9]。 2methanol , 1h O CH 3 O N Ar N O Ar OCH 3
Pinner脒合成的反应机理及应用进展
Pinner脒合成的反应机理及应用进展 王阳阳 (西北农林科技大学理学院陕西杨凌712100) 摘要:脒类化合物在农药、医药以及其他领域上都具有很广泛的用途。合成脒类化合物的方法主要为:Pinner脒合成法。本文重点介绍了Pinner脒合成方法的机理和副反应机理,并对其在有机合成中的应用进行了探讨。 关键词:Pinner脒合成;机理;改进;应用 The reaction mechanism and application of Pinner amidine synthesis Wang Yangyang (College of science, Northwest A&F University, Yangling, 712100, China) Abstract:The amidine compounds have a very wide range of functions in the pesticide, medicine and other fields. The primary method of synthesis of amidine compounds is Pinner amidine synthesis. This article focuses on the reaction mechanism of Pinner amidine synthesis and the side reactions mechanism Its application in organic synthesis is also discussed. Key words: Pinner amidine synthesis; mechanism; improvement; application 1.前言 脒类化合物在农药和医药上具有很广泛的用途。早年发现某些脒盐可以治疗血吸虫病,但毒性较大,一些长链烷氧基取代的苯甲脒盐具有表面活性剂的作用,被称为杀虫脒[1]。现在,脒类化合物的主要用途是合成含氮的杂环化合物,如:咪唑、噻唑、嘧啶环等,在含氮杂环的合成中起着重要作用。研究发现,脒盐还可以作为水溶性偶氮类引发剂,在水溶液聚合与乳液聚合中得到广泛应用[2]。 脒类化合物的合成方法一般采用酸催化法即Pinner 脒合成法。反应式如scheme 1: Pinner脒合成: cheme 1
黄酮类化合物糖苷化反应的研究
黄酮类化合物糖苷化反应的研究 摘要:黄酮是广泛存在于自然界的一类化合物,多属于植物的次级代谢产物在植物体内大部分与糖结合成苷或以碳糖基的形式存在。但大多都是以苷类的形式存在,多数的黄酮苷属于O-苷,少部分属于C-苷,具有多方面的生理活性。天然黄酮糖苷化合物资源有限,故而使其化学合成成为当今糖化学领域的研究热点之一。本文从各类黄酮类化合物着手,研究其糖苷化反应的条件,并以实例比较同类黄酮类化合物不同结构对糖苷化反应的影响。 关键词:黄酮黄酮苷糖苷化合成 Doi:10.3969/j.issn.1671-8801.2014.06.004 Abstract:Flavonoids are widely exists in the nature of a class of compounds,more belongs to the most of plant secondary metabolites in plant body combined with sugar into glycosides or exists in the form of carbon sugar base.But mostly in the form of glycosides,most of the flavonoid glycosides belong to O-glycosides,a few belong to C-glycosides,has various biological activities.Natural flavonoid glycoside compounds with limited resources,and make the chemical synthesis of sugar today one of the hot research topic in the field
论文 嘧啶类化合物的合成
本科毕业论文(设计) 学 院 化 学 化 工 学 院 专 业 化 学 年 级 2008 级 姓 名 XXX 论文(设计)题目 2-羟基嘧啶衍生物的合成 指导教师 XXX 职称 讲 师 2012年5月5日 学号:
目录 摘要 (2) 关键词 (2) Abstract (2) Keywords (2) 引言 (2) 1实验部分 (3) 1.1 实验所用仪器及试剂 (3) 1.2 4,6-二甲基嘧啶-2-酮盐酸盐的制备 (3) 1.3 N,N-二甲胺基苯甲醛的制备 (3) 1.4 最终产物的合成 (4) 2结果与讨论 (4) 2.1对反应机理的探讨 (4) 2.2 反应时间的选择 (6) 2.3柱层析淋洗济的选择 (6) 3结束语 (7) 参考文献 (8) 附注 (8)
2-羟基嘧啶衍生物的合成 姓名:XXX 学号:20085051159 院系:化学化工学院专业:化学 指导老师:XXX 职称:讲师 摘要:2-羟基嘧啶类衍生物具有独特的双光子吸收效应。本文主要介绍了一种二羟基嘧衍生物的合成方法及其反应机理。 关键词:2-羟基嘧啶;衍生物;合成;反应机理 Abstract: Dihydroxy pyrimidine derivative has an unique two-photon absorption. This paper introduces the synthesis and their reaction mechanism of the dihydroxy pyrimidine derivatives. Key Words: Dihydroxy pyrimidine;Derivatives;Synthesis ;Mechanism 引言 2-羟基嘧啶衍生物是重要的有机合成中间体,被广泛应用于医药、农药嘧啶类产品的合成中。在农药的发展史中,嘧啶类化合物一直占有重要的地位。此类化合物的研究开发一直受到医药和农药界的重视。近几年,作为农药的嘧啶类化合物层出不穷,如作为杀菌剂的嘧啶胺类,嘧啶腺类及嘧啶丙烯酸酯类,除草剂的嘧啶磺酰脲类,嘧啶水杨酸类及三唑并嘧啶磺酰胺类。嘧菌酯是一种甲氧基丙烯酸酯类杀菌剂,由于具有高效、广谱、保护、治疗、铲除、渗透、内吸活性,对几乎所有真菌纲病害均有很好的活性等特点,被广泛应用于谷物、蔬菜、果树及其他作物病虫害的防治。由于其良好的杀菌活性,在国内有很大的市场,而2-羟基嘧啶是合成嘧菌酯的重要中间体。众所周知,一些有机化合物的荧光或吸光性质随pH的变化可用来指示目标介质中酸碱性的改变。这种基于光学信号变化而建立的pH测定方法,可弥补玻璃电极所存在的上述不足,并得到 长足的发展。其中,荧光法测定pH具有灵敏度高、可以采用缓和模式操作(这种技术特别适合研究混浊和非均匀体系),分析仪器的几何设计更加灵活等特点。此外,利用各种荧光参数(如荧光强度、荧光寿命等)的变化来测定pH值,不仅便于荧光显微学研究,而且可实时检测细胞内pH的动态分布和区域变化,引起了人们的 关注。
酰肼类发泡剂的简介产品知识
酰肼类发泡剂的简介 在有机发泡剂中,酰肼类结构品种占有重要地位,其中以芳香族磺酰肼格外突出。纯的磺酰肼类发泡剂一般为无毒无味的结晶固体,其分解温度范围和发气量低于发泡剂H和发泡剂AC。其分解机理是磺酰肼基内部发生氧化还原反应,二者相互补偿,发泡过程中发热量适中。磺酰肼类发泡剂能定量释放N2和水蒸气,其残渣多为无毒、无色的烷基或芳基二硫代物和硫代亚砜。尽管如此,磺酰肼类发泡剂在一般的储存条件下还是比较稳定的。 就化学结构而言,磺酰肼类发泡剂包括对称性和非对称型两种类型。对称型品种主要有OBSH、3,3-二磺酰肼二苯砜等,以OBSH为代表。非对称型品种包括苯磺酰肼(BSH)、对甲苯磺酰肼(TSH)、2,4-甲苯二磺酰肼、对(N-甲氧基甲酰氨基)苯磺酰肼等,以TSH为典型代表。 OBSH是磺酰肼类发泡剂中产耗量最大的品种,为适应性极广的发泡剂,有“万能发泡剂”之称。在橡胶工业中,OBSH外观为白色微晶粉末,分解温度约160℃,发气量为发泡剂H和发泡剂AC的一半左右,分解气体为N2和水蒸气。OBSH通常很少使用发泡助剂活化,但尿素及其衍生物、胺、有机酸、硬脂酸酯、PVC热稳定剂具有不同程度的活化效能。按照DonaldG的活化分类体系,脲和三乙醇胺是OBSH的最强级活化剂;二苯胍属于强活化剂,在橡胶发泡体系中兼有硫化促进和发泡活化双重功效。 OBSH的发泡特征是气孔结构细微均匀,无着色性,几乎可以在所有的塑料和橡胶发泡制品中使用。OBSH价格较高,一定程度上限制了其应用范围。目前OBSH主要用于EPDM 挡风条,氯丁橡胶泡沫制品,PE、PS、PVC的注射和挤出成型加工,还用于PVC壁纸及其他发泡剂性能无法满足的场合。特别指出的是OBSH的分解残渣不影响制品的电气绝缘性,在电线电缆材料中具有显着的优势。OBSH的显着缺陷是分散性较差和吸湿。烷醇胺类抗静电剂对OBSH有促进水解反应的作用,随之生成大量氨气释放,应用中必须慎重。考虑到过氧化物可能引起OBSH急剧分解的问题,OBSH不宜用于以有机过氧化物作交联剂的交联发泡体系。 TSH发泡剂分解速度缓慢,与橡胶硫化条件趋势一致,主要作为橡胶发泡剂使用。近来研究发现TSH属变异性物质,日本劳动省已将其列入限制范围,因消耗量日渐减少。此外,有机发泡剂的重要品种还包括三唑类化合物、叠氮化合物等 深圳市长园特发科技有限公司 技术部:范宇 日期:2012年8月28号
脒基金属化合物的合成和催化反应研究
脒基金属化合物的合成和催化反应研究 【摘要】:金属有机化学是现代合成化学的基石之一,如今已经成为跨于无机和有机之间并与结构、催化、环境、生命和材料等方面研究密切相关的一门化学重点学科,理论和应用研究十分活跃,成果卓著。现代金属有机化学的发展见证了脒基配体作为均相催化剂支撑配体的脱颖而出,脒基配体由于其自身的灵活可变性、易于合成、能提供丰富的配位模式等优点从而成为金属有机化学研究的焦点之一。本课题组长期致力于脒基金属化合物的结构和催化性能的研究,本论文就是基于此展开的。本论文分为以下三部分:第一章导论,分三部分介绍了本论文的研究背景:(1)脒基锂、铝、锌化合物的研究进展;(2)反冠醚化合物的研究概况及其合成方法;(3)Tishchenko反应的最新研究进展。第二章主要研究了脒基锂化合物的亲氧性,将脒基锂化合物与O2/H2O反应,得到了一系列脒基锂反冠醚化合物,并通过NMR、X-Ray 单晶衍射等手段进行了结构表征,其中两个反冠醚化合物中心为不常见的O22-,为我们提供了一些帮助理解活泼有机金属化合物和O2/H2O反应过程的有用信息。第三章将脒基锂(铝、锌)化合物应用于催化脂肪醛和芳香醛的Tishchenko反应,通过优化反应条件,高产率得到相应的羧酸酯。脒基锂化合物适合催化无α-H的芳香醛,产率高、适应性广;脒基铝、锌化合物适合催化脂肪醛,产率高、反应速度快。【关键词】:催化脒基金属化合物Tishchenko反应反冠醚 【学位授予单位】:山西大学
【学位级别】:硕士 【学位授予年份】:2013 【分类号】:O621.3;O643.32 【目录】:中文摘要8-9ABSTRACT9-11第一章导论11-251.1脒基金属化合物的研究概况11-161.1.1脒基锂化合物的研究进展12-141.1.2脒基铝化合物的研究进展14-161.1.3脒基锌化合物的研究进展161.2反冠醚化合物的研究概况16-201.2.1反冠醚化合物简介16-191.2.2反冠醚化合物的合成方法19-201.3Tishchenko反应的研究进展20-25第二章脒基锂化合物参与的小分子活化反应研究25-452.1引言25-262.1.1研究背景25-262.1.2本章设计思路262.2结果与讨论26-302.2.1脒基配体的合成26-272.2.2含O_2~(2-)反冠醚化合物的合成27-302.2.3含O~(2-)反冠醚化合物的合成302.3化合物的光谱表征及结构特征30-412.3.1主要化合物的NMR数据分析30-322.3.2主要化合物的晶体结构分析32-412.4实验部分41-432.5本章小结43-45第三章脒基金属化合物催化Tishchenko反应的研究45-593.1引言45-473.1.1研究背景45-473.1.2本章设计思路473.2结果与讨论47-533.2.1脒基配体对催化反应的影响47-483.2.2温度对催化反应的影响48-493.2.3时间对催化反应的影响493.2.4催化剂用量对催化反应的影响49-503.2.5溶剂对催化反应的影响503.2.6催化剂对各种芳香醛的适应性503.2.7脒基金属化合物对脂肪醛的适应性50-533.3实
