d区元素一(相关知识点)

1、三个过渡系:
第一过渡系——第四周期元素从钪(Sc)到锌(Zn);
第二过渡系——第五周期元素从钇(Y)到镉(Cd);
第三过渡系——第六周期元素从镥(Lu)到汞(Hg);
2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、
密度大、导电性和导热性良好的金属;
3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;
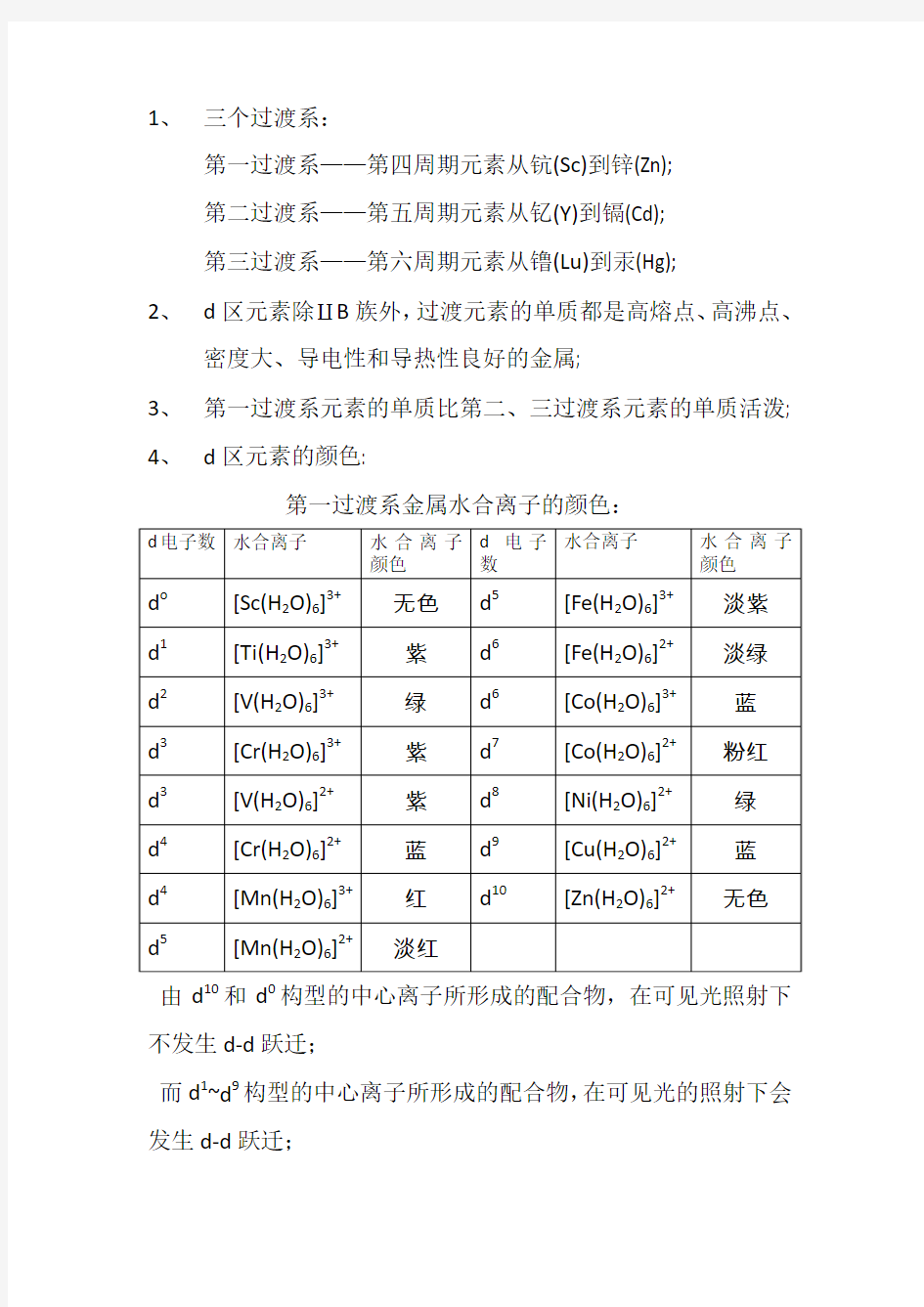
4、d区元素的颜色:
第一过渡系金属水合离子的颜色:
由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;
而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;
对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;
(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:
3002222C
TiO nH O TiO nH O ???→+
;
(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;
(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:
通常用TiO 2、碳和氯气在800C~900C 时进行反应:
800~900224222C C
TiO C Cl TiCl CO ++????→+ ;
用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:
2TiCl 4+H 2=2TiCl 3+2HCl ;
(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;
(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:
TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;
(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):
2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;
(11)向含有Ti3+的溶液中加入碳酸时:
2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;
(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:
4Ti3++2H2O+O2=4TiO2++4H+;
(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:
RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;
6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;
(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;
(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;
(4)加热时。钒可以与大多数非金属反应;
(5)钒原子的价层电子构型为3d34s2;
V5+的化合物都是反磁性的,有些是无色的;
V的+4,+3,+2价化合物都是顺磁性的,常呈现颜色;
(6)钒的化合物都有毒:
V2O5+6NaOH=2Na3VO4+3H2O ;
V 2O 5+H 2SO 4=(VO 2)2SO 4(硫酸钒酰)+H 2O ;
(7)灼烧NH 4VO 3时: 432532
22NH VO V O NH H O ?
??→++; V 2O 5是两性偏酸的氧化物,易溶于强碱溶液,在冷的溶液中正钒酸盐34M VO I ,在热的溶液中形成偏钒酸盐3M VO I :
在加热条件下,V 2O 5也可以与Na 2CO 3作用生成偏钒酸盐: (8)V 2O 5是较强的氧化剂:
22522622()3V O H Cl VO Cl H O ?+-
+++??
→++蓝色 ; 在有SO 32-的溶液中,V2O5可溶解: V 2O 5+SO 32-+4H +=2VO 2++SO 42-+2H 2O ; (9)V 2O 5在加热情况下的一些反应: V
O 4
VCl V 2O 5 2O 3;
(10)酸性溶液中钒的各种离子:
(11)VO 2+具有较强的氧化性,易被还原为VO 2+:
2VO 2++SO 32-=2VO 2++SO 42-+H 2O ; 用KMnO 4溶液可把VO 2+氧化为VO 2+: 5VO 2++H 2O+MnO 4-=5VO 2++Mn 2++2H + ;
(12)V 3+在水溶液中并不十分稳定,特别是在碱性条件下很容易被空气中的氧所氧化,V 2+具有较强的还原性,V 2+的化合物能从水中置换出H 2;
7、钼、钨、钨都是灰白色金属,它们的熔、沸点都很高,铬是金属中最硬的,表面易形成一层氧化膜,从而降低了它们的活泼性;
8、(1)铬原子的价层电子构型为3d 54s 1; (2)水溶液中铬的各种离子:
(3)通常由铬铁矿借助于碱熔法制得Cr 6+的化合物:
1000222322272324e()878a 28C
F CrO Na CO O N Cr O Fe O CO ++????→++约
;
再在Na 2CrO 4溶液中加入适量的H 2SO 4: 2Na 2CrO 4+H 2SO 4=Na 2Cr 2O 7+Na 2SO 4+H 2O ;
(4)以K2Cr2O7为原材料:
(NH4)2Cr2O7
2
K2Cr2O)
(5)氯化铬酰是深红色易挥发的液体,有较强的氧化性;易吸水放出HCl,本身变为CrO3(铬酐):
CrO2Cl2+H2O=CrO3+2HCl ;
(6)CrO3在冷却的条件下与氨水作用:
332422
2r O2()
C N H H O N H C r O
++???→
冷却;
(7)有些铬酸盐比重铬酸盐难溶于水:
22
2724
22(s,)+2
Pb Cr O H O PbCrO H
+-+
??→
++←??黄色;
2+2
2724
2a2aCrO(s,)+2
B Cr O H O B H
-+
??→
++←??淡黄;
2
27224
4g2(,)+2
A Cr O H O Ag CrO s H
+-+
??→
++←??砖红;
(8)在Cr2O72-的溶液中,加入H2O2和乙醚时,有蓝色的过氧化物CrO(O2)2.(C2H5)2O生成,这一反应用来鉴定溶液中是否有Cr6+存在;
(9)Cr2O72-具有较强的氧化性,而CrO42-的氧化性较差:
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O ;
Cr2O72-+3H2S+8H+=3S(s,黄色)+2Cr3++7H2O ;
Cr2O72-+3Sn2++14H+=3Sn4++2Cr3++7H2O ;
Cr 2O 72-+3SO 32-+8H +=3SO 42-+2Cr 3++4H 2O ; K 2Cr 2O 7(s)+14HCl(浓)=3Cl 2+2CrCl 3+2KCl+7H 2O; (10) (NH 4)2Cr 2O 7晶体受热分解:
17042272223()4C
NH Cr O N H O Cr O ???→++ ;
Cr 2O 3俗称铬绿,可做绿色颜料; (11)在Cr 3+的溶液中加入碱至过量: Cr 3++3OH -=Cr(OH)3(s,灰绿色) ; Cr(OH)3+OH -=[Cr(OH)4]-(亮绿色) ; 溶液颜色由灰绿色变为亮绿色;
(12)在酸性中,使Cr 3+氧化为Cr 2O 72-比较困难,需要采用氧化性更强的氧化剂,如S 2O 82-(过硫酸根离子):
32
2228
22742r 37614Ag C S O H O Cr O SO H +
+
---+
++???→++;
在碱性溶液中,把[Cr(OH)4]-氧化为铬酸盐比较容易: [Cr(OH)4]-+3H 2O 2+2OH -=2CrO 42-+8H 2O ;
(13)32232()3()Cr OH H O Cr O ?
??
→+绿, Cr 2O 3(铬绿); 2234r 32()C O Cr O ?
+??
→绿 ; 2Cr 3++3S 2-+6H 2O=Cr(OH)3(s,灰绿)+3H 2S ;
2Cr 3++3CO 32-+3H 2O=2Cr(OH)3(s,灰绿)+3CO 2(g);
(14)在含有[Cr(H 2O)6]3+的溶液中加入锌粉,可得到蓝色的[Cr(H 2O)6]2+:
2Cr 3++Zn=2Cr 2++Zn 2+ ;
当有Ac -存在时,可看到难溶的、粉红色的Cr 2(Ac)4.2H 2O 生成;
9、(1)锰在自然界中主要以软锰矿MnO 22xH O 的形式存在; (2)块状锰是白色金属,质硬而脆:
23432Mn O Mn O ?
+??
→ ,Mn+X 2=MnX 2(X F ≠) ; Mn+F 2=MnF 4和MnF 3 ; Mn+2H 2O=Mn(OH)2(s,白)+H 2 ;
22422432n 2Mn KOH O K M O H O ++???→+熔融
;
Mn+2H +(稀)=Mn 2++H 2(g) ;
(3) KMnO 4晶体(紫红色或近乎黑色) ; K 2MnO 4(暗绿色) , MnO 2粉末(黑色); MnSO 4.7H 2O 晶体(肉红色) ;
MnCl 2.4H 2O(肉红色) ; (4)水溶液中的锰的各种离子:
(5)以软锰矿制取KMnO 4时:
232
42363n O 3M n O K O H K C l O K M K C l
H O
++
???→++熔融
; 再用氯气氧化:
2K 2MnO 4+Cl 2=2KMnO 4+2KCl ; (6)MnO 4-的空间构型为四面体型;
(7) 20042422C KMnO K MnO KCl O ????
→++以上
; MnO 4-在不同条件下:
2MnO 4-+SO 32-+2OH-(浓)=2MnO 42-+SO 42-+H 2O ; MnO 4-+3SO 32-+H 2O=2MnO 2(s)+3SO 42-+2OH - ; 2MnO 4-+5SO 32-+6H +=2Mn 2++5SO 42-+3H 2O ; 2MnO 4-+5H 2C 2O 4+6H +=2Mn 2++10CO 2+8H 2O ; (8)通常用棕色瓶装KMnO 4溶液:
MnO 4-+4H +=4MnO 2+2H 2O+3O 2 (中性或弱碱性); 4MnO 4-+4OH -=4MnO 42-+O 2+2H 2O (浓碱); 2MnO 4-+5H 2S+5H +=2Mn 2++5S+8H 2O ; 6MnO 4-+5S+8H +=6Mn 2++5SO 42-+4H 2O ;
(9) MnO 4-在微酸性条件下通入CO 2或加入醋酸,甚至在中性条件下,可发生歧化反应:
3MnO 42-+4H +=2MnO 4-+MnO 2+2H 2O ; 3MnO 42-+2CO 2=MnO 2+2MnO 4-+2CO 32- ; (10)在酸性溶液中,MnO 2具有强氧化性:
22442222()2nSO 2MnO H SO M O H O ?
+??
→++浓 ; 22224()22MnO HCl MnCl Cl H O ?
+??
→++浓 ; (11)加热MnO 2可分解为Mn 3O 4和O 2:
53023423C
MnO Mn O O ???
→+ ; 在氢气流中加热MnO 2或Mn 3O 4:
450~500
222()+C C MnO H MnO H O +????→绿色 ;
34223Mn O H MnO H O ?
+??→+ ;
(12)向Mn 2+的溶液中加入OH -时:
2
222n()(s,)O Mn OH M OH +
-
???→+←???
无白 ; 它在空气中很快被氧化:
2Mn(OH)2+O 2=2MnO(OH)2(棕黄色) ; (13)Mn 2+的特征反应:
2Mn 2++5NaBiO 3+14H +=2MnO 4-+5Bi 2++5Na ++7H 2O ;
由于反应生成了MnO 4-而使溶液呈紫色,因此常用这一反应来检验溶液中是否存在微量的 Mn 2+;但是溶液中有Cl -存在时,溶液颜色变为紫红色后立即褪去,这是由于MnO 4-被还原为Cl -还原,当Mn 2+过多时,也会在紫红色出现后立即消失: 2MnO 4-+3Mn 2++2H 2O=5MnO 2+4H + ;
10、(1)铁与冷的稀硝酸作用时,没有气态氮氧化合物生成: 4Fe+10H ++NO 3-=4Fe 2++NH 4++3H 2O ; 铁与热的稀硝酸作用时:
Fe+4H ++NO 3-(较浓)=Fe 3++NO+2H 2O ; Fe+6H ++3NO 3-(浓)=Fe 3++3NO 2+3H 2O ; 冷的浓硝酸可使铁、钴、镍变成钝态; (2)铁的价层电子构型为:3d 64s 2;
(3)铁的常见氧化物有红棕色的Fe 2O 3、黑色的FeO 、黑色的Fe 3O 4;
600~700332322
32()62
C C
Fe NO Fe O NO O ????→++242e FeC O F O CO CO ?????→++隔绝空气加热
;
实验室常用上述反应制取Fe 2O 3或FeO; (4)向Fe 2+或Fe 3+的溶液中加入强碱或氨水:
2333e()(,)O Fe OH F OH s +-
+???
→有红褐; 2
2+2e +2e()(,)O F OH F OH s -
???
→无白; 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3(s) , 溶液颜色由白变灰绿,再变为红褐色; (5)在浓碱溶液中:
2Fe(OH)3+3ClO -+4OH -=3Cl -+5H 2O+2FeO 42-(高铁酸根离子); 高铁酸根离子(FeO 42-)的颜色为紫红色;
(6)带有结晶水的FeCl 3.6H 2O 易潮解,工业上常将其用作净水剂; (7)在酸性溶液中,Fe 3+是中强氧化剂: 2Fe 3++2I -=2Fe 2++I 2 ; 2Fe 3++H 2S=2Fe 2++S(s)+2H + ; 2Fe 3++Fe=3Fe 2+ ; 2Fe 3++Cu=2Fe 2++Cu 2+ ; 2Fe 3++Sn 2+=Sn 4++2Fe 2+ ;
(8)在Fe 2+的溶液中,加入KSCN 溶液,首先: Fe 2++2CN -=Fe(CN)2(s,白) ; 过量时:Fe(CN)2+4CN -=[Fe(CN)6]4- ; 用氯气氧化时:
2[Fe(CN)6]4-+Cl 2=2[Fe(CN)6]3-+2Cl - ; (9)鉴定Fe 3+:
xFe 3++xK ++x[Fe(CN)6]4-=[KFe(CN)6Fe]x (蓝色) ,普鲁士蓝; 鉴定Fe 2+:
xFe 2++xK ++x[Fe(CN)6]3-=[Kfe(CN)6Fe]x , 滕氏蓝; 两种鉴定均在酸性条件下; (10)用于鉴定NO 3-:
3Fe 2++NO 3-+4H +=3Fe 3++NO+2H 2O ; [Fe(H 2O)6]2++NO=[Fe(NO)(H 2O)5]2++H 2O ; (11)当硝酸与[Fe(CN)6]4-的溶液作用时:
[Fe(CN)6]4-+4H ++NO 3-=[Fe(CN)5(NO)]2-+CO 2+NH 4+; [Fe(CN)5(NO)]2-(五氰亚硝酰合铁酸根离子); 用于鉴定S 2-:
[Fe(CN)5(NO)]2-+S 2-=[Fe(CN)5NOS]4-(紫红色) ;
11、(1) 500234o oO C
C O Co O C +???
→和 ; Co 2O 3+6HCl(浓)=2CoCl 2+Cl 2+3H 2O ; PbO 2
MnO 2 ; (2)钴的价层电子构型为:3d 74s 2 ; (3)Co 2++2OH -=Co(OH)2(s,粉红) ;
2Co(OH)2+1/2O 2+(x-2)H 2O=Co 2O 32xH O ; (4)CoF 3是淡棕色粉末,与水猛烈作用放出氧气: 在有机合成上:
3222442CoF CH CoF CF F +--→+--+ ;
(5)氯化钴CoCl 2.6H 2O 在受热脱水过程中: CoCl 2.6H 2O 是变色硅胶;
90120222222262C C
CoCl H O CoCl H O CoCl H O CoCl ??→???→???→←??←???←???
; (粉红) (紫红) (蓝紫) (蓝色) ; (6)制取[Co(CN)6]Cl 3的反应:
4[Co(CN)6]4-+O 2+2H 2O=4[Co(CN)6]3-+4OH - ; (7)把Na 3[Co(NO 2)6]溶液加到K +的溶液: 2K ++Na ++[Co(NO 2)6]3-=K 2Na[Co(NO 2)6](s,黄) , K 2Na[Co(NO 2)6](六硝基合钴酸钠) ;
(8) 222264[()][]Cl H O
Co H O CoCl -
+
-???→←??? ; (粉红) (蓝) ;
(9)[Co(NH 3)6]具有较强的还原性,易被空气中的O 2氧化: 4[Co(NH 3)6]2++O 2+2H 2O=4[Co(NH 3)6]3++4OH -;
(10)在含有Co 2+的溶液中加入KSCN(S)及丙酮,用于鉴定Co 2+:
2244[()]Co NCS Co NCS +--+??
?→丙酮
; 12、(1)镍的价层电子构型:3d 84s 2;
(2) 5002
22C
Ni O NiO +???→ ; (3)Ni 2++2OH -=Ni(OH)2(s,苹果绿) ; 在Ni(OH)2溶液中加入较强的氧化剂:
222()2()OH
Ni OH ClO NiO OH Cl H O -
--+???
→++ ; 13、(1)Fe 、Co 、Ni 具有永久磁性;
(2)还原性:Fe 2+>Co 2+>Ni 2+(关于失电子能力),因为随原子序数的
增加,有效电荷增加,增强了核对3d电子的束缚作用;
(3)(NH4)2Fe(SO4)2,硫酸亚铁铵晶体(摩尔盐),绿色;CoCl2.6H2O,氯化钴晶体,粉红色;
CoSO4.7H2O,硫酸钴晶体,淡紫色;
NiCl2.6H2O,氯化镍晶体,草绿色;
NiSO4.7H2O,硫酸镍晶体,暗绿色;
Ni(NO3)2.6H2O,硝酸镍晶体,青绿色;
高中化学氧族元素知识点
2H 2O 2===2H 2O+O 2 ↑ MnO 2 三、氧族元素 1、氧族元素的原子结构及性质的递变规律 2、臭氧和过氧化氢 臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞 过氧化氢不稳定分解, 可作氧化剂、漂白剂。 3.硫:难溶于水,微溶于酒精,易溶于二硫化碳 (1)与O 2 (2)与强碱 4、二氧化硫的物理性质 无色、有刺激性气味的有毒气体;密度比空气大;易溶于水(1∶40);易液化(-10℃) 5、二氧化硫的化学性质 1)、酸性氧化物 能和碱反应生成盐和水:SO 2+2NaOH===Na 2SO 3+H 2O 与水反应生成相应的酸:SO 2+H 2O===H 2SO 3(二氧化硫的水溶液使紫色石蕊试液变红) 二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。SO 2+H 2O H 2SO 3 2)、氧化性: SO 2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。 SO 2+2H 2S===3S ↓+2H 2O 3)、还原性:SO 2使溴水和高锰酸钾溶液褪色 SO 2+Br 2+2H 2O=== H 2SO 4+2HBr 5SO 2+2KMnO 4+2H 2O===K 2SO 4+2MnSO 4+2H 2SO 4 2SO 2+O 2 2 SO 3 (SO 3+H 2O===H 2SO 4,SO 3是无色固体SO 3是一种无色固体,熔点是16.80 C ,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。) 4)、漂白性:SO 2使品红溶液褪色:由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。 把Cl 2和SO 2混合用于漂白,能否增强漂白效果?为什么? 〖答案〗不能,SO 2+Cl 2+2H 2O=== H 2SO 4+2HCl 6.. 浓硫酸 (1)物理性质:无色油状液体,常见的浓硫酸质量分数为98.3%,沸点为338℃,高沸点难挥发性。 (2)化学性质: ① 吸水性(干燥剂) 吸收气体中水蒸气(作为干燥剂,不能干燥硫化氢、溴化氢、碘化氢、氨气) 浓硫酸与胆矾反应,由胆矾蓝色变为白色说明浓硫酸有吸水性。 ② 脱水性(炭化)
高中化学元素及其化合物知识点总结大全非常实用
1.单质硫的颜色_______,______溶于水,______ 于酒精,易溶于_______________。 2.SO2漂白的原理为________________________________________________________ 。 3.CO2(SO2)除杂试剂为_____________________________________________________ 4.实验室制SO2的化学方程式__________________________________________________。 5.设计实验证明SO2气体中含有CO2:___________________________________________。 6.写出一个体现SO2具有氧化性的化学方程式_____________________________________。 7.写出两个体现CO2具有氧化性的方程式_________________________________________ ___________________________________________。 8. SO2通入FeCl3溶液的现象为_____________________________,写出反应的离子方程式 __________________________________________。 9. SO2能使酸性高锰酸钾溶液褪色,写出反应的离子方程式___________________________ ___________________________________________。 10. SO2催化氧化的化学方程式___________________________________________________。 11. Cu与S加热条件下反应方程式:_____________________________________________。 12. 写出两种鉴别CO2与SO2的方法_______________________、____________________。 13. 检验SO2的试剂为_________________________________________; 检验水的试剂为______________________;检验CO2的试剂为_____________________。 14. 检验Clˉ的试剂是_________________________;检验SO42-的试剂是_______________ _____________________;检验Cl2的试剂是_____________________________________。 15. SO2通入BaCl2溶液中的现象为_______________,SO2通入Ba(NO3)2溶液中的现象为 __________________,SO2通入FeCl3和BaCl2溶液中的现象为_______________________。 16. SO2和Cl21:1混合通入品红溶液中,现象为_____________,反应的离子方程式为 __________________________________________________。 17. SO2通入紫色石蕊试液中的现象是_______________,体现了SO2的________性。 18. Cl2通入紫色石蕊试液中的现象是______________________________________________。 19. SO2使溴水褪色的化学方程式为_______________________________________________。 20. Na2SO3既有氧化性又有还原性,证明Na2SO3具有氧化性的试剂是____________和 ____________,反应方程式是_________________________________________证明Na2SO3具有还原性的试剂是_________,反应的离子方程式为_____________________________。 21. 常见离子的还原性由大到小的顺序为_________________________________(写六个)。 22. SO2使碘水褪色,说明SO2具有__________________性。 23. 氢气在氯气__________燃烧,发出_________色火焰,集气瓶口有__________产生。 24. 铜丝在氯气中燃烧的现象为__________________________________________。 25. 氯气的水溶液叫_______________,Cl2___________溶于水,溶于水的Cl2约有________ 与水反应,化学方程式为___________________________________________。 26. 新制氯水的成分有_____________________________,颜色为___________________, 溶质为_____________,久置氯水的成分为_______________________。 27. 家用消毒液的制备原理:___________________________________________,其有效成分 为__________________。 28. 工业漂白粉的制备原理_____________________________________________,其主要成分 为______________________,有效成分为________________________。 29. 漂白粉久置在空气中失效的原理为____________________________________________。 30. 增强漂白粉和家用消毒液的漂白消毒作用的方法是______________________________。 31. Cl2的尾气处理原理:_______________________________________________________。 32. 除去Cl2中的HCl的试剂是________________,验满Cl2的方法为__________________。
元素周期表规律总结(同一主族_对角线规则)1
知识网络 中子N (不带电荷) 同位素 原子核 → 质量数(A=N+Z ) 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元素 → 元素符号 原子结构 : 最外层电子数决定主族元素的 电子数(Z 个): 化学性质及最高正价和族序数 核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 决定原子呈电中性 编排依据 X)(A Z 七 主七副零 和八 三长三短一不全 决定元素种类
最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S >Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如: Li
氧族元素知识点梳理
臭氧O3 1. 同素异形体:有同一种元素组成的性质不同的单质。氧气和臭氧、金刚石和石墨、S 有多种同素异形体。 2. 在常温、常压下,臭氧是一种有特殊臭味的淡蓝色气体,密度比空气的大,也比氧气易溶于水。液态臭氧呈深蓝色,沸点为-112.4℃,固态臭氧呈紫黑色,熔点为-251℃。 3. 臭氧不稳定,在常温下能缓慢分解生成氧气,在高温时可以迅速分解。 2O33O2 4. 臭氧具有极强的氧化性,银、汞等在空气或氧气中不易被氧化的金属,可以与臭氧发生反应。 5. 臭氧可用于漂白和消毒。某些染料受到臭氧的强烈氧化作用会褪色,臭氧还可以杀死许多细菌,因此,它是一种很好的脱色剂和消毒剂。 6. 在空气中高压放电就能产生臭氧。 3O22O3 放电 过氧化氢H2O2 1. 过氧化氢是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性。 2. 市售双氧水中过氧化氢的质量分数一般约为30%。医疗上广泛使用稀双氧水的质量分数为3%(或更小)作为消毒杀菌剂。工业上用10%的双氧水漂白毛、丝以及羽毛等。 过氧化氢可用作氧化剂、漂白剂、消毒剂、脱氯剂等,也可作为火箭燃料,及生产过氧化物的原料。 3. 过氧化氢会分解生成水和氧气。 2H2O22H2O + O2↑ MnO2 综合实验活动:H 2O 2 性质研究及化学反应条件的控制 活动任务:通过实验研究H2O2的化学性质,并讨论反应条件如浓度、温度、反应介质(水溶液的酸碱性)、催化剂等对化学反应结果的影响。 任务一:研究H2O2的化学性质 通过实验研究H2O2的化学性质。 设计实验方案 1. 请你根据你对H2O2性质的了解和对H2O2中氧元素化合价的分析,预测过氧化氢可能 具有哪些化学性质。
元素化合物知识点归纳与练习
专题一元素及其化合物 1.重要无机物的特性 (1)常温下呈液态的非金属单质是; (2)能与二氧化硅反应而能雕刻玻璃的是; (3)能与水剧烈反应生成非金属单质是; (4)能与NaOH溶液反应放出氢气的是; (5)遇淀粉变蓝色的是;(6)具有磁性的是。…… 2.重要无机物的工业制法 (1)漂粉精: (2)硫酸的制法(接触法): (3)硝酸的制法(氨氧化法): (4)氯气的制备: (5)钠、镁、铝的制备: (6)工业制玻璃: (7)煅烧石灰石: (8)工业制粗硅: (9)工业制水煤气: (10)工业制纯碱(侯德榜法): 3.常见物质燃烧时的火焰颜色 (1)苍白色——(2)蓝色—— (3)淡蓝色(4)黄色—— (5)紫色(透过蓝色钴玻璃) 4.重要物质的用途 (1)呼吸面具和潜水艇的供氧剂; (2) 用于自来水的消毒杀菌; (3) 用于制造发酵粉; (4) 在医疗上作造影剂; (5) 用作感光材料;(6) 用于焊接钢轨、冶炼难熔金属; (7) 用于腐蚀印刷电路板。 5.物质结构方面 熟悉常见的分子或单质、化合物的结构(水、氨气、二氧化碳、金刚石、二氧化硅的结构
特点)。 (1)具有正四面体结构的有甲烷、白磷、NH+4等; (2)不含金属元素的离子化合物为铵盐; (3)组成为1∶1型的化合物可能为H2O2、C2H2、Na2O2、C6H6等。6.物质的特有颜色 常见的有颜色的物质 7.特殊反应条件 (1)高温:铝热反应,制水煤气,制粗硅,水蒸气与Fe反应等。 (2)高温高压、催化剂 N2+3H2 (3)加热、催化剂 2KClO3 2SO2+O2 4NH3+5O2 (4)放电 3O2 N2+O2 8.三角关系
高考化学基础复习知识点总结:元素及其化合物
元素及其化合物 1、元素化合物知识包括金属和非金属两部分,是高中化学的基础知识之一。知识特点是作为化学基本概念、原理、实验和计算的载体,其信息量大,反应复杂,常作为综合试题的知识背景或突破思维的解题题眼。 2、注意处理好两个关系,必须先处理好元素化合物知识的内部关系,方法是:“抓重点,理关系,用规律,全考虑”。 ①抓重点:以每族典型元素为代表,以化学性质为抓手,依次学习其存在、制法、用途、检验等“一条龙”知识,做到牵一发而动全身 ②理关系:依据知识内在联系,按单质→氧化物→氧化物的水化物→盐的顺序,将零碎的知识编织成网络,建立起完整的知识结构,做到滴水不漏 ③用规律:用好化学反应特有的规律,如以强置弱等规律,弄清物质间相互反应。 ④全考虑:将元素化合物作为一个整体、一个系统理解,从而达到解综合试题时能将所需的元素化合物知识信手拈来。 另一方面是处理好元素化合物知识与本学科理论、计算或跨学科知识间的外部关系,采取的方法是“分析与综合、抽象与具体”。 ①分析:将综合试题拆分思考。 ②综合:将分散的“点”衔接到已有的元素化合物知识“块”中。 ③抽象:在分析综合基础上,提取相关信息。 ④具体:将提取出的信息具体化,衔接到综合试题中,从而完整解题。 (一)元素非金属性的强弱规律 ⑴常见非金属元素的非金属性由强到弱的顺序如下:F、O、Cl、N、Br、I、S、P、C、Si、H。 ⑵元素非金属性与非金属单质活泼性的区别: 元素的非金属性是元素的原子吸引电子的能力,影响其强弱的结构因素有:①原子半径:原子半径越小,吸引电子能力越强;②核电荷数:核电荷数越大,吸引电子能力越强;③最外层电子数:同周期元素,最外层电子越多,吸引电子能力越强。但由于某些非金属单质是双原子分子,原子是以强列的共价键相结合(如N N等),当参加化学反应时,必须消耗很大的能量才能形成原子,表现为单质的稳定性。这种现象不一定说明这种元素的非金属性弱。 ⑶非金属性强弱的判断依据及其应用 元素的非金属性的本质是元素的原子吸引电子的能力。这种能力的大小取决于原子半径、核
高中化学氧族元素知识点
2H 2O 2===2H 2O+O 2 ↑ MnO 2 氧族元素 难点聚焦 1、氧族元素的原子结构及性质的递变规律 2、臭氧和过氧化氢 臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞 过氧化氢不稳定分解, 可作氧化剂、漂白剂。 3、二氧化硫的物理性质 无色、有刺激性气味的有毒气体;密度比空气大;易溶于水(1∶40);(可用于进行喷泉实验,如SO 2、HCl 、NH 3);易液化(-10℃) 4、二氧化硫的化学性质 1)、酸性氧化物 能和碱反应生成盐和水:SO 2+2NaOH===Na 2SO 3+H 2O 与水反应生成相应的酸:SO 2+H 2O===H 2SO 3(二氧化硫的水溶液使紫色石蕊试液变红) 二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。SO 2+H 2O H 2SO 3 2)、氧化性: SO 2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。 SO 2+2H 2S===3S ↓+2H 2O 3)、还原性:SO 2使溴水和高锰酸钾溶液褪色 SO 2+Br 2+2H 2O=== H 2SO 4+2HBr 5SO 2+2KMnO 4+2H 2O===K 2SO 4+2MnSO 4+2H 2SO 4 2SO 2+O 2 2 SO 3 (SO 3+H 2O===H 2SO 4,SO 3是无色固体SO 3是一种无色固体,熔点是16.80C ,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。) 4)、漂白性:SO 2使品红溶液褪色:由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。 漂白性的比较 具有漂白性的物质 物质 HClO 、O 3、H 2O 2 、Na 2O 2 SO 2 木炭 原理 将有色物质氧化分解 与有色物质结合生成无色物质 将有色物质的分子吸附在其表面 实质 氧化还原反应 非氧化还原反应 物理吸附 效果 永久性 暂时性 暂时性 范围 可漂白大多数有色物质,能 使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
高一化学金属及其化合物知识点总结
高一化学金属及其化合物知识点总结 1.元素的存在形式有两种:游离态和化合态。 (1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。 (2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。 2.金属单质的用途: (1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。 (2)镁条燃烧发出耀眼的白光,用来做照明弹。 (3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。 3.金属化合物的用途: (1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。 (2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。 (3)明矾做净水剂。 4.金属的分类: (1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。 (2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。 5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。 (1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。 (2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。 (3)非金属氧化物分为酸性氧化物、不成盐氧化物。
细胞中的元素和化合物 知识点汇总
组成细胞的元素 1.细胞中常见的化学元素有20多种。根据含量的多少,分为大量元素与微量元素。 2.大量元素有_等。 3.微量元素有_等。 4.构成细胞的元素中,最基本的元素就是;其中4种元素含量最多。 鲜重状态下,4种基本元素的含量就是O > C > H > N ; 干重状态下,4种基本元素的含量就是C > O > N > H。 组成细胞的化合物 1.细胞中的化合物包括:________与________。 细胞中的无机物主要包括____________与____________,_________就是细胞中含量最多的化合物,______________大多数以___________的形式存在。 2.水在细胞中以_____________与___________两种形式存在,其中_____________就是细胞 结构的重要组成成分,_____________占细胞中水的绝大部分,以形式存在,可以自由流动。 3.细胞中无机盐的主要功能包括维持___________________________________________, 维持____________________________________________________。 细胞中的水 自由水/结合水的比值对生命活动的影响 (1)当自由水/结合水比值高(即自由水含量高时),代谢强度高,抗寒、抗旱性等抗逆性差。如种子萌发时,先要吸收大量的水分,以增加自由水的含量,并加快代谢速度。 (2)当自由水/结合水比值低(即结合水含量高时),抗寒、抗旱性强,代谢强度差。如冬季,植物吸水减少时,细胞内结合水相对含量升高,由于结合水不易结冰与蒸腾,从而使植被抗寒性加强。 自由水与结合水的存在及其功能的验证 (1)鲜种子放在阳光下暴晒,重量减轻―→自由水散失,代谢减弱。 (2)干种子用水浸泡后仍能萌发―→失去自由水的种子仍保持其生理活性。 (3)干种子放在试管中,用酒精灯加热,试管壁上有水珠―→失去结合水。种子浸泡后不萌发―→失去结合水的细胞丧失生理活性。 [特别提醒] 一般情况下,温度略升高,自由水含量将升高,反之则自由水含量降低。相同条件下,自由水含量高的细胞,代谢旺盛。结合水含量高的细胞代谢较弱。 环境恶化——自由水↓,结合水↑。 细胞衰老——自由水↓,结合水↑。生命活动增强——自由水↑,结合水↓。 细胞中的无机物 1、含量:无机盐在生物体中含量很少,仅占细胞鲜重的1%-1、5%。 2、存在形式:大部分以离子形式存在。少数无机盐与其她化合物结合,如Mg2+就是叶绿素的成分
元素周期表的规律总结
元素周期表的规律 一、原子半径 同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减; 同一族中,从上到下,随着原子序数的递增,元素原子半径递增。 二、主要化合价(最高正化合价和最低负化合价) 同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。元素最高价的绝对值与最低价的绝对值的和为8 三、元素的金属性和非金属性 同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减; 四、单质及简单离子的氧化性与还原性 同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。 五、最高价氧化物所对应的水化物的酸碱性 同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱); 同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。 元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强。 六、单质与氢气化合的难易程度 同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易; 同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。 七、气态氢化物的稳定性 同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强; 同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。 此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充: 随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。元素的气态氢化物越稳定,非金属性越强。 同一族的元素性质相近。 以上规律不适用于稀有气体。 八、位置规律判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2)主族元素的族数等于最外层电子数。 九、阴阳离子的半径大小辨别规律 三看: 一看电子层数,电子层数越多,半径越大, 二看原子序数,当电子层数相同时,原子序数越大半径反而越小 三看最外层电子数,当电子层数和原子序数相同时最外层电子书越多半径越小 r(Na)>r(Mg)>r(Al)>r(S)>r(Cl)、r(Na+ ) >r(Mg2+ )>r(Al3+ )、r(O2- ) >r(F-) r(S2—)>r(Cl—)>r(Ar) >r(K+)>r(Ca2+)、r(O2—)> r(F—)> r(Na+)> r(Mg2+)> r(Al3+) r(Na+ )
非金属元素及化合物知识点总结
★碳族元素基础知识点 一、知识网络 1.碳及其化合物的知识网络 2.硅及其化合物的知识网络 二、基础知识 1.碳族元素 ①特征:最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键。 碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。 C CO 2 CaCO 3 CaC 2 C 2H 2 CO 有机物 NH 4HCO 3 CH 4 H 2CO 3 Na 2CO 3 NaHCO 3 O 2 SiC 、CCl 4 不完全燃烧 O 2(不足) O 2 ( 不足 ) ①O 2 ②CuO 炽 热的碳 NH 3·H 2O O 2 ( 点 燃 ) △ H 2O CaO △ Si 、Cl 2 (△) Mg (点燃) ①O 2 (点) ②CuO (△) C 、CO Na 2O 2 NaOH H 2O NaOH H + C a (O H )2 ①高温②H + Ca 2+ CO 2 、H 2O △ C a (O H )2 CO 2 (水) ①OH ― ②加热 Na 2SiO 3 CO 2,H 2O NaOH H 2SiO 3 SiH 4 Si SiO 2 CaSiO 3 SiF 4 H 4SiO 4 SiC SiCl 4 O 2 (自燃) H 2 ①O 2(△) ②FeO (高温) F 2 HF Cl 2 (高温) H 2 (高温) C( 高温) C(高温)足量 Na 2CO 3 ( 高 温 ) NaOH( 溶液) ①CaO(△) ②CaCO 3 (△) Ca 2+ -H 2O C(适量)
几种同素异形体:碳:金刚石、石墨、C 60、C 70等;硅:晶体硅,无定形硅 2.碳 在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。 ① 燃烧反应 ② 与某些氧化物的反应:Cu CO CuO C CO CO C 22; 222+↑?→?+?? →?+? 高温 O H CO O H C 22+??→?+高温(CO 、H 2的混合气体叫水煤气); ↑+??→?+2CO Si SiO 2C 2电炉 ③ 与氧化性酸反应: C +2H 2SO 4(浓)?→?? CO 2↑+2SO 2↑+2H 2O ; C +4HNO 3(浓)?→?? CO 2↑+4NO 2↑+2H 2O 3.CO :不溶于水,有毒(CO 和血红蛋白结合,使血红蛋白无法和O 2结合,而使细胞缺氧引起 中毒),但由于CO 无色无味因此具有更大的危险性。 ①可燃性 ②还原性:CO+CuO ?→? ? CO 2+Cu ,CO+H 2O(g)CO 2+H 2O 4.CO 2:直线型(O =C =O )非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。 固态CO 2俗称干冰,能升华,常用于人工降雨。 实验室制法:CaCO 3+2HCl =CaCl 2+CO 2↑+H 2O 。 5.碳酸盐 ①溶解性:Ca(HCO 3)2>CaCO 3;Na 2CO 3>NaHCO 3。 ②热稳定性:Na 2CO 3>CaCO 3;碱金属正盐>碱金属酸式盐: Na 2CO 3>NaHCO 3。 ③相互转化:碳酸正盐碳酸酸式盐(除杂用) 6.硅 ① 硅在地壳中只有化合态,没有游离态。其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。 ② 晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。 ③ 硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反应: Si+2F 2→SiF 4、 Si+4HF →SiF 4+2H 2↑、Si+2NaOH+H 2O →Na 2SiO 3+2H 2↑; 在加热条件下,能与氧气、氯气等少数非金属单质化合:Si +O 2?→? ? SiO 2。 7.SiO 2 ①SiO 2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。 ② 二氧化硅的化学性质很稳定,不能跟酸(氢氟酸除外)发生反应。由于它是一种酸性氧化物, 所以能跟碱性氧化物或强碱反应 SiO 2+CaO ??→ ?高温 CaSiO 3 SiO 2+2NaOH →Na 2SiO 3+H 2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中) ③ 二氧化硅是一种特殊的酸性氧化物 a .酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水 化物(硅酸)只能用相应的可溶性硅酸盐跟盐酸作用制得 b .酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应: SiO 2+4HF →SiF 4+2H 2O(氢氟酸不能盛放在玻璃容器中)。
高中化学必修一非金属及其化合物知识点总结
一、常见物理性质: 1、颜色: A、红色世界 (1)基态:Fe2O3 (红棕色)、Fe (OH)3(红褐色)、[Fe (SCN)]2+(血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2(红棕色)、P(红磷、暗红色)、Br2(深红棕色)、红色石蕊试纸、品红溶液。在空气中久置的苯酚(红色) (2)化学变化: ①紫色石蕊在酸性溶液(p H<5.0)中变红; ②润湿的蓝色石蕊试纸遇酸性气体(C O2、S O2、H2S、H C l)变红; ③酚酞在碱性溶液中呈浅红色(8.2<p H<10.0)或红色(p H>10); ④甲基橙在酸性溶液(p H<3.1)中呈红色; ⑤已经被二氧化硫褪色的品红溶液在加热时会出现红色。 B、橙色世界: (1)基态:浓溴水、甲基橙试剂、B r2(C C l4)呈橙红色。 C、黄色世界: (1)基态:工业盐酸(含有Fe3+)、Au 、S(淡黄色)、Na2O2 (淡黄色)、AgBr(淡黄色)、AgI、Ag3PO4、碘水(黄色)、三硝基甲苯(黄色)、蛋白质加浓硝酸 (2)激发态:钠元素焰色呈黄色 (3)化学变化:久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄 D、绿色世界 (1)基态:F2(浅黄绿色)、Cl2(黄绿色)、Cu 2(OH)2CO3(绿色)、 CuCl2(浓溶液呈绿色)、F e S O4(浅绿色) (2)化学变化:F e(O H)2(白色)——灰绿色——F e(O H)3(红褐色)
E、青(黑)世界:F e F e O F e3O4F e S C u S A g2S M n O2石墨(灰黑) F、蓝色世界 (1)基态:C u S O4(溶液)、C u S O4·5H2O(晶体)、液氧、臭氧 (2)化学变化: ①紫色石蕊在碱性溶液(p H>8)中变蓝; ②润湿的红色石蕊试纸遇碱性气体变蓝; ③无水C u S O4(白色粉末)遇水变蓝; ④H2、H2S、C H4、C2H5O H燃烧火焰呈淡蓝色,C O燃烧火焰呈蓝色; ⑤S在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰; ⑥淀粉遇I2(a q)变蓝; ⑦C l2、B r2、N O2、O3遇湿润的淀粉碘化钾试纸变蓝。 G、紫色世界 (1)基态:K M n O4(H+)、紫色石蕊、碘单质呈紫黑色; (2)激发态:钾元素的焰色呈紫色(透过蓝色钴玻璃观察); (3)化学变化: ①I2升华生紫烟; ②N H4I受热生紫烟; ③紫色石蕊在(5.0<p H<8.0)溶液中呈紫色。 H、白色世界 (1)基态:Hg、铝粉、大多数块状金属、PbSO4、BaSO4、AgCl、BaCO3、Ba3(PO4)2、BaSO3、CaCO3、 Fe (O H)2(不稳定)、M g(O H)2、A l(O H)3等。 (2)化学变化:
元素周期表的九大规律
第七讲元素周期表和元素周期律 一、分析热点把握命题趋向 热点内容主要集中在以下几个方面:一是元素周期律的迁移应用,该类题目的特点是:给出一种不常见的主族元素,分析推测该元素及其化合物可能或不可能具有的性质。解该类题目的方法思路是:先确定该元素所在主族位置,然后根据该族元素性质递变规律进行推测判断。二是确定“指定的几种元素形成的化合物”的形式,该类题目的特点是:给出几种元素的原子结构或性质特征,判断它们形成的化合物的形式。解此类题的方法思路是:定元素,推价态,想可能,得化学式。三是由“位构性”关系推断元素,该类题目综合性强,难度较大,一般出现在第Ⅱ卷笔答题中,所占分值较高。 二.学法指导:1、抓牢两条知识链 (1)金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子失去电子的能力→元素的金属性→最高价氧化物对应水化物的碱性→单质置换水(或酸)中氢的能力→单质的还原性→离子的氧化性。 (2)非金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子获得电子的能力→元素的非金属性→最高价氧化物对应水化物的酸性→气态氢化物形成难易及稳定性→单质的氧化性→离子的还原性。
2、理解判断元素金属性或非金属性强弱的实验依据 (1)金属性强弱的实验标志 ①单质与水(或酸)反应置换氢越容易,元素的金属性越强。②最高价氧化物对应的水化物的碱性越强,元素的金属性越强。③相互间的置换反应,金属性强的置换弱的。④原电池中用作负极材料的金属性比用作正极材料的金属性强。⑤电离能 (2)非金属性强弱的实验标志 ①与氢气化合越容易(条件简单、现象明显),元素的非金属性越强。②气态氢化物越稳定,元素的非金属性越强。③最高价氧化物对应的水化物的酸性越强,元素的非金属性越强。④相互间置换反应,非金属性强的置换弱的。⑤电负性 三.规律总结: 1、同周期元素“四增四减”规律 同周期元素从左至右:①原子最外层电子数逐渐增多,原子半径逐渐减小;②非金属性逐渐增强,金属性逐渐减弱;③最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱;④非金属气态氢化物的稳定性逐渐增强,还原性逐渐减弱。 2、同主族元素“四增四减四相同”规律 同主族元素从上到下:①电子层数逐渐增多,核对外层电子的引
氧族元素知识点梳理备课讲稿
氧族元素知识点梳理
臭氧O3 1. 同素异形体:有同一种元素组成的性质不同的单质。氧气和臭氧、金刚石和石墨、S有多种同素异形体。 2. 在常温、常压下,臭氧是一种有特殊臭味的淡蓝色气体,密度比空气的大,也比氧气易溶于水。液态臭氧呈深蓝色,沸点为-112.4℃,固态臭氧呈紫黑色,熔点为-251℃。 3. 臭氧不稳定,在常温下能缓慢分解生成氧气,在高温时可以迅速分解。 2O33O2 4. 臭氧具有极强的氧化性,银、汞等在空气或氧气中不易被氧化的金属,可以与臭氧发生反应。 5. 臭氧可用于漂白和消毒。某些染料受到臭氧的强烈氧化作用会褪色,臭氧还可以杀死许多细菌,因此,它是一种很好的脱色剂和消毒剂。 6. 在空气中高压放电就能产生臭氧。 放电 3O22O3 过氧化氢H2O2 1. 过氧化氢是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性。 2. 市售双氧水中过氧化氢的质量分数一般约为30%。医疗上广泛使用稀双氧水的质量分数为3%(或更小)作为消毒杀菌剂。工业上用10%的双氧水漂白毛、丝以及羽毛等。
过氧化氢可用作氧化剂、漂白剂、消毒剂、脱氯剂等,也可作为火箭燃料,及生产过氧化物的原料。 3. 过氧化氢会分解生成水和氧气。 MnO2 2H2O22H2O + O2↑ 综合实验活动:H2O2性质研究及化学反应条件的控制 活动任务:通过实验研究H2O2的化学性质,并讨论反应条件如浓度、温度、反应介质(水溶液的酸碱性)、催化剂等对化学反应结果的影响。 任务一:研究H2O2的化学性质 通过实验研究H2O2的化学性质。 设计实验方案 1. 请你根据你对H2O2性质的了解和对H2O2中氧元素化合价的分析,预测 过氧化氢可能具有哪些化学性质。 2. 请选择具体试剂,实现上述反应关系。 可供选择的试剂:5% H2O2溶液、二氧化锰、碘化钾溶液、酸性高锰酸 钾溶液、稀硫酸
(完整版)高三一轮复习金属及其化合物知识点总结
高三化学总复习――金属及其化合物知识点总结 5.18一.金属的通性 1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非金属单质O24Na+O2=2Na2O O2+2Na Na2O2 4Al+3O22Al2O33Fe+2O2Fe3O42Cu+O2 2CuO Cl22Na+Cl22NaCl 2Al+3Cl22AlCl32Fe+3Cl22FeCl3 Cu+Cl2 CuCl2 S 2Na+S Na 2 S 2Al+3S Al2S3Fe+S FeS 2Cu+S Cu2S H2O 2Na+2H2O=2NaOH+H2↑2Al+6H 2 O 2Al(OH)3+3H2↑3Fe+4H2O Fe3O4+4H2 不反应 HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O= 2NaAlO2+3H2↑ 不反应不反应 CuSO4溶液2Na+2H2O+CuSO4= Na2SO4+Cu(OH)2↓+H2↑ 较复杂较复杂不反应 制备 2NaCl 2Na+Cl2↑2Al2O34Al+3O2↑Fe2O3+3CO 2Fe+3CO2 CuO+CO Cu+CO2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快 熔化) 是电和热的良导体 ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体) B:与氯气:2Na+Cl22NaCl; C:与S:2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2H2O=2NaOH+H2↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质
氧族元素知识点总结说课材料
2H 2 O 2===2H 2O+O 2 ↑ MnO 2 氧族元素 1.复习重点 1.氧族元素的物理性质和化学性质的递变规律; 2.硫单质、臭氧、过氧化氢、硫化氢的物理性质与化学性质; 3.重点是硫的化学性质及氧族元素性质递变规律。 2.难点聚焦 元素 氧(O ) 硫(S ) 硒(Se ) 碲(Te ) 核电荷数 8 16 34 52 最外层电子数 6 6 6 6 电子层数 2 3 4 5 化合价 -2 -2,+4,+6 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 密度 逐渐增大 与H 2化合难 易 点燃剧烈反应 加热时化合 较高温度时化合 不直接化合 氢化物稳定性 逐渐减弱 氧化物化学式 —— SO 2 SO 3 SeO 2 SeO 3 TeO 2 TeO 3 氧化物对应水化物化学式 —— H 2SO 3 H 2SO 4 H 2SeO 3 H 2SeO 4 H 2TeO 3 H 2TeO 4 最高价氧化物水化物酸性 逐渐减弱 元素非金属性 逐渐减弱 臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞 过氧化氢不稳定分解,可作氧化剂、漂白剂。 归纳知识体系。 2.1.1.与氧气有关的反应 (1)有氧气参加的反应方程式 ① 与绝大多数金属单质作用 4Na+O 2=2Na 2O
②与绝大多数非金属单质作用 ③与非还原性化合物作用 2NO+O2=2NO2 4FeS2+11O22Fe2O2+8SO2 ④与有机物作用 ⑤在空气中易被氧化而变质的物质 a.氢硫酸或可溶性硫化物:2H2S+O2=2S↓+2H2O b.亚硫酸及其可溶性盐2H2SO3+O2=2H2SO4,2Na2SO3+O2=2Na2SO4 c.亚铁盐、氢氧化亚铁4Fe(OH)2+O2+2H2O=4Fe(OH)3 d.苯酚 e.氢碘酸及其可溶性碘化物4HI+O2=2H2O+2I2 ⑥吸氧腐蚀(如:铁生锈) 负极:2Fe—4e—=2Fe2+正极:O2+4e—+2H2O=4OH—Fe2++2OH—=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O (2)生成氧气的反应方程式
化学元素化合物知识点复习
元素化合物知识点归纳 1、钠的原子结构及性质 结构 钠原子最外层只有一个电子,化学反应中易失去电子而表现出强还原性 物理性质 质软,银白色,有金属光泽的,有良好导电导热性,密度比水小,比煤油大,熔点较低 化学性质 与非金属单质 钠在常温下切开后表面变暗:4Na+O 2==2Na 2O(灰白色) 钠在氯气中燃烧,黄色火焰,白烟:2Na+Cl 2===2NaCl 与化 合物 与水反应,现象:浮,游,声,球,红2Na+2H 2O==2NaOH+H 2↑ 与酸反应,现象与水反应相似,更剧烈,钠先与酸反应,再与水反应 与盐溶液反应:钠先与水反应,生成NaOH 和H 2,再考虑NaOH 与溶液中的盐反应。如:钠投入CuSO 4溶液中,有气体放出,生成蓝色沉淀。 2Na+2H 2O+CuSO 4==Cu(OH)2+Na 2SO 4+H 2↑ 存在 自然界中只能以化合态存在 保存 煤油,使之隔绝空气和水 用途 制备钠的化合物,作强还原剂,作电光源 2、钠的氧化物比较 氧化钠 过氧化钠 化学式 Na 2O Na 2O 2 氧元素的化合价 —2 —1 色、态 白色,固态 淡黄色,固态 稳定性 不稳定 稳定 与水反应方程式 Na 2O+H 2O==2NaOH 2Na 2O 2+2H 2O==4NaOH+O 2↑ 与二氧化碳反应方程 式 Na 2O+CO 2==Na 2CO 3 2Na 2O 2+2CO 2==2Na 2CO 3+O 2 氧化性、漂白性 无 有 用途 制备NaOH 供氧剂,氧化剂,漂白剂等 3、碳酸钠和碳酸氢钠的比校 Na 2CO 3 NaHCO 3 俗名 纯碱,苏打,面碱 小苏打 色、态 白色,固态,粉末 白色,固态,晶体 水溶性 > 碱性 碱性(同浓度时,碳酸钠碱性比碳酸氢 钠碱性强,pH 值大) 碱性 热稳定性 不易分解 2NaHCO 3==Na 2CO 3+H 2O+CO 2↑ 与盐酸反应 Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ NaHCO 3+HCl==NaCl+H 2O+CO 2↑ 与氢氧化钠溶液 不反应 NaHCO 3+NaOH==Na 2CO 3+H 2O 与澄清石灰水 Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH NaHCO 3+Ca(OH)2=CaCO 3↓ +H 2O+NaOH 与二氧化碳 Na 2CO 3+H 2O+CO 2=2NaHCO 3 不反应 与氯化钙溶液 Na 2CO 3+CaCl 2=CaCO 3↓+2NaCl 不反应 点燃 △
