07第7章 热力学基础
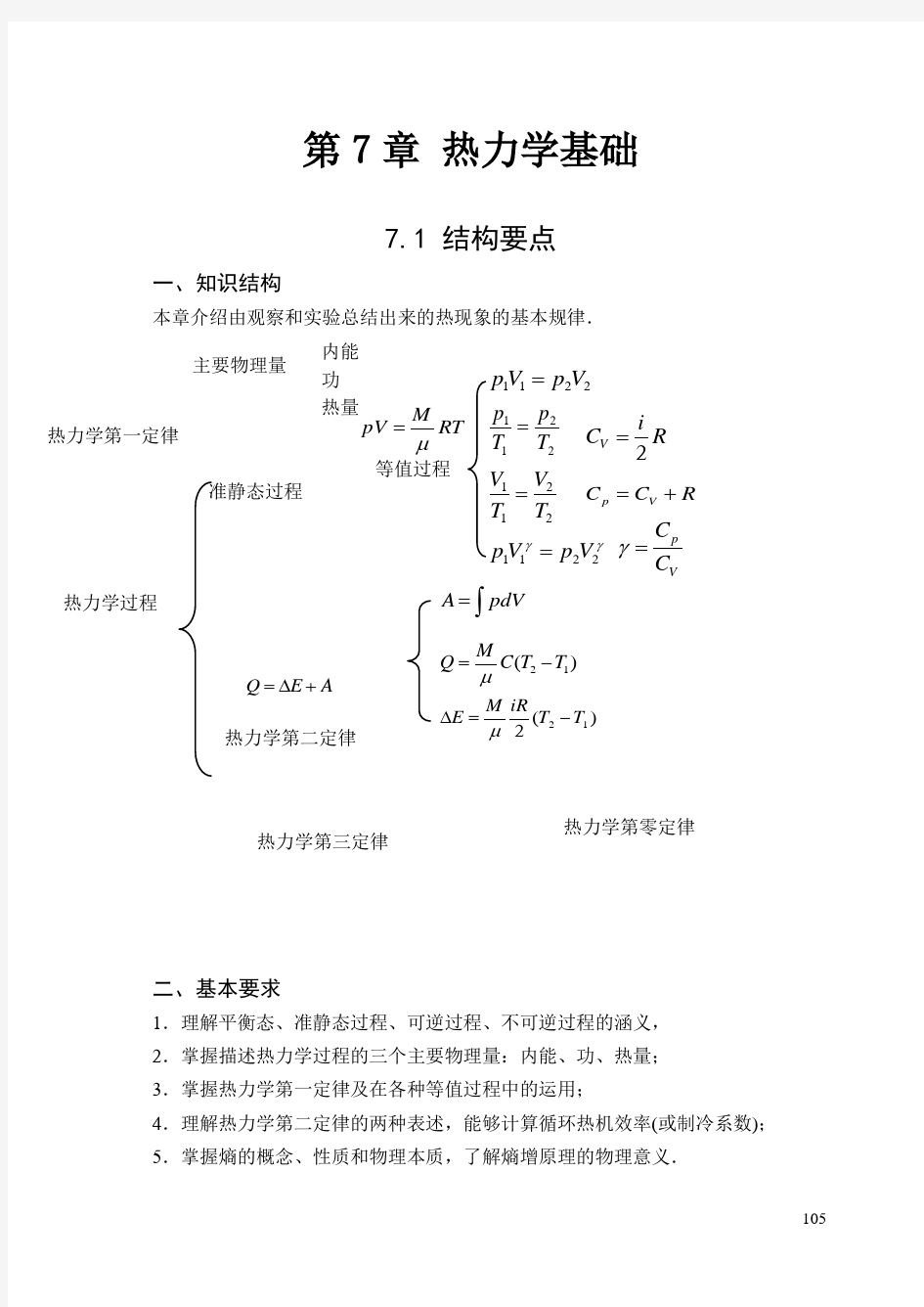

105
第7章 热力学基础
7.1 结构要点
一、知识结构
本章介绍由观察和实验总结出来的热现象的基本规律.
二、基本要求
1.理解平衡态、准静态过程、可逆过程、不可逆过程的涵义, 2.掌握描述热力学过程的三个主要物理量:内能、功、热量; 3.掌握热力学第一定律及在各种等值过程中的运用;
4.理解热力学第二定律的两种表述,能够计算循环热机效率(或制冷系数); 5.掌握熵的概念、性质和物理本质,了解熵增原理的物理意义.
热力学过程
准静态过程
等值过程
热力学第一定律
热力学第二定律
热力学第三定律 热力学第零定律
2
2
11T p T p =2
2
11T V T V =2
211V p V p =γ
γ
2
211V p V p =A
E Q +?=?=pdV
A )(2
12T T iR
M E -=
?μ)
(12T T C M
Q -=
μ
R i C V 2
=
R
C C V p +=V
p C C =
γRT
M
pV μ
=
主要物理量
内能 功 热量
106
7.2 学习指南
一、内能、功、热量
1.内能
系统内分子运动的动能、分子间相互作用的势能及分子内原子等运动的动能的总和,称为系统的内能.
内能是状态的单值函数,简称为态函数.
理想气体的内能指系统内所有分子各种动能的总和.对于质量为M 、摩尔质量为μ的理想气体,其内能为RT i M E 2
μ=。 (7—1)
理想气体的内能是温度的单值函数,即内能只与温度有关.如果温度的变化量为△T ,则其内能变化量为T R i
M E ?=
?2
μ。 (7—2) 2.功
由于体积变化,理想气体组成的系统对外界在无限小的准静态过程中所作的功为
pdV dA =,当系统体积膨胀时,d V >0,系统对
外作正功,即d A >0,当系统被压缩时,d V <0,系统对外作负功,即d A <0.
在一个有限的准静态过程中,系统的体积由V 1变为V 2时,系统对外界所作的总功为
?
=
2
1
V V p d V
A (7—3) 在p -V 图上,过程曲线下面所围成的面积代
表功的大小,如图7-1示.系统从同一初态经历不同准静态过程到达同一终态,对外所作的功不同.因此,功是一个过程量.不能离开系统的变化过程谈功.
3.热量
热量是指系统与外界发生的热交换的能量,是过程量。如果系统原来的温度为T 1,传入热量Q 后的温度为T 2,则吸收的热量为)(12T T Mc Q -=。 (7—4)
式中M 是系统的质量,c 是物质的比热.Mc 为系统温度升高(或降低)1℃所吸收(或放出)的热量,称为该系统的热容量.一摩尔物质温度升高(或降低)1℃所吸收(或放出)的热量叫该物质的摩尔热容量.如果物质的摩尔质量为μ,则摩尔热容量为
V
图7-1
p
V 1 V 2 V V +d V
107
c C μ=。
系统在热交换中吸收或放出的热量不仅与温度差有关,且随着状态变化过程而不同,升高一定温度所需的热量也不同,所以同一种气体在不同的过程中有不同的热容量.
(1)定体摩尔热容
设有一摩尔的气体,在体积不变的条件下,吸收的热量为V dQ )(,温度升高d T ,则定体摩尔热容为: R i
dT dQ C V V 2
)(==
(7—5) μ
M 摩尔理想气体在体积保持不变时,温度由T 1变为T 2
吸收的热量为
T R i
M T T C M
Q V V ?=
-=
2
)(12μμ
(7—6) (2)定压摩尔热容
设一摩尔的理想气体在压强不变的条件下,吸收的热量为p dQ )(,温度升高d T ,则定压摩尔热容为 R R i
dT
dQ C p p +=
=
2
)( (7—7) 在等压过程中,
μ
M
摩尔气体温度由T 1升高T 2,所吸收的热量为
T R i M T T C M Q p p ?+=-=)12
()(12μμ (7—8)
二、热力学第一定律
1.内容
设一个系统从外界吸收热量为Q ,同时对外界作功为A ,使系统从内能为E 1的状态(初态)变化到内能为E 2的状态(终态).则有: A E E Q +-=)(12 (7—9)
这就是热力学第一定律的表达式.它表明系统从外界吸收的热量,一部分用于改变系统的内能,另一部分用于对外作功.
对于系统状态的微小变化过程,热力学第一定律可写成d Q =d E +d A (7—10) 2. 热力学第一定律的实质
热力学第一定律是能量守恒定律在热现象中的表达形式.是自然界中一切热现象必须遵守的基本定律.
3.热量Q 、内能增量△E 和功A 在定律中的正、负号的意义 Q 为正表示系统从外界吸热,Q 为负表示系统向外界放热; △E 为正表示系统的内能增加,△E 为负表示系统的内能减少;
108
A 为正表示系统对外界作功,A 为负表示外界对系统作功. 4.适用范围
热力学第一定律适用于初、末状态确定的任何热力学系统的任何热力学过程.只需要初态和终态是平衡态,至于过程中所经历的各态并不一定是平衡态.
三、热力学第一定律对理想气体的应用
1.等体过程
系统的体积保持不变的过程,称为等体过程.
(1)等体过程的特点: V =常量(d V =0). 0=?=?dV p A
即系统对外不作功.该过程的p -V 图线为一段平行于p 轴的线段,称等体线. 热力学第一定律的表达式变为:dE dQ V =)(, Q =△E .即系统从外界所吸收的热量,全部用于增加系统的内能.
(2)有关量计算 设有
μ
M
摩尔的理想气体,定体摩尔热容为C V ,系统的温度由T 1变为T 2,则系统
内能的增量等于外界传给系统的热量:
T R i
M T T C M
Q E V V ?=
-=
=?2
)(12μμ
(7—11) 在常温下(温度低于2500K ),单原子分子R C V 23=,双原子分子R C V 2
5
=,多原子分子R C V 2
7
=
. 2.等压过程
系统的压强保持不变的过程称为等压过程. (1)等压过程的特点: p =常量(d p =0).
等压过程的p -V 图线为一段平行于V 轴的线段,称等压线.显然,在等压过程中,系统的体积必定发生变化.
热力学第一定律的表达式为pdV dE dQ p +=)(,)(12V V p E Q p -+?= (2)有关量计算
对外作功:T R M
V V p dV p A V V ?=
-=?=?μ
)(122
1. (7—12)
109
如果V 2>V 1,则A >0;如果V 2<V 1,则A <0. 热量: )(12V V p E Q p -+?=
T R i
M T T C M
p ?+=
-=
)12
()(12μμ
(7—13) 3.等温过程
系统的温度保持不变的过程称为等温过程. (1)等温过程的特点:T =常量,即d T =0. 系统的内能不变,即△E =0.
该过程的p -V 图线为一段双曲线,如图7-2所示,称等温线.等温线下的面积在量值上等于系统对外界所作的功.
热力学第一定律的表达式变为dA dQ T =)(,Q =A ,即在等温变化过程中,系统从外界吸收的热量全部用于对外作功,其内能不变.
作功有两种可能:当V 1<V 2即体积膨胀,系统从外界吸热对外作功;当V 1>V 2即体积被压缩时,外界对系统作功,系统向外界放热.
(2)有关量计算
设系统在等温过程中的温度为T ,初、末态体积、压强分别为V 1、p 1和V 2、p 2,则系统对外界所作的功等于所吸收的热量.
2
112ln ln 2
1
21
p p RT M
V V RT M V dV RT
M
pdV Q A V V V V T μμμ
=====?
? (7—14) 当等温膨胀时,Q T 、A 为正,表明系统是吸热,同时对外作功;当等温压缩时,Q T 、A 为负,表明外界对系统作功,同时系统对外放热.
4.绝热过程
系统在整个过程中始终不和外界交换热量,这样的过程称为绝热过程.
绝热过程是理论研究中建立的一种理想化模型.在实际问题中,绝热过程是不可能的,但是,许多实际情况,可近似当作绝热过程处理.
(1)绝热过程的特点
V
图7-2
V 1 V 2 V V +d V V
图7-3
110
系统与外界无热交换,d Q =0,Q =0.
热力学第一定律的形式变为d A =-d E ,A =-△E ,即系统只能依靠消耗其内能对外作功或通过外界对系统作功增加系统的内能.
其过程曲线在p -V 图上是一条比等温线要陡的曲线,称绝热线,如图7-3所示.绝热线下的面积在数值上等于绝热过程中系统所作的功.
(2)绝热方程
在绝热条件下,系统三个状态之间的关系式称系统的绝热方程.它是依据理想气体状态方程和热力学第一定律推得的.绝热方程的三种形式分别为:
=γ
pV 常量 (7—15),=-1
γTV 常量 (7—16),=-γγT
p 1
常量 (7—17)
式中i
i C C V
p 2
+=
=γ,称为气体的摩尔热容比,也称泊松比. (7—18) 上述方程可改写为γγ2211V p V p =,212111T V T V --=γγ,γ
γγγ21
2111T p T p --=
根据绝热方程=γ
pV 常量,在p -V 图上画出的曲线,就是绝热线.因为1>γ,所以绝热曲线要比等温线陡些.
(3)绝热过程中,系统内能的变化及作功的求法
内能变化量:RdT i
M dT C M
dE V 2μμ=
=
T R i
M T T C M E V ?=-=?2
)(12μμ
功的求法:由于在绝热过程中Q =0,根据热力学第一定律可知
T R i
M T T C M
E E A V ?-
=--
=--=2
)()(1212μμ
也可以根据计算功的公式求得γ
--=
11
122V p V p A
四、循环过程 卡诺循环
1.循环过程
系统由某一状态出发,经过任意的一系列过程,最后又回到原来的状态,这样的过程称为循环过程.循环过程的基本特征是△E =0.如果组成一循环过程的每一个过程都
111
是准静态过程,则此循环过程可在p -V 图上用一闭合曲线表示,如图7-4所示.按顺时针方向进行的,即沿A →B →C →D →A ,称为正循环,反之称为逆循环.
对于正循环,系统对外作的功大于外界对系统作的功.经循环过程,系统从高温热源吸收的热量,一部分变为有用功,即净功,另一部分放给低温热源,这就是热机原理.有用功与总吸热之比为该循环的效率,即
吸
放吸
放
吸吸
净Q Q Q Q Q Q A -
=-=
=
1η (7—19)
对于逆循环,外界对系统作的功大于系统对外界作的功.也就是说,在外界作功的条件下,经一逆循环之后,系统把从低温热源吸收的热量送到了高温热源,这就是致冷机原理.把系统从低温热源吸收热量Q 2与外界对系统所坐的净功A 之比称为致冷系数,即2
12
2Q Q Q A Q w -=
=
(7—20) 式中Q 1为系统向高温热源放出的热量.
2.卡诺循环
由两个等温过程和两个绝热过程组成的循环称卡诺循环,如图7-5.实现卡诺循环的条件是必须要有两个恒温热源,即高温热源和低温热源.
由热力学第一定律可知,系统对外作的净功为 A =Q 1-Q 2 所以热机的效率为
1
2
11T T T Q A -=
=
η (7—21) 通过分析,可得出如下结论:
(1)卡诺循环的效率只由高温热源和低温热源的温度决定.
(2)T 1越大,T 2越小,则效率η越高.因此除了减少损耗外,提高热机效率的有效途径是尽量设法增大高温热源和低温热源的温差.
(3)因为T 1不可能无限大,T 2不可能达到绝对零度,所以热机效率η不可能达到100%.即不可能把由高温热源所吸收的热量全部用来对外作功.
V
图7-5
V
图7-4
112
五、热力学第二定律
热力学第二定律也是关于内能和其他形式能量相互转化的规律,但它是独立于热力学第一定律的一条基本定律,它主要用于解决与热现象有关的过程的进行方向问题.
1. 可逆过程与不可逆过程
一个系统,由某一状态出发,经过某一过程到达另一状态,如果存在另一过程,它能使系统和外界完全复原(即系统回到原来的状态,同时消除了原来过程对外界引起的一切影响),则原来的过程称为可逆过程.反之,如果用任何方法都不能使系统和外界完全复原,称为不可逆过程。实际上,只要是无摩擦的准静态过程,都是可逆过程.封闭系统内进行的自发过程就不是可逆过程.
2. 热力学第二定律的两种表述
开尔文表述:不可能从单一热源吸收热量,使之完全变为有用功而不产生其他影响. 克劳修斯表述:不可能把热量从低温物体传到高温物体,而不产生其他影响. 两种表述实质上是等效的. 3. 热力学第二定律的实质
热力学第二定律的实质是,它指出一切与热现象有关的实际过程都是不可逆的. 4. 热力学第二定律的统计意义
热力学第二定律的统计意义是:一个不受外界影响的“孤立系统”,其内部发生的过程,总是由几率小的状态向几率大的状态进行,由包含微观状态数目少的宏观状态向包含微观状态数目多的宏观状态进行.
总之,热力学第一定律说明过程必须满足能量守恒定律,而热力学第二定律则说明过程能否实现.在热力学中,热力学第一定律和热力学第二定律是相辅相成的,缺一不可,都是非常重要的.
六、熵 熵增加原理
1. 态函数熵
系统由初态a 经和末态b 构成的任意可逆循环过程,其积分?
b
a
T
dQ
的值与a 、b 之间经历的过程无关,只由始末两个状态决定,称状态函数
T
dQ
为熵,以S 表示,则: ?
=-b
a
a b T
dQ
S S (7—22) 式中b a S S 、为系统在平衡态b a 、的熵,积分路线对应于从a 到b 的任意可逆过
113
程。
对于不可逆微变化过程,则有:
T
dQ
<dS 即:在可逆微变化过程中,熵的增量等与系统的热温比;在不可逆微变化过程中,这个值小于熵的增量。
2. 熵增加原理
?
≥
-b
a
a b T dQ S S 即:0≥≥dS T
dQ
dS 或 (7—23) 表明:当系统从一平衡态经绝热过程到达另一平衡态时,它的熵永不减少;在可逆绝热过程中熵不变;在不可逆绝热过程中熵增加——熵增加原理。
任意的孤立系统的熵永不减少。
七、热力学第零定律和热力学第三定律
7.3 解题指导
一、热力学第一定律的应用
抓住一个公式A E Q +?=、记住一个方程RT M
pV μ
=
、确定一个关系(等体、
等压、等温和绝热)、得到一个表达:)(12T T C M Q -=μ
,?=
pdV
A ,
)(12T T C M
E V -=
?μ
、记住三个关系:R i
C V 2
=
,R C C V p +=,V p C C =γ. 例7.1 1mol 氧气,温度为300K 时,体积为2×10-3m 3.试计算下列两过程中氧气所作的功和吸收的热量:
(1)绝热膨胀至体积为20×10-3m 3;
(2)等温膨胀至体积为20×10-3m 3,然后再等体冷却,直到温度等于绝热膨胀所达到的温度为止.
解:(1)将氧气视为理想气体.由题意知:=μ
M
1mol ,T 1=300K ,V 1=2×10-3m 3,
V 2=20×10-3m 3.
114
系统由状态1绝热膨胀至状态2,在p -V 图中画出其绝热线1→2,如图7-6所示. 根据绝热过程的特征,氧气在此过程中吸收的热量为零,即Q 12=0
由热力学第一定律Q =△E +A 得
)(212112T T C M
E A V -=
?-=μ
其中C V 为氧气的定体摩尔热容量,R C V 2
5
=.T 2为
未知量,为求出T 2,根据绝热过程方程
1221
11--=γγV T V T ,得 1
21
12-???
? ??=γV
V T T
40.1==V
p C C γ.所以此过程中氧气所作的功为
???
????????? ??-=-1
21111225
γμV V T T R M A )(1075.3102010230030031.82513
1
40.133J ?=???
????????? ?????-???=--- (2)由题意,系统经历等温过程和等体过程,在p -V 图上画出其过程曲线1→2’→2如图7-6所示.
在等温过程(1→2’)中,因温度不变,即△T =0,所以系统的内能增量,△E =0,由热力学第一定律1
21'12'12ln
V V RT M
Q A μ
=
= )(1074.51021020ln 30031.813
33J ?=?
??
? ???????=-- 在等体过程(2’→2)中,因为△V =0,所以气体对外作功为零,即A 2’2=0由热力学第一定律,则在此过程(2’→2)中系统吸收的热量
)(1075.3)(32121'222'2J T T C M
E E Q V ?-=--
=?=?=μ
V
图7-6
p 112
115
负号表示系统放热.
因此,在过程1→2’→2中,系统吸收的热量为
Q 12’2=Q 12’+Q 2’2 =5.74×103+(-3.75×103)=1.99×103(J ) 系统所作的功为A 12’2=A 12’= 5.74×103(J )
例7.2 比热γ=1.40的理想气体,进行如图7-7所示的ABCA 循环,状态A 的温度为300K .(1)求状态B 、C 的温度;(2)计算各过程中气体所吸收的热量、气体所作的功和气体内能的增量.
解:(1)C →A 过程为等体过程,有C
C A A T p T p
=
所以 K p p T T A C A C 75400100300=?=???
?
??= B →C 过程为等压过程,有
C
C
B B T V T V = 所以 K V V T T
C B
C B 2252675=?=???
?
??= (2)由理想气体状态方程可知气体的摩尔数
)(321.0300
31.82
400mol RT V p M
A A A =??==
μ
由γ=1.40可知气体为双原子气体,故R C V 25=
,R C p 2
7= C →A 为等体吸热过程:A CA =0
)(C A V AC CA T T C M
E Q -=
?=μ
=0.321×
2
5
×8.31×(300-75)=1500(J ) B →C 为等压压缩过程:
400)62(100)(-=-?=-==?B C B V V BC V V p pdV A C
B
(J )
图7-7
2
V (m 3)
6
4
116
1000)22575(31.825
321.0)(-=-???=-=
?B C V CB T T C M
E μ(J ) 1400)1000(400-=-+-=+?=BC CB BC A E Q (J )
A →
B 为一般膨胀过程:
A →
B 过程中气体所作的功就等于过程曲线下的面积.所以
1000)26()100400(21
=-?+=
AB A (J ) 500)300225(31.82
5
321.0)(-=-???=-=
?A B V BA T T C M
E μ(J ) 5001000500=+-=+?=AB BA AB A E Q (J )
二、热机效率的计算
热机效率的计算公式为吸
净Q A =
η,即热机效率η等于工作物质在一个循环过程中所
作的净功A 净与整个循环中吸收的总热量Q 吸之比.因为在热机循环中,净功A 净等于在整个循环中吸收的总热量与放出的总热量之差,即A 净=Q 吸-Q 放,所以热机效率公式也可写为吸
放Q Q -
=1η
运用上式计算热机效率可避免净功的计算,只需计算Q 放与Q 吸之比.这对于计算含有绝热过程的热机效率尤其方便.
例7.3 一定量的理想气体所经历的循环过程如图7-8所示,其中AB 和CD 为等压过程,BC 和DA 为绝热过程.(1)试问该循环过程是热机还是致冷机?(2)若已知B 点和C 点的温度分别为T B 和T C ,求热机效率或致冷系数.
解:(1)从p -V 图中可见,此循环为顺时针循环,即正循环,显然作这种循环的是热机.
(2)在整个循环过程中,只有等压膨胀过程AB 吸热,等压压缩过程CD 放热,则一个循环中吸收总热量为
V
图7-8
117
)(A B p T T C M
Q -=
μ
吸
放出的总热量为 )(D C p T T C M
Q -=μ
放
根据热机效率公式有
A
B D
C A B p
D C p T T T T T T C M
T T C M
Q Q ---
=---
=-
=1)
()
(11μ
μ
η吸
放 (1) 根据等压过程方程有
A B A B T T V V = (2), C
D C D T T
V V = (3) 根据绝热过程方程有 11
--=γγB B C
C V T V T (4), 1
1--=γγA A D D V T V T (5)
联立(2)~(5)解得C B A D T T T T =,将其代入(1)得:B
C A B C
B
A
C T T T T T T T T -=--
-=11η 三、热力学综合题
例7.4 有1mol 的单原子理想气体,作如图7-9所示的循环过程.求(1)A 、B 、C 各点的温度;(2)循环过程的净功;(3)循环效率.
解:(1)以理想气体为研究对象,根据理想气体状态方程A A A RT M
V p μ
=
可得
31.8110
4.2210013.13
5
????==
-R
M V p T A A A μ
=273(K )
同理可得:54631.81104.2210013.123
5=?????==-R
M V p T B B B μ
(K )
图7-9
22.4
33.6 2 1
3
)
118
82031.81106.3310013.123
5=?????==-R
M V p T C C C μ
(K )
(2)循环过程的净功可用图7-9中的矩形ABCD 的面积表示,故净功为
)(A B A B V V p p A -?-=)(净
33
5
1013.110
)4.226.33(10013.11?=?-???=-(J )
(3)在整个循环过程中,只有等体升压过程AB 和等压膨胀过程BC 吸收热量,故吸收的总热量为
)()(B C p A B V T T C M
T T C M
Q -+
-=
μ
μ
吸
31009.9)546820(31.82
5
1)273546(31.8231?=-???+-???
=(J ) 根据热机循环效率公式得
%4.121009.91013.13
3=??==
吸
净Q A η 例7.5 1mol 双原子分子理想气体,作如图7-10所示的可逆循环过程,其中1→2为直线,2→3为绝热线,3→1为等温线,已知状态1的温度为T 1,且T 2=2T 1,V 3=8V 1.试求:
(1)各过程的功、内能增量和传递的热量(用T 1和已知常数表示);
(2)此循环的效率.
解:(1)1→2为任意过程.其内能变化为
1121212
5
)2()(RT T T C T T C M
E V V =
-=-=
?μ
对外所作的功为过程线下的面积
112112212
12121)(21RT RT RT V p V p A =-=-=
由热力学第一定律,吸收的热量为
图7-10
V 1
V 2 p 2 p 1
V 3
119
11111132
1
25RT RT RT A E Q =+=
+?= 2→3为绝热膨胀过程.其吸收的热量为零,即Q 2=0 内能的改变为 1212322
5
)()(RT T T C T T C M
E V V -=-=-=?μ 负号表示内能减少.
对外作功为 1222
5
RT E A =
?-= 3→1为等温压缩过程.其内能改变为零,即ΔE 3=0. 对外作功为 11
11131308.2)8ln()ln(
RT V V
RT V V RT A -=-=-= 吸收的热量为 13308.2RT A Q -==
(2)循环效率 %7.30308.21111
1
1
3=-
=-
=-
=RT RT Q Q Q Q 吸
放η
7.4检测练习(一)
一、选择题
1.关于可逆过程和不可逆过程的判断: (1)可逆热力学过程一定是准静态过程. (2)准静态过程一定是可逆过程.
(3)不可逆过程就是不能向相反方向进行的过程. (4)凡有摩擦的过程,一定是不可逆过程.
以上四种判断,其中正确的是: ( )
A .(1)、(2)、(3)
B .(1)、(2)、(4)
C .(2)、(4)
D .(1)、(4)
2.理想气体经历如图7-11所示的abc 平衡过程,则该系统对外作功,从外界吸收的热量Q 和内能的增量ΔE 的正负情况正确的是: ( )
A .ΔE >0,Q >0,A <0
B .ΔE >0,Q >0,A >0
C .ΔE >0,Q <0,A <0
D .Δ
E <0,Q <0,A >0
120
3.如图7-12,一定量的理想气体,由平衡状态A 变到平衡状态B (p A =p B ),则无论经过的是什么过程,系统必然 ( )
A .对外作正功
B .内能增加
C .从外界吸热
D .向外界放热 4.如图7-13,理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为S 1和S 2,则二者的大小关系是: ( )
A .S 1>S 2
B .S 1=S 2
C .S 1<S 2
D .无法确定
5.某理想气体分别进行了如图7-14所示的两个卡诺循环:Ⅰ(abcda )和Ⅱ(a ’b ’c ’d ’a ’),且两条循环曲线所围面积相等,设循环Ⅰ的效率为η,每次循环在高温
热源处吸收的热量为Q ,循环Ⅰ的效率为η’,每次循环在高温处收的热量为Q ’,则 ( )
A .η<η’,Q <Q ’
B .η<η’,Q >Q ’
C .η>η’,Q <Q ’
D .η>η’,Q >Q ’ 6.如图7-15,一定量的理想气体经历acb
过程时吸热200J ,则经历acbda 过程时,吸热为:
( )
p
o
V
图7-11
a
c
b
p
o
V
图7-12
? A
? B
V
图7-13
图7-14
V
图7-15
A.-1200J
B.-1000J
C.-700J
D.1000J
7.对于理想气体来说,在下列过程中,哪个过程系统吸收的热量、内能的增量和对外作的功三者均为负值?()
A.等容降压过程B.等温膨胀过程
C.绝热膨胀过程D.等压压缩过程
8.同下列两种方法(1)使高温热源的温度T1升高ΔT;(2)使低温热源的温度T2降低同样的ΔT值,分别可使卡诺循环的效率升高Δη1和Δη2,两者相比:()
A.η1<Δη2B.Δη1<Δη2C.Δη1=Δη2D.无法确定
9.在温度分别为327℃和27℃的高温热源和低温热源之间工作的热机,理论上的最大效率为()A.25%B.50%C.75%D.91.74%
10.根据热力学第二定律,下列表述正确的是:()A.功可以全部转换为热,但热不能全部转换为功
B.热可以从高温物体传到低温物体,但不能从低温物体传到高温物体
C.不可逆过程就是不能向相反方向进行的过程
D.一切自发过程都是不可逆过程
11.有人设计一台卡诺热机(可逆的),每循环一次可从400K的高温热源吸热1800J,向300K的低温热源放热800J,同时对外作功1000J,这样的设计是:
A.可行,符合热力学第一定律()B.可行,符合热力学第二定律
C.不行,卡诺循环所作的功不能大于向低温热源放出的热量
D.不行,这个热机的效率超过理论值
二、填空题
1.如图7-16 所示,已知图中不同斜线的两部分分别为S1和S2,那么(1)如果气体的膨胀过程为a-1-b,则气体对外作功A=;(2)如果气体进行a-2-b-1-a的循环过程,则它对外作功A=.
121
122
2.如图7-17所示,一定量的理想气体经历a →b →c 过程,在此过程中气体从外界吸收热量Q ,系统内能变化ΔE ,请在以下空格内填上>0或<0或=0:
Q , ΔE .
3.常温常压下,一定量的某种理想气体(可视为刚性分子自由度为i ),在等压过程中吸热为Q ,对外作功为A ,内能增加ΔE ,则
=Q A ;=?Q
E
. 4.一个处于平衡态A 的热力学系统,若经准静态等容过程变到平衡态B ,它从外界吸收热量为416J ;若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,它从外界吸收热量为582J .那么,从平衡态A 变到平衡态C 的准静态等压过程中系统对外界所作的功为 .
5.如图7-18,1mol 单原子理想气体,从状态Ⅰ(p 1V 1T 1)变化至状态Ⅱ(p 2V 2T 2),则此过程气体对外作功为 ,吸收热量为 .
6.一定量理想气体,从A 状态(2p 1,V 1)经历如图7-19所示的直线过程变到B 状态(p 1,2V 1),则AB 过程中系统作功A = ;内能改变ΔE = 。
7.气体经历如图7-20所示的一个循环过程,在这个循环中,外界传给气体的净热量是 .
图7-16
o
图7-17
图7-19
图7-18
2V 1
2V 1
3) 1
4
图7-20
123
8.热力学第二定律的开尔文表述和克劳修斯表述是等价的,表明在自然界中与热现象有关的实际宏观过程都是不可逆的,开尔文表述指出了 的过程是不可逆,而克劳修斯表述指出了 的过程是不可逆.
三、计算题
1.如图7-21,一定量的单原子分子理想气体,从初态A 出发,沿图示直线过程变到另一状态B ,又经过等体、等压两过程回到状态A .
(1)求A →B ,B →C ,C →A 各过程中系统对外所作的功A ,内能的增量ΔE 以及所吸收的热量Q .
(2)整个循环过程中系统对外所作的总功以及从外界吸收的总热量(各过程吸收的代数和).
2.2mol 氢气(视为理想气体)开始时处于标准状态,后经等温过程从外界吸取了400J 的热量,达到末态,求末态的压强.
3.如图7-22所示,abcda 为1mol 单原子理想气体的循环过程,求:
(1)气体循环一次,在吸热过程中从外界共吸收的热量;
(2)气体循环一次对外作的净功; (3)证明T a T c =T b T a .
4.如图7-23所示,有一定量的理想气体,从初态a (p 1,V 1)开始,经过一个等体过程达到压强为
4
1
p 的b 态,再经过一个等压过程达到状态c ,最后经等温过程而完成一个循环,求该循环过程中系统对外作的功A 和所吸收的热量Q .
检测练习题(二)
一、选择题
1.一物质系统从外界吸收一定的热量,则 ( ) A .系统的内能一定增加 B .系统的内能一定减少
2
V (10-3m 3)
o
3 1 1
2
图7-21
2
V (10-3m 3)
o
1
2
3 图7-
22
V
V 1
图7-23
124
C .系统的内能一定保持不变
D .系统的内能可能增加,也可能减少或不变 2.氮、氦、水蒸气(均视为理想气体),它们的摩尔数相同,初始状态相同,若使它们在体积不变情况下吸收相等的热量,则 ( )
A .温度升高相同,压强增加相同
B .温度升高相同,压强增加不相同
C .温度升高不相同,压强增加不相同
D .温度升高不相同,压强增加相同 3.“理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外作功.”对此说法,有如下几种评论,哪种是正确的? ( )
A .不违反热力学第一定律,但违反热力学第二定律
B .不违反热力学第二定律,但违反热力学第一定律
C .不违反热力学第一定律,也不违反热力学第二定律
D .违反热力学第一定律,也违反热力学第二定律
4.如图7-24,一定量的理想气体,从a 态出发经过①或②过程到达b 态,acb 为等温线,则①、②两过程中外界对系统传递的热量Q 1、Q 2是 ( )
A .Q 1>0,Q 2>0
B .Q 1<0,Q 2<0
C .Q 1>0,Q 2<0
D .Q 1<0,Q 2>0
5.如图7-25,一定量的理想气体分别由初态a 经①过程ab 和由初态a ’经②过程a ’cb 到达相同的终态b ,如图p -T 图所示,则两个过程中气体从外界吸收的热量Q 1、Q 2的关系为 ( )
A .Q 1<0,Q 1>Q 2
B .Q 1>0,Q 1>Q 2
C .Q 1<0,Q 1<Q 2
D .Q 1>0,Q 1<Q 2
6.设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在一次卡诺循环中,传给低温热源的热量是从高温热源吸取的热量的 ( )
o
图7-24
o
图7-25
第七章、统计热力学基础习题和答案
统计热力学基础 一、选择题 1. 下面有关统计热力学的描述,正确的是:( ) A. 统计热力学研究的是大量分子的微观平衡体系 B. 统计热力学研究的是大量分子的宏观平衡体系 C. 统计热力学是热力学的理论基础 D. 统计热力学和热力学是相互独立互不相关的两门学科B 2. 在研究N、V、U有确定值的粒子体系的统计分布时,令刀n i = N,刀n i & i = U , 这是因为所研究的体系是:( ) A. 体系是封闭的,粒子是独立的 B 体系是孤立的,粒子是相依的 C. 体系是孤立的,粒子是独立的 D. 体系是封闭的,粒子是相依的C 3. 假定某种分子的许可能级是0、&、2 £和3 &,简并度分别为1、1、2、3四个这样的分子构成的定域体系,其总能量为3£时,体系的微观状态数为:() A. 40 B. 24 C. 20 D. 28 A 4. 使用麦克斯韦-波尔兹曼分布定律,要求粒子数N 很大,这是因为在推出该定律时:( ) . 假定粒子是可别的 B. 应用了斯特林近似公式 C. 忽略了粒子之间的相互作用 D. 应用拉氏待定乘因子法A 5. 对于玻尔兹曼分布定律n i =(N/q) ? g i ? exp( - £ i/kT)的说法:(1) n i是第i能级上的粒子分布数; (2) 随着能级升高,£ i 增大,n i 总是减少的; (3) 它只适用于可区分的独立粒子体系; (4) 它适用于任何的大量粒子体系其中正确的是:( ) A. (1)(3) B. (3)(4) C. (1)(2) D. (2)(4) C 6. 对于分布在某一能级£ i上的粒子数n i,下列说法中正确是:() A. n i 与能级的简并度无关 B. £ i 值越小,n i 值就越大 C. n i 称为一种分布 D. 任何分布的n i 都可以用波尔兹曼分布公式求出B 7. 15?在已知温度T时,某种粒子的能级£ j = 2 £ i,简并度g i = 2g j,则「和£ i上 分布的粒子数之比为:( ) A. 0.5exp( j/2£kT) B. 2exp(- £j/2kT) C. 0.5exp( -£j/kT) D. 2exp( 2 j/k£T) C 8. I2的振动特征温度? v= 307K,相邻两振动能级上粒子数之n(v + 1)/n(v) = 1/2的温度是:( ) A. 306 K B. 443 K C. 760 K D. 556 K B 9. 下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:( ) A. S、G、F、C v B. U、H、P、C v C. G、F、H、U D. S、U、H、G B 10. 分子运动的振动特征温度?v是物质的重要性质之一,下列正确的说法是: ( ) A. ? v越高,表示温度越高 B. ?v越高,表示分子振动能越小 C. ?越高,表示分子处于激发态的百分数越小 D. ?越高,表示分子处于基态的百分数越小 C 11. 下列几种运动中哪些运动对热力学函数G与
第七章、统计热力学基础习题和答案
统计热力学基础 题 择 一、选 1. 下面有关统计热力学的描述,正确的是:( ) A. 统计热力学研究的是大量分子的微观平衡体系 B. 统计热力学研究的是大量分子的宏观平衡体系 C. 统计热力学是热力学的理论基础 D. 统计热力学和热力学是相互独立互不相关的两门学科B 2.在研究N、V、U 有确定值的粒子体系的统计分布时,令∑n i = N,∑n iεi = U, 3.这是因为所研究的体系是:( ) A. 体系是封闭的,粒子是独立的 B 体系是孤立的,粒子是相依的 C. 体系是孤立的,粒子是独立的 D. 体系是封闭的,粒子是相依的 C 4.假定某种分子的许可能级是0、ε、2ε和3ε,简并度分别为1、1、2、3 四个这样的分子构成的定域体系,其总能量为3ε时,体系的微观状态数为:( ) A. 40 B. 24 C. 20 D. 28 A 5. 使用麦克斯韦-波尔兹曼分布定律,要求粒子数N 很大,这是因为在推出该定律 6.时:( ) . 假定粒子是可别的 B. 应用了斯特林近似公式 C. 忽略了粒子之间的相互作用 D. 应用拉氏待定乘因子法 A 7.对于玻尔兹曼分布定律n i =(N/q) ·g i·exp( -εi/kT)的说法:(1) n i 是第i 能级上的 粒子分布数; (2) 随着能级升高,εi 增大,n i 总是减少的; (3) 它只适用于可区分的独 8.立粒子体系; (4) 它适用于任何的大量粒子体系其中正确的是:( ) A. (1)(3) B. (3)(4) C. (1)(2) D. (2)(4) C 9.对于分布在某一能级εi 上的粒子数n i ,下列说法中正确是:( ) 10.A. n i 与能级的简并度无关 B. εi 值越小,n i 值就越大 C. n i 称为一种分布 D.任何分布的n i 都可以用波尔兹曼分布公式求出 B 11. 15.在已知温度T 时,某种粒子的能级εj = 2εi,简并度g i = 2g j,则εj 和εi 上分布的粒子数之比为:( ) A. 0.5exp( j/2εk T) B. 2exp(- εj/2kT) C. 0.5exp( -εj/kT) D. 2exp( 2 j/kεT) C 12. I2 的振动特征温度Θv= 307K,相邻两振动能级上粒子数之n(v + 1)/n(v) = 1/2 的温度 13.是:( ) A. 306 K B. 443 K C. 760 K D. 556 K B 14.下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:( ) A. S、G、F、C v B. U、H、P、C v C. G、F、H、U D. S、U、H、G B 15. 分子运动的振动特征温度Θv 是物质的重要性质之一,下列正确的说法是: ( ) A.Θv 越高,表示温度越高 B.Θv 越高,表示分子振动能越小 C. Θv 越高,表示分子处于激发态的百分数越小 D. Θv 越高,表示分子处于基态的百分数越小 C 16.下列几种运动中哪些运动对热力学函数G 与A 贡献是不同的:( ) A. 转动运动 B. 电子运动 C. 振动运动 D. 平动运动 D 17.三维平动子的平动能为εt = 7h 2 /(4mV2/ 3 ),能级的简并度为:( )
统计热力学基础复习整理版汇总
统计热力学基础 一、单选题 1) 统计热力学主要研究(A )。 (A) 平衡体系(B) 近平衡体系(C) 非平衡体系(D) 耗散结构(E) 单个粒子的行为 2) 体系的微观性质和宏观性质是通过( C)联系起来的。 (A) 热力学(B) 化学动力学(C) 统计力学(D) 经典力学(E) 量子力学 3) 统计热力学研究的主要对象是:( D) (A) 微观粒子的各种变化规律(B) 宏观体系的各种性质 (C) 微观粒子的运动规律(D) 宏观系统的平衡性质 (E) 体系的宏观性质与微观结构的关系 4) 下述诸体系中,属独粒子体系的是:(D ) (A) 纯液体(B) 理想液态溶液(C) 理想的原子晶体(D) 理想气体(E) 真实气体 5) 对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:(B ) (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论(D) 统计学原理(E) 能量均分原理 6) 在台称上有7个砝码,质量分别为1g、2g、5g、10g、50g、100g,则能够称量的质量共有:(B ) (A) 5040 种(B) 127 种(C) 106 种(D) 126 种 7) 在节目单上共有20个节目序号,只知其中独唱节目和独舞节目各占10个,每人可以在节目单上任意挑选两个不同的节目序号,则两次都选上独唱节目的几率是:(A ) (A) 9/38 (B) 1/4 (C) 1/180 (D) 10/38 8) 以0到9这十个数字组成不重复的三位数共有(A ) (A) 648个(B) 720个(C) 504个(D) 495个 9) 各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:(B ) (A)?ε t > ?ε r > ?ε v > ?ε e(B)?ε t < ?ε r < ?ε v < ?ε e (C) ?ε e > ?ε v > ?ε t > ?ε r(D)?ε v > ?ε e > ?ε t > ?ε r (E)?ε r > ?ε t > ?ε e > ?ε v 10) 在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:(C ) (A) 气体和晶体皆属定域子体系(B) 气体和晶体皆属离域子体系 (C) 气体属离域子体系而晶体属定域子体系(D) 气体属定域子体系而晶体属离域子体系 11) 对于定域子体系分布X所拥有的微观状态t x为:( B)
物理化学答案——第六章-统计热力学
第六章 统计热力学基础 内容提要: 1、 系集最终构型: 其中“n*”代表最可几分布的粒子数目 2.玻耳兹曼关系式: 玻耳兹曼分布定律: 其中,令 为粒子的配分函数。玻耳兹曼分布定律描述了微观粒子能量分布中最可几的分布方式。 3、 系集的热力学性质: (1)热力学能U : (2)焓H : **ln ln ln ! i n i m i i g t t n ≈=∏ 总2,ln ( )N V Q U NkT T ?=?i i i Q g e βε-=∑ *i i i i i i i i n g e g e N g e Q βεβεβε---==∑ m ln ln S k t k t ==总
(3)熵S : (4)功函A : (5)Gibbs 函数G : (6)其他热力学函数: 4、粒子配分函数的计算 (1)粒子配分函数的析因子性质 粒子的配分函数可写为: ,ln ln ln ()m N V S k t Q Q Nk NkT Nk N T =?=++? (i) t v e n r kT i i kT kT kT kT kT t r v e n t r v e n t r v e n Q g e g e g e g e g e g e Q Q Q Q Q εεεεεε------===∑∑∑∑∑∑2,ln N V Q H U pV NkT NkT T ??? =+=+ ????ln Q A NkT NkT N =--ln Q G NkT N =-() 22 ln ln ln ln V V U Q Q C Nk Nk T T T ????? ==+ ??????
第七章 统计热力学基础
第七章统计热力学基础 一、选择题 1、统计热力学主要研究()。 (A) 平衡体系(B)单个粒子的行为案(C) 非平衡体系(D) 耗散结构 2、能量零点的不同选择,在下面诸结论中哪一种说法是错误的:( ) (A) 影响配分函数的计算数值(B) 影响U,H,F,G 的数值 (C) 影响Boltzmann分布数N 的数值(D) 影响能级能量εi的计算数值 3、最低能量零点选择不同,对哪些热力学函数值无影响:( ) (A) U (B) S (C) G (D) H 4、统计热力学研究的主要对象是:() (A) 微观粒子的各种变化规律 (B) 宏观体系的各种性质 (C) 微观粒子的运动规律 (D) 宏观系统的平衡性质 5、对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:() (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论(D) 统计学原理 6、以0到9这十个数字组成不重复的三位数共有() (A) 648个(B) 720个(C) 504个(D) 495个 7、各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:() (A) t > r > v > e(B) t < r < v < e (C) e > v > t > r(D) v > e > t > r 8、在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:() (A) 气体和晶体皆属定域子体系 (B) 气体和晶体皆属离域子体系 (C) 气体属离域子体系而晶体属定域子体系 (D) 气体属定域子体系而晶体属离域子体系 9、对于定域子体系分布X所拥有的微观状态t x为:() (A) (B)
07第7章 热力学基础
105 第7章 热力学基础 7.1 结构要点 一、知识结构 本章介绍由观察和实验总结出来的热现象的基本规律. 二、基本要求 1.理解平衡态、准静态过程、可逆过程、不可逆过程的涵义, 2.掌握描述热力学过程的三个主要物理量:内能、功、热量; 3.掌握热力学第一定律及在各种等值过程中的运用; 4.理解热力学第二定律的两种表述,能够计算循环热机效率(或制冷系数); 5.掌握熵的概念、性质和物理本质,了解熵增原理的物理意义. 热力学过程 准静态过程 等值过程 热力学第一定律 热力学第二定律 热力学第三定律 热力学第零定律 2 2 11T p T p =2 2 11T V T V =2 211V p V p =γ γ 2 211V p V p =A E Q +?=?=pdV A )(2 12T T iR M E -= ?μ) (12T T C M Q -= μ R i C V 2 = R C C V p +=V p C C = γRT M pV μ = 主要物理量 内能 功 热量
106 7.2 学习指南 一、内能、功、热量 1.内能 系统内分子运动的动能、分子间相互作用的势能及分子内原子等运动的动能的总和,称为系统的内能. 内能是状态的单值函数,简称为态函数. 理想气体的内能指系统内所有分子各种动能的总和.对于质量为M 、摩尔质量为μ的理想气体,其内能为RT i M E 2 μ=。 (7—1) 理想气体的内能是温度的单值函数,即内能只与温度有关.如果温度的变化量为△T ,则其内能变化量为T R i M E ?= ?2 μ。 (7—2) 2.功 由于体积变化,理想气体组成的系统对外界在无限小的准静态过程中所作的功为 pdV dA =,当系统体积膨胀时,d V >0,系统对 外作正功,即d A >0,当系统被压缩时,d V <0,系统对外作负功,即d A <0. 在一个有限的准静态过程中,系统的体积由V 1变为V 2时,系统对外界所作的总功为 ? = 2 1 V V p d V A (7—3) 在p -V 图上,过程曲线下面所围成的面积代 表功的大小,如图7-1示.系统从同一初态经历不同准静态过程到达同一终态,对外所作的功不同.因此,功是一个过程量.不能离开系统的变化过程谈功. 3.热量 热量是指系统与外界发生的热交换的能量,是过程量。如果系统原来的温度为T 1,传入热量Q 后的温度为T 2,则吸收的热量为)(12T T Mc Q -=。 (7—4) 式中M 是系统的质量,c 是物质的比热.Mc 为系统温度升高(或降低)1℃所吸收(或放出)的热量,称为该系统的热容量.一摩尔物质温度升高(或降低)1℃所吸收(或放出)的热量叫该物质的摩尔热容量.如果物质的摩尔质量为μ,则摩尔热容量为 V 图7-1 p V 1 V 2 V V +d V
07章统计热力学基础(1)
第七章统计热力学基础 1. 设有一个体系,由三个定位的单维简谐振子所组成,体系能量为11/2 hν,这三个振子在三个固定的位置上振动,试求体系全部的微观状态数。 2. 当热力学体系的熵函数S增加0.418 J/K时,则体系的微观状态数增加多少?用ΔΩ/Ω1表示。 3. 对于双原子分子,证明: U r=NkT U v=NkT 设基态振动能为零,≈1+x 。 4.将N2气在电弧中加热,从光谱中观察到处于第一激发态的相对分子数 N(v=1)/N(v=0)=0.26,式中ν为振动量子数N(v=0)为基态占有的分子数,N(v=1)为第一激发振动态占有的分子数,已知N2的振动频率ν= 6.99×, (1) 计算气体温度。 (2) 计算振动能量在总能量(包括平动,转动和振动)中所占的百分数。 5.设某理想气体A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级的能量为ε,其简并度为2,忽略更高能级。 (1)写出A分子的总配分函数的表达式。 (2)设ε=kT,求出相邻两能级上最概然分子数之比n1/n0。 (3)设ε=kT,试计算1 摩尔该气体的平均能量是多少? 6.某气体的第一电子激发态比基态能量高400 kJ/mol,试计算 (1)在300 K时,第一激发态分子所占的百分数? (2)若要使激发态的分子数占10%,则需多少温度? 7.零族元素氩(Ar)可看作理想气体,相对分子量为40,取分子的基态(设其简并度为1)作为能量零点,第一激发态(设其简并度为2)与基态能量差为ε,忽略其它高能级。 (1)写出氩分子的总的配分函数表达式。 (2)设ε=5kT,求在第一激发态上最可几分布的分子数占总分子数的百分数。
第三章 统计热力学基础 (2)
第三章统计热力学基础 返回上一页 1. 设有一个体系,由三个定位的单维简谐振子所组成,体系能量为11/2 hν,这三个振子在三个固定的位置上振动,试求体系全部的微观状态数。 2. 当热力学体系的熵函数S增加0.418 J/K时,则体系的微观状态数增加多少?用ΔΩ/Ω1表示。 3. 对于双原子分子,证明:U r=NkT U v=NkT 设基态振动能为零,≈1+x 。 4.将N2气在电弧中加热,从光谱中观察到处于第一激发态的相对分子数 N(v=1)/N(v=0)=0.26,式中ν为振动量子数N(v=0)为基态占有的分子数,N(v=1)为第一激发振动态占有的分子数,已知N2的振动频率ν= 6.99×,
(1) 计算气体温度。 (2) 计算振动能量在总能量(包括平动,转动和振动)中所占的百分数。 5.设某理想气体A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级的能量为ε,其简并度为2,忽略更高能级。 (1)写出A分子的总配分函数的表达式。 (2)设ε=kT,求出相邻两能级上最概然分子数之比n1/n0。 (3)设ε=kT,试计算1 摩尔该气体的平均能量是多少? 6.某气体的第一电子激发态比基态能量高400 kJ/mol,试计算 (1)在300 K时,第一激发态分子所占的百分数? (2)若要使激发态的分子数占10%,则需多少温度?
7.零族元素氩(Ar)可看作理想气体,相对分子量为40,取分子的基态(设其简并度为1)作为能量零点,第一激发态(设其简并度为2)与基态能量差为ε,忽略其它高能级。 (1)写出氩分子的总的配分函数表达式。 (2)设ε=5kT,求在第一激发态上最可几分布的分子数占总分子数的百分数。(3)计算1 mol Ar气在标准状态下的统计熵值。设Ar 的核和电子的简并度均等于1。 8. Na原子气体(设为理想气体)凝聚成一表面膜 (1)若Na原子在膜内可自由运动(即二维平动),试写出此凝聚过程的摩尔平动熵变的统计表达式。 (2)若 Na原子在膜内不动,其凝聚过程的摩尔平动熵变的统计表达式又将如何? (要用相对原子质量Ar,体积V,表面积A,温度T等表示的表达式)
第七章 统计热力学基础
第七章统计热力学基础 一、单选题 1.统计热力学主要研究()。 (A) 平衡体系(B) 近平衡体系(C) 非平衡体系 (D) 耗散结构(E) 单个粒子的行为 2.体系的微观性质和宏观性质是通过()联系起来的。 (A) 热力学(B) 化学动力学(C) 统计力学(D) 经典力学(E) 量子力学 3.统计热力学研究的主要对象是:() (A) 微观粒子的各种变化规律(B) 宏观体系的各种性质 (C) 微观粒子的运动规律(D) 宏观系统的平衡性质 (E) 体系的宏观性质与微观结构的关系 4.下述诸体系中,属独粒子体系的是:() (A) 纯液体(B) 理想液态溶液(C) 理想的原子晶体 (D) 理想气体(E) 真实气体 5.对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:() (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论 (D) 统计学原理(E) 能量均分原理
6.在台称上有7个砝码,质量分别为1g、2g、5g、10g、50g、100g,则能够称量的质量共有:() (A) 5040 种(B) 127 种(C) 106 种(D) 126 种 7.在节目单上共有20个节目序号,只知其中独唱节目和独舞节目各占10个,每人可以在节目单上任意挑选两个不同的节目序号,则两次都选上独唱节目的几率是:() (A) 9/38 (B) 1/4 (C) 1/180 (D) 10/38 8.以0到9这十个数字组成不重复的三位数共有() (A) 648个(B) 720个(C) 504个(D) 495个 9.各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:() (A)△e t >△e r >△e v >△e e(B)△e t <△e r <△e v <△e e (C) △e e >△e v >△e t >△e r(D)△e v >△e e >△e t >△e r (E)△e r >△e t >△e e >△e v 10.在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:() (A) 气体和晶体皆属定域子体系(C) 气体属离域子体系而晶体属定域子体系 (B) 气体和晶体皆属离域子体系(D) 气体属定域子体系而晶体属离域子体系 11.对于定位系统分布X所拥有的微观状态t x为:(B) (A)(B)
热力学与统计物理课后习题答案第六章
第六章 近独立粒子的最概然分布 6.1 试根据式(6.2.13)证明:在体积V 内,在ε到d ε+ε的能量范围内,三维自由粒子的量子态数为 ()()13 2232d 2d .V D m h πεεεε= 解: 式(6.2.13)给出,在体积3V L =内,在x p 到d ,x x y p p p +到 d ,y y x p p p +到d x x p p +的动量范围内,自由粒子可能的量子态数为 3 d d d .x y z V p p p h (1) 用动量空间的球坐标描述自由粒子的动量,并对动量方向积分,可得在体积V 内,动量大小在p 到d p p +范围内三维自由粒子可能的量子态数为 2 34πd .V p p h (2) 上式可以理解为将μ空间体积元24d Vp p π(体积V ,动量球壳24πd p p )除以相格大小3h 而得到的状态数. 自由粒子的能量动量关系为 2 .2p m ε= 因此 d . p p p md ε== 将上式代入式(2),即得在体积V 内,在ε到d εε+的能量范围内,三维自由粒子的量子态数为 ()13 2232π()d 2d .V D m h εεεε= (3) 6.2 试证明,对于一维自由粒子,在长度L 内,在ε到d εε+的能量范围内,量子态数为 ()1 2 2d d .2L m D h εεεε?? = ???
解: 根据式(6.2.14),一维自由粒子在μ空间体积元d d x x p 内可能的量子态数为 d d .x x p h 在长度L 内,动量大小在p 到d p p +范围内(注意动量可以有正负两个可能的方向)的量子态数为 2d .L p h (1) 将能量动量关系 2 2p m ε= 代入,即得 ()1 2 2d d .2L m D h εεεε?? = ??? (2) 6.3 试证明,对于二维的自由粒子,在面积2L 内,在ε到d εε+的能量范围内,量子态数为 ()2 22π.L D d md h εεε= 解: 根据式(6.2.14),二维自由粒子在μ空间体积元d d d d x y x y p p 内的量子态数为 21 d d d d .x y x y p p h (1) 用二维动量空间的极坐标,p θ描述粒子的动量,,p θ与,x y p p 的关系为 cos ,sin . x y p p p p θθ== 用极坐标描述时,二维动量空间的体积元为 d d .p p θ 在面积2L 内,动量大小在p 到d p p +范围内,动量方向在θ到d θθ+范围内,二维自由粒子可能的状态数为 22 d d .L p p h θ (2)
第七章 统计热力学习题解答
第七章 习题及解答 1. 设有一个体系,由三个定位的一维简谐振子所组成,体系能量为νh 2 11,这三个振子在三个固定的位置上振动, 试求体系全部的微观状态数。 解 对振动 ν υεν h )2 1 (+=,在总能量 νεν h 2 11= 时,三个一维简谐振子可能有以下四种分布方式: (1) N 0=2, N 4=1, ν εν h 2 1 20?=, νεν h 2 94 =, 3! 2!1! 31==t (2) N 0=1, N 2=2, νεν h 2 1 10 ?=, ν εν h 2 5 22?=, 3! 2!1! 32== t (3) N 0=1, N 1=1, N 3=1, ν εν h 2 1 0=, νενh 2 31 =, νεν h 2 7 3= , 6!1!1!1!33==t (4) N 1=2, N 2=1, νεν h 2 3 21 ?=, νεν h 2 52=, 3! 2!1! 34==t Ω= t 1+t 2+t 3+t 4=3+3+6+3=15 2. 当热力学体系的熵函数S 增加0.418J ·K -1时,体系的微观状态数增加多少?用1/?ΩΩ表示。 解 S 1=kln Ω1, S 2=kln Ω2, S 2-S 1=kln(Ω2/Ω1) ln(Ω2/Ω1)=(S 2-S 1)/k =(0.418J·K -1)/(1.38×10-23J ·K -1)=3.03×1022 1/Ω?Ω=(Ω2 -Ω1 )/Ω1 =(Ω2 /Ω1 )-1≈Ω2 /Ω1 = exp(3.03×1022) 3. 在海平面上大气的组成用体积百分数可表示为:N 2(g)为0.78,O 2(g)为0.21,其他气体为0.01。设大气中各种气体都符合Bolzenmann 分布,假设大气柱在整个高度内的平均温度为220K 。试求:这三类气体分别在海拔10km ,60km 和500km 处的分压。已知重力加速度为9.8m·s -2。 解 所用公式为p=p 0e -Mgh/RT ,其中M(空气) =29g·mol -1, M(N 2)=28g·mol -1, M(O 2)=32g·mol -1, M(其它)=[M(空气)-0.78M(N 2)-0.21M(O 2)]/0.01
第三章 统计热力学基础.
第三章 统计热力学基础 思考题: 1.当系统的U ,V ,N 一定时,由于粒子可以处于不同的能级上,因而分布数不同所以系统总微观数不能确定,这句话是否正确? 2.由离域子系统和定域子系统熵与配分函数的关系可以看出,定域子系统熵比离域子系统的熵大S=klnN!,但是一般说来晶体总比同温度下气体的熵小,为什么? 3.分子能量零点的选择不同,所有热力学函数的值都要改变,对吗? 4.三维平动子第一激发态的简并度是多少?一维谐振子第一激发态的简并度是多少? 5.对于单原子理想气体在室温下的一般物理化学过程,若要通过配分函数来求过程热力学函数的变化值,只须知道g t 这一配分函数值就行了,对吗? 选择题: 1.1mol 双原子理想气体常温下热力学能为: (A)RT 23 (B) RT 25 (C) RT 2 7 (D) 无法确定 2.下列化合物中,298.15K 时标准摩尔熵ΔS 0最大的是: (A) He (B) N 2 (C) CO (D) 一样大 3.在作N 、V 、U 有确定值的粒子体系的统计分布时,令∑n i = N ,∑n i εi = U ,这是因为所研究的体系是: (A) 体系是封闭的,粒子是独立的 (B) 体系是孤立的,粒子是相依的 (C) 体系是孤立的,粒子是独立的 (D) 体系是封闭的,粒子是相依的 4.下列哪个体系不具有玻尔兹曼-麦克斯韦统计特点 : (A) 每一个可能的微观状态以相同的几率出现 (B) 各能级的各量子态上分配的粒子数,受保里不相容原理的限制 (C) 体系由独立可别的粒子组成,U = ∑n i εi (D) 宏观状态参量 N 、U 、V 为定值的封闭体系 5. HI 的转动特征温度Θr =9.0K ,300K 时HI 的摩尔转动熵为: (A) 37.45J ·K -1·mol -1 (B) 31.70J ·K -1·mol -1 (C) 29.15J ·K -1·mol -1 (D) 都不正确 6. 对于单原子分子理想气体,当温度升高时,小于分子平均能量的能级上分布的粒子数: (A) 不变 (B) 增多 (C) 减少 (D) 不能确定 7. O 2的转动惯量J = 19.3 × 10-47 kg ·m 2,则O 2的转动特征温度是: (A) 10K (B) 5K (C) 2.07K (D) 8K 8. 各种运动形式的配分函数中与压力有关的是: (A) 电子配分函数 ; (B) 平动配分函数 ; (C) 转动配分函数 ; (D) 振动配分函数 。
统计热力学
第七章统计热力学基础 热力学: 基础:三大定律 研究对象:(大量粒子构成的)宏观平衡体系 研究方法:状态函数法 手段:利用可测量量p-T-V+C p,m和状态方程 结果:求状态函数(U,H,S,G,等)的改变值,以确定变化过程所涉及的能量和方向。 但是,热力学本身无法确定体系的状态方程,需借助实验。很显然,体系的宏观热力学性质取决于其微观运动状态,是大量粒子微观运动的统计平均结果。 热力学宏观性质体系的微观运动状态 统计热力学 统计热力学: 基础:微观粒子普遍遵循的(量子)力学定律 对象:大量粒子所构成的体系的微观运动状态 工具:统计力学原理 目的:大量粒子某一性质的微观统计平均的结果(值)与系统的热力学宏观性质相关联。 7.1概述 统计热力学是宏观热力学与量子化学相关联的桥梁。通过系统粒子的微观性质(分子质量、分子几何构型、分子内及分子间作用力等),利用分子的配分函数计算系统的宏观
性质。 微观运动状态有多种描述方法: 经典力学方法是用粒子的空间位置(三维坐标)和表示能量的动量(三维动量)描述; 量子力学用代表能量的能级和波函数描述。 由于统计热力学研究的是热力学平衡系统,不考虑粒子在空间的速率分布,只考虑粒子的能量分布。这样,宏观状态和微观状态的关联就转化为一种能级分布(宏观状态)与多少微观状态相对应的问题,即几率问题。 Boltzmann给出了宏观性质—熵(S)与微观性质—热力学几率(Ω)之间的定量关系:=Ω。 S k ln 热力学平衡系统熵值最大,但是通过概率理论计算一个平衡系统的无法做到,也没有必要。因为在一个热力学平衡系统中,存在一个微观状态数最大的分布(最概然分布),摘取最大项法及其原理可以证明,最概然分布即是平衡分布,可以用最概然分布代替一切分布。因此,有了数学上完全容许的ln ln W D,max。 所以,S=k ln W D,max 这样,求所有分布的微观状态数—热力学几率的问题转化为求一种分布—最概然分布的微观状态数的问题。 波尔兹曼分布就是一种最概然分布,该分布公式中包含重要概念—配分函数。用波尔兹曼分布求任何宏观状态函数时,最后都转化为宏观状态函数与配分函数之间的定量关系。
第七章、统计热力学基础习题和答案
统计热力学基础 一、 选择题 1. 下面有关统计热力学的描述,正确的是: ( ) A. 统计热力学研究的是大量分子的微观平衡体系 B. 统计热力学研究的是大量分子的宏观平衡体系 C. 统计热力学是热力学的理论基础 D. 统计热力学和热力学是相互独立互不相关的两门学科 B 2.在研究 N 、 V 、U 有确定值的粒子体系的统计分布时,令∑ ni = N ,∑ ni εi = U , 这是因为所研究的体系是: ( ) A. 体系是封闭的,粒子是独立的 B 体系是孤立的,粒子是相依的 C. 体系是孤立的,粒子是独立的 D. 体系是封闭的,粒子是相依的 C 3.假定某种分子的许可能级是 0、 ε、2ε 和 3ε ,简并度分别为 1、 1、 2、 3 这样的分子构成的定域体系,其总能量为 3ε 时,体系的微观状态数为: ( 四个 ) A. 40 B. 24 C. 20 D. 28 A 4. 使用麦克斯韦 -波尔兹曼分布定律,要求粒子数N 很大,这是因为在推出该定律 时: () . 假定粒子 是可别的 B. 应用了斯特林近似公式 C. 忽略了粒子之间的相互作用 D. 应用拉氏待定乘因子法 A 5.对于玻尔兹曼分布定律 ni =(N/q) ·gi ·exp( -ε i /kT) 的说法: (1) n i 是 第 i 能级上的 粒子分布数 ; (2) 随着能级升高, εi 增大,ni 总是减少的 ; (3) 它只适用于可区分的独 立粒子体系 ; (4) 它适用于任何的大量粒子体系其中正确的是: ( ) A. (1)(3) B. (3)(4) C. (1)(2) D . (2)(4) C 6.对于分布在某一能级 εi 上的粒子数 ni ,下列说法中正确是: ( ) A. n i 与能级的简并度无关 B. ε i 值越小, i 值就越大 D.任何分布的 ni n C. n i 称为一种分布 都可以用波尔兹曼分布公式求出 B 7. 15.在已知温度 T 时,某种粒子的能级 εj = 2εi ,简并度 gi = 2gj ,则 ε j 和εi 上 分布的粒子数之比为: () A. 0.5exp( j /2kT)ε B. 2exp(- ε/2kT) j C. 0.5exp( -εj/kT) D. 2exp( 2 j /kT)ε C 2 的振动特征温度 Θv = 307K ,相邻两振动能级上粒子数之 n(v + 1)/n(v) = 1/2 的温度 8. I 是: () A. 306 K B. 443 K C. 760 K D. 556 K B 9.下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关: () A. S 、G 、F 、Cv B. U 、 H 、 P 、C v C. G 、F 、H 、U D. S 、U 、H 、 G B 10. 分子运动的振动特征温度 Θ v 是物质的重要性质之一,下列正确的说法是:
第七章热力学基础
第七部分热力学基础 §7-1 热力学第一定律 【基本内容】 一、热力学系统与热力学过程 热力学系统分类: 孤立系统:与外界没有任何相互作用的系统。 封闭系统:与外界没有物质交换,但有能量交换的系统。 开放系统:与外界即有物质交换又有能量交换的系统。 准静态过程(平衡过程):在热力学过程中的所有中间状态都无限接近于平衡态的过程。实际过程中, 进行得无限缓慢的过程,可视为准静态过程;反之,若过程进行较快,则视为非准静态过程。 二、热量、内能、功 1、热能和热量 热能:是系统内分子无规则运动的总动能,是状态量。 热量Q :是热能的改变量,是过程量。 规定:Q>0表示系统从外界吸收热量。Q ?0表示系统向外界放出热量。 3、功 ? = 2 1 V V PdV W 功是过程量,在P —V 图下的意义:? ==V V PdV W 1 P —V 图中,相应过程曲线下的面积。 4、系统状态变化的原因 作功:是通过物体的宏观位移完成的,宏观有序能量→微观无序能量。 传热:是通过分子之间的相互完成的,微观无序能量→微观无序能量。 三、热力学第一定律 表述一、系统从外吸收的热量等于系统内能的增量与系统对外作功之和。 dW dE dQ W E E Q +=+-=12
表述二、第一类永动机是不可能制成的。 第一类永动机是不消耗任何形式的能量(Q=0),而能循环地(ΔE=0)对外作功(W>0)的机器。 四、热容量 1、热容量 热容量C / 的定义:一个系统所吸收的热量与温升的比值,称为该系统的热容量。 dT dQ C = / 单位:J/K (1)比热:若系统的质量为单位质量,则称系统的热量为比热容,简称比热。 dT dQ M c 1= 单位:J/Kg.K ,显然:Mc C =/ (2)摩尔热容量:若系统的质量为一摩尔,则称系统的热量为摩尔热容量 。 dT dQ C ν1= 单位:J/mol.K ,显然:C C ν=/ 2、理想气体的定容、定压摩尔热容 (1)定容摩尔热容量 定义:dT dQ C V V )(1ν=,对理想气体:R i C V 2= (2)定压摩尔热量 定义:dT dQ C P P )(1ν=,对理想气体:R C C V P += (3)比热比:i i C C V P +==2γ 3、几个重要公式: dT C dQ dT C dE V V V νν==)( 1、 (1
统计热力学试题及答案
第六章统计热力学初步练习题 一、判断题: 1.当系统的U,V,N一定时,由于粒子可以处于不同的能级上,因而分布数不同,所以系统的总微态数Ω不能确定。 2.当系统的U,V,N一定时,由于各粒子都分布在确定的能级上,且不随时间变化,因而系统的总微态数Ω一定。 3.当系统的U,V,N一定时,系统宏观上处于热力学平衡态,这时从微观上看系统只能处于最概然分布的那些微观状态上。 4.玻尔兹曼分布就是最概然分布,也是平衡分布。 5.分子能量零点的选择不同,各能级的能量值也不同。 6.分子能量零点的选择不同,各能级的玻尔兹曼因子也不同。 7.分子能量零点的选择不同,分子在各能级上的分布数也不同。 8.分子能量零点的选择不同,分子的配分函数值也不同。 9.分子能量零点的选择不同,玻尔兹曼公式也不同。 10.分子能量零点的选择不同,U,H,A,G四个热力学函数的数值因此而改变,但四个函数值变化的差值是相同的。 11.分子能量零点的选择不同,所有热力学函数的值都要改变。 12.对于单原子理想气体在室温下的一般物理化学过程,若要通过配分函数来求过程热力学函数的变化值,只须知道q t这一配分函数值就行了。 13.根据统计热力学的方法可以计算出U、V、N确定的系统熵的绝对值。 14.在计算系统的熵时,用ln W B(W B最可几分布微观状态数)代替1nΩ,因此可以认为W B与Ω大小差不多。 15.在低温下可以用q r = T/σΘr来计算双原子分子的转动配分函数。 二、单选题: 1.下面有关统计热力学的描述,正确的是: (A) 统计热力学研究的是大量分子的微观平衡体系; (B) 统计热力学研究的是大量分子的宏观平衡体系; (C) 统计热力学是热力学的理论基础; (D) 统计热力学和热力学是相互独立互不相关的两门学科。 2.在统计热力学中,物系的分类常按其组成的粒子能否被辨别来进行,按此原则,下列说法正确的是: (A) 晶体属离域物系而气体属定域物系;(B) 气体和晶体皆属离域物系; (C) 气体和晶体皆属定域物系;(D) 气体属离域物系而晶体属定域物系。
第7章 热力学基础答案
第7章 热力学基础 7.16 一摩尔单原子理想气体从270C 开始加热至770C (1)容积保持不变;(2)压强保持不变; 问这两过程中各吸收了多少热量?增加了多少内能?对外做了多少功?(摩尔热容 11,11,78.20,46.12----?=?=K mol J C K mol J C m P m V ) 解(1)是等体过程,对外做功A =0。J T C U Q m V 623)2777(46.12,=-?=?=?= (2)是等压过程,吸收的热量J T C Q m p 1039)2777(78.20,=-?=?= J T C U m V 623)2777(46.12,=-?=?=? J U Q A 4166231039=-=?-= 7.17 一系统由如图所示的a 状态沿acb 到达状态b ,有334J 热量传入系统,而系统做功126J 。 (1)若沿adb 时系统做功42J ,问有多少热量传入系统? (2)当系统由状态b 沿曲线ba 返回态a 时,外界对系统做功84J , 试问系统是吸热还是放热?传递热量是多少? (3)若态d 与态a 内能之差为167J ,试问沿ad 及db 各自吸收的热量是多少? 解:已知J A J Q acb acb 126.334== 据热力学第一定律得内能 增量为 J A Q U acb acb ab 208126334=-=-=? (1) 沿曲线adb 过程,系统吸收的热量 J A U Q adb ab adb 25042208=+=+?= (2) 沿曲线ba J A U A U Q ba ab ba ba ba 292)84(208-=-+-=+?-=+?=, 即系统放热292J (3) J A A A adb ad db 420 === J A U Q ad ad ad 20942167=+=+?= J U U A U Q ad ab db db db 41167208=-=?-?=+?=,即在db 过程中吸热41J. 7.18 8g 氧在温度为270C 时体积为34101.4m -?,试计算下列各情形中气体所做的功。 (1)气体绝热地膨胀到33101.4m -?; (2)气体等温地膨胀到33101.4m -?; 再等容地冷却到温度等于绝热膨胀最后所达到的温 7.17题示图
大学物理各章练习题:第七章 热力学基础
第七章 热力学基础 7-1 假设火箭中的气体为单原子理想气体,温度为2000 K ,当气体离开喷口时,温度为1000 K ,(1)设气体原子质量为4个原子质量单位,求气体分子原来的方均根速率2v .已知一个原子质量单位=1.6605×10-27 kg ;(2)假设气体离开喷口时的流速(即分子定向运动速度)大小相等,均沿同一方向,求这速度的大小,已知气体总的能量不变. 分析 气体动理论的能量公式表明,气体的温度是气体分子平均平动动能的量度.当气体的内能转化为定向运动的动能时,即表现为平均平动动能的减少,也就是温度的降低. 解 (1)由气体动理论的能量公式kT m 2 3 212=v ,得 m/s 3530.7m/s 106605.142000 1038.13327 232 =?????== --m kT v (2)气体总的能量不变,气体内能的减少应等于定向运动动能的增量,就气体分子而言,即分子的平均平动动能的减少应等于定向运动动能的增量.若分子定向运动速度为d v ,则有 212 d 2 32321kT kT m -=v m/s 2496.6m/s 106605.14) 10002000(1038.13)(327 2321d =??-???=-=--m T T k v 7-2 单原子理想气体从状态a 经过程abcd 到状态d ,如图7-2所示.已知 Pa 10013.15?==d a p p ,Pa 10026.25?==c b p p ,L 1=a V ,L 5.1=b V ,L 3=c V , (1)试计算气体在abcd 过程中作的功,内能的变化和吸收的热量;(2)如果气 体从状态d 保持压强不变到a 状态,如图中虚线所示,问以上三项计算变成多少?(3)若过程沿曲线从a 到c 状态,已知该过程吸热257 cal ,求该过程中气体所作的功. 分析 理想气体从体积1V 膨胀到体积2V 的过程中所作的功为?2 1d )(V V V V p ,其量值为V p -图上 过程曲线下的面积.如果过程曲线下是规则的几何图形,通常可以直接计算面积获得该过程中气体所作的功. 解 (1)气体在abcd 过程中作的功应等于过程曲线下的面积,得 Pa 531.8 Pa 10)5.13(1001312 1 103100131 353514=?+???+???=+=--..S S W adcb da abcd 图7-2
